福建省龙岩市连城县第一中学2024-2025学年高一下学期5月月考 化学试题 (含答案)
文档属性
| 名称 | 福建省龙岩市连城县第一中学2024-2025学年高一下学期5月月考 化学试题 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 669.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-19 17:59:55 | ||
图片预览



文档简介
连城一中2024-2025学年下期高一年级月考2化学试卷
满分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1、C-12、O-16、Na-23、Al-27
一、选择题(本大题共14小题,每小题3分,共42分,每个选项只有一项符合题目要求)
1.化学与生产、生活和科技密切相关。下列说法错误的是( )
A.2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料
B.疫苗一般冷藏存放以避免蛋白质变性
C.“天和号”推进器上的氮化硼陶瓷属于有机高分子材料
D.北京冬奥会采用光伏发电有利于实现“碳中和”
2.下列表示正确的是( )
A.氢氧根离子的电子式: B.原子的结构示意图:
C.氯化钠的电子式: D.水分子的结构式:
3.下列有关说法正确的是( )
A.元素的最高价氧化物对应水化物的酸性越强,非金属性越强,碱性越强,金属性越强
B.元素的原子得电子越多,非金属性越强,失电子越多,金属性越强
C.同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小
D.第VIIA族元素的最高正价都为+7
4.X、Y、Z、W、R均是短周期主族元素,X和Z同主族,Y、Z、W、R同周期,W的简单氢化物可用作制冷剂。它们组成的某种化合物的结构如图所示。下列叙述正确的是( )
A.简单氢化物的稳定性:
B.简单离子半径:
C.W的简单氢化物能使湿润的蓝色石蕊试纸变红
D.能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
5.取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡,静置,下列有关该实验的说法不正确的是( )
A.下层CCl4层溶液呈紫红色
B.取少量上层溶液,滴加酸性AgNO3溶液,若溶液显黄色,则表明该反应存在化学反应限度
C.取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
D.该实验中KI与FeCl3反应后(未加CCl4),溶液中存在Fe3+、Fe2+、I-、I2等微粒
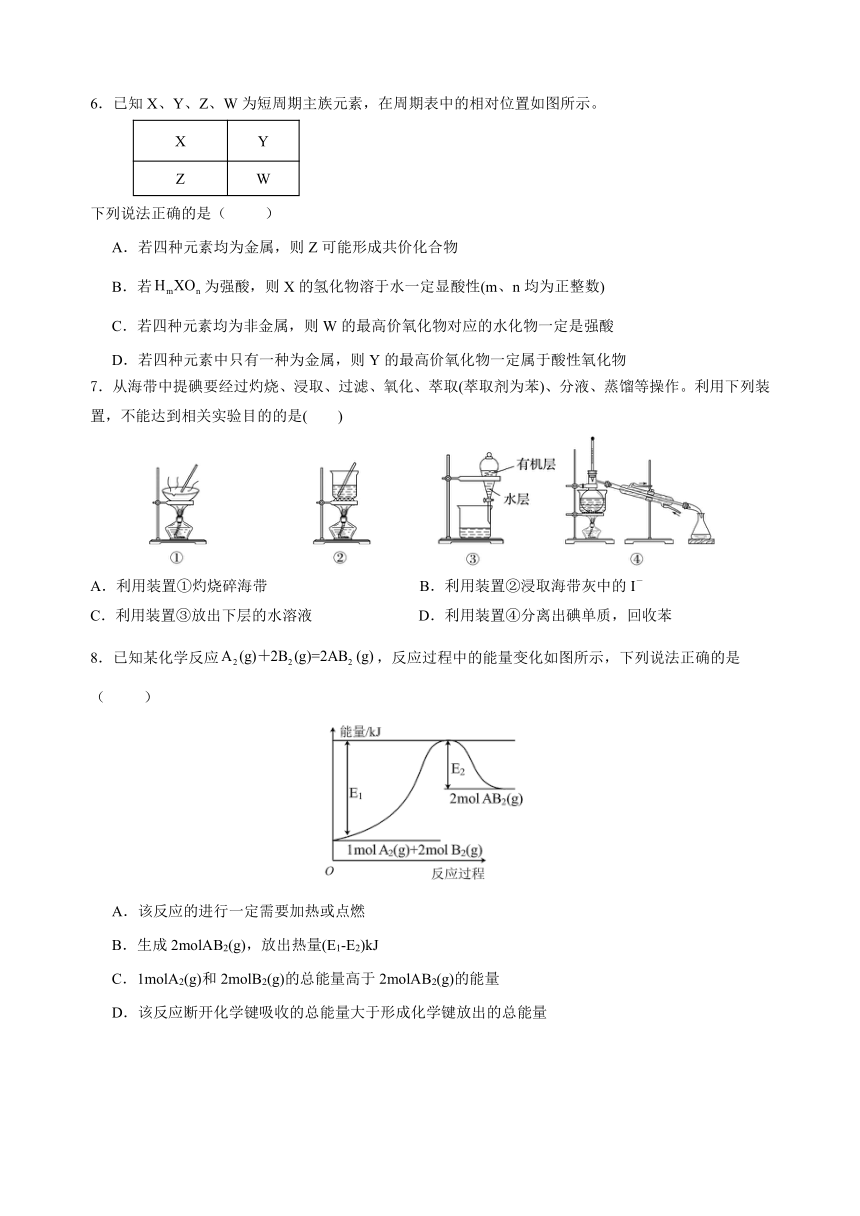
6.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示。
X Y
Z W
下列说法正确的是( )
A.若四种元素均为金属,则Z可能形成共价化合物
B.若为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
D.若四种元素中只有一种为金属,则Y的最高价氧化物一定属于酸性氧化物
7.从海带中提碘要经过灼烧、浸取、过滤、氧化、萃取(萃取剂为苯)、分液、蒸馏等操作。利用下列装置,不能达到相关实验目的的是( )
A.利用装置①灼烧碎海带 B.利用装置②浸取海带灰中的I-
C.利用装置③放出下层的水溶液 D.利用装置④分离出碘单质,回收苯
8.已知某化学反应,反应过程中的能量变化如图所示,下列说法正确的是( )
A.该反应的进行一定需要加热或点燃
B.生成2molAB2(g),放出热量(E1-E2)kJ
C.1molA2(g)和2molB2(g)的总能量高于2molAB2(g)的能量
D.该反应断开化学键吸收的总能量大于形成化学键放出的总能量
9.某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:,12s时生成C的物质的量为1.2mol(过程如图所示)。下列说法中不正确的是( )
A.12s时,A的转化率为75%
图中m点表示A的消耗速率等于A的生成速率
C.12s时容器内的压强为起始压强的
D.0~2s,B的平均反应速率为0.05mol/(L·s)
10.一种利用废旧镀锌铁皮制备磁性纳米粒子的工艺流程如图。
已知Zn的化学性质与Al相似。下列说法错误的是( )
A.“碱洗”是为了去除废旧镀锌铁皮表面的油污和锌
B.“氧化”时发生反应的离子方程式为
C.“氧化”后溶液中的金属阳离子是
D.持续通入的目的是防止被氧化
11.将Al条插入6 mol·L-1盐酸中,反应过程中产生H2的速率的变化情况如图1所示。下列说法错误的是( )
A.图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B.图1中影响t2~t3时间段内速率变化的主要因素是c(Cl-)
C.图1中t1~t2时间段内速率变化的主要原因是反应放热,溶液温度升高
D.图2可以表示该反应过程的能量变化
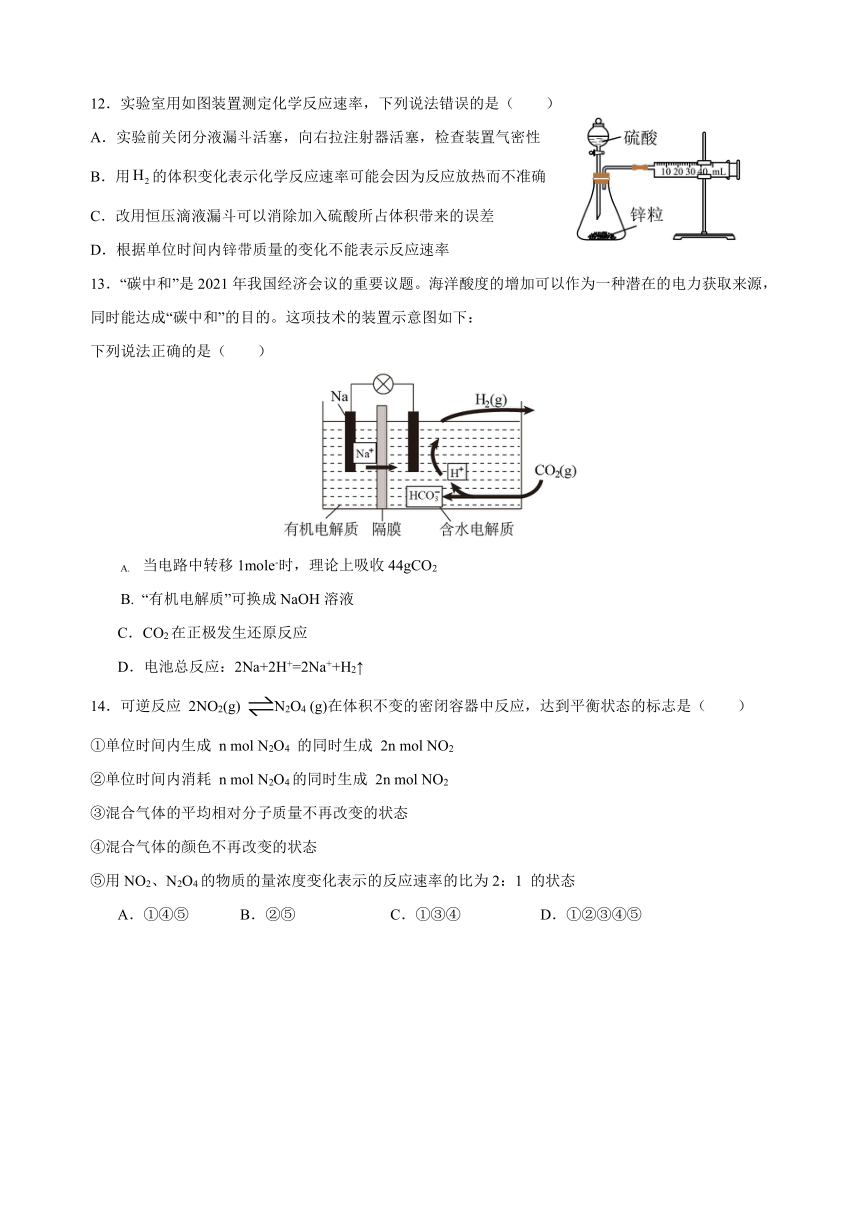
12.实验室用如图装置测定化学反应速率,下列说法错误的是( )
A.实验前关闭分液漏斗活塞,向右拉注射器活塞,检查装置气密性
B.用的体积变化表示化学反应速率可能会因为反应放热而不准确
C.改用恒压滴液漏斗可以消除加入硫酸所占体积带来的误差
D.根据单位时间内锌带质量的变化不能表示反应速率
13.“碳中和”是2021年我国经济会议的重要议题。海洋酸度的增加可以作为一种潜在的电力获取来源,同时能达成“碳中和”的目的。这项技术的装置示意图如下:
下列说法正确的是( )
当电路中转移1mole-时,理论上吸收44gCO2
“有机电解质”可换成NaOH溶液
C.CO2在正极发生还原反应
D.电池总反应:2Na+2H+=2Na++H2↑
14.可逆反应 2NO2(g) N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
①④⑤ B.②⑤ C.①③④ D.①②③④⑤
二、填空题(本大题共5小题,共58分)
15.(10分,每空2分)下表为元素周期表的一部分,表中所列的每个字母分别代表一种元素。
回答下列问题:
(1)元素f的原子结构示意图为 。
(2)c、d、e的简单离子半径由大到小的顺序为 (用离子符号表示)。
(3)c与d形成的原子个数比为1:1的化合物中含有的化学键类型为 。
(4)下列事实能说明d元素原子的失电子能力比e强的是___________(填标号)。
A.单质的熔点:dB.简单阳离子的氧化性:e>d
C.常温下,d单质能与水剧烈反应而e不能
D.相同物质的量的d、e单质分别与足量盐酸反应,生成的的量:d(5)高温下e的氧化物可与a、b单质反应生成高导热结构陶瓷eb和一种还原性气体,该反应的化学方程式为 。
16. (12分,每空2分)海洋是巨大的资源宝库,从海洋中获取部分资源的流程如图:
Ⅰ.海水提溴
“空气吹出法”从海水中提取的工艺流程如图中虚线框内所示。
(1)往“酸化苦卤”中通入,反应的离子方程式为 。
(2)吸收塔中,与溶液反应生成、和,则氧化产物与还原产物的物质的量之比为 。
(3)蒸馏塔中加入的物质A为 (填“稀硫酸”或“盐酸”)。
Ⅱ.海水提镁
(4)粗产品步骤中,从生产成本角度考虑加入的碱为 (填化学式)。
(5)用亚硫酰氯对进行脱水时,生成了两种酸性气体和,反应的化学方程式为 。
Ⅲ.产品应用
(6)下列关于纯碱用途的说法正确的是 (填标号)。
a.可直接加入面团中做膨松剂 b.可用于中和过多的胃酸
c.是制造普通玻璃的主要原料之一 d.可用于去除餐具表面的油污
17.(10分,除标注外每空2分)天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)上图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A (填“上升”或“下降”),说明此反应是 (填“放热”或“吸热”)反应。(以上2空各1分)
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g) N2(g)+CO2(g)+H2O(g)。
①下列措施能够使该反应速率加快的是 。
使用催化剂 b.降低温度 c.及时分离水 d.把容器的体积缩小一倍
e.充入 f.恒容下,充入Ar惰性气体
②若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是 。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化 d.混合气体的质量不再变化
e. f.单位时间内生成同时生成
(3)甲烷可直接应用于燃料电池,该电池采用溶液为电解质,其工作原理如下图所示:
①外电路电子移动方向: (填“a→b”或“b→a”)。
②b电极的电极方程式为 。
18.(16分,每空2分)化学反应速率和限度与生产、生活密切相关。
(1)恒温恒容下2mol和2mol通入体积为2L的密闭容器中发生反应:。2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol L-1。
①从开始反应至达到平衡状态, mol L-1 min-1。
②x= 。
③A的转化率与B的转化率之比为 。
(2)近年来,研究人员提出用作为水溶液中:歧化反应的催化剂,实现含工业污水的处理。其催化过程分两步完成:
i. ii.
为探究i、ii反应速率与歧化反应速率的关系,实验如下:分别向18mL饱和溶液中加入2mL下列试剂,密闭放置,观察现象(已知:易溶解在KI溶液中)。
实验组 a b c d
试剂组成 0.4mol·L-1KI Amol·L-1KI、0.2mol·L-1 x 0.2mol·L-1KI、0.0002mol
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较①快 无明显现象 棕褐色溶液迅速褪色,变成黄色,出现浑浊较①快
①上述实验需要“密闭放置”的主要原因是 。
②实验a和b互为对照组,则A= ,比较实验a和b可得出结论 。
③实验c试剂x为 ,比较实验b和c可知单独存在时不能催化的歧化反应。综合实验a、b、c得出结论:是歧化反应的催化剂。
④实验表明,歧化反应速率d>a,,结合i和ii的反应速率解释其原因 。
19.(10分,除标注外,每空2分)CO2催化加氢合成新能源甲醇,既实现了碳资源充分利用,又可有效减少CO2排放。反应过程中能量变化如下左图所示:
(1)在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= 。
②达到平衡时,H2的浓度为 mol L-1。
③能说明上述反应达到平衡状态的是 ;
恒温、恒容时,容器内混合气体的密度不再变化 B. 反应中CO2与CH3OH的物质的量浓度相等C. 有2个C=O键断裂的同时,有3个H-H键生成 D. 当v正(CO2)=3v逆(H2)
(2)甲醇既可以直接作为燃料提供动力,也可以设计成甲醇燃料电池,具有理论能量效率高的优点,甲醇燃料电池工作原理如图所示:a、b均为惰性电极。
①使用时空气从 (填“A”或“B”)口通入。(1分)
②若此燃料电池电路中转移2mol电子,则消耗的O2在标准状况下的体积为 L (2分);电池工作一段时间后,电解质溶液的碱性 (填“增强”、“减弱”或“不变”)。(1分)
《连城一中2024-2025学年下期高一年级月考2化学试卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A A B D A D B C
题号 11 12 13 14
答案 B D A C
(每空2分,共10分)
(1)
(2)
(3)离子键、共价键
(4)BC
(5)
16.(每空2分,共12分)
(1)
(2)1:5
(3)稀硫酸
(4)
(5)
(6)
17.(除特别标注外,每空2分,共10分)
(1) 下降(1分) 放热(1分)
(2) ①ade ②acf
(3) ①a→b ②O2+4e+2H2O=4OH-
18.(每空2分,共16分)
(1) ①0.6 ②3 ③2∶1
(2) ①防止氧气参与反应,影响实验结果的准确性
② 0.4 可以加快和反应的速率
③ 0.2mol L-1溶液
④反应ii比i快,且由反应ii生成的使反应i加快
19.(除特别标注外,每空2分,共10分)
(1) ① 0.0375 ②0.375 ③C
(2) ① B(1分) ②11.2 减弱(1分)
满分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1、C-12、O-16、Na-23、Al-27
一、选择题(本大题共14小题,每小题3分,共42分,每个选项只有一项符合题目要求)
1.化学与生产、生活和科技密切相关。下列说法错误的是( )
A.2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料
B.疫苗一般冷藏存放以避免蛋白质变性
C.“天和号”推进器上的氮化硼陶瓷属于有机高分子材料
D.北京冬奥会采用光伏发电有利于实现“碳中和”
2.下列表示正确的是( )
A.氢氧根离子的电子式: B.原子的结构示意图:
C.氯化钠的电子式: D.水分子的结构式:
3.下列有关说法正确的是( )
A.元素的最高价氧化物对应水化物的酸性越强,非金属性越强,碱性越强,金属性越强
B.元素的原子得电子越多,非金属性越强,失电子越多,金属性越强
C.同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小
D.第VIIA族元素的最高正价都为+7
4.X、Y、Z、W、R均是短周期主族元素,X和Z同主族,Y、Z、W、R同周期,W的简单氢化物可用作制冷剂。它们组成的某种化合物的结构如图所示。下列叙述正确的是( )
A.简单氢化物的稳定性:
B.简单离子半径:
C.W的简单氢化物能使湿润的蓝色石蕊试纸变红
D.能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
5.取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡,静置,下列有关该实验的说法不正确的是( )
A.下层CCl4层溶液呈紫红色
B.取少量上层溶液,滴加酸性AgNO3溶液,若溶液显黄色,则表明该反应存在化学反应限度
C.取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
D.该实验中KI与FeCl3反应后(未加CCl4),溶液中存在Fe3+、Fe2+、I-、I2等微粒
6.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示。
X Y
Z W
下列说法正确的是( )
A.若四种元素均为金属,则Z可能形成共价化合物
B.若为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
D.若四种元素中只有一种为金属,则Y的最高价氧化物一定属于酸性氧化物
7.从海带中提碘要经过灼烧、浸取、过滤、氧化、萃取(萃取剂为苯)、分液、蒸馏等操作。利用下列装置,不能达到相关实验目的的是( )
A.利用装置①灼烧碎海带 B.利用装置②浸取海带灰中的I-
C.利用装置③放出下层的水溶液 D.利用装置④分离出碘单质,回收苯
8.已知某化学反应,反应过程中的能量变化如图所示,下列说法正确的是( )
A.该反应的进行一定需要加热或点燃
B.生成2molAB2(g),放出热量(E1-E2)kJ
C.1molA2(g)和2molB2(g)的总能量高于2molAB2(g)的能量
D.该反应断开化学键吸收的总能量大于形成化学键放出的总能量
9.某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:,12s时生成C的物质的量为1.2mol(过程如图所示)。下列说法中不正确的是( )
A.12s时,A的转化率为75%
图中m点表示A的消耗速率等于A的生成速率
C.12s时容器内的压强为起始压强的
D.0~2s,B的平均反应速率为0.05mol/(L·s)
10.一种利用废旧镀锌铁皮制备磁性纳米粒子的工艺流程如图。
已知Zn的化学性质与Al相似。下列说法错误的是( )
A.“碱洗”是为了去除废旧镀锌铁皮表面的油污和锌
B.“氧化”时发生反应的离子方程式为
C.“氧化”后溶液中的金属阳离子是
D.持续通入的目的是防止被氧化
11.将Al条插入6 mol·L-1盐酸中,反应过程中产生H2的速率的变化情况如图1所示。下列说法错误的是( )
A.图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B.图1中影响t2~t3时间段内速率变化的主要因素是c(Cl-)
C.图1中t1~t2时间段内速率变化的主要原因是反应放热,溶液温度升高
D.图2可以表示该反应过程的能量变化
12.实验室用如图装置测定化学反应速率,下列说法错误的是( )
A.实验前关闭分液漏斗活塞,向右拉注射器活塞,检查装置气密性
B.用的体积变化表示化学反应速率可能会因为反应放热而不准确
C.改用恒压滴液漏斗可以消除加入硫酸所占体积带来的误差
D.根据单位时间内锌带质量的变化不能表示反应速率
13.“碳中和”是2021年我国经济会议的重要议题。海洋酸度的增加可以作为一种潜在的电力获取来源,同时能达成“碳中和”的目的。这项技术的装置示意图如下:
下列说法正确的是( )
当电路中转移1mole-时,理论上吸收44gCO2
“有机电解质”可换成NaOH溶液
C.CO2在正极发生还原反应
D.电池总反应:2Na+2H+=2Na++H2↑
14.可逆反应 2NO2(g) N2O4 (g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成 n mol N2O4 的同时生成 2n mol NO2
②单位时间内消耗 n mol N2O4的同时生成 2n mol NO2
③混合气体的平均相对分子质量不再改变的状态
④混合气体的颜色不再改变的状态
⑤用NO2、N2O4的物质的量浓度变化表示的反应速率的比为2:1 的状态
①④⑤ B.②⑤ C.①③④ D.①②③④⑤
二、填空题(本大题共5小题,共58分)
15.(10分,每空2分)下表为元素周期表的一部分,表中所列的每个字母分别代表一种元素。
回答下列问题:
(1)元素f的原子结构示意图为 。
(2)c、d、e的简单离子半径由大到小的顺序为 (用离子符号表示)。
(3)c与d形成的原子个数比为1:1的化合物中含有的化学键类型为 。
(4)下列事实能说明d元素原子的失电子能力比e强的是___________(填标号)。
A.单质的熔点:d
C.常温下,d单质能与水剧烈反应而e不能
D.相同物质的量的d、e单质分别与足量盐酸反应,生成的的量:d
16. (12分,每空2分)海洋是巨大的资源宝库,从海洋中获取部分资源的流程如图:
Ⅰ.海水提溴
“空气吹出法”从海水中提取的工艺流程如图中虚线框内所示。
(1)往“酸化苦卤”中通入,反应的离子方程式为 。
(2)吸收塔中,与溶液反应生成、和,则氧化产物与还原产物的物质的量之比为 。
(3)蒸馏塔中加入的物质A为 (填“稀硫酸”或“盐酸”)。
Ⅱ.海水提镁
(4)粗产品步骤中,从生产成本角度考虑加入的碱为 (填化学式)。
(5)用亚硫酰氯对进行脱水时,生成了两种酸性气体和,反应的化学方程式为 。
Ⅲ.产品应用
(6)下列关于纯碱用途的说法正确的是 (填标号)。
a.可直接加入面团中做膨松剂 b.可用于中和过多的胃酸
c.是制造普通玻璃的主要原料之一 d.可用于去除餐具表面的油污
17.(10分,除标注外每空2分)天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)上图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将铝片加入小试管内,然后注入足量的盐酸,U形导管中液面A (填“上升”或“下降”),说明此反应是 (填“放热”或“吸热”)反应。(以上2空各1分)
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g) N2(g)+CO2(g)+H2O(g)。
①下列措施能够使该反应速率加快的是 。
使用催化剂 b.降低温度 c.及时分离水 d.把容器的体积缩小一倍
e.充入 f.恒容下,充入Ar惰性气体
②若上述反应在恒容密闭容器中进行,下列叙述能说明该反应已达平衡状态的是 。
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.容器内气体的压强不再变化 d.混合气体的质量不再变化
e. f.单位时间内生成同时生成
(3)甲烷可直接应用于燃料电池,该电池采用溶液为电解质,其工作原理如下图所示:
①外电路电子移动方向: (填“a→b”或“b→a”)。
②b电极的电极方程式为 。
18.(16分,每空2分)化学反应速率和限度与生产、生活密切相关。
(1)恒温恒容下2mol和2mol通入体积为2L的密闭容器中发生反应:。2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol L-1。
①从开始反应至达到平衡状态, mol L-1 min-1。
②x= 。
③A的转化率与B的转化率之比为 。
(2)近年来,研究人员提出用作为水溶液中:歧化反应的催化剂,实现含工业污水的处理。其催化过程分两步完成:
i. ii.
为探究i、ii反应速率与歧化反应速率的关系,实验如下:分别向18mL饱和溶液中加入2mL下列试剂,密闭放置,观察现象(已知:易溶解在KI溶液中)。
实验组 a b c d
试剂组成 0.4mol·L-1KI Amol·L-1KI、0.2mol·L-1 x 0.2mol·L-1KI、0.0002mol
实验现象 溶液变黄,一段时间后出现浑浊 溶液变黄,出现浑浊较①快 无明显现象 棕褐色溶液迅速褪色,变成黄色,出现浑浊较①快
①上述实验需要“密闭放置”的主要原因是 。
②实验a和b互为对照组,则A= ,比较实验a和b可得出结论 。
③实验c试剂x为 ,比较实验b和c可知单独存在时不能催化的歧化反应。综合实验a、b、c得出结论:是歧化反应的催化剂。
④实验表明,歧化反应速率d>a,,结合i和ii的反应速率解释其原因 。
19.(10分,除标注外,每空2分)CO2催化加氢合成新能源甲醇,既实现了碳资源充分利用,又可有效减少CO2排放。反应过程中能量变化如下左图所示:
(1)在体积为2L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= 。
②达到平衡时,H2的浓度为 mol L-1。
③能说明上述反应达到平衡状态的是 ;
恒温、恒容时,容器内混合气体的密度不再变化 B. 反应中CO2与CH3OH的物质的量浓度相等C. 有2个C=O键断裂的同时,有3个H-H键生成 D. 当v正(CO2)=3v逆(H2)
(2)甲醇既可以直接作为燃料提供动力,也可以设计成甲醇燃料电池,具有理论能量效率高的优点,甲醇燃料电池工作原理如图所示:a、b均为惰性电极。
①使用时空气从 (填“A”或“B”)口通入。(1分)
②若此燃料电池电路中转移2mol电子,则消耗的O2在标准状况下的体积为 L (2分);电池工作一段时间后,电解质溶液的碱性 (填“增强”、“减弱”或“不变”)。(1分)
《连城一中2024-2025学年下期高一年级月考2化学试卷》参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C D A A B D A D B C
题号 11 12 13 14
答案 B D A C
(每空2分,共10分)
(1)
(2)
(3)离子键、共价键
(4)BC
(5)
16.(每空2分,共12分)
(1)
(2)1:5
(3)稀硫酸
(4)
(5)
(6)
17.(除特别标注外,每空2分,共10分)
(1) 下降(1分) 放热(1分)
(2) ①ade ②acf
(3) ①a→b ②O2+4e+2H2O=4OH-
18.(每空2分,共16分)
(1) ①0.6 ②3 ③2∶1
(2) ①防止氧气参与反应,影响实验结果的准确性
② 0.4 可以加快和反应的速率
③ 0.2mol L-1溶液
④反应ii比i快,且由反应ii生成的使反应i加快
19.(除特别标注外,每空2分,共10分)
(1) ① 0.0375 ②0.375 ③C
(2) ① B(1分) ②11.2 减弱(1分)
同课章节目录
