高一下学期化学人教版(2019)必修第二册 5.2.2氮及其化合物课件(24张)
文档属性
| 名称 | 高一下学期化学人教版(2019)必修第二册 5.2.2氮及其化合物课件(24张) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-20 08:05:25 | ||
图片预览






文档简介
(共24张PPT)
第五章 化工生产中的重要非金属材料
第二节 氮及其化合物
三、氨和铵盐
1、氨
(1)氨的物理性质
色态 气味 密度 溶解性 沸点
无色
气体
刺激性
气味
比空气
的小
极易溶于水(常温下1体积水可溶解700体积的氨,其水溶液称为氨水)
较低
易液化
注:液氨因汽化时要吸收大量的热,液氨常用作制冷剂
(2)氨的化学性质
实验5 6:氨溶于水的喷泉实验
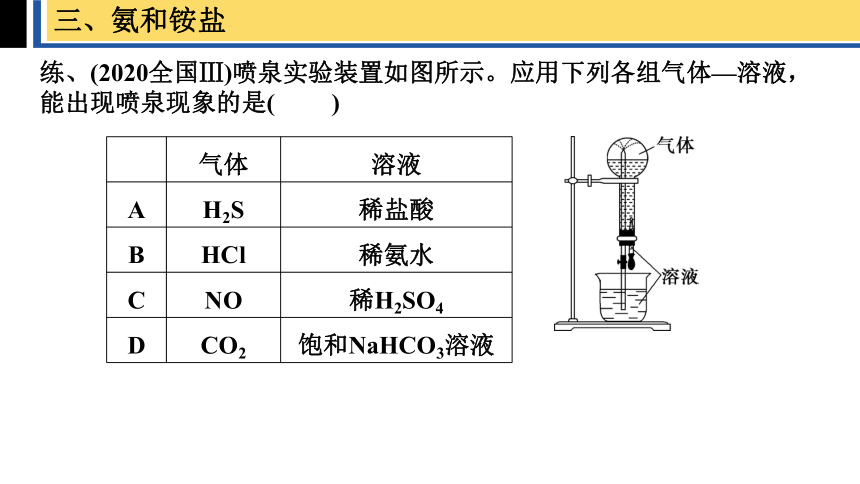
步骤:在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。
三、氨和铵盐
(2)氨的化学性质
实验5 6:氨溶于水的喷泉实验
现象:
原因:
结论:
烧杯中的水倒吸进入烧瓶,形成红色的喷泉
氨极易溶于水,大量氨溶于水后,瓶内的压强迅速减小形成负压,这时外界的大气压将烧瓶中的水迅速压上去,形成了喷泉。
极易溶于水,并能与水反应生成碱性物质
三、氨和铵盐
气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
练、(2020全国Ⅲ)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
三、氨和铵盐
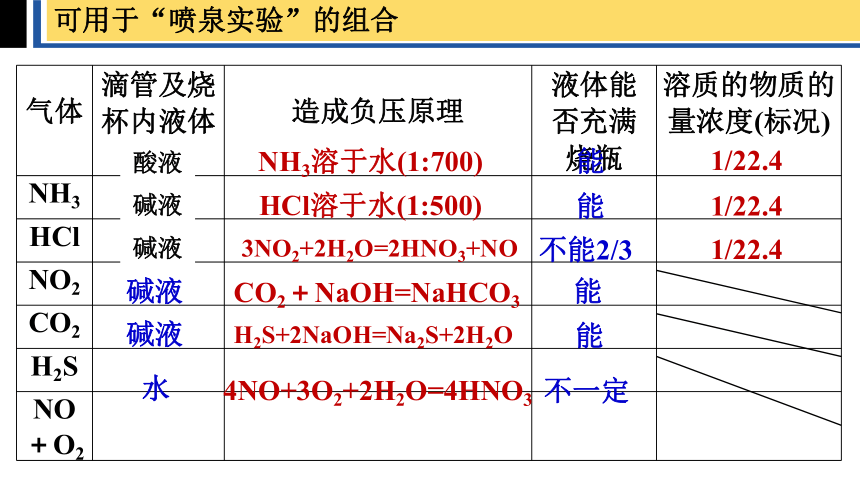
气体 滴管及烧杯内液体 造成负压原理 液体能否充满烧瓶 溶质的物质的量浓度(标况)
NH3
HCl
NO2
CO2
H2S
NO+O2
水
NH3溶于水(1:700)
能
1/22.4
水
HCl溶于水(1:500)
能
1/22.4
3NO2+2H2O=2HNO3+NO
水
不能2/3
1/22.4
碱液
CO2+NaOH=NaHCO3
能
碱液
H2S+2NaOH=Na2S+2H2O
能
4NO+3O2+2H2O=4HNO3
不一定
水
酸液
碱液
碱液
可用于“喷泉实验”的组合
(2)氨的化学性质
①与水反应:
氨大部分与水结合成NH3·H2O(一水合氨),少部分的NH3·H2O会电离成NH4+和OH-。
NH3+H2O NH3·H2O NH4++OH
注:(1)NH3·H2O很不稳定,受热会分解;
NH3·H2O == NH3↑+H2O
(2)NH3是中学阶段所学的唯一能使湿润的红色石蕊试纸变蓝的碱性气体。
三、氨和铵盐
(2)氨的化学性质
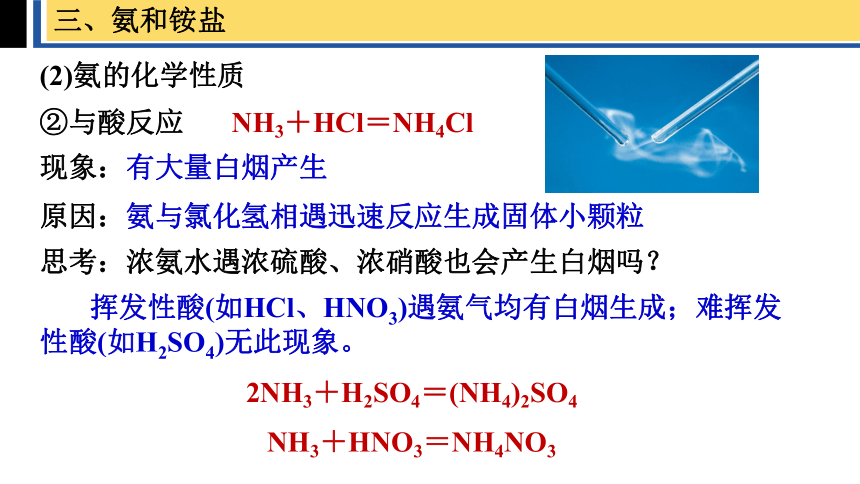
②与酸反应
NH3+HCl=NH4Cl
现象:有大量白烟产生
原因:氨与氯化氢相遇迅速反应生成固体小颗粒
思考:浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
挥发性酸(如HCl、HNO3)遇氨气均有白烟生成;难挥发性酸(如H2SO4)无此现象。
2NH3+H2SO4=(NH4)2SO4
NH3+HNO3=NH4NO3
三、氨和铵盐
(2)氨的化学性质
③与氧气反应
氨的催化氧化:
4NH3+5O2 === 4NO+6H2O
催化剂
(工业制NO的方法)
三、氨和铵盐
(2)氨的化学性质
④与其它氧化剂的反应(如Cl2 、CuO、NOx等)
2NH3(少量)+3Cl2=N2+6HCl
8NH3(过量)+3Cl2=N2+6NH4Cl
应用:检查氯气管道是否泄露
2NH3+3CuO=N2+3Cu+3H2O
(实验室制N2)
4NH3+5NO=5N2+6H2O
8NH3+6NO2=7N2+12H2O
(治理NOx污染)
三、氨和铵盐
(3)氨的用途
制
纯碱
制
化肥
制
冷剂
有机
合成
原料
制
硝酸
三、氨和铵盐
2、铵盐
(1)概念:
由铵根离子(NH4+)与酸根离子构成的化合物
大多数铵盐都是白/无色晶体、易溶于水
(2)物理性质:
(3)化学性质:
①受热易分解
NH4Cl == NH3↑ + HCl↑
三、氨和铵盐
(3)化学性质:
①受热易分解
NH4HCO3==NH3↑+CO2↑+H2O
特点:挥发性酸(如HCl、H2CO3等)形成的铵盐,受热时分解为氨和对应的酸。
NH4NO3==N2O↑+2H2O
特点:氧化性酸(如HNO3等)形成的铵盐,受热时发生氧化还原反应。
三、氨和铵盐
NH4Cl == NH3↑ + HCl↑
(3)化学性质:
实验5 7:铵盐与碱的反应
实验操作 实验现象 实验结论
向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。
产生有刺激性气味的气体,湿润的红色石蕊试纸变蓝
加热条件下铵盐与碱反应有氨气放出
NH4++OH == NH3↑+H2O
三、氨和铵盐
(3)化学性质:
②与碱反应
Ⅰ、与碱溶液在常温下反应:
NH4++OH == NH3↑+H2O
NH4++OH =NH3·H2O
Ⅱ、与碱溶液在加热条件下反应:
特点:在水溶液中、固相反应中均可发生
应用:检验铵根离子、制氨气
三、氨和铵盐
3、NH4+的检验
固体
液体
取少量样品于研钵中,加入固体碱进行研磨。若闻到氨的刺激性气味,则样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
取少量溶液于试管中,加入浓碱溶液,微热,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
三、氨和铵盐
4、氨气的实验室制法
(1)实验原理:铵盐与碱共热产生氨气
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
(2)实验装置:固+固 气体
(3)收集方法:
(4)验满方法:
或用蘸有浓盐酸(或浓硝酸)的玻璃棒靠近试管口,有白烟生成。
棉花的作用:防止NH3与空气对流而造成收集的NH3不纯
向下排空气法
湿润的红色石蕊试纸放置在试管口,试纸变蓝;
三、氨和铵盐
碱石灰:在NaOH的浓溶液中加入CaO,加热制成的白色固体即为碱石灰。
4、氨气的实验室制法
(5)干燥方法:
注意:NH3不可用中性的无水CaCl2干燥,因为CaCl2可与NH3反应生成CaCl2·8NH3
三、氨和铵盐
4、氨气的实验室制法
(6)尾气处理:
水或酸溶液
(防倒吸)
肚容式 倒立漏斗式 安全瓶 隔离式
三、氨和铵盐
4、氨气的实验室制法:快速简易制法
方法一:加热浓氨水
氨水易挥发,且氨水中的NH3·H2O受热易分解,因此可由加热浓氨水的方法获得NH3。
NH3·H2O == NH3↑+H2O
三、氨和铵盐
4、氨气的实验室制法:快速简易制法
方法二:浓氨水+固体CaO(或NaOH)
CaO作用:①吸水;②吸水后放热促进NH3逸出;③增大溶液中的OH 浓度,减少NH3的溶解
NH3·H2O+CaO=NH3↑+Ca(OH)2
NaOH作用:NaOH固体溶于水放热,促进NH3·H2O分解;且OH 浓度的增大有利于NH3的逸出
三、氨和铵盐
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
练、实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
C
三、氨和铵盐
5、氨气的工业制法
高温高压
催化剂
N2+3H2 2NH3
三、氨和铵盐
6、铵盐的用途:
铵盐在工业、农业生产中也有着重要的用途。大量的铵盐用作氮肥,硝酸氨还可用作炸药,氯化铵常用作印染和制作干电池的原料,它也用在金属焊接上除去金属表面的氧化物薄层(焊药)。
三、氨和铵盐
第五章 化工生产中的重要非金属材料
第二节 氮及其化合物
三、氨和铵盐
1、氨
(1)氨的物理性质
色态 气味 密度 溶解性 沸点
无色
气体
刺激性
气味
比空气
的小
极易溶于水(常温下1体积水可溶解700体积的氨,其水溶液称为氨水)
较低
易液化
注:液氨因汽化时要吸收大量的热,液氨常用作制冷剂
(2)氨的化学性质
实验5 6:氨溶于水的喷泉实验
步骤:在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。打开弹簧夹,挤压胶头滴管,使水进入烧瓶。
三、氨和铵盐
(2)氨的化学性质
实验5 6:氨溶于水的喷泉实验
现象:
原因:
结论:
烧杯中的水倒吸进入烧瓶,形成红色的喷泉
氨极易溶于水,大量氨溶于水后,瓶内的压强迅速减小形成负压,这时外界的大气压将烧瓶中的水迅速压上去,形成了喷泉。
极易溶于水,并能与水反应生成碱性物质
三、氨和铵盐
气体 溶液
A H2S 稀盐酸
B HCl 稀氨水
C NO 稀H2SO4
D CO2 饱和NaHCO3溶液
练、(2020全国Ⅲ)喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
三、氨和铵盐
气体 滴管及烧杯内液体 造成负压原理 液体能否充满烧瓶 溶质的物质的量浓度(标况)
NH3
HCl
NO2
CO2
H2S
NO+O2
水
NH3溶于水(1:700)
能
1/22.4
水
HCl溶于水(1:500)
能
1/22.4
3NO2+2H2O=2HNO3+NO
水
不能2/3
1/22.4
碱液
CO2+NaOH=NaHCO3
能
碱液
H2S+2NaOH=Na2S+2H2O
能
4NO+3O2+2H2O=4HNO3
不一定
水
酸液
碱液
碱液
可用于“喷泉实验”的组合
(2)氨的化学性质
①与水反应:
氨大部分与水结合成NH3·H2O(一水合氨),少部分的NH3·H2O会电离成NH4+和OH-。
NH3+H2O NH3·H2O NH4++OH
注:(1)NH3·H2O很不稳定,受热会分解;
NH3·H2O == NH3↑+H2O
(2)NH3是中学阶段所学的唯一能使湿润的红色石蕊试纸变蓝的碱性气体。
三、氨和铵盐
(2)氨的化学性质
②与酸反应
NH3+HCl=NH4Cl
现象:有大量白烟产生
原因:氨与氯化氢相遇迅速反应生成固体小颗粒
思考:浓氨水遇浓硫酸、浓硝酸也会产生白烟吗?
挥发性酸(如HCl、HNO3)遇氨气均有白烟生成;难挥发性酸(如H2SO4)无此现象。
2NH3+H2SO4=(NH4)2SO4
NH3+HNO3=NH4NO3
三、氨和铵盐
(2)氨的化学性质
③与氧气反应
氨的催化氧化:
4NH3+5O2 === 4NO+6H2O
催化剂
(工业制NO的方法)
三、氨和铵盐
(2)氨的化学性质
④与其它氧化剂的反应(如Cl2 、CuO、NOx等)
2NH3(少量)+3Cl2=N2+6HCl
8NH3(过量)+3Cl2=N2+6NH4Cl
应用:检查氯气管道是否泄露
2NH3+3CuO=N2+3Cu+3H2O
(实验室制N2)
4NH3+5NO=5N2+6H2O
8NH3+6NO2=7N2+12H2O
(治理NOx污染)
三、氨和铵盐
(3)氨的用途
制
纯碱
制
化肥
制
冷剂
有机
合成
原料
制
硝酸
三、氨和铵盐
2、铵盐
(1)概念:
由铵根离子(NH4+)与酸根离子构成的化合物
大多数铵盐都是白/无色晶体、易溶于水
(2)物理性质:
(3)化学性质:
①受热易分解
NH4Cl == NH3↑ + HCl↑
三、氨和铵盐
(3)化学性质:
①受热易分解
NH4HCO3==NH3↑+CO2↑+H2O
特点:挥发性酸(如HCl、H2CO3等)形成的铵盐,受热时分解为氨和对应的酸。
NH4NO3==N2O↑+2H2O
特点:氧化性酸(如HNO3等)形成的铵盐,受热时发生氧化还原反应。
三、氨和铵盐
NH4Cl == NH3↑ + HCl↑
(3)化学性质:
实验5 7:铵盐与碱的反应
实验操作 实验现象 实验结论
向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。
产生有刺激性气味的气体,湿润的红色石蕊试纸变蓝
加热条件下铵盐与碱反应有氨气放出
NH4++OH == NH3↑+H2O
三、氨和铵盐
(3)化学性质:
②与碱反应
Ⅰ、与碱溶液在常温下反应:
NH4++OH == NH3↑+H2O
NH4++OH =NH3·H2O
Ⅱ、与碱溶液在加热条件下反应:
特点:在水溶液中、固相反应中均可发生
应用:检验铵根离子、制氨气
三、氨和铵盐
3、NH4+的检验
固体
液体
取少量样品于研钵中,加入固体碱进行研磨。若闻到氨的刺激性气味,则样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
取少量溶液于试管中,加入浓碱溶液,微热,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
三、氨和铵盐
4、氨气的实验室制法
(1)实验原理:铵盐与碱共热产生氨气
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
(2)实验装置:固+固 气体
(3)收集方法:
(4)验满方法:
或用蘸有浓盐酸(或浓硝酸)的玻璃棒靠近试管口,有白烟生成。
棉花的作用:防止NH3与空气对流而造成收集的NH3不纯
向下排空气法
湿润的红色石蕊试纸放置在试管口,试纸变蓝;
三、氨和铵盐
碱石灰:在NaOH的浓溶液中加入CaO,加热制成的白色固体即为碱石灰。
4、氨气的实验室制法
(5)干燥方法:
注意:NH3不可用中性的无水CaCl2干燥,因为CaCl2可与NH3反应生成CaCl2·8NH3
三、氨和铵盐
4、氨气的实验室制法
(6)尾气处理:
水或酸溶液
(防倒吸)
肚容式 倒立漏斗式 安全瓶 隔离式
三、氨和铵盐
4、氨气的实验室制法:快速简易制法
方法一:加热浓氨水
氨水易挥发,且氨水中的NH3·H2O受热易分解,因此可由加热浓氨水的方法获得NH3。
NH3·H2O == NH3↑+H2O
三、氨和铵盐
4、氨气的实验室制法:快速简易制法
方法二:浓氨水+固体CaO(或NaOH)
CaO作用:①吸水;②吸水后放热促进NH3逸出;③增大溶液中的OH 浓度,减少NH3的溶解
NH3·H2O+CaO=NH3↑+Ca(OH)2
NaOH作用:NaOH固体溶于水放热,促进NH3·H2O分解;且OH 浓度的增大有利于NH3的逸出
三、氨和铵盐
A. ①是氨气发生装置 B. ②是氨气吸收装置
C. ③是氨气发生装置 D. ④是氨气收集、检验装置
练、实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
C
三、氨和铵盐
5、氨气的工业制法
高温高压
催化剂
N2+3H2 2NH3
三、氨和铵盐
6、铵盐的用途:
铵盐在工业、农业生产中也有着重要的用途。大量的铵盐用作氮肥,硝酸氨还可用作炸药,氯化铵常用作印染和制作干电池的原料,它也用在金属焊接上除去金属表面的氧化物薄层(焊药)。
三、氨和铵盐
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
