四川省德阳市什邡中学2024-2025学年高二下学期5月期中考试化学试题(含答案)
文档属性
| 名称 | 四川省德阳市什邡中学2024-2025学年高二下学期5月期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 879.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-22 08:59:58 | ||
图片预览



文档简介
四川省什邡中学高二(下)平实部期中考试
化 学 试 题
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Cl-35.5 Fe-56
第I卷(选择题 共45分)
选择题:(本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合)
1.化学与生产、生活、科技等方面密切相关,下列说法正确的是
A.实现“碳中和”具有直接贡献的一种措施:研发催化剂将转化为甲醇(),该过程中发生了氧化反应
B.“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,说明铁合金的硬度比纯铁小
C.可用于制玻璃、肥皂、造纸、纺织等工业
D.维生素C又称“抗坏血酸”,利用维生素C的氧化性,能帮助人体将食物中摄取的不易吸收的转变为易吸收的
2.下列化学用语表示错误的是
A.乙烯的结构简式: B.甲烷的空间填充模型:
C.的结构式: D.的电子式:
3.下列关于有机化合物的说法正确的是
A.甲烷中混有杂质乙烯,可用酸性高锰酸钾溶液除杂
B.和互为同系物
C.丙烯(CH2=CH-CH3)中所有原子一定共面
D.因为二氯甲烷没有同分异构体,所以甲烷为正四面体结构
4.汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
A.汉黄芩素的分子式为C16H13O5
B.该物质既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C.1mol该物质与溴水反应,最多消耗1molBr2 ,足量NaOH溶液反应,最多消耗4mol NaOH
D.该有机物中不含醚键
5.由下列实验方案、现象得出的结论正确的是
实验方案 现象 结论
A 向碘水中加入,振荡后静置 上层为紫红色 在中的溶解度大于在水中的溶解度
B 向溶液中加入乙醇 析出深蓝色固体 在乙醇中溶解度小
C 用毛皮摩擦过的带电橡胶靠近液流 液流方向改变 为正四面体结构
D 用pH计测相同浓度和的pH 前者小于后者 的推电子效应小于
A.A B.B C.C D.D
6.下列有关烃的说法错误的是
A.、、均属于脂肪链烃
B.1-丁烯分子的键线式:
C.丁二烯和丁烯互为同系物
D.烷烃()的命名为:3,3-二甲基-4-乙基己烷
7.下列反应的化学方程式错误的是
A.乙醛溶液与足量银氨溶液共热:
B.苯酚钠溶液中通入少量的:
C.溴乙烷与NaOH的乙醇溶液共热:
D.光照下甲苯与氯气反应生成一氯代物:
8.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:YB.化合物WY3中只存在离子键
C.原子半径:W>Z>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
9.下列各组离子,在指定的环境中能大量共存的是
A.由水电离出的的溶液中:,,,
B.滴加酚酞显红色的溶液中:,,,
C.在的溶液中:,,,
D.使甲基橙变红的溶液中:,,,
10.2023年杭州亚运会在场馆建设中用到一种耐腐蚀、耐高温的涂料是以某双环烯酯()为原料制得的,下列说法不正确的是
A. 1 mol双环烯酯能与2 mol H2发生加成反应
B. 该双环烯酯完全加氢后的产物一氯代物有7种
C. 该双环烯酯的水解产物均能使酸性高锰酸钾褪色
D. 该双环烯酯分子中有2个手性碳原子
11.常温下,几种弱酸的电离平衡常数如表所示,下列说法正确的是
化学式 HCOOH H2CO3 HCN
电离平衡常数 K=1.8×10﹣4 K1=4.3×10﹣7 K2=5.6×10﹣11 K=4.9×10﹣10
A.结合H+的能力由大到小:CO>CN﹣>HCO>HCOO﹣
B.等物质的量浓度的 HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa>NaCN
C.加水稀释 HCOOH溶液,其电离平衡常数将减小
D.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN﹣=2HCN+CO
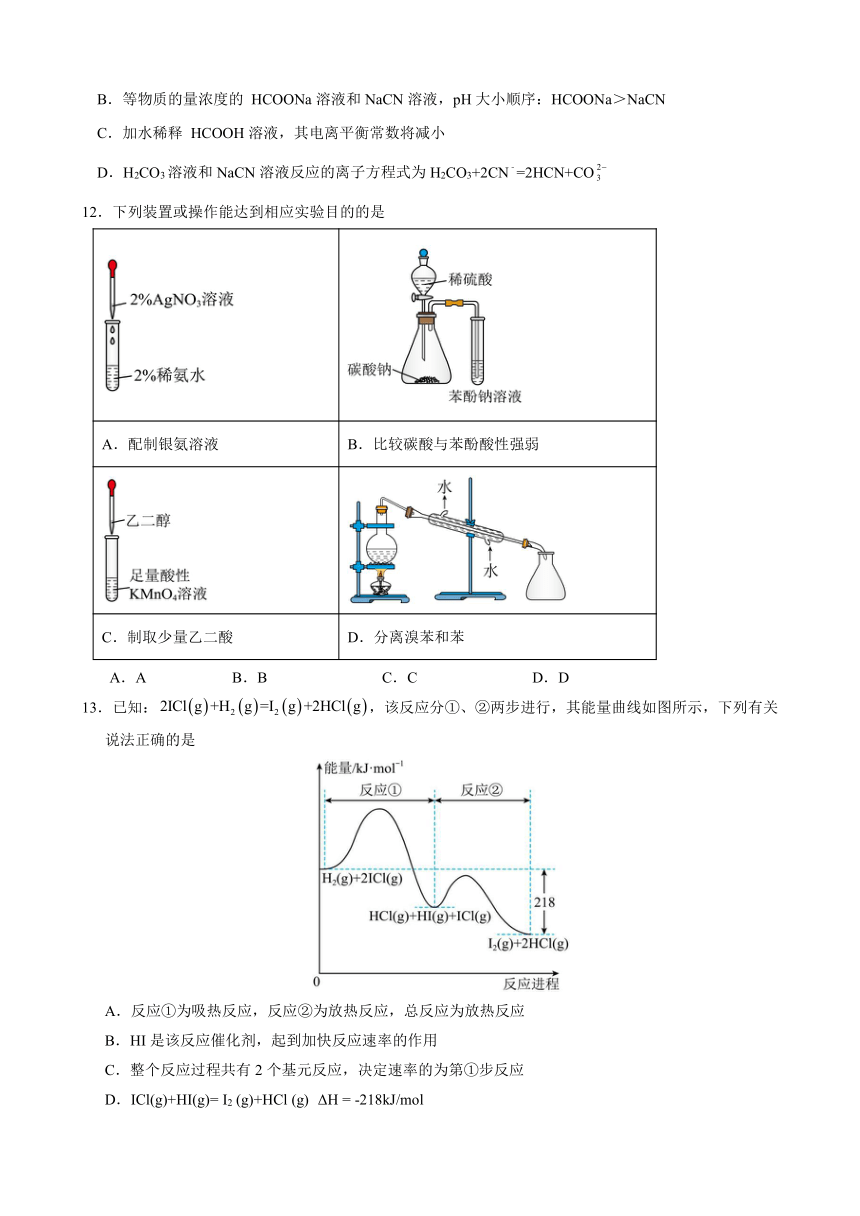
12.下列装置或操作能达到相应实验目的的是
A.配制银氨溶液 B.比较碳酸与苯酚酸性强弱
C.制取少量乙二酸 D.分离溴苯和苯
A.A B.B C.C D.D
13.已知:,该反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是
A.反应①为吸热反应,反应②为放热反应,总反应为放热反应
B.HI是该反应催化剂,起到加快反应速率的作用
C.整个反应过程共有2个基元反应,决定速率的为第①步反应
D.ICl(g)+HI(g)= I2 (g)+HCl (g) ΔH = -218kJ/mol
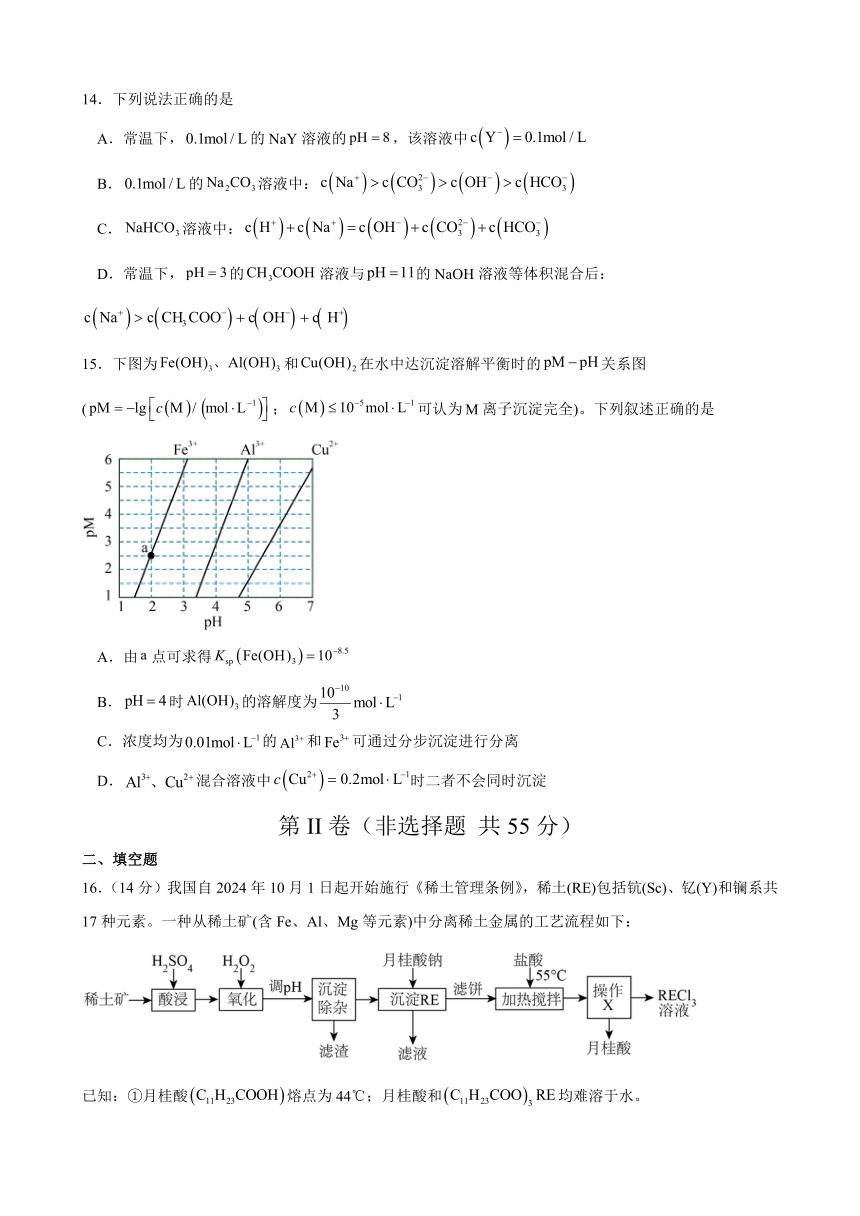
14.下列说法正确的是
A.常温下,的NaY溶液的,该溶液中
B.的溶液中:
C.溶液中:
D.常温下,的溶液与的NaOH溶液等体积混合后:
15.下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
A.由点可求得
B.时的溶解度为
C.浓度均为的和可通过分步沉淀进行分离
D.混合溶液中时二者不会同时沉淀
第II卷(非选择题 共55分)
二、填空题
16.(14分)我国自2024年10月1日起开始施行《稀土管理条例》,稀土(RE)包括钪(Sc)、钇(Y)和镧系共17种元素。一种从稀土矿(含Fe、Al、Mg等元素)中分离稀土金属的工艺流程如下:
已知:①月桂酸熔点为44℃;月桂酸和均难溶于水。
②该工艺流程中稀土金属离子保持价;的。
③开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见下表:
离子
开始沉淀时的pH 8.8 1.5 3.6 6.2-7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化”步骤的主要目的是转化,发生反应的离子方程式为 。
(2)“沉淀除杂”前调pH的适宜范围是 ,滤渣的成分有 。
(3)“沉淀RE”后,滤液中浓度为2.4g/L。为确保滤饼中检测不到Mg元素,滤液中应低于 。
(4)①“加热搅拌”有利于加快溶出、提高产率,其原因是 。
②“操作X”的过程为:先 ,再固液分离。
(5)稀土元素钇(Y)可用于制备高活性的合金类催化剂,还原和熔融盐制备(稀土离子保持价不变),生成转移 电子。
17.(13分)实验室利用(亚硫酰氯)和晶体制备无水,并检验气体产物中是否含有,采用装置如下图所示(加热及夹持装置略)。
已知:常温下呈液态,沸点为,极易与水反应。
回答下列问题:
(1)仪器的名称是 ;为了充分回收未反应的,应对装置采取的有效措施是 。
(2)装置A中发生反应的化学方程式为 。实验室不采用直接加热晶体的方法制备无水,而是用与晶体共热的原因是 。
(3)装置的连接顺序为_______________________。
(4)实验结束后测定三颈烧瓶中的纯度。
取产品配成溶液,向其中加入足量溶液,再滴入几滴淀粉溶液,用标准溶液滴定至终点,重复三次,平均消耗溶液。(已知:)
①若溶液酸性较强,可能导致标准溶液变质,值偏大,原因是 (用离子方程式表示)。
②的纯度为 (用含的式子表示)。
18.(14分)让二氧化碳能够成功转化为人类可以利用的能源,是许多科学家正在研究的课题。
(1)我国科学家利用合成淀粉的研究已取得成功,其涉及的关键反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
Ⅱ. CO2(g)+H2(g) CO(g)+H2O(g)
Ⅲ. CO(g)+2H2(g) CH3OH(g)
①反应Ⅲ中 ;该反应在 条件下自发进行(填“高温”、“低温”、“任意温度”)。
②在一定条件下,向容积恒为1L的容器中按的比例通入气体,只发生反应Ⅰ,下列情况可以说明反应Ⅰ已经达到平衡的是 。
A.混合气体密度不再改变
B.混合气体平均相对分子质量不再改变
C.容器内的压强不再改变
D.容器中与的物质的量之比不再改变
(2)一定条件下,向1L恒容密闭容器中充入1mol和2mol,只发生反应Ⅰ。测得5min时的转化率在5种不同温度下的变化如下图所示。
①温度为K时,在0~5min内的平均反应速率 。
②分析a点至b点CO2转化率降低的原因: 。
(3)科学研究人员用下图所示装置原理,实现了的回收利用。
①X为电源的 极。
②写出生成的电极反应式 。
19.(14分)有机物数量众多,不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物的主要来源。现有下列几种有机物:
A. B. C. D. E.环戊烷 F. G.
已知:①Diels-Alder反应:;
②;
请回答下列问题:
(1)上述有机物中互为同系物的 (填字母,下同);互为同分异构体的是 。
(2)用系统命名法对D进行命名: ;D在催化剂作用下发生加聚反应的化学方程式为 。
(3)由B和D发生Diels-Alder反应的产物为(用键线式表示) 。
(4)G物质中官能团名称为 。
(5)下列不属于F与发生加成产物的是 。
a. b. c. d.
(6)D的一种同分异构体与酸性溶液反应后,经检测其产物为和,试推测该物质的结构简式为 。
答案
1—5 CDDBB 6—10 CBABB 11—15ABCBC
16.(1)
(2) 4.7~6.2
(3)
(4) 加热可以提高反应物粒子运动速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶出速度,提高产率 冷却结晶
(5)15
17.(1) (直形)冷凝管 用冰水浴冷却
(2) 可与水反应,且生成的可抑制的水解
(3)
(4)
18.(1) -90.2 低温 BC
(2) 0.36mol/(L·min) b点温度较低,5min时未达平衡状态,a点温度较高,化学反应速率较快,转化率更高
(3) 正
19.(1) AC DE
(2) 甲基丁烯
(3)
(4)碳氯键(氯原子)、羟基
(5)d
(6)
化 学 试 题
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Cl-35.5 Fe-56
第I卷(选择题 共45分)
选择题:(本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合)
1.化学与生产、生活、科技等方面密切相关,下列说法正确的是
A.实现“碳中和”具有直接贡献的一种措施:研发催化剂将转化为甲醇(),该过程中发生了氧化反应
B.“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,说明铁合金的硬度比纯铁小
C.可用于制玻璃、肥皂、造纸、纺织等工业
D.维生素C又称“抗坏血酸”,利用维生素C的氧化性,能帮助人体将食物中摄取的不易吸收的转变为易吸收的
2.下列化学用语表示错误的是
A.乙烯的结构简式: B.甲烷的空间填充模型:
C.的结构式: D.的电子式:
3.下列关于有机化合物的说法正确的是
A.甲烷中混有杂质乙烯,可用酸性高锰酸钾溶液除杂
B.和互为同系物
C.丙烯(CH2=CH-CH3)中所有原子一定共面
D.因为二氯甲烷没有同分异构体,所以甲烷为正四面体结构
4.汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
A.汉黄芩素的分子式为C16H13O5
B.该物质既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C.1mol该物质与溴水反应,最多消耗1molBr2 ,足量NaOH溶液反应,最多消耗4mol NaOH
D.该有机物中不含醚键
5.由下列实验方案、现象得出的结论正确的是
实验方案 现象 结论
A 向碘水中加入,振荡后静置 上层为紫红色 在中的溶解度大于在水中的溶解度
B 向溶液中加入乙醇 析出深蓝色固体 在乙醇中溶解度小
C 用毛皮摩擦过的带电橡胶靠近液流 液流方向改变 为正四面体结构
D 用pH计测相同浓度和的pH 前者小于后者 的推电子效应小于
A.A B.B C.C D.D
6.下列有关烃的说法错误的是
A.、、均属于脂肪链烃
B.1-丁烯分子的键线式:
C.丁二烯和丁烯互为同系物
D.烷烃()的命名为:3,3-二甲基-4-乙基己烷
7.下列反应的化学方程式错误的是
A.乙醛溶液与足量银氨溶液共热:
B.苯酚钠溶液中通入少量的:
C.溴乙烷与NaOH的乙醇溶液共热:
D.光照下甲苯与氯气反应生成一氯代物:
8.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:Y
C.原子半径:W>Z>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
9.下列各组离子,在指定的环境中能大量共存的是
A.由水电离出的的溶液中:,,,
B.滴加酚酞显红色的溶液中:,,,
C.在的溶液中:,,,
D.使甲基橙变红的溶液中:,,,
10.2023年杭州亚运会在场馆建设中用到一种耐腐蚀、耐高温的涂料是以某双环烯酯()为原料制得的,下列说法不正确的是
A. 1 mol双环烯酯能与2 mol H2发生加成反应
B. 该双环烯酯完全加氢后的产物一氯代物有7种
C. 该双环烯酯的水解产物均能使酸性高锰酸钾褪色
D. 该双环烯酯分子中有2个手性碳原子
11.常温下,几种弱酸的电离平衡常数如表所示,下列说法正确的是
化学式 HCOOH H2CO3 HCN
电离平衡常数 K=1.8×10﹣4 K1=4.3×10﹣7 K2=5.6×10﹣11 K=4.9×10﹣10
A.结合H+的能力由大到小:CO>CN﹣>HCO>HCOO﹣
B.等物质的量浓度的 HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa>NaCN
C.加水稀释 HCOOH溶液,其电离平衡常数将减小
D.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN﹣=2HCN+CO
12.下列装置或操作能达到相应实验目的的是
A.配制银氨溶液 B.比较碳酸与苯酚酸性强弱
C.制取少量乙二酸 D.分离溴苯和苯
A.A B.B C.C D.D
13.已知:,该反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是
A.反应①为吸热反应,反应②为放热反应,总反应为放热反应
B.HI是该反应催化剂,起到加快反应速率的作用
C.整个反应过程共有2个基元反应,决定速率的为第①步反应
D.ICl(g)+HI(g)= I2 (g)+HCl (g) ΔH = -218kJ/mol
14.下列说法正确的是
A.常温下,的NaY溶液的,该溶液中
B.的溶液中:
C.溶液中:
D.常温下,的溶液与的NaOH溶液等体积混合后:
15.下图为和在水中达沉淀溶解平衡时的关系图(;可认为离子沉淀完全)。下列叙述正确的是
A.由点可求得
B.时的溶解度为
C.浓度均为的和可通过分步沉淀进行分离
D.混合溶液中时二者不会同时沉淀
第II卷(非选择题 共55分)
二、填空题
16.(14分)我国自2024年10月1日起开始施行《稀土管理条例》,稀土(RE)包括钪(Sc)、钇(Y)和镧系共17种元素。一种从稀土矿(含Fe、Al、Mg等元素)中分离稀土金属的工艺流程如下:
已知:①月桂酸熔点为44℃;月桂酸和均难溶于水。
②该工艺流程中稀土金属离子保持价;的。
③开始溶解时的pH为8.8,有关金属离子沉淀的相关pH见下表:
离子
开始沉淀时的pH 8.8 1.5 3.6 6.2-7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化”步骤的主要目的是转化,发生反应的离子方程式为 。
(2)“沉淀除杂”前调pH的适宜范围是 ,滤渣的成分有 。
(3)“沉淀RE”后,滤液中浓度为2.4g/L。为确保滤饼中检测不到Mg元素,滤液中应低于 。
(4)①“加热搅拌”有利于加快溶出、提高产率,其原因是 。
②“操作X”的过程为:先 ,再固液分离。
(5)稀土元素钇(Y)可用于制备高活性的合金类催化剂,还原和熔融盐制备(稀土离子保持价不变),生成转移 电子。
17.(13分)实验室利用(亚硫酰氯)和晶体制备无水,并检验气体产物中是否含有,采用装置如下图所示(加热及夹持装置略)。
已知:常温下呈液态,沸点为,极易与水反应。
回答下列问题:
(1)仪器的名称是 ;为了充分回收未反应的,应对装置采取的有效措施是 。
(2)装置A中发生反应的化学方程式为 。实验室不采用直接加热晶体的方法制备无水,而是用与晶体共热的原因是 。
(3)装置的连接顺序为_______________________。
(4)实验结束后测定三颈烧瓶中的纯度。
取产品配成溶液,向其中加入足量溶液,再滴入几滴淀粉溶液,用标准溶液滴定至终点,重复三次,平均消耗溶液。(已知:)
①若溶液酸性较强,可能导致标准溶液变质,值偏大,原因是 (用离子方程式表示)。
②的纯度为 (用含的式子表示)。
18.(14分)让二氧化碳能够成功转化为人类可以利用的能源,是许多科学家正在研究的课题。
(1)我国科学家利用合成淀粉的研究已取得成功,其涉及的关键反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
Ⅱ. CO2(g)+H2(g) CO(g)+H2O(g)
Ⅲ. CO(g)+2H2(g) CH3OH(g)
①反应Ⅲ中 ;该反应在 条件下自发进行(填“高温”、“低温”、“任意温度”)。
②在一定条件下,向容积恒为1L的容器中按的比例通入气体,只发生反应Ⅰ,下列情况可以说明反应Ⅰ已经达到平衡的是 。
A.混合气体密度不再改变
B.混合气体平均相对分子质量不再改变
C.容器内的压强不再改变
D.容器中与的物质的量之比不再改变
(2)一定条件下,向1L恒容密闭容器中充入1mol和2mol,只发生反应Ⅰ。测得5min时的转化率在5种不同温度下的变化如下图所示。
①温度为K时,在0~5min内的平均反应速率 。
②分析a点至b点CO2转化率降低的原因: 。
(3)科学研究人员用下图所示装置原理,实现了的回收利用。
①X为电源的 极。
②写出生成的电极反应式 。
19.(14分)有机物数量众多,不仅构成了生机勃勃的生命世界,也是燃料、材料、食品和药物的主要来源。现有下列几种有机物:
A. B. C. D. E.环戊烷 F. G.
已知:①Diels-Alder反应:;
②;
请回答下列问题:
(1)上述有机物中互为同系物的 (填字母,下同);互为同分异构体的是 。
(2)用系统命名法对D进行命名: ;D在催化剂作用下发生加聚反应的化学方程式为 。
(3)由B和D发生Diels-Alder反应的产物为(用键线式表示) 。
(4)G物质中官能团名称为 。
(5)下列不属于F与发生加成产物的是 。
a. b. c. d.
(6)D的一种同分异构体与酸性溶液反应后,经检测其产物为和,试推测该物质的结构简式为 。
答案
1—5 CDDBB 6—10 CBABB 11—15ABCBC
16.(1)
(2) 4.7~6.2
(3)
(4) 加热可以提高反应物粒子运动速度,搅拌增加溶剂与溶质的接触面积,使溶出更彻底,提高溶出速度,提高产率 冷却结晶
(5)15
17.(1) (直形)冷凝管 用冰水浴冷却
(2) 可与水反应,且生成的可抑制的水解
(3)
(4)
18.(1) -90.2 低温 BC
(2) 0.36mol/(L·min) b点温度较低,5min时未达平衡状态,a点温度较高,化学反应速率较快,转化率更高
(3) 正
19.(1) AC DE
(2) 甲基丁烯
(3)
(4)碳氯键(氯原子)、羟基
(5)d
(6)
同课章节目录
