江苏省2024-2025学年高三考前仿真模拟考试化学试题(PDF版,含答案)
文档属性
| 名称 | 江苏省2024-2025学年高三考前仿真模拟考试化学试题(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 735.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-22 09:39:28 | ||
图片预览




文档简介
2025 届高三考前仿真模拟考试
化学试题(一)
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 8页,包含选择题(第 1题~第 13题,共 13题)、非选择题(第 14题~
第 17题,共 4题)共两部分。本卷满分 100分,考试时间为 75分钟。考试结束后,
请将答题卡交回。
2.答题前,请务必将自己的姓名、考试证号用书写黑色字迹的 0.5毫米签字笔填写在
答题卡上。
3.作答选择题,必须用 2B铅笔把答题卡上对应题目的答案标号涂黑涂满;如需改动,
请用橡皮擦干净后,再选涂其它答案。答非选择题必须用书写黑色字迹的 0.5毫米
签字笔写在答题卡上的指定位置,作答在其它位置一律无效。
4.如有作图需要,可用 2B铅笔作答,并请加黑加粗,描写清楚。
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Cl-35.5 Co-59
一、单项选择题:共 13题,每题 3分, 共 39分。每题只有一个选项最符合题意。
1. 我国与共建“一带一路”国家进出口规模再创历史新高。下列贸易商品的主要成分不.
属.于.有机物的是
A.半导体芯片 B.丝绸 C.棉花 D. 油脂
浓硫酸
2. 反应 CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O可用于制备乙酸乙酯。下△
列有关说法正确的是
A.H2O分子的 VSEPR 模型: B.乙酸分子中σ与π键数目比为 7∶1
C.羟基的电子式: D.乙酸乙酯分子中含有离子键
3. 实验室用 SO2和MgO悬浊液制取MgSO3,下列实验原理与装置不.能.达到实验目的的是
70%硫酸
气体
气体 气体
NaHSO3(s) MgO NaHSO3
悬浊液 溶液
甲 乙 丙 丁
A.用装置甲制取 SO2 B.用装置乙收集 SO2
C.用装置丙制取MgSO3 D.用装置丁吸收尾气 SO2
第 1页,共 8页
OH
CH3
4. 麻黄碱盐酸盐( + )是治疗支气管哮喘的常用药物。下列说法正确的是NH2 Cl
H3C
A.原子半径:r(C)<r(N) B.元素的电负性:χ(O)<χ(S)
C.酸性:HNO3<HClO4 D.元素的第一电离能:I1(N)<I1(O)
阅读下列材料,完成 5~7题:
黄铜矿(CuFeS2)用 Fe2(SO4)3溶液浸泡后生成单质硫。Cu2O加入到稀硫酸中,溶液变
蓝色并有紫红色固体产生。CuSO 溶液中的 Cu 2+4 在水中以水合离子[Cu(H O) ]2+2 4 存在,向
其中滴入氨水可制备硫酸四氨合铜[Cu(NH3)4]SO4;Cu在 O2存在下也能与氨水反应生成
[Cu(NH3)4]2+。CuCl难溶于水,溶于不同浓度的 KCl溶液中可得到[CuCl ]-2 和[CuCl ]2 3 。
5. 下列说法正确的是
A.Cu2O晶胞如题 5图所示,与 O距离最近的 Cu有 2个
B.[Cu(H O) 2+2 4] 中的配位原子为 H原子
C.NH3转化为[Cu(NH ) ]2+3 4 后 H-N-H键角变大
D [CuCl ]-. 2 和[CuCl3]2 中 Cu元素的杂化类型相同
6. 题 5图下列化学反应表示正确的是
A.CuFeS2与 Fe2(SO4)3溶液反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S
B.Cu2O溶于稀硫酸:Cu2O+2H+=2Cu++H2O
C.CuCl溶于 KCl溶液:2Cu++5Cl-=[CuCl ]-+ [CuCl ]2 2 3
D.Cu在 O2存在下与氨水反应:2Cu+8NH3+O2+4H+=2[Cu(NH3)4]2++2H2O
7. 下列物质结构与性质或物质性质与用途具有对应关系的是
A.CuFeS2呈金黄色,可用于制取单质 Cu
B.CuSO4溶液呈酸性,可用于湿法炼铜
C.CuCl不溶于水,可用于制取 K[CuCl2]
D.Cu 2+有空轨道,可与 NH3反应制[Cu(NH 2+3)4]
8. 含 Ru(钌)化合物可催化 CO2转化为 HCOOH,其反应机理如题 8图所示。
下列说法不.正.确.的是 2H2O
H
Ru
H 2CO2
A.该催化剂不能提高 CO2的平衡转化率 过程 3
2H2 过程 1 O
B.过程 1中 CO2发生还原反应 OH O C HRu
OH Ru
C 3 1molH O 2mol 过程 2
O C H
.过程 中有 2 生成时有 电子转移 O
2HCOOH 2H2O
D.整个转化过程中 Ru和 O元素的化合价不变
题 8图
第 2页,共 8页
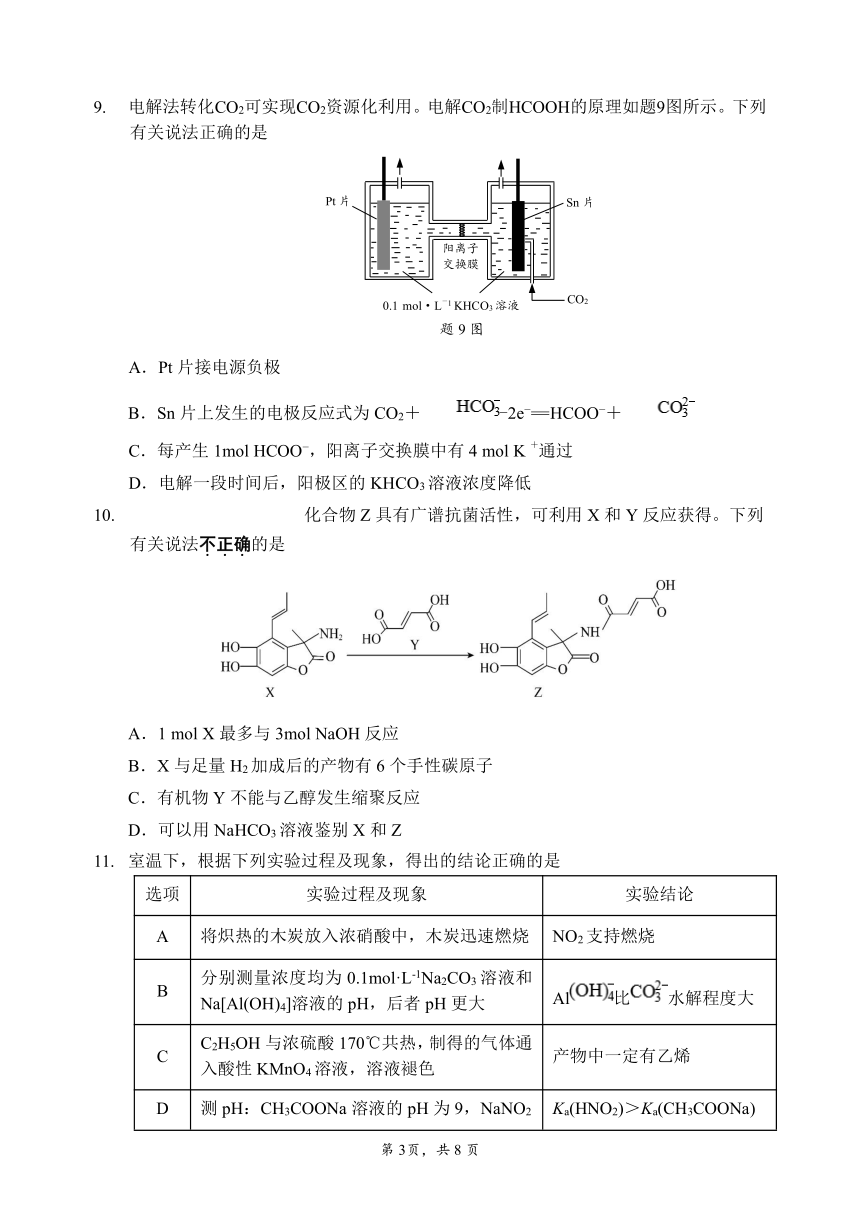
9. 电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如题9图所示。下列
有关说法正确的是
Pt片 Sn 片
阳离子
交换膜
0.1 mol -·L 1KHCO CO3溶液 2
题 9图
A.Pt片接电源负极
B.Sn片上发生的电极反应式为 CO2+ -2e =HCOO +
C +.每产生 1mol HCOO ,阳离子交换膜中有 4 mol K 通过
D.电解一段时间后,阳极区的 KHCO3溶液浓度降低
10. 化合物 Z具有广谱抗菌活性,可利用 X和 Y反应获得。下列
有关说法不.正.确.的是
A.1 mol X最多与 3mol NaOH反应
B.X与足量 H2加成后的产物有 6个手性碳原子
C.有机物 Y不能与乙醇发生缩聚反应
D.可以用 NaHCO3溶液鉴别 X和 Z
11. 室温下,根据下列实验过程及现象,得出的结论正确的是
选项 实验过程及现象 实验结论
A 将炽热的木炭放入浓硝酸中,木炭迅速燃烧 NO2支持燃烧
分别测量浓度均为 0.1mol·L-1Na2CO3溶液和
B
Na[Al(OH)4]溶液的 pH,后者 pH更大 Al 比 水解程度大
C2H5OH与浓硫酸 170℃共热,制得的气体通
C 产物中一定有乙烯
入酸性 KMnO4溶液,溶液褪色
D 测 pH:CH3COONa溶液的 pH为 9,NaNO2 Ka(HNO2)>Ka(CH3COONa)
第 3页,共 8页
溶液的 pH为 8
12. 室温下,通过下列实验探究 H2SO3溶液的性质。
实验 1:测定 0.40mol·L-1新制 H2SO3溶液,其 pH约为 1
实验 2:将等体积浓度均为 0.40mol·L-1BaCl2溶液与新制 H2SO3溶液混合,出现
白色浑浊
实验 3:向上述实验 2后得到的混合物中滴加过量的 H2O2溶液,充分振荡后出现白
色沉淀
已知:K -2 -7a1(H2SO3)=1.5×10 ,Ka2(H2SO3)=1.0×10 ,Ksp(BaSO3)=5.0×10-10,
Ksp(BaSO4)=1.1×10-10
下列说法正确的是
A.0.40mol·L-1H2SO3溶液中存在 c(H+)<c(HS )+c(S )
B.将 0.40mol·L-1H2SO3溶液稀释到 0.20mol·L-1,c(S )快速增大
C. 实验 2中充分反应后静置,上层清液中有:c(Ba2+)·c(S )<Ksp(BaSO3)
D. 实验 3中发生的主要反应为 Ba2++H2SO3+H2O2=BaSO4↓+2H++H2O
13. 使用 CH3COOCH3与 H2反应制 C2H5OH过程中的主要反应为
反应 I:CH3COOCH3(g)+2H2(g)=C2H5OH(g)+CH3OH(g) ΔH1=1004kJ·mol-1
反应 II:CH3COOCH 13(g)+H2(g)=CH3CHO(g)+CH3OH(g) ΔH2=1044kJ·mol-
反应 III:CH3COOCH3(g)+C2H5OH(g)=CH3COOCH2CH3(g)+CH3OH(g)
ΔH3= 1160kJ·mol-1
在催化剂作用下,在 1.0×105Pa、n 起始(CH3COOCH3)∶n 起始(H2)=1∶2时,若仅考虑上
述反应,反应相同时间,CH3COOCH3转化率、C2H5OH和 CH3COOCH2CH3的选择性
随温度的变化如题 13图所示。[C2H5OH的选择
80 80
= n(转化为 C2H5OH的 CH3COOCH3)
CH3COOCH2CH3
性 ×
n(转化的 CH3COOCH3) 60 60
CH CH OH
100%] 3 2。下列说法正确的是 40 40
A.反应 CH3CHO(g)+H2(g)=C2H5OH(g)的焓变 20 20
1 CH3COOCH3ΔH= 40 kJ·mol- 0 0
165 175 185 195 205 215 225 235
B.185℃时,若起始 n(CH3COOCH3)为 1mol, 温度/℃
则反应后体系中 C2H5OH为 0.04 mol 题 13图
C.温度在 165℃~205℃之间,反应后的体系中存在 CH3CHO
第 4页,共 8页
CH3COOCH3转化率/%
选择性/%
D.温度在 225℃~235℃之间,C2H5OH的选择性保持不变,说明反应 I达到了平衡
二、非选择题:共 4题,共 61分。
14. (15分)以钴锰废渣(含 LiCoO2,MnCO3,炭黑和 CaCO3、Fe 等)为原料制备 Co3O4。
钴锰废渣 酸浸、还原 除杂 萃取、反萃取 制备
(1)“酸浸、还原”。向钴锰废渣中加入稀 H2SO4和 H2O2,充分反应后,过滤。
①在加料完成后,提高浸取效率的措施有 ▲ (写 2点)。
②过滤后,滤渣的主要成分为 ▲ 。
(2)“除杂”。在搅拌下,向“酸浸、还原”后得到的滤液中加入MnCO3调节溶液
的 pH=4,除去溶液中的 Fe3+,过滤。向得到的滤液中加入MnF2固体除去溶液
中的 Ca2+。
①加入MnCO3除去溶液中 Fe3+的离子方程式为 ▲ 。
②滤液中加入MnF2固体发生的反应为MnF +Ca2+2 CaF2+Mn2+。已知:K
>105认为反应进行完全;Ksp(MnF2)=1.2×10-3,Ksp(CaF2)=1.6×10-10。
结合计算解释MnF 能除去 Ca 2+2 的原因: ▲ 。
(3)“萃取和反萃取”。向除杂后得到的滤液中加入有机萃取剂(用 HA表示)萃取金
2+ +
属离子,原理为 Co +2HA(有机层) CoA2(有机层)+2H (水层),
充分反应后,分离出有机层。向有机层中加入稀硫酸,进行反萃取得到富含 Co2+
的溶液。
①“萃取”时,随着 pH的升高,Co 2+在有机萃取剂中萃取率增大,其原因是
▲ 。
②“反萃取”时,为使 Co 2+尽可能多地转移到水层,应选择的实验条件或采取
的实验操作有 ▲ 。
(4)“制备”。已知:CoC2O4从水溶液中析出的主要成分为 CoC2O4·2H2O,其在空气
中受热的质量变化曲线如题 14图所示。 18.3
请补充由上述反萃取后得到的富含 Co 2+ 16 A(150℃,14.70g)
B(225℃,14.70g)
的溶液制备 Co3O4的实验方案:取富含
12
Co 2+的溶液, ▲ ,得到 Co3O4。
8
(须使用的试剂:0.1mol·L 1Na2C2O4溶液、 C(300℃,8.03g)
150 300 450 600 750
第 5页,共 8页 温度/℃
题 14图
剩余固体质量/g
盐酸、BaCl2溶液)。
第 6页,共 8页
15. (16分)化合物 H是四氢异喹啉阿司匹林衍生物,其合成路线如下:
O O H CH3
OH SOCl2 C H3CO N
75 Cl
POCl3
H C ℃3 H C Et3N,CH2Cl2,0℃ H3CO O3 甲苯,150℃
A B D
D
H3CO H3CO O H3CO
N NH G: O CH3
H CO H3CO C N3
NaBH4,0℃ O OH H3CO
CH3OH O O CH3DCC,HOBt,CH2Cl2,45℃
CH3 CH3 CH O3
E F H
D D D
(1)C的分子式为 C10H15NO2,则 C的结构简式为 ▲ 。
(2)D分子中含氧官能团的名称为 ▲ ,分子中采取 sp2杂化的碳原子数目为
▲ 。
(3)D→E过程中发生的化学反应依次为加成反应和消去反应,则过程中生成的中间
体 X的结构简式为 ▲ 。
(4)G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①1mol 该物质完全水解最多消耗 4 mol NaOH。
②在酸性条件下水解后的一种产物能与 FeCl3发生显色反应,且有 3种不同化学
环境的氢。
NH2
(5)写出以 CH2CH2OH 和 为原料制备 的合成路线
流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) ▲ 。
16. (15分)通过测定某蛋白质样品中氮元素的含量可以确定其优劣。“凯氏定氮法”测
定蛋白质中含氮量的实验方案如下:
浓硫酸 浓 NaOH溶液
蛋白质
消化 (NH4)2SO4 蒸出、吸收 (NH4)2B4O7 含量测定
样品
CuSO4溶液 H3BO3
(1)“消化”。将蛋白质样品与 CuSO4溶液(作催化剂)和浓硫酸中的一种混合后
第 7页,共 8页
放入三颈烧瓶中,实验装置如题 16图所示,然后再滴加其中的另一种物质,在
加热条件下充分反应,蛋白质中的氮
滴液漏斗
元素转化为(NH4)2SO4。
①滴液漏斗中盛放的物质是 K
N2
▲ 。
NaOH
②装置 B的作用是 ▲ 。 蛋白质 溶液
③反应结束后,打开止水夹 K并不 A B C
题 16图
断通入 N2,其原因是 ▲ 。
(2)“吸收”。向得到的(NH4)2SO4中加入足量的 NaOH溶液充分反应后,加热将所
得 NH3蒸出,然后用硼酸(H3BO3)溶液吸收,得到(NH4)2B4O7溶液。
①硼酸是一元弱酸,易与水结合生成 B(OH) 4,其水溶液显酸性的原因是 ▲
(用离子方程式表示)。
②NH3与 H3BO3反应生成(NH4)2B4O7的化学方程式为 ▲ 。
(3)“测定”。称取 0.8000g蛋白质样品,按照上述流程制取(NH4)2B4O7溶液,然后
将其加水稀释至 100mL。取出 25.00 mL放入锥形瓶中,滴加几滴指示剂,然后
用 0.1000 moL·L 1盐酸标准溶液滴定,滴定终点时消耗盐酸的体积为 20.00mL。
已知:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3。
①接近终点时滴加半滴盐酸溶液的操作:慢慢转动滴定管的活塞,使滴定管的
尖嘴处悬挂半滴液体不滴落, ▲ 。
②该样品中氮元素的质量分数为 ▲ 。(写出计算过程,否则不得分!)
17. (15分)性能优越的催化剂是实现二氧化碳加氢制甲烷工业化的关键。
(1)CO2在 Ni/γ-Al2O3催化剂表面加氢合成甲烷过程中发生以下两个反应:
反应 I:CO2(g)+4H2(g) = CH4(g)+2H2O(g) H1= -143.9 kJ·mol 1
反应 II:CO2(g)+H2(g) = CO(g)+H2O(g) H2
①已知在 25℃、101kPa 下,由最稳定单质生成 1 mol某纯物质的焓变称为该物
质的标准摩尔生成焓,用 表示。如表所示为几种常
见物质的标准摩尔生成焓。
物质 CO2(g) H2(g) H2O(g) CO(g)
-393.5 0 -241.8 -110.5
)
反应 2CO(g)+2H2(g) = CO2(g)+CH4(g)的焓变为 ▲ 。
第 8页,共 8页
②一定压强下,将一定比例 CO2和 H2通
过装有 Ni/γ-Ai2O3催化剂的反应器,反 80
应相同时间,测得 CO2转化率随温度变 60
化情况如题 17 图-1所示(虚线代表平 40
衡转化率)。高于 320℃后,CO2转化率 20
略有下降,可能原因 0200 250 300 350 400
是 ▲ 。 温度/℃ 0 0
③γ-Al2O3因价格低廉、较高的热稳定 题 17图-1
性和比表面积而成为工业上最常用的
催化剂载体。通过 Rh(NO3)3(硝酸铑)热分解将铑有效负载在γ-Al2O3表
面能有效提高催化性能的可能原因是 ▲ 。
(2)CeO2催化 CO2与 H2转化为 CH4的机理如题 17图-2所示。
CH4 H2 H2O
催化剂载体 (i) 催化剂载体
(iv) (ii)
H CO2
O
2 O CeH H
H2O C 空位H C2
CeO2 CeO2-x
催化剂载体 催化剂载体 _ _
(iii) Ce4+或 Ce3+ O2 或氧空位(无 O2 )
题 17图-2 题 17图-3
①在催化过程中由 CeO2转变成 CeO2-x晶胞的组成结构变化如题 17图-3所示,
一个 CeO2-x晶胞中 Ce4+和 Ce3+个数比为 ▲ 。
②催化剂中掺入少量 CaO,用 Ca2+替代 CeO2结构中部分 Ce4+形成 Ca xCe1-xOy可
提高催化效率,其原因是 ▲ 。
(3)通过 Sonogashira 偶联反应(如下图所示),将 CoTBrPP(甲)在 CuI与钯基催
化剂的作用下,在甲上枝接 PTAB(1,3,5-三乙炔苯聚合物)形成对 CH4有较高
选择性的 CoTBrPP-PTAB-Cu新型催化剂(乙)。
甲 乙
①CoTBrPP-PTAB-Cu催化剂比 CoTBrPP具有更好的导电性的原因是 ▲ 。
②实验表明 CoTBrPP和 CoTBrPP-PTAB-Cu的 ECSA(电化学活性面积,即参与
电化学反应的有效面积)分别是 7.1mF· cm-2和 3.8mF·cm-2,偶联后 ECSA降低
的可能原因是 ▲ 。
第 9页,共 8页
CO2转化率/%
化学试题参考答案及评分标准
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1.A 2.B 3.D 4.C 5.C 6.A 7.D 8.C 9.D 10.A
11.B 12.D 13.B
二、非选择题:共 4 题,共 61 分。
14.(15分)
(1)①适当搅拌,适当升高温度 (2分)
②CaSO4、炭黑 (2分)
(2)①3MnCO 3+ 2+3+2Fe +3H2O=2Fe(OH)3+3Mn +3CO2↑ (2分)
c Mn2+K Ksp MnF2 ②此反应 = 2+ = =7.5×10
6>105,反应进行完全,因此可将
c Ca Ksp CaF2
Ca2+完全除尽 (2分)
(3)①随 pH增大,溶液中 c(H+)减小,平衡往正向移动,MAn(有机层)浓度增大,
萃取率增大 (2分)
②适当提高稀硫酸的浓度(或充分振荡分液漏斗或用萃取剂分多次萃取)(2分)
(4)边搅拌向其中加入 0.1mol·L 1 Na2C2O4溶液,直至向上层清液中滴加 Na2C2O4
溶液不产生沉淀,停止滴加。过滤,洗涤滤渣至取最后一次洗涤滤液滴加盐酸
和 BaCl2溶液不再生成沉淀。将滤渣置于空气中加热到 300℃以上,充分反应至
固体质量不再改变 (3
分)
15.(16分)
H3CO NH2
(1) (2分)
H3CO
(2)醚键、酰胺基 (2分)
13 (1分)
第 10页,共 8页
(3) (3分)
(4) (3分)
(5)
O2 O2 SOCl2
Cu,△ 催化剂,△ △
POCl3
(5分)
甲苯,150℃
Et3N,CH2Cl2,0℃
16.(15分)
(1)①浓硫酸 (2分)
②作安全瓶,防止 NaOH溶液倒吸 (2分)
③将生成的 SO2赶入装置 C中完全吸收 (2分)
(2)①H3BO3+H2O +H+ (2 分)
②2NH3+4H3BO3=(NH4)2B4O7+5H2O (2分)
(3)①用锥形瓶内壁将其碰下来,并用蒸馏水将其冲入锥形瓶内 (2分)
②解:25.00mL:
n(HCl)= 0.1000mol·L 1×20.00×10 3 L=2.000×10 3 mol (1分)
由题意可得关系式:N~ NH+4~HCl
n(N)=n(HCl)=2.000×10 3 mol
m(N)=nM=2.000×10 3 mol×14g·mol-1=0.028g
100.00mL:
m(N)=0.028g×4=0.112 g (1分)
0.112 g
样品中铁元素的质量分数为 ×100%=14% (1分)
0.8000 g
17.(15分)
(1)①-226.3 kJ·mol 1 (2分)
②320℃时,CO2和 H2催化合成反应已达到平衡,升高温度,反应Ⅰ平衡向逆反
应方向移动占主导,CO2的转化率减小 (2分)
第 11页,共 8页
③Rh(NO3)3热分解放出大量气体使得γ-Al2O3的表面积增大 (2分)
1 2x
(2)① (3分)
2x
②结构中氧空位增加 (2分)
(3)①三乙炔苯聚合物中的碳是 sp和 sp2杂化结构,有未参加杂化的 p轨道上的电
子 (2分)
②CoTBrPP表面接枝了聚 1,3,5-三乙炔苯,使得活性位点难以暴露 (2分)
第 12页,共 8页
化学试题(一)
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共 8页,包含选择题(第 1题~第 13题,共 13题)、非选择题(第 14题~
第 17题,共 4题)共两部分。本卷满分 100分,考试时间为 75分钟。考试结束后,
请将答题卡交回。
2.答题前,请务必将自己的姓名、考试证号用书写黑色字迹的 0.5毫米签字笔填写在
答题卡上。
3.作答选择题,必须用 2B铅笔把答题卡上对应题目的答案标号涂黑涂满;如需改动,
请用橡皮擦干净后,再选涂其它答案。答非选择题必须用书写黑色字迹的 0.5毫米
签字笔写在答题卡上的指定位置,作答在其它位置一律无效。
4.如有作图需要,可用 2B铅笔作答,并请加黑加粗,描写清楚。
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Cl-35.5 Co-59
一、单项选择题:共 13题,每题 3分, 共 39分。每题只有一个选项最符合题意。
1. 我国与共建“一带一路”国家进出口规模再创历史新高。下列贸易商品的主要成分不.
属.于.有机物的是
A.半导体芯片 B.丝绸 C.棉花 D. 油脂
浓硫酸
2. 反应 CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O可用于制备乙酸乙酯。下△
列有关说法正确的是
A.H2O分子的 VSEPR 模型: B.乙酸分子中σ与π键数目比为 7∶1
C.羟基的电子式: D.乙酸乙酯分子中含有离子键
3. 实验室用 SO2和MgO悬浊液制取MgSO3,下列实验原理与装置不.能.达到实验目的的是
70%硫酸
气体
气体 气体
NaHSO3(s) MgO NaHSO3
悬浊液 溶液
甲 乙 丙 丁
A.用装置甲制取 SO2 B.用装置乙收集 SO2
C.用装置丙制取MgSO3 D.用装置丁吸收尾气 SO2
第 1页,共 8页
OH
CH3
4. 麻黄碱盐酸盐( + )是治疗支气管哮喘的常用药物。下列说法正确的是NH2 Cl
H3C
A.原子半径:r(C)<r(N) B.元素的电负性:χ(O)<χ(S)
C.酸性:HNO3<HClO4 D.元素的第一电离能:I1(N)<I1(O)
阅读下列材料,完成 5~7题:
黄铜矿(CuFeS2)用 Fe2(SO4)3溶液浸泡后生成单质硫。Cu2O加入到稀硫酸中,溶液变
蓝色并有紫红色固体产生。CuSO 溶液中的 Cu 2+4 在水中以水合离子[Cu(H O) ]2+2 4 存在,向
其中滴入氨水可制备硫酸四氨合铜[Cu(NH3)4]SO4;Cu在 O2存在下也能与氨水反应生成
[Cu(NH3)4]2+。CuCl难溶于水,溶于不同浓度的 KCl溶液中可得到[CuCl ]-2 和[CuCl ]2 3 。
5. 下列说法正确的是
A.Cu2O晶胞如题 5图所示,与 O距离最近的 Cu有 2个
B.[Cu(H O) 2+2 4] 中的配位原子为 H原子
C.NH3转化为[Cu(NH ) ]2+3 4 后 H-N-H键角变大
D [CuCl ]-. 2 和[CuCl3]2 中 Cu元素的杂化类型相同
6. 题 5图下列化学反应表示正确的是
A.CuFeS2与 Fe2(SO4)3溶液反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S
B.Cu2O溶于稀硫酸:Cu2O+2H+=2Cu++H2O
C.CuCl溶于 KCl溶液:2Cu++5Cl-=[CuCl ]-+ [CuCl ]2 2 3
D.Cu在 O2存在下与氨水反应:2Cu+8NH3+O2+4H+=2[Cu(NH3)4]2++2H2O
7. 下列物质结构与性质或物质性质与用途具有对应关系的是
A.CuFeS2呈金黄色,可用于制取单质 Cu
B.CuSO4溶液呈酸性,可用于湿法炼铜
C.CuCl不溶于水,可用于制取 K[CuCl2]
D.Cu 2+有空轨道,可与 NH3反应制[Cu(NH 2+3)4]
8. 含 Ru(钌)化合物可催化 CO2转化为 HCOOH,其反应机理如题 8图所示。
下列说法不.正.确.的是 2H2O
H
Ru
H 2CO2
A.该催化剂不能提高 CO2的平衡转化率 过程 3
2H2 过程 1 O
B.过程 1中 CO2发生还原反应 OH O C HRu
OH Ru
C 3 1molH O 2mol 过程 2
O C H
.过程 中有 2 生成时有 电子转移 O
2HCOOH 2H2O
D.整个转化过程中 Ru和 O元素的化合价不变
题 8图
第 2页,共 8页
9. 电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理如题9图所示。下列
有关说法正确的是
Pt片 Sn 片
阳离子
交换膜
0.1 mol -·L 1KHCO CO3溶液 2
题 9图
A.Pt片接电源负极
B.Sn片上发生的电极反应式为 CO2+ -2e =HCOO +
C +.每产生 1mol HCOO ,阳离子交换膜中有 4 mol K 通过
D.电解一段时间后,阳极区的 KHCO3溶液浓度降低
10. 化合物 Z具有广谱抗菌活性,可利用 X和 Y反应获得。下列
有关说法不.正.确.的是
A.1 mol X最多与 3mol NaOH反应
B.X与足量 H2加成后的产物有 6个手性碳原子
C.有机物 Y不能与乙醇发生缩聚反应
D.可以用 NaHCO3溶液鉴别 X和 Z
11. 室温下,根据下列实验过程及现象,得出的结论正确的是
选项 实验过程及现象 实验结论
A 将炽热的木炭放入浓硝酸中,木炭迅速燃烧 NO2支持燃烧
分别测量浓度均为 0.1mol·L-1Na2CO3溶液和
B
Na[Al(OH)4]溶液的 pH,后者 pH更大 Al 比 水解程度大
C2H5OH与浓硫酸 170℃共热,制得的气体通
C 产物中一定有乙烯
入酸性 KMnO4溶液,溶液褪色
D 测 pH:CH3COONa溶液的 pH为 9,NaNO2 Ka(HNO2)>Ka(CH3COONa)
第 3页,共 8页
溶液的 pH为 8
12. 室温下,通过下列实验探究 H2SO3溶液的性质。
实验 1:测定 0.40mol·L-1新制 H2SO3溶液,其 pH约为 1
实验 2:将等体积浓度均为 0.40mol·L-1BaCl2溶液与新制 H2SO3溶液混合,出现
白色浑浊
实验 3:向上述实验 2后得到的混合物中滴加过量的 H2O2溶液,充分振荡后出现白
色沉淀
已知:K -2 -7a1(H2SO3)=1.5×10 ,Ka2(H2SO3)=1.0×10 ,Ksp(BaSO3)=5.0×10-10,
Ksp(BaSO4)=1.1×10-10
下列说法正确的是
A.0.40mol·L-1H2SO3溶液中存在 c(H+)<c(HS )+c(S )
B.将 0.40mol·L-1H2SO3溶液稀释到 0.20mol·L-1,c(S )快速增大
C. 实验 2中充分反应后静置,上层清液中有:c(Ba2+)·c(S )<Ksp(BaSO3)
D. 实验 3中发生的主要反应为 Ba2++H2SO3+H2O2=BaSO4↓+2H++H2O
13. 使用 CH3COOCH3与 H2反应制 C2H5OH过程中的主要反应为
反应 I:CH3COOCH3(g)+2H2(g)=C2H5OH(g)+CH3OH(g) ΔH1=1004kJ·mol-1
反应 II:CH3COOCH 13(g)+H2(g)=CH3CHO(g)+CH3OH(g) ΔH2=1044kJ·mol-
反应 III:CH3COOCH3(g)+C2H5OH(g)=CH3COOCH2CH3(g)+CH3OH(g)
ΔH3= 1160kJ·mol-1
在催化剂作用下,在 1.0×105Pa、n 起始(CH3COOCH3)∶n 起始(H2)=1∶2时,若仅考虑上
述反应,反应相同时间,CH3COOCH3转化率、C2H5OH和 CH3COOCH2CH3的选择性
随温度的变化如题 13图所示。[C2H5OH的选择
80 80
= n(转化为 C2H5OH的 CH3COOCH3)
CH3COOCH2CH3
性 ×
n(转化的 CH3COOCH3) 60 60
CH CH OH
100%] 3 2。下列说法正确的是 40 40
A.反应 CH3CHO(g)+H2(g)=C2H5OH(g)的焓变 20 20
1 CH3COOCH3ΔH= 40 kJ·mol- 0 0
165 175 185 195 205 215 225 235
B.185℃时,若起始 n(CH3COOCH3)为 1mol, 温度/℃
则反应后体系中 C2H5OH为 0.04 mol 题 13图
C.温度在 165℃~205℃之间,反应后的体系中存在 CH3CHO
第 4页,共 8页
CH3COOCH3转化率/%
选择性/%
D.温度在 225℃~235℃之间,C2H5OH的选择性保持不变,说明反应 I达到了平衡
二、非选择题:共 4题,共 61分。
14. (15分)以钴锰废渣(含 LiCoO2,MnCO3,炭黑和 CaCO3、Fe 等)为原料制备 Co3O4。
钴锰废渣 酸浸、还原 除杂 萃取、反萃取 制备
(1)“酸浸、还原”。向钴锰废渣中加入稀 H2SO4和 H2O2,充分反应后,过滤。
①在加料完成后,提高浸取效率的措施有 ▲ (写 2点)。
②过滤后,滤渣的主要成分为 ▲ 。
(2)“除杂”。在搅拌下,向“酸浸、还原”后得到的滤液中加入MnCO3调节溶液
的 pH=4,除去溶液中的 Fe3+,过滤。向得到的滤液中加入MnF2固体除去溶液
中的 Ca2+。
①加入MnCO3除去溶液中 Fe3+的离子方程式为 ▲ 。
②滤液中加入MnF2固体发生的反应为MnF +Ca2+2 CaF2+Mn2+。已知:K
>105认为反应进行完全;Ksp(MnF2)=1.2×10-3,Ksp(CaF2)=1.6×10-10。
结合计算解释MnF 能除去 Ca 2+2 的原因: ▲ 。
(3)“萃取和反萃取”。向除杂后得到的滤液中加入有机萃取剂(用 HA表示)萃取金
2+ +
属离子,原理为 Co +2HA(有机层) CoA2(有机层)+2H (水层),
充分反应后,分离出有机层。向有机层中加入稀硫酸,进行反萃取得到富含 Co2+
的溶液。
①“萃取”时,随着 pH的升高,Co 2+在有机萃取剂中萃取率增大,其原因是
▲ 。
②“反萃取”时,为使 Co 2+尽可能多地转移到水层,应选择的实验条件或采取
的实验操作有 ▲ 。
(4)“制备”。已知:CoC2O4从水溶液中析出的主要成分为 CoC2O4·2H2O,其在空气
中受热的质量变化曲线如题 14图所示。 18.3
请补充由上述反萃取后得到的富含 Co 2+ 16 A(150℃,14.70g)
B(225℃,14.70g)
的溶液制备 Co3O4的实验方案:取富含
12
Co 2+的溶液, ▲ ,得到 Co3O4。
8
(须使用的试剂:0.1mol·L 1Na2C2O4溶液、 C(300℃,8.03g)
150 300 450 600 750
第 5页,共 8页 温度/℃
题 14图
剩余固体质量/g
盐酸、BaCl2溶液)。
第 6页,共 8页
15. (16分)化合物 H是四氢异喹啉阿司匹林衍生物,其合成路线如下:
O O H CH3
OH SOCl2 C H3CO N
75 Cl
POCl3
H C ℃3 H C Et3N,CH2Cl2,0℃ H3CO O3 甲苯,150℃
A B D
D
H3CO H3CO O H3CO
N NH G: O CH3
H CO H3CO C N3
NaBH4,0℃ O OH H3CO
CH3OH O O CH3DCC,HOBt,CH2Cl2,45℃
CH3 CH3 CH O3
E F H
D D D
(1)C的分子式为 C10H15NO2,则 C的结构简式为 ▲ 。
(2)D分子中含氧官能团的名称为 ▲ ,分子中采取 sp2杂化的碳原子数目为
▲ 。
(3)D→E过程中发生的化学反应依次为加成反应和消去反应,则过程中生成的中间
体 X的结构简式为 ▲ 。
(4)G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
①1mol 该物质完全水解最多消耗 4 mol NaOH。
②在酸性条件下水解后的一种产物能与 FeCl3发生显色反应,且有 3种不同化学
环境的氢。
NH2
(5)写出以 CH2CH2OH 和 为原料制备 的合成路线
流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) ▲ 。
16. (15分)通过测定某蛋白质样品中氮元素的含量可以确定其优劣。“凯氏定氮法”测
定蛋白质中含氮量的实验方案如下:
浓硫酸 浓 NaOH溶液
蛋白质
消化 (NH4)2SO4 蒸出、吸收 (NH4)2B4O7 含量测定
样品
CuSO4溶液 H3BO3
(1)“消化”。将蛋白质样品与 CuSO4溶液(作催化剂)和浓硫酸中的一种混合后
第 7页,共 8页
放入三颈烧瓶中,实验装置如题 16图所示,然后再滴加其中的另一种物质,在
加热条件下充分反应,蛋白质中的氮
滴液漏斗
元素转化为(NH4)2SO4。
①滴液漏斗中盛放的物质是 K
N2
▲ 。
NaOH
②装置 B的作用是 ▲ 。 蛋白质 溶液
③反应结束后,打开止水夹 K并不 A B C
题 16图
断通入 N2,其原因是 ▲ 。
(2)“吸收”。向得到的(NH4)2SO4中加入足量的 NaOH溶液充分反应后,加热将所
得 NH3蒸出,然后用硼酸(H3BO3)溶液吸收,得到(NH4)2B4O7溶液。
①硼酸是一元弱酸,易与水结合生成 B(OH) 4,其水溶液显酸性的原因是 ▲
(用离子方程式表示)。
②NH3与 H3BO3反应生成(NH4)2B4O7的化学方程式为 ▲ 。
(3)“测定”。称取 0.8000g蛋白质样品,按照上述流程制取(NH4)2B4O7溶液,然后
将其加水稀释至 100mL。取出 25.00 mL放入锥形瓶中,滴加几滴指示剂,然后
用 0.1000 moL·L 1盐酸标准溶液滴定,滴定终点时消耗盐酸的体积为 20.00mL。
已知:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3。
①接近终点时滴加半滴盐酸溶液的操作:慢慢转动滴定管的活塞,使滴定管的
尖嘴处悬挂半滴液体不滴落, ▲ 。
②该样品中氮元素的质量分数为 ▲ 。(写出计算过程,否则不得分!)
17. (15分)性能优越的催化剂是实现二氧化碳加氢制甲烷工业化的关键。
(1)CO2在 Ni/γ-Al2O3催化剂表面加氢合成甲烷过程中发生以下两个反应:
反应 I:CO2(g)+4H2(g) = CH4(g)+2H2O(g) H1= -143.9 kJ·mol 1
反应 II:CO2(g)+H2(g) = CO(g)+H2O(g) H2
①已知在 25℃、101kPa 下,由最稳定单质生成 1 mol某纯物质的焓变称为该物
质的标准摩尔生成焓,用 表示。如表所示为几种常
见物质的标准摩尔生成焓。
物质 CO2(g) H2(g) H2O(g) CO(g)
-393.5 0 -241.8 -110.5
)
反应 2CO(g)+2H2(g) = CO2(g)+CH4(g)的焓变为 ▲ 。
第 8页,共 8页
②一定压强下,将一定比例 CO2和 H2通
过装有 Ni/γ-Ai2O3催化剂的反应器,反 80
应相同时间,测得 CO2转化率随温度变 60
化情况如题 17 图-1所示(虚线代表平 40
衡转化率)。高于 320℃后,CO2转化率 20
略有下降,可能原因 0200 250 300 350 400
是 ▲ 。 温度/℃ 0 0
③γ-Al2O3因价格低廉、较高的热稳定 题 17图-1
性和比表面积而成为工业上最常用的
催化剂载体。通过 Rh(NO3)3(硝酸铑)热分解将铑有效负载在γ-Al2O3表
面能有效提高催化性能的可能原因是 ▲ 。
(2)CeO2催化 CO2与 H2转化为 CH4的机理如题 17图-2所示。
CH4 H2 H2O
催化剂载体 (i) 催化剂载体
(iv) (ii)
H CO2
O
2 O CeH H
H2O C 空位H C2
CeO2 CeO2-x
催化剂载体 催化剂载体 _ _
(iii) Ce4+或 Ce3+ O2 或氧空位(无 O2 )
题 17图-2 题 17图-3
①在催化过程中由 CeO2转变成 CeO2-x晶胞的组成结构变化如题 17图-3所示,
一个 CeO2-x晶胞中 Ce4+和 Ce3+个数比为 ▲ 。
②催化剂中掺入少量 CaO,用 Ca2+替代 CeO2结构中部分 Ce4+形成 Ca xCe1-xOy可
提高催化效率,其原因是 ▲ 。
(3)通过 Sonogashira 偶联反应(如下图所示),将 CoTBrPP(甲)在 CuI与钯基催
化剂的作用下,在甲上枝接 PTAB(1,3,5-三乙炔苯聚合物)形成对 CH4有较高
选择性的 CoTBrPP-PTAB-Cu新型催化剂(乙)。
甲 乙
①CoTBrPP-PTAB-Cu催化剂比 CoTBrPP具有更好的导电性的原因是 ▲ 。
②实验表明 CoTBrPP和 CoTBrPP-PTAB-Cu的 ECSA(电化学活性面积,即参与
电化学反应的有效面积)分别是 7.1mF· cm-2和 3.8mF·cm-2,偶联后 ECSA降低
的可能原因是 ▲ 。
第 9页,共 8页
CO2转化率/%
化学试题参考答案及评分标准
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1.A 2.B 3.D 4.C 5.C 6.A 7.D 8.C 9.D 10.A
11.B 12.D 13.B
二、非选择题:共 4 题,共 61 分。
14.(15分)
(1)①适当搅拌,适当升高温度 (2分)
②CaSO4、炭黑 (2分)
(2)①3MnCO 3+ 2+3+2Fe +3H2O=2Fe(OH)3+3Mn +3CO2↑ (2分)
c Mn2+K Ksp MnF2 ②此反应 = 2+ = =7.5×10
6>105,反应进行完全,因此可将
c Ca Ksp CaF2
Ca2+完全除尽 (2分)
(3)①随 pH增大,溶液中 c(H+)减小,平衡往正向移动,MAn(有机层)浓度增大,
萃取率增大 (2分)
②适当提高稀硫酸的浓度(或充分振荡分液漏斗或用萃取剂分多次萃取)(2分)
(4)边搅拌向其中加入 0.1mol·L 1 Na2C2O4溶液,直至向上层清液中滴加 Na2C2O4
溶液不产生沉淀,停止滴加。过滤,洗涤滤渣至取最后一次洗涤滤液滴加盐酸
和 BaCl2溶液不再生成沉淀。将滤渣置于空气中加热到 300℃以上,充分反应至
固体质量不再改变 (3
分)
15.(16分)
H3CO NH2
(1) (2分)
H3CO
(2)醚键、酰胺基 (2分)
13 (1分)
第 10页,共 8页
(3) (3分)
(4) (3分)
(5)
O2 O2 SOCl2
Cu,△ 催化剂,△ △
POCl3
(5分)
甲苯,150℃
Et3N,CH2Cl2,0℃
16.(15分)
(1)①浓硫酸 (2分)
②作安全瓶,防止 NaOH溶液倒吸 (2分)
③将生成的 SO2赶入装置 C中完全吸收 (2分)
(2)①H3BO3+H2O +H+ (2 分)
②2NH3+4H3BO3=(NH4)2B4O7+5H2O (2分)
(3)①用锥形瓶内壁将其碰下来,并用蒸馏水将其冲入锥形瓶内 (2分)
②解:25.00mL:
n(HCl)= 0.1000mol·L 1×20.00×10 3 L=2.000×10 3 mol (1分)
由题意可得关系式:N~ NH+4~HCl
n(N)=n(HCl)=2.000×10 3 mol
m(N)=nM=2.000×10 3 mol×14g·mol-1=0.028g
100.00mL:
m(N)=0.028g×4=0.112 g (1分)
0.112 g
样品中铁元素的质量分数为 ×100%=14% (1分)
0.8000 g
17.(15分)
(1)①-226.3 kJ·mol 1 (2分)
②320℃时,CO2和 H2催化合成反应已达到平衡,升高温度,反应Ⅰ平衡向逆反
应方向移动占主导,CO2的转化率减小 (2分)
第 11页,共 8页
③Rh(NO3)3热分解放出大量气体使得γ-Al2O3的表面积增大 (2分)
1 2x
(2)① (3分)
2x
②结构中氧空位增加 (2分)
(3)①三乙炔苯聚合物中的碳是 sp和 sp2杂化结构,有未参加杂化的 p轨道上的电
子 (2分)
②CoTBrPP表面接枝了聚 1,3,5-三乙炔苯,使得活性位点难以暴露 (2分)
第 12页,共 8页
同课章节目录
