2025年四川省绵阳市江油市中考二模化学试卷(含答案)
文档属性
| 名称 | 2025年四川省绵阳市江油市中考二模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 203.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-22 17:56:00 | ||
图片预览



文档简介
四川江油市2024-2025学年度九年级中考第二次模拟检测
(九年级化学)
(考试时间:50分钟满分:100分)
可能用到的相对原子质量:
H-1 C-12 N-14 O—16 Na-23 Mg--24 CI- 35.5 Ca- 40
第I卷(选择题,共36分)
一、(本题包括9小题,每小题4分,共36分。每小题只有-一个选项最符合题目要求)
1.下列过程只发生物理变化的是( )
A.动植物的呼吸
B.水的蒸馏
C.用粮食酿造黄酒
D.天然气不慎泄漏发生爆炸
2.化肥能提高农作物产量。下列物质能用作钾肥的是( )
A.CaSO4 B.CO(NH2)2
C.K2CO3 D.Ca(H2PO4)2
3.在“测定土壤样品酸碱性”实验中,下列装置和操作正确的是( )
A.取样 B.溶解
C.过滤 D.测pH
4.C919大飞机采用大量的钛合金材料,使飞机总重量大幅度下降。如图为钛在元素周期表中的相关信息及其原子结构示意图。下列说法正确的是( )
A.钛元素属于金属元素,在反应中易失电子
B.钛原子的中子数为22
C.钛原子的相对原子质量为47.87g
D.钛元素位于元素周期表的第二周期
5.某混合物经高温煅烧产生一种能使澄清石灰水变浑浊的气体,若在灼烧的残渣中滴入稀盐酸,则残渣完全消失,并放出一种可燃性单质气体,则该混合物的组成可能是( )
A.含有Fe2O3、CuO、C B.含有Fe2O3、CaCO3
C.含有Fe2O3、CaCO3、C D.含有CaCO3、CuO、C
6.化学学科核心素养展现化学课程对学生发展的重要价值,下列示例说法正确的是( )
A.化学观念:分子是构成物质的一种粒子,不同的分子构成不同的物质
B.科学思维:溶液具有均一性、稳定性,则均一、稳定的液体都是溶液
C.科学探究:将无色酚酞试液滴入某无色溶液中变成红色,证明该溶液一定是碱溶液
D.科学推理:中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
7.人类对金属材料的认识和使用经历了漫长的探索过程。据此回答下面小题。
为验证贝开托夫得到的规律,向CuSO4溶液中加入铁片,反应前后微粒变化如图所示,则下列判断正确的是( )
A B C D
Cu2+ Fe2+ Cu2+ Fe2+
A.A B.B C.C D.D
8.固体甲、乙、丙在不同温度下的溶解度如下表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法不正确的是( )
温度/℃ 0 20 40 60 80
溶解度/g 甲 0.18 0.16 0.14 0.12 0.09
乙 35.7 36.0 36.6 37.3 38.4
丙 13.3 31.6 63.9 110 169
A.固体甲的溶解度随温度的升高而降低
B.20℃时,丙溶液中溶质和溶剂质量比为31.6:100
C.丙溶液中含有少量的乙,可以用降温结晶的方法提纯丙
D.分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶剂质量大小:甲>丙
9.某实验小组用传感器探究氢氧化钠溶液与稀硫酸反应过程中温度和pH的变化。测定结果如图所示。下列说法错误的是( )
A.反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O
B.该实验是将稀硫酸加入到氢氧化钠溶液中
C.反应过程中有热量放出
D.30s时,溶液中溶质为H2SO4和Na2SO4
第II卷(非选择题,共64分)
二、填空题(本题包括2小题,共26分)
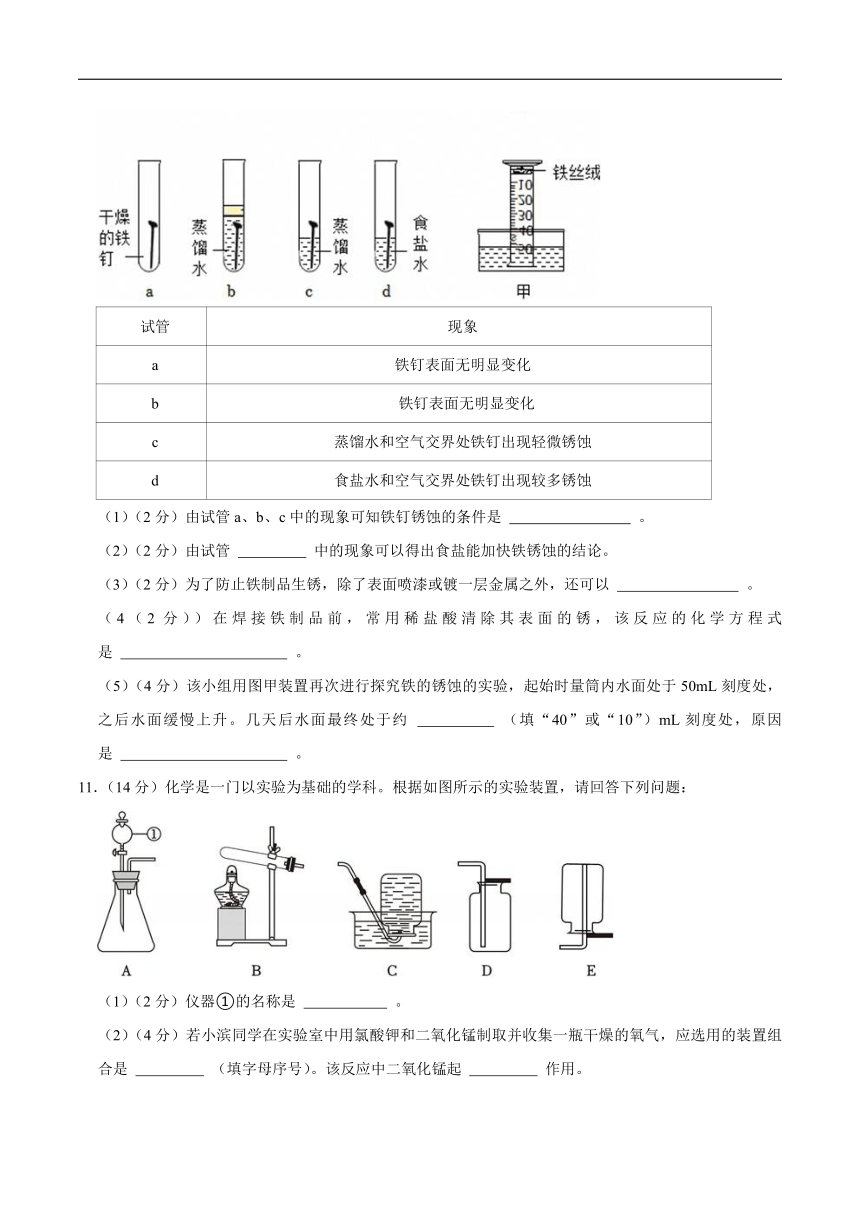
10.(12分)铁钉是生活中常见的铁制品。学习小组对不同条件下铁钉的锈蚀进行探究。取四枚铁钉,按图所示进行实验。一天后观察到的现象如下表。
试管 现象
a 铁钉表面无明显变化
b 铁钉表面无明显变化
c 蒸馏水和空气交界处铁钉出现轻微锈蚀
d 食盐水和空气交界处铁钉出现较多锈蚀
(1)(2分)由试管a、b、c中的现象可知铁钉锈蚀的条件是 。
(2)(2分)由试管 中的现象可以得出食盐能加快铁锈蚀的结论。
(3)(2分)为了防止铁制品生锈,除了表面喷漆或镀一层金属之外,还可以 。
(4(2分))在焊接铁制品前,常用稀盐酸清除其表面的锈,该反应的化学方程式是 。
(5)(4分)该小组用图甲装置再次进行探究铁的锈蚀的实验,起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约 (填“40”或“10”)mL刻度处,原因是 。
11.(14分)化学是一门以实验为基础的学科。根据如图所示的实验装置,请回答下列问题:
(1)(2分)仪器①的名称是 。
(2)(4分)若小滨同学在实验室中用氯酸钾和二氧化锰制取并收集一瓶干燥的氧气,应选用的装置组合是 (填字母序号)。该反应中二氧化锰起 作用。
(3)(4分)实验室用加热氯化铵和熟石灰两种固体混合物的方法制取氨气(氨气极易溶于水,密度比空气小),应选用的收集装置是 。将生成的氨气在纯净氧气中燃烧(如图),生成一种空气中的单质和一种常见氧化物,该反应的化学方程式为 。
(4)(4分)实验室制取二氧化碳可选用的药品为 ,下列干燥剂中,可用于干燥CO2的是 (填字母序号)。
A.碱石灰
B.浓硫酸
C.氢氧化钠固体
三.工艺流程题
12.(13分)兴趣小组在实验室用某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的流程如图所示,请回答下列问题:
(1)(2分)过滤中用到的仪器有烧杯、漏斗、 。
(2)(3分)“酸溶”后,溶液中溶质成分是 (填化学式)。
(3)(4分)“沉钙”时发生反应的化学方程式为
CaCl2+2NH3+CO2+X=2NH4Cl+CaCO3↓,X的化学式为 ,推测依据为 。
(4)(2分)氯化铵和氢氧化钙反应的化学方程式为 。
(5)(2分)流程中可循环利用的物质有 (写一种)。
四.科学探究题(共2小题)
13.(14分)47中学化学兴趣小组在探究酸碱盐的相关性质时做了如图实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中,产生白色沉淀,上层为无色澄清溶液。
(1)(4分)乙试管中除了能观察到银白色固体逐渐减少的现象外还有 现象。写出甲试管中发生反应的化学方程式 。
【提出问题】烧杯中溶液的溶质是什么?
【提出猜想】
(2)(2分)小四:Na2SO4
小诗:Na2SO4、H2SO4和ZnSO4
小琪:Na2SO4、CuSO4和ZnSO4
小珍:Na2SO4和NaOH
小棒:Na2SO4和
【交流讨论】
(3)(2分)经讨论,大家一致认为 两同学猜想是错误的。
【进行实验】
(4)(2分)小珍同学设计如下实验方案:
实验步骤 实验现象
方案 取少量烧杯中溶液于试管中,滴入石蕊试液 。
【实验结论】自己的猜想正确。
【表达交流】
(5)(4分)同学们继续向烧杯中滴加溶质质量分数为3%的氢氧化钡溶液,测得烧杯内某些离子数目的变化如图丙所示,图丙中a表示的是 (填离子符号),b表示的是 (填离子符号)。请计算恰好完全反应时,烧杯中NaOH的质量 g。
五.计算题(共11分)
14.(11分)大理石的主要成分是CaCO3,小东同学称取8g大理石样品放入烧杯中,把40g稀盐酸平均分4次加入(假设大理石中除碳酸钙外的其他成分都不落于水,且不与稀盐酸反应),每次充分反应后,经过滤、干燥等操作后称量剩余固体的质量,测得有关数据如下表:
实验 1 2 3 4
加入盐酸/g 10 10 10 10
剩余固体/g 5.5 M 1.2 1.2
请计算:
(1)8g大理石样品中含有杂质 g。(填数字)
(2)如表中M的数值应为 。(填数字)
(3)该稀盐酸中溶质的质量分数是多少?(写出详细的计算过程)
参考答案
题号 1 2 3 4 5 6 7 8 9
答案 B C D A C A D B B
10. (1)与水和氧气同时接触。
(2)cd。
(3)涂油、制成不锈钢等。
(4)Fe2O3+6HCl═2FeCl3+3H2O。
(5)40;铁丝绒生锈能够消耗约10mL氧气。
11. (1)分液漏斗;
(2)BD;催化;
(3)E;4NH3+3O22N2+6H2O;
(4)大理石或石灰石与稀盐酸;B。
12. (1)玻璃棒、铁架台;
(2)HCl、CaCl2、FeCl3;
(3)H2O;质量守恒定律(或化学反应前后原子种类和个数不变);
(4)2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
(5)NH3或CO2。
13. (1)有气泡产生;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)ZnSO4;
(3)小诗、小琪;
(4)溶液变蓝;
(5)Na+;;4.8。
14. 解:(1)最终剩余的固体是不和盐酸反应的杂质。由表中内容可知,8g大理石样品中含有1.2g杂质。
(2)实验1中,减小8g﹣5.5g=2.5g固体,说明消耗2.5g大理石,由于5.5g﹣1.2g=4.3g>2.5g,则第2次加入10g盐酸时,应继续消耗2.5g大理石,则剩余固体质量为5.5g﹣2.5g=3g,即M为3。
(3)设10g盐酸中溶质质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
2.5g x
解得x=1.825g
则该稀盐酸中溶质的质量分数是
答:该稀盐酸中溶质的质量分数是18.25%。
故答案为:
(1)1.2;
(2)3;
(3)18.25%。
(九年级化学)
(考试时间:50分钟满分:100分)
可能用到的相对原子质量:
H-1 C-12 N-14 O—16 Na-23 Mg--24 CI- 35.5 Ca- 40
第I卷(选择题,共36分)
一、(本题包括9小题,每小题4分,共36分。每小题只有-一个选项最符合题目要求)
1.下列过程只发生物理变化的是( )
A.动植物的呼吸
B.水的蒸馏
C.用粮食酿造黄酒
D.天然气不慎泄漏发生爆炸
2.化肥能提高农作物产量。下列物质能用作钾肥的是( )
A.CaSO4 B.CO(NH2)2
C.K2CO3 D.Ca(H2PO4)2
3.在“测定土壤样品酸碱性”实验中,下列装置和操作正确的是( )
A.取样 B.溶解
C.过滤 D.测pH
4.C919大飞机采用大量的钛合金材料,使飞机总重量大幅度下降。如图为钛在元素周期表中的相关信息及其原子结构示意图。下列说法正确的是( )
A.钛元素属于金属元素,在反应中易失电子
B.钛原子的中子数为22
C.钛原子的相对原子质量为47.87g
D.钛元素位于元素周期表的第二周期
5.某混合物经高温煅烧产生一种能使澄清石灰水变浑浊的气体,若在灼烧的残渣中滴入稀盐酸,则残渣完全消失,并放出一种可燃性单质气体,则该混合物的组成可能是( )
A.含有Fe2O3、CuO、C B.含有Fe2O3、CaCO3
C.含有Fe2O3、CaCO3、C D.含有CaCO3、CuO、C
6.化学学科核心素养展现化学课程对学生发展的重要价值,下列示例说法正确的是( )
A.化学观念:分子是构成物质的一种粒子,不同的分子构成不同的物质
B.科学思维:溶液具有均一性、稳定性,则均一、稳定的液体都是溶液
C.科学探究:将无色酚酞试液滴入某无色溶液中变成红色,证明该溶液一定是碱溶液
D.科学推理:中和反应一定有盐和水生成,则有盐和水生成的反应一定是中和反应
7.人类对金属材料的认识和使用经历了漫长的探索过程。据此回答下面小题。
为验证贝开托夫得到的规律,向CuSO4溶液中加入铁片,反应前后微粒变化如图所示,则下列判断正确的是( )
A B C D
Cu2+ Fe2+ Cu2+ Fe2+
A.A B.B C.C D.D
8.固体甲、乙、丙在不同温度下的溶解度如下表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法不正确的是( )
温度/℃ 0 20 40 60 80
溶解度/g 甲 0.18 0.16 0.14 0.12 0.09
乙 35.7 36.0 36.6 37.3 38.4
丙 13.3 31.6 63.9 110 169
A.固体甲的溶解度随温度的升高而降低
B.20℃时,丙溶液中溶质和溶剂质量比为31.6:100
C.丙溶液中含有少量的乙,可以用降温结晶的方法提纯丙
D.分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶剂质量大小:甲>丙
9.某实验小组用传感器探究氢氧化钠溶液与稀硫酸反应过程中温度和pH的变化。测定结果如图所示。下列说法错误的是( )
A.反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O
B.该实验是将稀硫酸加入到氢氧化钠溶液中
C.反应过程中有热量放出
D.30s时,溶液中溶质为H2SO4和Na2SO4
第II卷(非选择题,共64分)
二、填空题(本题包括2小题,共26分)
10.(12分)铁钉是生活中常见的铁制品。学习小组对不同条件下铁钉的锈蚀进行探究。取四枚铁钉,按图所示进行实验。一天后观察到的现象如下表。
试管 现象
a 铁钉表面无明显变化
b 铁钉表面无明显变化
c 蒸馏水和空气交界处铁钉出现轻微锈蚀
d 食盐水和空气交界处铁钉出现较多锈蚀
(1)(2分)由试管a、b、c中的现象可知铁钉锈蚀的条件是 。
(2)(2分)由试管 中的现象可以得出食盐能加快铁锈蚀的结论。
(3)(2分)为了防止铁制品生锈,除了表面喷漆或镀一层金属之外,还可以 。
(4(2分))在焊接铁制品前,常用稀盐酸清除其表面的锈,该反应的化学方程式是 。
(5)(4分)该小组用图甲装置再次进行探究铁的锈蚀的实验,起始时量筒内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约 (填“40”或“10”)mL刻度处,原因是 。
11.(14分)化学是一门以实验为基础的学科。根据如图所示的实验装置,请回答下列问题:
(1)(2分)仪器①的名称是 。
(2)(4分)若小滨同学在实验室中用氯酸钾和二氧化锰制取并收集一瓶干燥的氧气,应选用的装置组合是 (填字母序号)。该反应中二氧化锰起 作用。
(3)(4分)实验室用加热氯化铵和熟石灰两种固体混合物的方法制取氨气(氨气极易溶于水,密度比空气小),应选用的收集装置是 。将生成的氨气在纯净氧气中燃烧(如图),生成一种空气中的单质和一种常见氧化物,该反应的化学方程式为 。
(4)(4分)实验室制取二氧化碳可选用的药品为 ,下列干燥剂中,可用于干燥CO2的是 (填字母序号)。
A.碱石灰
B.浓硫酸
C.氢氧化钠固体
三.工艺流程题
12.(13分)兴趣小组在实验室用某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的流程如图所示,请回答下列问题:
(1)(2分)过滤中用到的仪器有烧杯、漏斗、 。
(2)(3分)“酸溶”后,溶液中溶质成分是 (填化学式)。
(3)(4分)“沉钙”时发生反应的化学方程式为
CaCl2+2NH3+CO2+X=2NH4Cl+CaCO3↓,X的化学式为 ,推测依据为 。
(4)(2分)氯化铵和氢氧化钙反应的化学方程式为 。
(5)(2分)流程中可循环利用的物质有 (写一种)。
四.科学探究题(共2小题)
13.(14分)47中学化学兴趣小组在探究酸碱盐的相关性质时做了如图实验,实验结束后,小组同学将两支试管中的废液同时倒入一个洁净的烧杯中,产生白色沉淀,上层为无色澄清溶液。
(1)(4分)乙试管中除了能观察到银白色固体逐渐减少的现象外还有 现象。写出甲试管中发生反应的化学方程式 。
【提出问题】烧杯中溶液的溶质是什么?
【提出猜想】
(2)(2分)小四:Na2SO4
小诗:Na2SO4、H2SO4和ZnSO4
小琪:Na2SO4、CuSO4和ZnSO4
小珍:Na2SO4和NaOH
小棒:Na2SO4和
【交流讨论】
(3)(2分)经讨论,大家一致认为 两同学猜想是错误的。
【进行实验】
(4)(2分)小珍同学设计如下实验方案:
实验步骤 实验现象
方案 取少量烧杯中溶液于试管中,滴入石蕊试液 。
【实验结论】自己的猜想正确。
【表达交流】
(5)(4分)同学们继续向烧杯中滴加溶质质量分数为3%的氢氧化钡溶液,测得烧杯内某些离子数目的变化如图丙所示,图丙中a表示的是 (填离子符号),b表示的是 (填离子符号)。请计算恰好完全反应时,烧杯中NaOH的质量 g。
五.计算题(共11分)
14.(11分)大理石的主要成分是CaCO3,小东同学称取8g大理石样品放入烧杯中,把40g稀盐酸平均分4次加入(假设大理石中除碳酸钙外的其他成分都不落于水,且不与稀盐酸反应),每次充分反应后,经过滤、干燥等操作后称量剩余固体的质量,测得有关数据如下表:
实验 1 2 3 4
加入盐酸/g 10 10 10 10
剩余固体/g 5.5 M 1.2 1.2
请计算:
(1)8g大理石样品中含有杂质 g。(填数字)
(2)如表中M的数值应为 。(填数字)
(3)该稀盐酸中溶质的质量分数是多少?(写出详细的计算过程)
参考答案
题号 1 2 3 4 5 6 7 8 9
答案 B C D A C A D B B
10. (1)与水和氧气同时接触。
(2)cd。
(3)涂油、制成不锈钢等。
(4)Fe2O3+6HCl═2FeCl3+3H2O。
(5)40;铁丝绒生锈能够消耗约10mL氧气。
11. (1)分液漏斗;
(2)BD;催化;
(3)E;4NH3+3O22N2+6H2O;
(4)大理石或石灰石与稀盐酸;B。
12. (1)玻璃棒、铁架台;
(2)HCl、CaCl2、FeCl3;
(3)H2O;质量守恒定律(或化学反应前后原子种类和个数不变);
(4)2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
(5)NH3或CO2。
13. (1)有气泡产生;2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)ZnSO4;
(3)小诗、小琪;
(4)溶液变蓝;
(5)Na+;;4.8。
14. 解:(1)最终剩余的固体是不和盐酸反应的杂质。由表中内容可知,8g大理石样品中含有1.2g杂质。
(2)实验1中,减小8g﹣5.5g=2.5g固体,说明消耗2.5g大理石,由于5.5g﹣1.2g=4.3g>2.5g,则第2次加入10g盐酸时,应继续消耗2.5g大理石,则剩余固体质量为5.5g﹣2.5g=3g,即M为3。
(3)设10g盐酸中溶质质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
2.5g x
解得x=1.825g
则该稀盐酸中溶质的质量分数是
答:该稀盐酸中溶质的质量分数是18.25%。
故答案为:
(1)1.2;
(2)3;
(3)18.25%。
同课章节目录
