江苏省2024-2025学年高考押题预测化学试卷01(含答案)
文档属性
| 名称 | 江苏省2024-2025学年高考押题预测化学试卷01(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 828.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-23 23:10:34 | ||
图片预览


文档简介
2025年高考押题预测卷01
高三化学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 N-14 O-16 S-32 Fe-56 V-51
第I卷(选择题 共39分)
一、选择题:本题共13小题,每小题3分,共39分。每小题只有一个选项符合题目要求。
1.2025年,AI在材料化学等领域取得了多项重要的研究成果。下列材料属于无机非金属材料的是
A.陶瓷花瓶 B.纸质作业本 C.蚕丝领带 D.高强度铝合金
2.有的自来水厂除了在自来水中通入氯气之外,还会通入适量氨气,以延长消毒时间,氨气与次氯酸发生如下反应:NH3+HClO NH2Cl+H2O。下列说法正确的是
A.HClO的结构式为H—Cl—O B.NH3和H2O都能作配合物的配体
C.NH3和H2O的VSEPR模型不同 D.NH2Cl中既含离子键又含共价键
3.SO2催化氧化生成SO3的过程是无机基础化工的重要催化过程。某化学兴趣小组利用如图装置模拟工业上SO2的催化氧化过程,并测定此条件下SO2的转化率。已知:SO3的熔点为16.8℃,下列装置不能达到实验目的的是
A.用甲装置制备SO2气体 B.用乙装置进行SO2的催化氧化
C.用丙装置吸收SO3并测定其质量 D.用丁装置吸收SO2并测定沉淀质量
4.高岭石的化学组成可表示为Al4[Si4O10](OH)8,其性质相当稳定,被誉为“万能石”,常作为制造瓷器和陶器的主要原料。下列说法正确的是
A.半径大小:r(Al3+)C.电离能大小:I1(Al)>I1(Si) D.沸点:SiH4>H2O
阅读下列材料,完成下列几个问题:
氮及其化合物在生产生活中有重要应用。氮元素是典型变价非金属元素,其氧化物和请化物种类较多,氢化物有NH3、N2H4(联氨,又名肼)、HN3(叠氮酸)等。人工固氮技术是20世纪人类最伟大的成就之一,为人类解决粮食短缺问题作出了巨大的贡献。氨易液化,液氨能与钠反应。NH3中的一个H原子被-OH取代可形成羟胺(NH2OH),被-NH2取代可形成肼(N2H4),肼的燃烧热为622kJ·mol-1。将尿素、NaClO和NaOH溶液混合,在一定条件下反应可制得肼。
5.下列有关含氮物质的性质与用途对应关系正确的是
A.NO为无色气体,在人的生命活动中作为一种信息分子
B.N2H4具有较强的还原性,可用作火箭升空的燃料
C.NH4Cl受热易分解,实验室可用NH4Cl和Ca(OH)2共热制NH3
D.浓硝酸有强酸性,常温下可用铁槽车运输浓硝酸
6.下列化学反应的表示正确的是
A.金属钠和液氨反应:NH3+Na=NaNH2+H2↑
B.过量氨水和SO2反应:SO2+2NH3·H2O=(NH4)2SO3+H2O
C.尿素、NaClO、NaOH溶液制取肼的离子方程式:CO(NH2)2+ClO-=CO2↑+N2H4+Cl-
D.肼燃烧的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH =-622kJ·mol-1
7.已知:-OH的吸电子能力比-NH2的强。下列说法正确的是
A.NH3的键角比H2O小 B.NH3、HN3、NH4Cl形成的晶体都是分子晶体
C.NH2OH难溶于水 D.NH2OH中N结合H+的能力比N2H4弱
8.化合物Z是合成某种抗真菌药药物的中间体,下列说法不正确的是
A.X分子中所有碳原子可能共平面 B.Y分子存在对映异构现象
C.1mol Z最多能与3mol NaOH反应 D.Y、Z可用溴的CCl4溶液鉴别
9.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Cu(s)Cu(NO3)(aq)Cu(NO3)(s)
B.浓H2SO4(l)SO2(g)BaSO3(s)
C.NH3(g)NO(g)NaNO3(aq)
D.Na2CO3(aq)CO2(g)NaHCO3(aq)
10.室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-→S,S+e-→S,2Na++S+2(1-)e-→Na2Sx
下列叙述错误的是
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
11.室温下,根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 向BaCl2溶液中通入SO2和气体X,产生白色沉淀 X有强氧化性,白色沉淀一定为BaSO4
B 向丙烯醇(CH2=CHCH2OH)中加入酸性KMnO4溶液,KMnO4溶液褪色 验证丙烯醇中是否含碳碳双键
C 向Na2SO3溶液中先滴加酚酞,再滴加BaCl2溶液至过量,溶液红色变浅至消失 Na2SO3溶液 水解使溶液呈碱性
D 在2 mL 0.01 mol·L-1Na2S溶液中先滴入几滴0.01 mol·L-1CuSO4溶液有黑色沉淀生成,再滴入0.01 mol·L-1ZnSO4溶液,又有白色沉淀生成 Ksp(ZnS)A.A B.B C.C D.D
12.室温下,通过下列实验探究NaHCO3和Na2CO3的性质:
实验1:测定0.1mol·L-1 NaHCO3溶液的pH约为8。
实验2:将0.1mol·L-1 Na2CO3溶液与0.1mol·L-1 CaCl2溶液等体积混合,产生白色沉淀。
实验3:将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3沉淀。
下列说法不正确的是
A.实验1的溶液中存在:Ka1(H2CO3)·Ka2(H2CO3)<KW
B.实验2的上层清液中存在:c(Ca2+)·c()<Ksp(CaCO3)
C.实验2的上层清液中存在:c(Na+)+2c(Ca2+)+c(H+)=c()+2c()+c(OH-)
D.实验3生成FeCO3沉淀的离子方程式为:2+Fe2+=FeCO3↓+CO2↑+H2O
13.历史上曾用地康法制氯气,其反应为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下图为恒容容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系。若起始进料浓度c(O2)=1mol·L-1,则下列说法正确的是
A.反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的ΔS<0,ΔH>0
B.400℃时,A、B、C三点的反应速率:v(A)>v(B)>v(C)
C.400℃时,该反应的平衡常数K=
D.400℃时,B点O2的平衡转化率为38%
第II卷(非选择题 共61分)
二、非选择题:共4题,共61分。
14.钒元素是一种以神话女神名字命名的元素。钒及其化合物在工业生产上有重要应用,V2O5是一种具有优良性能的化工原料,广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
“还原”步骤中生成VOCl2的同时还生成一种无色无污染的气体,反应的化学方程式为 ;若不加N2H4,HCl也能还原V2O5生成VO2+和Cl2,Cl2可被Na2SO3溶液吸收,则、Cl-、VO2+的还原性由强到弱的顺序是 ;分析制备反应中不生成Cl2的原因: 。
(2)对制得的晶体进行含钒量的测定:称取4.000g样品,经过系列处理后将钒(Ⅳ)完全氧化为VO,定容为100mL溶液;量取20.00mL溶液,加入几滴指示剂,用0.2000mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,VO转化为VO2+;平行滴定4次,消耗标准溶液的体积分别为22.50mL、22.45mL、21.00mL、22.55mL。则滴定过程中发生反应的离子方程式为 ,样品中钒元素的质量分数为 (写出计算过程,结果保留两位小数)。
(3)钒的某种氧化物的立方晶胞结构如图所示。
该钒的氧化物的化学式为 ,V原子的配位数与O的配位数之比为 。
15.化合物H是一种类生物碱,具有抗炎、抗肿瘤、抗病原微生物等生物活性,它的一种合成路线如下:
(1)G中官能团的名称为 ,其分子中碳原子的杂化类型为 。
(2)反应①②④⑤中,属于加成反应的是 (填序号)。
(3)反应③中有和E互为同分异构体的副产物生成,该副产物的结构简式为 。
(4)G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①属于芳香族化合物,且能发生银镜反应;
②酸性条件下水解得到三种分子在1H核磁共振谱中都有两组峰。
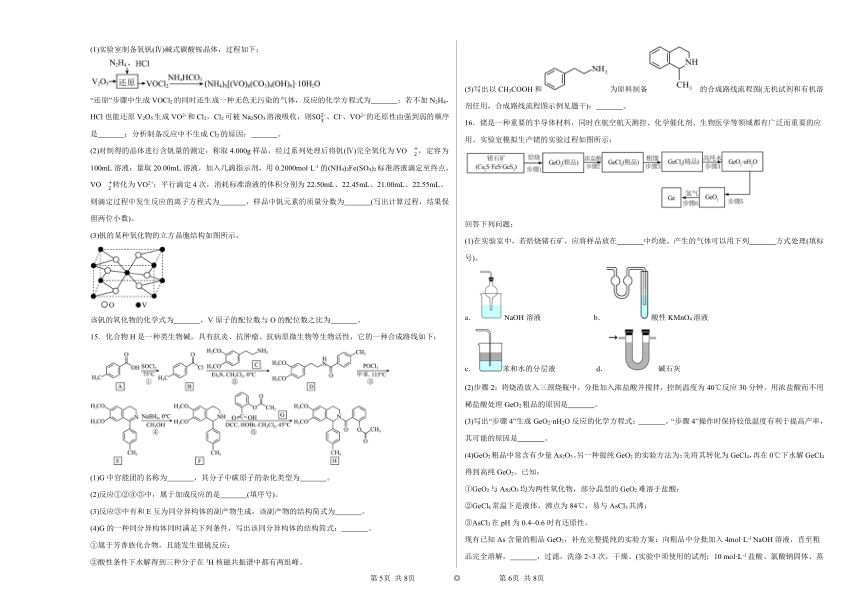
(5)写出以CH3COOH和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见题干): 。
16.锗是一种重要的半导体材料,同时在航空航天测控、化学催化剂、生物医学等领域都有广泛而重要的应用。实验室模拟生产锗的实验过程如图所示:
回答下列问题:
(1)在实验室中,若焙烧锗石矿,应将样品放在 中灼烧。产生的气体可以用下列 方式处理(填标号)。
a.NaOH溶液 b.酸性KMnO4溶液
c.苯和水的分层液 d.碱石灰
(2)步骤2:将烧渣放入三颈烧瓶中,分批加入浓盐酸并搅拌,控制温度为40℃反应30分钟。用浓盐酸而不用稀盐酸处理GeO2粗品的原因是 。
(3)写出“步骤4”生成GeO2·nH2O反应的化学方程式: 。“步骤4”操作时保持较低温度有利于提高产率,其可能的原因是 。
(4)GeO2粗品中常含有少量As2O3。另一种提纯GeO2的实验方法为:先将其转化为GeCl4,再在0℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4mol·L-1 NaOH溶液,直至粗品完全溶解, ,过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
17.天然气既是一种清洁能源,也是重要的化工原料,研究天然气的净化和利用具有重要意义。
(1)天然气中含少量H2S和CO2,需用一定方法脱除。
已知:H2S的Ka1=10-6.97,Ka2=10-12.9,H2CO3的Ka1=10-6.38,Ka2=10-10.25。
①用NaOH溶液脱H2S和CO2,脱除后的溶液中存在:S2-+H2O HS-+OH-、+H2O +OH-。下列说法正确的是 。
a.适当升高温度,溶液中c(OH-)增大
b.加入少量水,溶液中离子总数增大
c.通入少量HCl气体,增大
②用Na2CO3溶液脱H2S和CO2。将含H2S和CO2的天然气缓缓通入100mL 0.1mol·L-1 Na2CO3溶液中,脱除过程中H2S与Na2CO3发生反应的离子方程式是 。
(2)甲烷与硫化氢重整制氢反应为CH4(g)+2H2S(g) CS2(g)+4H2(g),其过程中反应ⅰ、ⅱ及其相对能量变化示意图如图1所示。在恒压条件下,起始时按n(H2S):n(CH4)=2:1 (同时通入一定量的N2进行稀释,N2不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中CH4、H2S、CS2、H2的物质的量分数(ω)的影响如图2所示。
①反应CH4(g)+2H2S(g) CS2(g)+4H2(g)的ΔH= 。
②研究发现,在800~870℃温度区间内,随温度升高,H2S在平衡时反应混合物中含量迅速下降,而CS2的含量几乎为0,其原因可能是 。
③研究发现,当温度大于900℃时,平衡混合物中非常接近4。则N点对应温度下,CH4的平衡转化率为 ;保持其他条件不变,若起始时不通入N2进行稀释,则CH4的平衡转化率会 (填“降低”“升高”或“无影响”)。
(3)CH4和CO2在Zn/ZSM—5分子筛催化反应生成CH3COOH反应机理如图所示:
①催化剂载体表面存在O2-、Zn2+两种活性吸附位,·CH3被 (填“O2-”或“Zn2+”)活性吸附位吸附。
②从电负性和化学键角度分析,过程ii可描述为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A 2.B 3.A 4.A 5.B 6.B 7.D
8.C 9.D 10.A 11.C 12.B 13.C
14.(1)2V2O5+N2H4+8HCl=4VOCl2+N2↑+6H2O >Cl->VO2+
N2H4的还原性强于HCl
(2) VO+Fe2++2H+=VO2++Fe3++H2O 28.69%
(3) VO2 2:1
15.(1) 羧基、酯基 sp2、sp3
(2)④
(3)
(4)
(5)CH3COOHCH3COCl
16.(1) 坩埚 abd
(2)加快反应速率,同时抑制生成的GeCl4水解
(3) GeCl4+(n+2)H2O=GeO2·nH2O↓+4HCl 该水解反应为放热反应,温度较低时平衡常数较大,反应物平衡转化率更高
(4)向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意值均可);随后加入足量NaClO3固体充分反应;在84℃蒸馏,将馏分冷却后,与0℃的蒸馏水混合,充分搅拌直至无沉淀生成
17.(1) ab H2S+=+HS-
(2) +234 kJ·mol-1 反应ⅱ的活化能比反应ⅰ大,在较低温度下,反应ⅱ未发生 或33.3% 降低
(3) Zn2+ 由于电负性:O > C > H,·CH3中碳原子带部分负电荷,CO2中碳原子带部分正电荷,两分子间形成C-C σ键,同时CO2中断裂π键,生成CH3COO·
答案第1页,共2页
答案第1页,共2页
高三化学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 N-14 O-16 S-32 Fe-56 V-51
第I卷(选择题 共39分)
一、选择题:本题共13小题,每小题3分,共39分。每小题只有一个选项符合题目要求。
1.2025年,AI在材料化学等领域取得了多项重要的研究成果。下列材料属于无机非金属材料的是
A.陶瓷花瓶 B.纸质作业本 C.蚕丝领带 D.高强度铝合金
2.有的自来水厂除了在自来水中通入氯气之外,还会通入适量氨气,以延长消毒时间,氨气与次氯酸发生如下反应:NH3+HClO NH2Cl+H2O。下列说法正确的是
A.HClO的结构式为H—Cl—O B.NH3和H2O都能作配合物的配体
C.NH3和H2O的VSEPR模型不同 D.NH2Cl中既含离子键又含共价键
3.SO2催化氧化生成SO3的过程是无机基础化工的重要催化过程。某化学兴趣小组利用如图装置模拟工业上SO2的催化氧化过程,并测定此条件下SO2的转化率。已知:SO3的熔点为16.8℃,下列装置不能达到实验目的的是
A.用甲装置制备SO2气体 B.用乙装置进行SO2的催化氧化
C.用丙装置吸收SO3并测定其质量 D.用丁装置吸收SO2并测定沉淀质量
4.高岭石的化学组成可表示为Al4[Si4O10](OH)8,其性质相当稳定,被誉为“万能石”,常作为制造瓷器和陶器的主要原料。下列说法正确的是
A.半径大小:r(Al3+)
阅读下列材料,完成下列几个问题:
氮及其化合物在生产生活中有重要应用。氮元素是典型变价非金属元素,其氧化物和请化物种类较多,氢化物有NH3、N2H4(联氨,又名肼)、HN3(叠氮酸)等。人工固氮技术是20世纪人类最伟大的成就之一,为人类解决粮食短缺问题作出了巨大的贡献。氨易液化,液氨能与钠反应。NH3中的一个H原子被-OH取代可形成羟胺(NH2OH),被-NH2取代可形成肼(N2H4),肼的燃烧热为622kJ·mol-1。将尿素、NaClO和NaOH溶液混合,在一定条件下反应可制得肼。
5.下列有关含氮物质的性质与用途对应关系正确的是
A.NO为无色气体,在人的生命活动中作为一种信息分子
B.N2H4具有较强的还原性,可用作火箭升空的燃料
C.NH4Cl受热易分解,实验室可用NH4Cl和Ca(OH)2共热制NH3
D.浓硝酸有强酸性,常温下可用铁槽车运输浓硝酸
6.下列化学反应的表示正确的是
A.金属钠和液氨反应:NH3+Na=NaNH2+H2↑
B.过量氨水和SO2反应:SO2+2NH3·H2O=(NH4)2SO3+H2O
C.尿素、NaClO、NaOH溶液制取肼的离子方程式:CO(NH2)2+ClO-=CO2↑+N2H4+Cl-
D.肼燃烧的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH =-622kJ·mol-1
7.已知:-OH的吸电子能力比-NH2的强。下列说法正确的是
A.NH3的键角比H2O小 B.NH3、HN3、NH4Cl形成的晶体都是分子晶体
C.NH2OH难溶于水 D.NH2OH中N结合H+的能力比N2H4弱
8.化合物Z是合成某种抗真菌药药物的中间体,下列说法不正确的是
A.X分子中所有碳原子可能共平面 B.Y分子存在对映异构现象
C.1mol Z最多能与3mol NaOH反应 D.Y、Z可用溴的CCl4溶液鉴别
9.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Cu(s)Cu(NO3)(aq)Cu(NO3)(s)
B.浓H2SO4(l)SO2(g)BaSO3(s)
C.NH3(g)NO(g)NaNO3(aq)
D.Na2CO3(aq)CO2(g)NaHCO3(aq)
10.室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:S8+e-→S,S+e-→S,2Na++S+2(1-)e-→Na2Sx
下列叙述错误的是
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++S8+2e-→Na2Sx
D.炭化纤维素纸的作用是增强硫电极导电性能
11.室温下,根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 向BaCl2溶液中通入SO2和气体X,产生白色沉淀 X有强氧化性,白色沉淀一定为BaSO4
B 向丙烯醇(CH2=CHCH2OH)中加入酸性KMnO4溶液,KMnO4溶液褪色 验证丙烯醇中是否含碳碳双键
C 向Na2SO3溶液中先滴加酚酞,再滴加BaCl2溶液至过量,溶液红色变浅至消失 Na2SO3溶液 水解使溶液呈碱性
D 在2 mL 0.01 mol·L-1Na2S溶液中先滴入几滴0.01 mol·L-1CuSO4溶液有黑色沉淀生成,再滴入0.01 mol·L-1ZnSO4溶液,又有白色沉淀生成 Ksp(ZnS)
12.室温下,通过下列实验探究NaHCO3和Na2CO3的性质:
实验1:测定0.1mol·L-1 NaHCO3溶液的pH约为8。
实验2:将0.1mol·L-1 Na2CO3溶液与0.1mol·L-1 CaCl2溶液等体积混合,产生白色沉淀。
实验3:将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3沉淀。
下列说法不正确的是
A.实验1的溶液中存在:Ka1(H2CO3)·Ka2(H2CO3)<KW
B.实验2的上层清液中存在:c(Ca2+)·c()<Ksp(CaCO3)
C.实验2的上层清液中存在:c(Na+)+2c(Ca2+)+c(H+)=c()+2c()+c(OH-)
D.实验3生成FeCO3沉淀的离子方程式为:2+Fe2+=FeCO3↓+CO2↑+H2O
13.历史上曾用地康法制氯气,其反应为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。下图为恒容容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系。若起始进料浓度c(O2)=1mol·L-1,则下列说法正确的是
A.反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)的ΔS<0,ΔH>0
B.400℃时,A、B、C三点的反应速率:v(A)>v(B)>v(C)
C.400℃时,该反应的平衡常数K=
D.400℃时,B点O2的平衡转化率为38%
第II卷(非选择题 共61分)
二、非选择题:共4题,共61分。
14.钒元素是一种以神话女神名字命名的元素。钒及其化合物在工业生产上有重要应用,V2O5是一种具有优良性能的化工原料,广泛用于冶金、化工行业,可制取多种含钒化合物。
(1)实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
“还原”步骤中生成VOCl2的同时还生成一种无色无污染的气体,反应的化学方程式为 ;若不加N2H4,HCl也能还原V2O5生成VO2+和Cl2,Cl2可被Na2SO3溶液吸收,则、Cl-、VO2+的还原性由强到弱的顺序是 ;分析制备反应中不生成Cl2的原因: 。
(2)对制得的晶体进行含钒量的测定:称取4.000g样品,经过系列处理后将钒(Ⅳ)完全氧化为VO,定容为100mL溶液;量取20.00mL溶液,加入几滴指示剂,用0.2000mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,VO转化为VO2+;平行滴定4次,消耗标准溶液的体积分别为22.50mL、22.45mL、21.00mL、22.55mL。则滴定过程中发生反应的离子方程式为 ,样品中钒元素的质量分数为 (写出计算过程,结果保留两位小数)。
(3)钒的某种氧化物的立方晶胞结构如图所示。
该钒的氧化物的化学式为 ,V原子的配位数与O的配位数之比为 。
15.化合物H是一种类生物碱,具有抗炎、抗肿瘤、抗病原微生物等生物活性,它的一种合成路线如下:
(1)G中官能团的名称为 ,其分子中碳原子的杂化类型为 。
(2)反应①②④⑤中,属于加成反应的是 (填序号)。
(3)反应③中有和E互为同分异构体的副产物生成,该副产物的结构简式为 。
(4)G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: 。
①属于芳香族化合物,且能发生银镜反应;
②酸性条件下水解得到三种分子在1H核磁共振谱中都有两组峰。
(5)写出以CH3COOH和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见题干): 。
16.锗是一种重要的半导体材料,同时在航空航天测控、化学催化剂、生物医学等领域都有广泛而重要的应用。实验室模拟生产锗的实验过程如图所示:
回答下列问题:
(1)在实验室中,若焙烧锗石矿,应将样品放在 中灼烧。产生的气体可以用下列 方式处理(填标号)。
a.NaOH溶液 b.酸性KMnO4溶液
c.苯和水的分层液 d.碱石灰
(2)步骤2:将烧渣放入三颈烧瓶中,分批加入浓盐酸并搅拌,控制温度为40℃反应30分钟。用浓盐酸而不用稀盐酸处理GeO2粗品的原因是 。
(3)写出“步骤4”生成GeO2·nH2O反应的化学方程式: 。“步骤4”操作时保持较低温度有利于提高产率,其可能的原因是 。
(4)GeO2粗品中常含有少量As2O3。另一种提纯GeO2的实验方法为:先将其转化为GeCl4,再在0℃下水解GeCl4得到高纯GeO2。已知:
①GeO2与As2O3均为两性氧化物,部分晶型的GeO2难溶于盐酸;
②GeCl4常温下是液体,沸点为84℃,易与AsCl3共沸;
③AsCl3在pH为0.4~0.6时有还原性。
现有已知As含量的粗品GeO2,补充完整提纯的实验方案:向粗品中分批加入4mol·L-1 NaOH溶液,直至粗品完全溶解, ,过滤,洗涤2~3次,干燥。(实验中须使用的试剂:10 mol·L-1盐酸、氯酸钠固体、蒸馏水)
17.天然气既是一种清洁能源,也是重要的化工原料,研究天然气的净化和利用具有重要意义。
(1)天然气中含少量H2S和CO2,需用一定方法脱除。
已知:H2S的Ka1=10-6.97,Ka2=10-12.9,H2CO3的Ka1=10-6.38,Ka2=10-10.25。
①用NaOH溶液脱H2S和CO2,脱除后的溶液中存在:S2-+H2O HS-+OH-、+H2O +OH-。下列说法正确的是 。
a.适当升高温度,溶液中c(OH-)增大
b.加入少量水,溶液中离子总数增大
c.通入少量HCl气体,增大
②用Na2CO3溶液脱H2S和CO2。将含H2S和CO2的天然气缓缓通入100mL 0.1mol·L-1 Na2CO3溶液中,脱除过程中H2S与Na2CO3发生反应的离子方程式是 。
(2)甲烷与硫化氢重整制氢反应为CH4(g)+2H2S(g) CS2(g)+4H2(g),其过程中反应ⅰ、ⅱ及其相对能量变化示意图如图1所示。在恒压条件下,起始时按n(H2S):n(CH4)=2:1 (同时通入一定量的N2进行稀释,N2不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中CH4、H2S、CS2、H2的物质的量分数(ω)的影响如图2所示。
①反应CH4(g)+2H2S(g) CS2(g)+4H2(g)的ΔH= 。
②研究发现,在800~870℃温度区间内,随温度升高,H2S在平衡时反应混合物中含量迅速下降,而CS2的含量几乎为0,其原因可能是 。
③研究发现,当温度大于900℃时,平衡混合物中非常接近4。则N点对应温度下,CH4的平衡转化率为 ;保持其他条件不变,若起始时不通入N2进行稀释,则CH4的平衡转化率会 (填“降低”“升高”或“无影响”)。
(3)CH4和CO2在Zn/ZSM—5分子筛催化反应生成CH3COOH反应机理如图所示:
①催化剂载体表面存在O2-、Zn2+两种活性吸附位,·CH3被 (填“O2-”或“Zn2+”)活性吸附位吸附。
②从电负性和化学键角度分析,过程ii可描述为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A 2.B 3.A 4.A 5.B 6.B 7.D
8.C 9.D 10.A 11.C 12.B 13.C
14.(1)2V2O5+N2H4+8HCl=4VOCl2+N2↑+6H2O >Cl->VO2+
N2H4的还原性强于HCl
(2) VO+Fe2++2H+=VO2++Fe3++H2O 28.69%
(3) VO2 2:1
15.(1) 羧基、酯基 sp2、sp3
(2)④
(3)
(4)
(5)CH3COOHCH3COCl
16.(1) 坩埚 abd
(2)加快反应速率,同时抑制生成的GeCl4水解
(3) GeCl4+(n+2)H2O=GeO2·nH2O↓+4HCl 该水解反应为放热反应,温度较低时平衡常数较大,反应物平衡转化率更高
(4)向溶液中加入10 mol·L-1盐酸至pH=0.5(0.4~0.6间的任意值均可);随后加入足量NaClO3固体充分反应;在84℃蒸馏,将馏分冷却后,与0℃的蒸馏水混合,充分搅拌直至无沉淀生成
17.(1) ab H2S+=+HS-
(2) +234 kJ·mol-1 反应ⅱ的活化能比反应ⅰ大,在较低温度下,反应ⅱ未发生 或33.3% 降低
(3) Zn2+ 由于电负性:O > C > H,·CH3中碳原子带部分负电荷,CO2中碳原子带部分正电荷,两分子间形成C-C σ键,同时CO2中断裂π键,生成CH3COO·
答案第1页,共2页
答案第1页,共2页
同课章节目录
