2025年湖北省襄阳市襄州区中考适应性考试化学试题(含答案)
文档属性
| 名称 | 2025年湖北省襄阳市襄州区中考适应性考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-25 21:52:49 | ||
图片预览


文档简介
2025年4月湖北省襄阳市襄州区中考适应性考试化学试题
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.熟茶制作主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等工序,下列工序中以化学变化为主的是
A.采摘 B.摊晾 C.揉捻 D.渥堆发酵
2.从微观角度来看,煮茶时闻到茶香的原因是
A.分子的质量和体积都很小 B.分子之间有间隔
C.温度升高,分子运动速率加快 D.分子是由原子构成的
3.以茶立德,以茶陶情,以茶会友,以茶敬宾。茶汤中含有茶黄素(化学式为C29H24O12)。下列有关茶黄素的说法中,不正确的是
A.茶黄素属于氧化物
B.茶黄素由碳、氢、氧元素组成
C.茶黄素中氢元素的质量分数最小
D.1个茶黄素分子由29个碳原子、24个氢原子和12个氧原子构成
4.2025年六五环境日的主题为“美丽中国我先行”,下列做法符合该主题的是
A.提倡使用一次性餐具 B.随意大量燃放烟花爆竹
C.开发和使用清洁能源 D.垃圾不分类就直接丢弃
5.锂离子电池是塞力斯汽车的核心部件之一。如图是锂在元素周期表中的信息,下列有关说法错误的是
A.锂属于金属元素
B.锂原子核内的质子数为3
C.氯化锂的化学式为LiCl2
D.锂的相对原子质量约为6.94
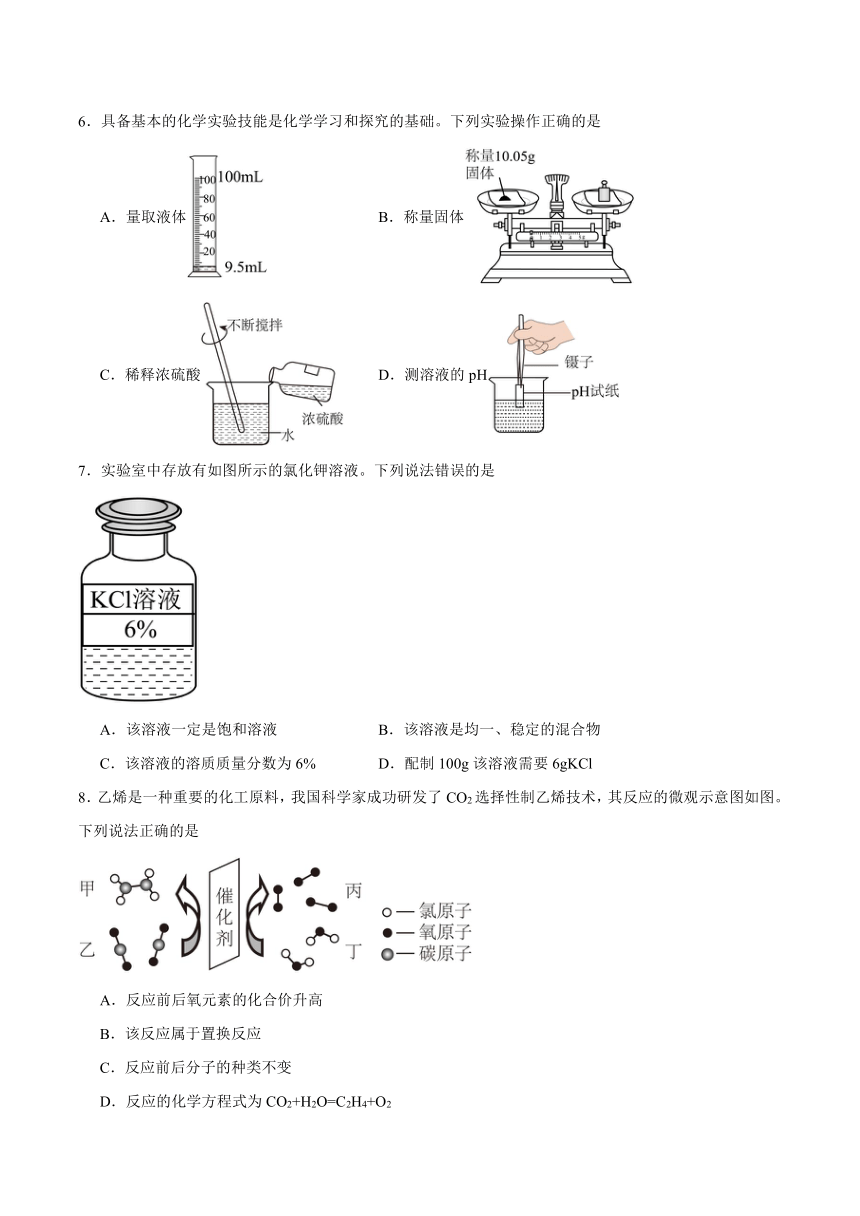
6.具备基本的化学实验技能是化学学习和探究的基础。下列实验操作正确的是
A.量取液体 B.称量固体
C.稀释浓硫酸 D.测溶液的pH
7.实验室中存放有如图所示的氯化钾溶液。下列说法错误的是
A.该溶液一定是饱和溶液 B.该溶液是均一、稳定的混合物
C.该溶液的溶质质量分数为6% D.配制100g该溶液需要6gKCl
8.乙烯是一种重要的化工原料,我国科学家成功研发了CO2选择性制乙烯技术,其反应的微观示意图如图。下列说法正确的是
A.反应前后氧元素的化合价升高
B.该反应属于置换反应
C.反应前后分子的种类不变
D.反应的化学方程式为CO2+H2O=C2H4+O2
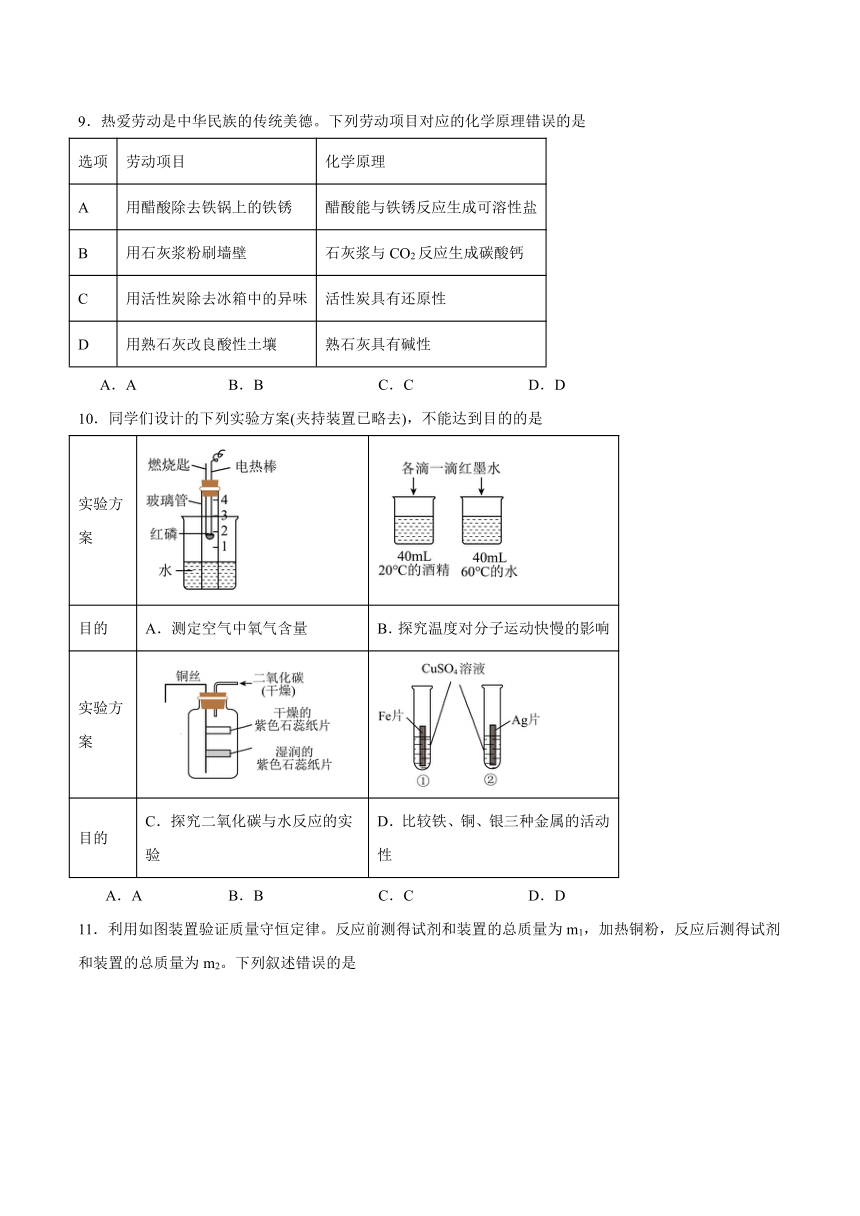
9.热爱劳动是中华民族的传统美德。下列劳动项目对应的化学原理错误的是
选项 劳动项目 化学原理
A 用醋酸除去铁锅上的铁锈 醋酸能与铁锈反应生成可溶性盐
B 用石灰浆粉刷墙壁 石灰浆与CO2反应生成碳酸钙
C 用活性炭除去冰箱中的异味 活性炭具有还原性
D 用熟石灰改良酸性土壤 熟石灰具有碱性
A.A B.B C.C D.D
10.同学们设计的下列实验方案(夹持装置已略去),不能达到目的的是
实验方案
目的 A.测定空气中氧气含量 B.探究温度对分子运动快慢的影响
实验方案
目的 C.探究二氧化碳与水反应的实验 D.比较铁、铜、银三种金属的活动性
A.A B.B C.C D.D
11.利用如图装置验证质量守恒定律。反应前测得试剂和装置的总质量为m1,加热铜粉,反应后测得试剂和装置的总质量为m2。下列叙述错误的是
A.加热过程中,铜粉由红色变成黑色
B.实验中铜粉未完全反应,仍能验证质量守恒定律
C.该反应遵守质量守恒定律时,m1=m2
D.该实验不使用橡胶塞和气球时,则
12.利用溶解度曲线,可以获得许多有关物质溶解度的信息。Ca(OH)2、K2CO3的溶解度曲线示意图如图,下列说法正确的是
A.40℃时,Ca(OH)2的溶解度比K2CO3的溶解度大
B.40℃时,Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.40℃时,K2CO3饱和溶液的溶质质量分数为11.7%
D.40℃时,将0.14gCa(OH)2放入100g水中充分溶解后得到100.14g溶液
13.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列有关说法不正确的是
A.“以水淋汁”包含溶解过程
B.“石碱”的主要成分不可能是NaOH
C.“石碱”发面时会产生气体
D.“石碱”去油污的原理和汽油去油污的原理相同
二、填空与简答
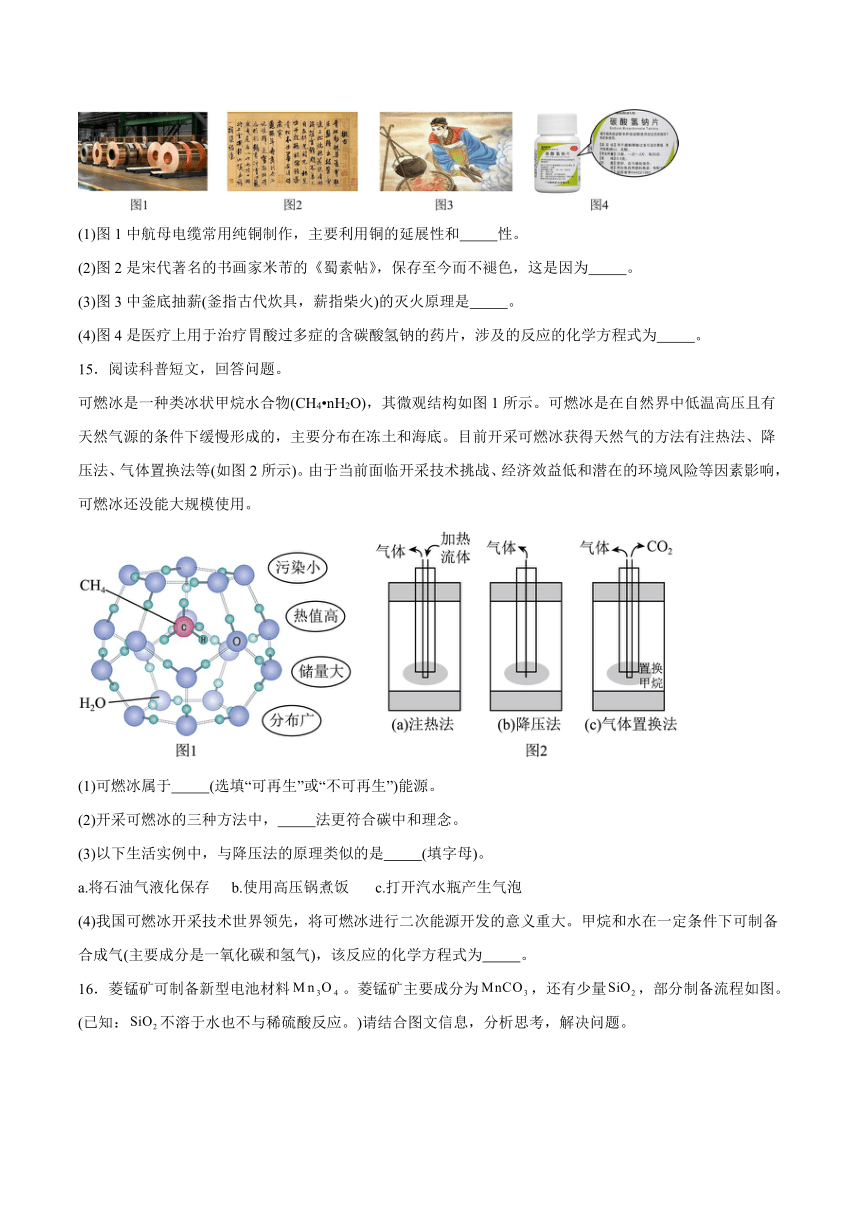
14.生产、生活中蕴含着许多化学知识。
(1)图1中航母电缆常用纯铜制作,主要利用铜的延展性和 性。
(2)图2是宋代著名的书画家米芾的《蜀素帖》,保存至今而不褪色,这是因为 。
(3)图3中釜底抽薪(釜指古代炊具,薪指柴火)的灭火原理是 。
(4)图4是医疗上用于治疗胃酸过多症的含碳酸氢钠的药片,涉及的反应的化学方程式为 。
15.阅读科普短文,回答问题。
可燃冰是一种类冰状甲烷水合物(CH4 nH2O),其微观结构如图1所示。可燃冰是在自然界中低温高压且有天然气源的条件下缓慢形成的,主要分布在冻土和海底。目前开采可燃冰获得天然气的方法有注热法、降压法、气体置换法等(如图2所示)。由于当前面临开采技术挑战、经济效益低和潜在的环境风险等因素影响,可燃冰还没能大规模使用。
(1)可燃冰属于 (选填“可再生”或“不可再生”)能源。
(2)开采可燃冰的三种方法中, 法更符合碳中和理念。
(3)以下生活实例中,与降压法的原理类似的是 (填字母)。
a.将石油气液化保存 b.使用高压锅煮饭 c.打开汽水瓶产生气泡
(4)我国可燃冰开采技术世界领先,将可燃冰进行二次能源开发的意义重大。甲烷和水在一定条件下可制备合成气(主要成分是一氧化碳和氢气),该反应的化学方程式为 。
16.菱锰矿可制备新型电池材料。菱锰矿主要成分为,还有少量,部分制备流程如图。(已知:不溶于水也不与稀硫酸反应。)请结合图文信息,分析思考,解决问题。
(1)粉碎机中将菱锰矿粉碎的目的是 。
(2)溶解池中与稀硫酸发生的反应,与与稀硫酸发生的反应类似,该反应的化学方程式是 。稀硫酸过量的作用是 。
(3)过滤器中得到的滤渣是 。
(4)反应器中,,X的化学式是 。
17.化学小组的同学基于碳中和理念设计低碳行动方案。
I.“碳”素发现
(1)图1是地球表面温度变化和大气二氧化碳浓度的变化趋势示意图。图1中可作为“二氧化碳排放量的增加会导致地球表面温度上升”的证据的是 。
Ⅱ.物理固“碳”
(2)如图2,将海水注入充满CO2气体的集气瓶中,振荡。若观察到 的现象,则证明海水可以吸收CO2。
Ⅲ.捕风捉“碳”
同学们设计了一个简易的CO2捕捉器,如图3所示。
(3)在吸风机纱布上涂抹一层石灰乳[5mL]水和2gCa(OH)2混合制得]进行实验,一段时间后发现纱布变硬,吸风效果变差,原因可能是 (用化学方程式表示)。
Ⅳ.“碳”寻转化
(4)一定条件下,可将二氧化碳和氢气在催化剂表面转化为清洁的液体燃料甲醇(CH3OH)和水,该反应在有、无分子筛膜时甲醇的产率随温度的变化如图4所示。为提高甲醇的产率,合成甲醇应选择的最佳条件为 。
三、计算题
18.磷酸二氢铵(NH4H2PO4)是农业生产中重要的复合肥料,将磷酸溶液稀释至适当浓度后,在搅拌的条件下通入氨气制得该肥料,反应的化学方程式为NH3+H3PO4=NH4H2PO4。回答下列问题。
(1)磷酸二氢铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)若要生产23t磷酸二氢铵,理论上需要通入氨气的质量是多少 (写出计算过程及结果)
四、实验题
19.结合下列实验装置示意图,回答问题。
(1)写出仪器a的名称: 。
(2)若在实验室中选用A装置制取氧气,反应的化学方程式为 。
(3)实验室制取并检验CO2时,气体应从C装置的 (选填“m”或“n”)端管口通入。
(4)实验室用过氧化氢溶液和二氧化锰混合制取氧气,若要制取并收集较纯净的氧气,从上述实验装置中选择的组合为 (填字母)。
五、科学探究题
20.某化学兴趣小组同学对某自热食品专用发热包(部分标签如下)进行了如下探究。
[品名]食品专用发热包 [主要成分]氧化钙、铝粉、碳酸钠 [净含量]50g [使用方法]撕开塑料袋后加常温水 [注意事项]使用时要远离明火,严禁在密闭场所使用
I.初步探究
将一包撕开塑料袋后的发热包平放在烧杯底部,加入200mL常温水,插入温度计。观察到温度计示数逐渐升至92℃,冒出大量白雾,液体底部产生大量气泡。
(1)该发热包的主要成分中含有的三种物质都是生活中常见的物质,其中碳酸钠俗称纯碱或者苏打,氧化钙的俗称为 。
(2)甲同学认为热量来自氧化钙转化为氢氧化钙的过程,该反应所属的基本反应类型为 反应。
Ⅱ.深入探究
为什么要求“远离明火,严禁在密闭场所中使用”
[猜想假设]生成的气体是可燃性气体。
[查阅资料]2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应放热。
[设计并进行实验]根据资料,兴趣小组同学设计并进行了如图1实验。
(3)乙同学发现发热包主要成分中并无NaOH,用化学方程式表示产生NaOH的原因: 。
(4)丙同学按图1中①所示进行实验,发现气体无法被点燃。思考后改进实验装置如图1中②所示,并进行实验,观察到气体被点燃,烧杯内壁有水雾。②中浓硫酸的作用是 。
[结论]发热过程中产生可燃性气体。
Ⅲ.自制发热包
兴趣小组同学将碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀配成50g自制发热包,倒入无纺布袋中后封口。小组同学往自制发热包中加入200mL常温水,并用温度传感器和pH传感器进行测量,结果如图2,110s时观察到有大量气泡产生。
(5)根据检测结果,该自制发热包 (选填“能”或“不能”)达到专用发热包的效果。
(6)110~1856s内,pH先降低后升高的原因是 。
《2025年4月湖北省襄阳市襄州区中考适应性考试化学试题》参考答案
1.D
2.C
3.A
4.C
5.C
6.C
7.A
8.A
9.C
10.B
11.D
12.D
13.D
14.(1)导电
(2)墨的主要成分是碳,常温下碳的化学性质不活泼
(3)清除可燃物
(4)
15.(1)不可再生
(2)气体置换
(3)c
(4)
16.(1)增大反应物之间的接触面积,使反应更快更充分
(2) 使完全反应
(3)/二氧化硅
(4)
17.(1)随着大气二氧化碳浓度的增加,地球表面温度呈上升趋势
(2)气球变大
(3)
(4)有分子筛膜、210℃
18.(1)7:3
(2)解:设若要生产23t磷酸二氢铵,理论上需要通入氨气的质量为x,
x=3.4t
答:若要生产23t磷酸二氢铵,理论上需要通入氨气的质量是3.4t。
19.(1)锥形瓶
(2)
(3)m
(4)BE
20.(1)生石灰
(2)化合
(3)、
(4)干燥气体
(5)不能
(6)110s~880s内,氢氧化钠溶液被铝粉逐渐消耗,pH逐渐减小,880s~1856s内,完全反应,温度降低,氢氧化钙的溶解度增大,随着氢氧化钙的溶解度逐渐增大,pH逐渐升高
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.熟茶制作主要包括采摘、摊晾、杀青、揉捻、渥堆发酵、出堆解块等工序,下列工序中以化学变化为主的是
A.采摘 B.摊晾 C.揉捻 D.渥堆发酵
2.从微观角度来看,煮茶时闻到茶香的原因是
A.分子的质量和体积都很小 B.分子之间有间隔
C.温度升高,分子运动速率加快 D.分子是由原子构成的
3.以茶立德,以茶陶情,以茶会友,以茶敬宾。茶汤中含有茶黄素(化学式为C29H24O12)。下列有关茶黄素的说法中,不正确的是
A.茶黄素属于氧化物
B.茶黄素由碳、氢、氧元素组成
C.茶黄素中氢元素的质量分数最小
D.1个茶黄素分子由29个碳原子、24个氢原子和12个氧原子构成
4.2025年六五环境日的主题为“美丽中国我先行”,下列做法符合该主题的是
A.提倡使用一次性餐具 B.随意大量燃放烟花爆竹
C.开发和使用清洁能源 D.垃圾不分类就直接丢弃
5.锂离子电池是塞力斯汽车的核心部件之一。如图是锂在元素周期表中的信息,下列有关说法错误的是
A.锂属于金属元素
B.锂原子核内的质子数为3
C.氯化锂的化学式为LiCl2
D.锂的相对原子质量约为6.94
6.具备基本的化学实验技能是化学学习和探究的基础。下列实验操作正确的是
A.量取液体 B.称量固体
C.稀释浓硫酸 D.测溶液的pH
7.实验室中存放有如图所示的氯化钾溶液。下列说法错误的是
A.该溶液一定是饱和溶液 B.该溶液是均一、稳定的混合物
C.该溶液的溶质质量分数为6% D.配制100g该溶液需要6gKCl
8.乙烯是一种重要的化工原料,我国科学家成功研发了CO2选择性制乙烯技术,其反应的微观示意图如图。下列说法正确的是
A.反应前后氧元素的化合价升高
B.该反应属于置换反应
C.反应前后分子的种类不变
D.反应的化学方程式为CO2+H2O=C2H4+O2
9.热爱劳动是中华民族的传统美德。下列劳动项目对应的化学原理错误的是
选项 劳动项目 化学原理
A 用醋酸除去铁锅上的铁锈 醋酸能与铁锈反应生成可溶性盐
B 用石灰浆粉刷墙壁 石灰浆与CO2反应生成碳酸钙
C 用活性炭除去冰箱中的异味 活性炭具有还原性
D 用熟石灰改良酸性土壤 熟石灰具有碱性
A.A B.B C.C D.D
10.同学们设计的下列实验方案(夹持装置已略去),不能达到目的的是
实验方案
目的 A.测定空气中氧气含量 B.探究温度对分子运动快慢的影响
实验方案
目的 C.探究二氧化碳与水反应的实验 D.比较铁、铜、银三种金属的活动性
A.A B.B C.C D.D
11.利用如图装置验证质量守恒定律。反应前测得试剂和装置的总质量为m1,加热铜粉,反应后测得试剂和装置的总质量为m2。下列叙述错误的是
A.加热过程中,铜粉由红色变成黑色
B.实验中铜粉未完全反应,仍能验证质量守恒定律
C.该反应遵守质量守恒定律时,m1=m2
D.该实验不使用橡胶塞和气球时,则
12.利用溶解度曲线,可以获得许多有关物质溶解度的信息。Ca(OH)2、K2CO3的溶解度曲线示意图如图,下列说法正确的是
A.40℃时,Ca(OH)2的溶解度比K2CO3的溶解度大
B.40℃时,Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.40℃时,K2CO3饱和溶液的溶质质量分数为11.7%
D.40℃时,将0.14gCa(OH)2放入100g水中充分溶解后得到100.14g溶液
13.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”下列有关说法不正确的是
A.“以水淋汁”包含溶解过程
B.“石碱”的主要成分不可能是NaOH
C.“石碱”发面时会产生气体
D.“石碱”去油污的原理和汽油去油污的原理相同
二、填空与简答
14.生产、生活中蕴含着许多化学知识。
(1)图1中航母电缆常用纯铜制作,主要利用铜的延展性和 性。
(2)图2是宋代著名的书画家米芾的《蜀素帖》,保存至今而不褪色,这是因为 。
(3)图3中釜底抽薪(釜指古代炊具,薪指柴火)的灭火原理是 。
(4)图4是医疗上用于治疗胃酸过多症的含碳酸氢钠的药片,涉及的反应的化学方程式为 。
15.阅读科普短文,回答问题。
可燃冰是一种类冰状甲烷水合物(CH4 nH2O),其微观结构如图1所示。可燃冰是在自然界中低温高压且有天然气源的条件下缓慢形成的,主要分布在冻土和海底。目前开采可燃冰获得天然气的方法有注热法、降压法、气体置换法等(如图2所示)。由于当前面临开采技术挑战、经济效益低和潜在的环境风险等因素影响,可燃冰还没能大规模使用。
(1)可燃冰属于 (选填“可再生”或“不可再生”)能源。
(2)开采可燃冰的三种方法中, 法更符合碳中和理念。
(3)以下生活实例中,与降压法的原理类似的是 (填字母)。
a.将石油气液化保存 b.使用高压锅煮饭 c.打开汽水瓶产生气泡
(4)我国可燃冰开采技术世界领先,将可燃冰进行二次能源开发的意义重大。甲烷和水在一定条件下可制备合成气(主要成分是一氧化碳和氢气),该反应的化学方程式为 。
16.菱锰矿可制备新型电池材料。菱锰矿主要成分为,还有少量,部分制备流程如图。(已知:不溶于水也不与稀硫酸反应。)请结合图文信息,分析思考,解决问题。
(1)粉碎机中将菱锰矿粉碎的目的是 。
(2)溶解池中与稀硫酸发生的反应,与与稀硫酸发生的反应类似,该反应的化学方程式是 。稀硫酸过量的作用是 。
(3)过滤器中得到的滤渣是 。
(4)反应器中,,X的化学式是 。
17.化学小组的同学基于碳中和理念设计低碳行动方案。
I.“碳”素发现
(1)图1是地球表面温度变化和大气二氧化碳浓度的变化趋势示意图。图1中可作为“二氧化碳排放量的增加会导致地球表面温度上升”的证据的是 。
Ⅱ.物理固“碳”
(2)如图2,将海水注入充满CO2气体的集气瓶中,振荡。若观察到 的现象,则证明海水可以吸收CO2。
Ⅲ.捕风捉“碳”
同学们设计了一个简易的CO2捕捉器,如图3所示。
(3)在吸风机纱布上涂抹一层石灰乳[5mL]水和2gCa(OH)2混合制得]进行实验,一段时间后发现纱布变硬,吸风效果变差,原因可能是 (用化学方程式表示)。
Ⅳ.“碳”寻转化
(4)一定条件下,可将二氧化碳和氢气在催化剂表面转化为清洁的液体燃料甲醇(CH3OH)和水,该反应在有、无分子筛膜时甲醇的产率随温度的变化如图4所示。为提高甲醇的产率,合成甲醇应选择的最佳条件为 。
三、计算题
18.磷酸二氢铵(NH4H2PO4)是农业生产中重要的复合肥料,将磷酸溶液稀释至适当浓度后,在搅拌的条件下通入氨气制得该肥料,反应的化学方程式为NH3+H3PO4=NH4H2PO4。回答下列问题。
(1)磷酸二氢铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)若要生产23t磷酸二氢铵,理论上需要通入氨气的质量是多少 (写出计算过程及结果)
四、实验题
19.结合下列实验装置示意图,回答问题。
(1)写出仪器a的名称: 。
(2)若在实验室中选用A装置制取氧气,反应的化学方程式为 。
(3)实验室制取并检验CO2时,气体应从C装置的 (选填“m”或“n”)端管口通入。
(4)实验室用过氧化氢溶液和二氧化锰混合制取氧气,若要制取并收集较纯净的氧气,从上述实验装置中选择的组合为 (填字母)。
五、科学探究题
20.某化学兴趣小组同学对某自热食品专用发热包(部分标签如下)进行了如下探究。
[品名]食品专用发热包 [主要成分]氧化钙、铝粉、碳酸钠 [净含量]50g [使用方法]撕开塑料袋后加常温水 [注意事项]使用时要远离明火,严禁在密闭场所使用
I.初步探究
将一包撕开塑料袋后的发热包平放在烧杯底部,加入200mL常温水,插入温度计。观察到温度计示数逐渐升至92℃,冒出大量白雾,液体底部产生大量气泡。
(1)该发热包的主要成分中含有的三种物质都是生活中常见的物质,其中碳酸钠俗称纯碱或者苏打,氧化钙的俗称为 。
(2)甲同学认为热量来自氧化钙转化为氢氧化钙的过程,该反应所属的基本反应类型为 反应。
Ⅱ.深入探究
为什么要求“远离明火,严禁在密闭场所中使用”
[猜想假设]生成的气体是可燃性气体。
[查阅资料]2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应放热。
[设计并进行实验]根据资料,兴趣小组同学设计并进行了如图1实验。
(3)乙同学发现发热包主要成分中并无NaOH,用化学方程式表示产生NaOH的原因: 。
(4)丙同学按图1中①所示进行实验,发现气体无法被点燃。思考后改进实验装置如图1中②所示,并进行实验,观察到气体被点燃,烧杯内壁有水雾。②中浓硫酸的作用是 。
[结论]发热过程中产生可燃性气体。
Ⅲ.自制发热包
兴趣小组同学将碳酸钠粉末、氧化钙粉末(稍过量)、铝粉混合均匀配成50g自制发热包,倒入无纺布袋中后封口。小组同学往自制发热包中加入200mL常温水,并用温度传感器和pH传感器进行测量,结果如图2,110s时观察到有大量气泡产生。
(5)根据检测结果,该自制发热包 (选填“能”或“不能”)达到专用发热包的效果。
(6)110~1856s内,pH先降低后升高的原因是 。
《2025年4月湖北省襄阳市襄州区中考适应性考试化学试题》参考答案
1.D
2.C
3.A
4.C
5.C
6.C
7.A
8.A
9.C
10.B
11.D
12.D
13.D
14.(1)导电
(2)墨的主要成分是碳,常温下碳的化学性质不活泼
(3)清除可燃物
(4)
15.(1)不可再生
(2)气体置换
(3)c
(4)
16.(1)增大反应物之间的接触面积,使反应更快更充分
(2) 使完全反应
(3)/二氧化硅
(4)
17.(1)随着大气二氧化碳浓度的增加,地球表面温度呈上升趋势
(2)气球变大
(3)
(4)有分子筛膜、210℃
18.(1)7:3
(2)解:设若要生产23t磷酸二氢铵,理论上需要通入氨气的质量为x,
x=3.4t
答:若要生产23t磷酸二氢铵,理论上需要通入氨气的质量是3.4t。
19.(1)锥形瓶
(2)
(3)m
(4)BE
20.(1)生石灰
(2)化合
(3)、
(4)干燥气体
(5)不能
(6)110s~880s内,氢氧化钠溶液被铝粉逐渐消耗,pH逐渐减小,880s~1856s内,完全反应,温度降低,氢氧化钙的溶解度增大,随着氢氧化钙的溶解度逐渐增大,pH逐渐升高
同课章节目录
