江苏省泰兴市第一高级中学2015-2016学年高二下学期第四次阶段测试化学试题
文档属性
| 名称 | 江苏省泰兴市第一高级中学2015-2016学年高二下学期第四次阶段测试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-14 00:00:00 | ||
图片预览




文档简介
2016年春学期高二年级阶段测试(四)
化学(选修)试卷
(考试时间100分钟,满分120分)
可能用到的相对原子质量:H-1
C-12
N-14
O-16
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是
A.蛋白质中含有碳、氢、氧、氮等元素
B.蛋白质属于高分子化合物
C.消毒过程中细菌蛋白质发生了盐析
D.蛋白质可水解生成氨基酸
2.下列化学用语正确的是
A.甲基的电子式:
B.氮原子的电子排布图:
C.淀粉的实验式:CH2O
D.聚乙炔结构简式:
3.下列物质性质与应用对应关系正确的是
A.福尔马林具有防腐性,可用于制备酚醛树脂
B.甘油具有吸水性,可用作抗冻剂
C.乙酸乙酯能水解,可用于制备肥皂
D.淀粉水解能生成葡萄糖,可用于制备乙醇
4.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1
mol甲醇中含有C—H键的数目为4NA
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.1mol丙烯酸中含有双键的数目为NA
5.下列实验对应装置图正确的是
6.下图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有
A.①④
B.②③
C.①②③
D.①②③④
7.下列化学方程式正确的是
A.
B.
C.
D.
8.已知PCl3的熔点为
-93.6 °C,沸点为76.1℃,露置于空气中有白雾生成。下列叙述正确的是
A.PCl3属于离子晶体
B.PCl3中心磷原子为sp2杂化
C.
PCl3分子属于非极性分子
D.PCl3水解可以生成盐酸
9.为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
选项
物质
除杂试剂
分离方法
A
乙醇
(乙酸)
NaOH溶液
蒸馏
B
甲烷(乙烯)
酸性KMnO4溶液
洗气
C
苯(苯酚)
浓溴水
过滤
D
溴乙烷(溴)
NaOH溶液
分液
10.已知X、Y、Z、W是原子序数依次增
( http: / / www.21cnjy.com )大的短周期主族元素,X最外层电子数是次外层电子数的2倍,Y和W同主族,且W的原子序数是Y的2倍,Z的焰色反应为黄色。下列说法不正确的是
A.原子半径大小顺序:r(Z)>r(W)>r(Y)
B.Y的简单气态氢化物的热稳定性比W的强
C.Z和Y形成的原子个数比为1∶1和2∶1的化合物中化学键类型相同
D.X的最高价氧化物对应水化物的酸性比W的弱
不定项选择题:本题包括5小题,每小题4分,
( http: / / www.21cnjy.com )共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
氧化性:HClO>HClO4
HClO4分子中非羟基氧原子数目较多
B
沸点:SiO2>CO2
相对分子质量越大沸点越高
C
密度:干冰>冰
干冰晶体属于分子密堆积
D
分解温度:MgO>NaCl
MgO晶格能大于NaCl
12.根据下列结构示意图,判断下列说法中正确的是
A.在CsCl晶体中,距Cs+最近的Cl 有6个
B.在CaF2晶体中,Ca2+周围距离最近的F 有4个
C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子
D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个
13.化合物G(结构如下图)是合成抗癌药氨柔比星的中间体。下列说法正确的是
A.该有机物的分子式为C12H14NO4
B.该有机物既可与盐酸反应,又可与NaOH溶液反应
C.该有机物中含有2个手性碳原子
D.1mol该有机物最多只能与1molBr2发生取代反应
14.下列实验操作、实验现象以及实验结论完全正确的是
选项
实验操作
实验现象
实验结论
A
植物油中加入含有酚酞的NaOH溶液,微热
红色变浅,且不再分层
油脂发生了水解反应
B
柠檬醛()中加入酸性高锰酸钾溶液
溶液褪色
柠檬醛分子中含有醛基
C
溴乙烷与NaOH溶液共热后,加入AgNO3溶液
出现淡黄色沉淀
溴乙烷发生了水解
D
向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸
没有砖红色沉淀
淀粉未水解
15.X、Y都是芳香族化合物,1molX水
( http: / / www.21cnjy.com )解得到1molY和2mol醋酸。Y相对分子质量介于100~150之间,且碳和氢两种元素的总质量分数为65.2%。X溶液能发生银镜反应,向Y水溶液中滴加NaHCO3无气泡,滴加FeCl3溶液显紫色。下列说法正确的是
A.X分子中含有酯基和醛基
B.X和Y相对分子质量之差为120
C.X分子中有6个O原子,且水溶液显酸性
D.Y分子可能结构有6种
第II卷
(非选择题
共80分)
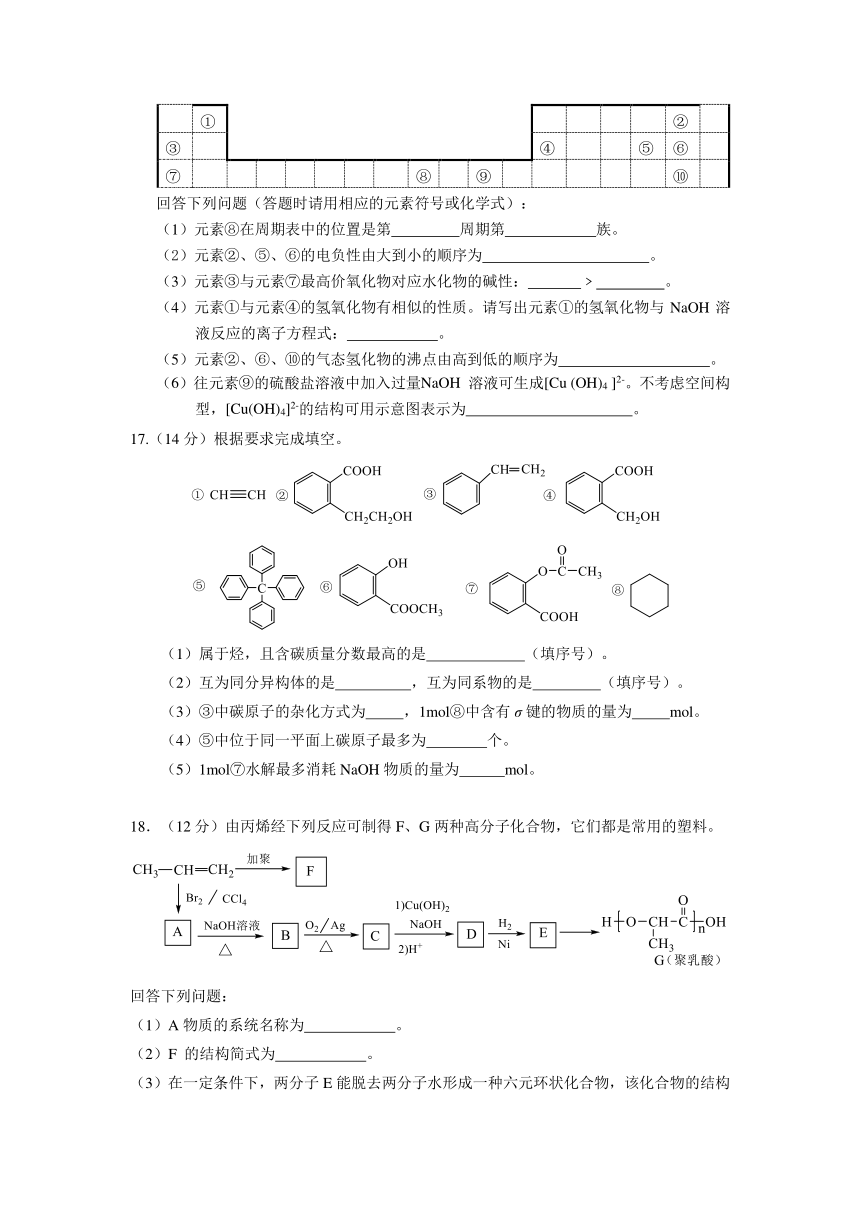
16.(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
回答下列问题(答题时请用相应的元素符号或化学式):
(1)元素⑧在周期表中的位置是第
周期第
族。
(2)元素②、⑤、⑥的电负性由大到小的顺序为
。
(3)元素③与元素⑦最高价氧化物对应水化物的碱性:
﹥
。
(4)元素①与元素④的氢氧化物有相似的性质。请写出元素①的氢氧化物与NaOH溶液反应的离子方程式:
。
(5)元素②、⑥、⑩的气态氢化物的沸点由高到低的顺序为
。
(6)往元素⑨的硫酸盐溶液
( http: / / www.21cnjy.com )中加入过量NaOH
溶液可生成[Cu
(OH)4
]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
。
17.(14分)根据要求完成填空。
(1)属于烃,且含碳质量分数最高的是
(填序号)。
(2)互为同分异构体的是
,互为同系物的是
(填序号)。
(3)③中碳原子的杂化方式为
,1mol⑧中含有σ键的物质的量为
mol。
(4)⑤中位于同一平面上碳原子最多为
个。
(5)1mol⑦水解最多消耗NaOH物质的量为
mol。
18.(12分)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
回答下列问题:
(1)A物质的系统名称为
。
(2)F
的结构简式为
。
(3)在一定条件下,两分子E能脱去两分
( http: / / www.21cnjy.com )子水形成一种六元环状化合物,该化合物的结构简式为
。
(4)①B→C化学方程式为:
。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式:
。
(5)X为E(C3H6O3)的一种
( http: / / www.21cnjy.com )同分异构体,1molX与足量金属钠反应产生1mol氢气,1molX与足量银氨溶液反应能生成2molAg,则X的结构简式为
。
(6)用G代替F制成一次性塑料餐盒的优点是
。
19.(15分)正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
反应物和生成物的相关数据如下:
相对分子质量
沸点/℃
密度/g·cm3
水中溶解性
正丁醇
74
117.2
0.8109
微溶
正丁醚
130
142.0
0.7704
几乎不溶
合成反应:
①将6
mL浓硫酸和37
g正丁醇,按一定顺序添加到A中,
并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70
mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40ml水,20mlNaOH溶液和40ml水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
回答下列问题:
(1)步骤①中浓硫酸和正丁醇的添加顺序为
。
(2)加热A前,需先从
(填“a”或“b”)口向B中通入水。
(3)反应过程中会观察到分水器中收
( http: / / www.21cnjy.com )集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为
,采用分水器除了可以提高正丁醇的利用率,还可以起到
作用(根据有关化学理论回答)。
(4)步骤③的目的是初步洗去
,振摇后静置,粗产物应在分液漏斗的
(填“上”或“下”)口分离出。
(5)若温度过高会发生副反应生成烯烃,可能的反应方程式为
。
(6)步骤⑤中,加热蒸馏时应收集
℃左右的馏分。本实验中,正丁醚的产率为
。
20.(15分)高原儿茶酸可用于治疗中枢神经性疾病,可通过以下方法合成。
(1)高原儿茶酸中含氧官能团的名称为
和
。
(2)合成路线中设计反应①和⑦的目的是
。
(3)反应①的反应类型为
,反应③的反应类型为
。
(4)G的一种同分异构体满足下列条件:
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式
。
(5)根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任选)。合成路线示例如下:
21.(12分)已知尿素(结构简式:)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。回答下列问题。
(1)基态Fe3+的核外电子排布式为
;
(2)C、N、O三种元素的第一电离能由大到小的顺序是
。
NH3分子的形状是
。尿素易溶于水,主要原因是
。
(3)和NO3 互为等电子体的一种阴离子是
。
(4)如图所示为铁的某种氧化物晶胞示意图,该氧化物的化学式为
。
高二化学答题纸
16.(12分)
(1)__________
__________
(2)__________________(3)__________>__________
(4)____________________________________________(5)___________________________
(6)_______________________________17.(14分)(1)________
(2)__________
___________
(3)_________
_________(4)________
(5)__________18.(12分)(1)__________________________
(2)_______________________________(3)__________________________________________(4)①______________________________________________________________②__________________________________________________________________
(5)_________________(6)_____________________________________________________________________
请在各题目的答题区内作答,超出黑色矩形框限定区域的答案无效
19.(15分)(1)__________________________________________________
(2)_________(3)___________
__________________________________________________(4)___________
________(5)________________________________________________________________(6)_____________
_____________20.(15分)(1)___________
___________
(2)________________________(3)________________
________________(4)
________________________(5)21.(12分)(1)_____________(2)_____________
____________
________________________________________(3)_________
(4)______________________________________________________
请在各题目的答题区内作答,超出黑色矩形框限定区域的答案无效
高二化学春阶段四参考答案和评分标准
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意
1、C
2、B
3、D
4、B
5、A
6、B
7、C
8、D
9、A
10、C
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11、CD
12、D
13、BC
14、A
15、AD
16.(12分)
(1)四
Ⅷ
(每空1分,共2分)
(2)F>Cl>S(2分)
(3)KOH
NaOH(2分)
(4)Be(OH)2+2OH-BeO22-+2H2O
(2分)
(5)HF>HBr>HCl(2分)
(6)
( http: / / www.21cnjy.com )(2分)
17.(14分)(每空2分)
⑴
⑤
(2)④⑥
②④
(3)sp2
18
(4)13
(5)3
18.(12分)
(1)1,2-二溴丙烷(1分)
(2)(1分)
(3)(2分)
(4)①(2分)
②(2分)
(5)
(2分)
(6)聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。(2分)
19.(15分)
(1)先加入正丁醇,再加入浓硫酸。(2分)
(2)b(1分)
(3)正丁醇(2分)不断分离出水,促使平衡正向移动(2分)
(4)浓硫酸
;上
(每空1分,共2分)
(5)(2分)
(6)142(2分)
40.0%(2分)
20.(15分)
(1)羟基(1分)、羧基(1分)
(2)保护酚羟基(2分)
(3)取代反应(2分)、还原反应(2分)
(4)或(2分)
(5)(5分)
21.(12分)(每空2分)
(1)[Ar]3d5
(2)N>O>C
三角锥形
尿素分子和水分子之间能形成氢键
(3)CO32
(4)FeO
其它合理答案参照给分
1s
2s
2p
↑↓
↑↓
↑
↑
↑
饱和碳酸钠
溶液
A.从煤焦油中提取苯
B.实验室制乙酸乙酯
乙醇
浓H2SO4
浓硫酸
C.实验室制乙烯
D.实验室制取、收集乙炔气体
CsCl晶体
CaF2晶体
SiO2晶体
铜晶体
化合物G
班
级_________
姓
名_________
考试号_________
装
订
线
座号
化学(选修)试卷
(考试时间100分钟,满分120分)
可能用到的相对原子质量:H-1
C-12
N-14
O-16
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是
A.蛋白质中含有碳、氢、氧、氮等元素
B.蛋白质属于高分子化合物
C.消毒过程中细菌蛋白质发生了盐析
D.蛋白质可水解生成氨基酸
2.下列化学用语正确的是
A.甲基的电子式:
B.氮原子的电子排布图:
C.淀粉的实验式:CH2O
D.聚乙炔结构简式:
3.下列物质性质与应用对应关系正确的是
A.福尔马林具有防腐性,可用于制备酚醛树脂
B.甘油具有吸水性,可用作抗冻剂
C.乙酸乙酯能水解,可用于制备肥皂
D.淀粉水解能生成葡萄糖,可用于制备乙醇
4.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1
mol甲醇中含有C—H键的数目为4NA
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.1mol丙烯酸中含有双键的数目为NA
5.下列实验对应装置图正确的是
6.下图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有
A.①④
B.②③
C.①②③
D.①②③④
7.下列化学方程式正确的是
A.
B.
C.
D.
8.已知PCl3的熔点为
-93.6 °C,沸点为76.1℃,露置于空气中有白雾生成。下列叙述正确的是
A.PCl3属于离子晶体
B.PCl3中心磷原子为sp2杂化
C.
PCl3分子属于非极性分子
D.PCl3水解可以生成盐酸
9.为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
选项
物质
除杂试剂
分离方法
A
乙醇
(乙酸)
NaOH溶液
蒸馏
B
甲烷(乙烯)
酸性KMnO4溶液
洗气
C
苯(苯酚)
浓溴水
过滤
D
溴乙烷(溴)
NaOH溶液
分液
10.已知X、Y、Z、W是原子序数依次增
( http: / / www.21cnjy.com )大的短周期主族元素,X最外层电子数是次外层电子数的2倍,Y和W同主族,且W的原子序数是Y的2倍,Z的焰色反应为黄色。下列说法不正确的是
A.原子半径大小顺序:r(Z)>r(W)>r(Y)
B.Y的简单气态氢化物的热稳定性比W的强
C.Z和Y形成的原子个数比为1∶1和2∶1的化合物中化学键类型相同
D.X的最高价氧化物对应水化物的酸性比W的弱
不定项选择题:本题包括5小题,每小题4分,
( http: / / www.21cnjy.com )共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
氧化性:HClO>HClO4
HClO4分子中非羟基氧原子数目较多
B
沸点:SiO2>CO2
相对分子质量越大沸点越高
C
密度:干冰>冰
干冰晶体属于分子密堆积
D
分解温度:MgO>NaCl
MgO晶格能大于NaCl
12.根据下列结构示意图,判断下列说法中正确的是
A.在CsCl晶体中,距Cs+最近的Cl 有6个
B.在CaF2晶体中,Ca2+周围距离最近的F 有4个
C.在SiO2晶体中,每个晶胞中含有4个Si原子和8个O原子
D.在铜晶体中,每个铜原子周围距离最近的铜原子有12个
13.化合物G(结构如下图)是合成抗癌药氨柔比星的中间体。下列说法正确的是
A.该有机物的分子式为C12H14NO4
B.该有机物既可与盐酸反应,又可与NaOH溶液反应
C.该有机物中含有2个手性碳原子
D.1mol该有机物最多只能与1molBr2发生取代反应
14.下列实验操作、实验现象以及实验结论完全正确的是
选项
实验操作
实验现象
实验结论
A
植物油中加入含有酚酞的NaOH溶液,微热
红色变浅,且不再分层
油脂发生了水解反应
B
柠檬醛()中加入酸性高锰酸钾溶液
溶液褪色
柠檬醛分子中含有醛基
C
溴乙烷与NaOH溶液共热后,加入AgNO3溶液
出现淡黄色沉淀
溴乙烷发生了水解
D
向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸
没有砖红色沉淀
淀粉未水解
15.X、Y都是芳香族化合物,1molX水
( http: / / www.21cnjy.com )解得到1molY和2mol醋酸。Y相对分子质量介于100~150之间,且碳和氢两种元素的总质量分数为65.2%。X溶液能发生银镜反应,向Y水溶液中滴加NaHCO3无气泡,滴加FeCl3溶液显紫色。下列说法正确的是
A.X分子中含有酯基和醛基
B.X和Y相对分子质量之差为120
C.X分子中有6个O原子,且水溶液显酸性
D.Y分子可能结构有6种
第II卷
(非选择题
共80分)
16.(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
回答下列问题(答题时请用相应的元素符号或化学式):
(1)元素⑧在周期表中的位置是第
周期第
族。
(2)元素②、⑤、⑥的电负性由大到小的顺序为
。
(3)元素③与元素⑦最高价氧化物对应水化物的碱性:
﹥
。
(4)元素①与元素④的氢氧化物有相似的性质。请写出元素①的氢氧化物与NaOH溶液反应的离子方程式:
。
(5)元素②、⑥、⑩的气态氢化物的沸点由高到低的顺序为
。
(6)往元素⑨的硫酸盐溶液
( http: / / www.21cnjy.com )中加入过量NaOH
溶液可生成[Cu
(OH)4
]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
。
17.(14分)根据要求完成填空。
(1)属于烃,且含碳质量分数最高的是
(填序号)。
(2)互为同分异构体的是
,互为同系物的是
(填序号)。
(3)③中碳原子的杂化方式为
,1mol⑧中含有σ键的物质的量为
mol。
(4)⑤中位于同一平面上碳原子最多为
个。
(5)1mol⑦水解最多消耗NaOH物质的量为
mol。
18.(12分)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
回答下列问题:
(1)A物质的系统名称为
。
(2)F
的结构简式为
。
(3)在一定条件下,两分子E能脱去两分
( http: / / www.21cnjy.com )子水形成一种六元环状化合物,该化合物的结构简式为
。
(4)①B→C化学方程式为:
。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式:
。
(5)X为E(C3H6O3)的一种
( http: / / www.21cnjy.com )同分异构体,1molX与足量金属钠反应产生1mol氢气,1molX与足量银氨溶液反应能生成2molAg,则X的结构简式为
。
(6)用G代替F制成一次性塑料餐盒的优点是
。
19.(15分)正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
反应物和生成物的相关数据如下:
相对分子质量
沸点/℃
密度/g·cm3
水中溶解性
正丁醇
74
117.2
0.8109
微溶
正丁醚
130
142.0
0.7704
几乎不溶
合成反应:
①将6
mL浓硫酸和37
g正丁醇,按一定顺序添加到A中,
并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70
mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40ml水,20mlNaOH溶液和40ml水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
回答下列问题:
(1)步骤①中浓硫酸和正丁醇的添加顺序为
。
(2)加热A前,需先从
(填“a”或“b”)口向B中通入水。
(3)反应过程中会观察到分水器中收
( http: / / www.21cnjy.com )集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为
,采用分水器除了可以提高正丁醇的利用率,还可以起到
作用(根据有关化学理论回答)。
(4)步骤③的目的是初步洗去
,振摇后静置,粗产物应在分液漏斗的
(填“上”或“下”)口分离出。
(5)若温度过高会发生副反应生成烯烃,可能的反应方程式为
。
(6)步骤⑤中,加热蒸馏时应收集
℃左右的馏分。本实验中,正丁醚的产率为
。
20.(15分)高原儿茶酸可用于治疗中枢神经性疾病,可通过以下方法合成。
(1)高原儿茶酸中含氧官能团的名称为
和
。
(2)合成路线中设计反应①和⑦的目的是
。
(3)反应①的反应类型为
,反应③的反应类型为
。
(4)G的一种同分异构体满足下列条件:
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式
。
(5)根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任选)。合成路线示例如下:
21.(12分)已知尿素(结构简式:)可用于制有机铁肥三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。回答下列问题。
(1)基态Fe3+的核外电子排布式为
;
(2)C、N、O三种元素的第一电离能由大到小的顺序是
。
NH3分子的形状是
。尿素易溶于水,主要原因是
。
(3)和NO3 互为等电子体的一种阴离子是
。
(4)如图所示为铁的某种氧化物晶胞示意图,该氧化物的化学式为
。
高二化学答题纸
16.(12分)
(1)__________
__________
(2)__________________(3)__________>__________
(4)____________________________________________(5)___________________________
(6)_______________________________17.(14分)(1)________
(2)__________
___________
(3)_________
_________(4)________
(5)__________18.(12分)(1)__________________________
(2)_______________________________(3)__________________________________________(4)①______________________________________________________________②__________________________________________________________________
(5)_________________(6)_____________________________________________________________________
请在各题目的答题区内作答,超出黑色矩形框限定区域的答案无效
19.(15分)(1)__________________________________________________
(2)_________(3)___________
__________________________________________________(4)___________
________(5)________________________________________________________________(6)_____________
_____________20.(15分)(1)___________
___________
(2)________________________(3)________________
________________(4)
________________________(5)21.(12分)(1)_____________(2)_____________
____________
________________________________________(3)_________
(4)______________________________________________________
请在各题目的答题区内作答,超出黑色矩形框限定区域的答案无效
高二化学春阶段四参考答案和评分标准
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意
1、C
2、B
3、D
4、B
5、A
6、B
7、C
8、D
9、A
10、C
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11、CD
12、D
13、BC
14、A
15、AD
16.(12分)
(1)四
Ⅷ
(每空1分,共2分)
(2)F>Cl>S(2分)
(3)KOH
NaOH(2分)
(4)Be(OH)2+2OH-BeO22-+2H2O
(2分)
(5)HF>HBr>HCl(2分)
(6)
( http: / / www.21cnjy.com )(2分)
17.(14分)(每空2分)
⑴
⑤
(2)④⑥
②④
(3)sp2
18
(4)13
(5)3
18.(12分)
(1)1,2-二溴丙烷(1分)
(2)(1分)
(3)(2分)
(4)①(2分)
②(2分)
(5)
(2分)
(6)聚乳酸制成的塑料在自然环境中可以降解为小分子,对环境无害。(2分)
19.(15分)
(1)先加入正丁醇,再加入浓硫酸。(2分)
(2)b(1分)
(3)正丁醇(2分)不断分离出水,促使平衡正向移动(2分)
(4)浓硫酸
;上
(每空1分,共2分)
(5)(2分)
(6)142(2分)
40.0%(2分)
20.(15分)
(1)羟基(1分)、羧基(1分)
(2)保护酚羟基(2分)
(3)取代反应(2分)、还原反应(2分)
(4)或(2分)
(5)(5分)
21.(12分)(每空2分)
(1)[Ar]3d5
(2)N>O>C
三角锥形
尿素分子和水分子之间能形成氢键
(3)CO32
(4)FeO
其它合理答案参照给分
1s
2s
2p
↑↓
↑↓
↑
↑
↑
饱和碳酸钠
溶液
A.从煤焦油中提取苯
B.实验室制乙酸乙酯
乙醇
浓H2SO4
浓硫酸
C.实验室制乙烯
D.实验室制取、收集乙炔气体
CsCl晶体
CaF2晶体
SiO2晶体
铜晶体
化合物G
班
级_________
姓
名_________
考试号_________
装
订
线
座号
同课章节目录
