【高考押题卷】2025年高考化学高频易错考前冲刺 化学用语(含解析)
文档属性
| 名称 | 【高考押题卷】2025年高考化学高频易错考前冲刺 化学用语(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-28 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
高考化学考前冲刺押题预测 化学用语
一.选择题(共20小题)
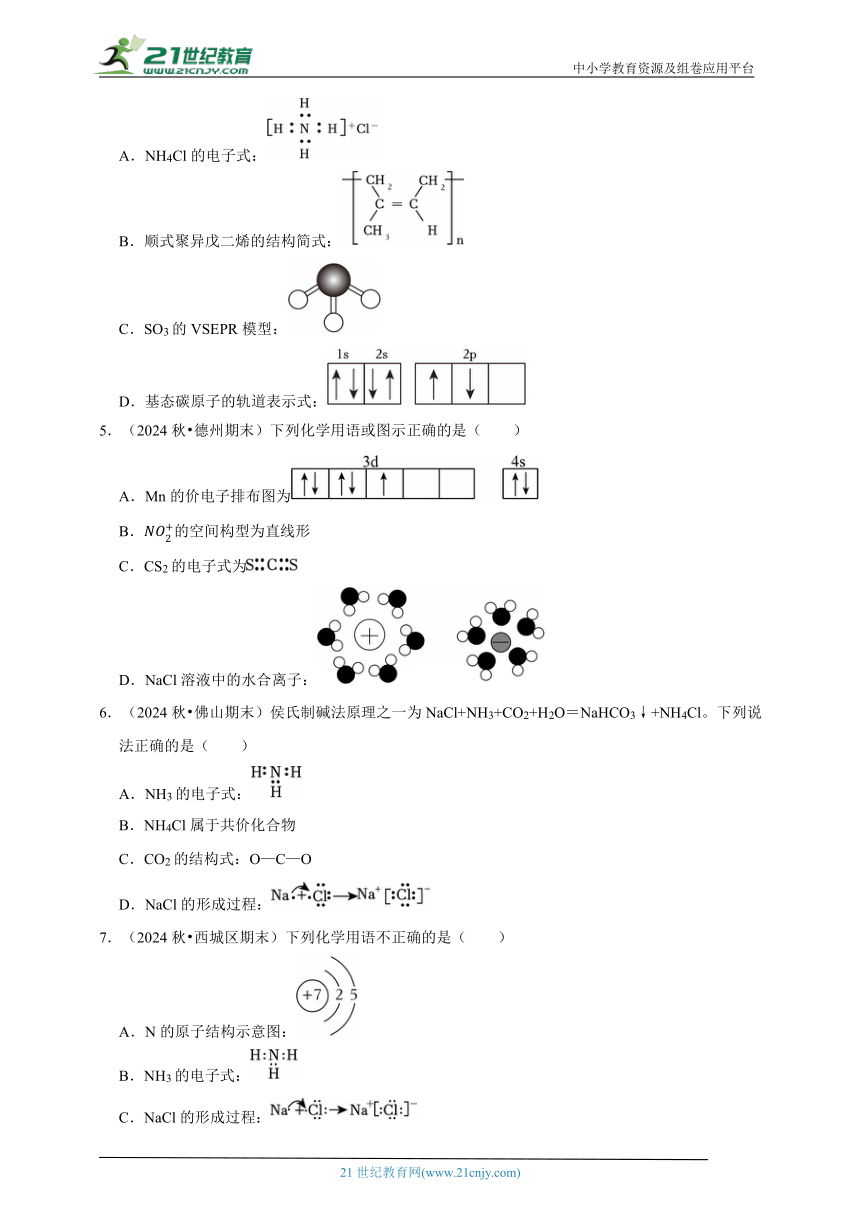
1.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.不能表示四氯化碳分子
B.SiO2的电子式:
C.石墨的平行六面体晶胞:
D.2﹣甲基﹣1﹣丁醇的键线式:
2.(2025 陕西一模)化学用语的选择和书写是化学学习的基础,下列化学用语正确的是( )
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
3.(2025 四川模拟)下列化学用语正确的是( )
A.H元素的三种核素:1H2、2H2、3H2
B.一氟乙烷的空间填充模型:
C.聚丙烯的结构简式:
D.HClO的电离方程式:HClO H++ClO﹣
4.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.NH4Cl的电子式:
B.顺式聚异戊二烯的结构简式:
C.SO3的VSEPR模型:
D.基态碳原子的轨道表示式:
5.(2024秋 德州期末)下列化学用语或图示正确的是( )
A.Mn的价电子排布图为
B.的空间构型为直线形
C.CS2的电子式为
D.NaCl溶液中的水合离子:
6.(2024秋 佛山期末)侯氏制碱法原理之一为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。下列说法正确的是( )
A.NH3的电子式:
B.NH4Cl属于共价化合物
C.CO2的结构式:O—C—O
D.NaCl的形成过程:
7.(2024秋 西城区期末)下列化学用语不正确的是( )
A.N的原子结构示意图:
B.NH3的电子式:
C.NaCl的形成过程:
D.Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3
8.(2024秋 连云港期末)反应2Na2O2+2CO2═2Na2CO3+O2可作呼吸面具的供氧剂。下列说法正确的是( )
A.Na+的结构示意图为
B.CO2空间填充模型为
C.Na2CO3仅含离子键
D.中子数为10的氧原子可表示为
9.(2024秋 石景山区期末)下列化学用语或图示表达正确的是( )
A.CO2的电子式:
B.基态N原子的价层电子轨道表示式:
C.HClO的结构式:H—Cl—O
D.反﹣2﹣丁烯的分子结构模型:
10.(2024秋 济南期末)下列化学用语或图示正确的是( )
A.的系统命名:5﹣氟甲苯
B.苯的结构简式:C6H4
C.HCl的形成过程:
D.基态碳原子的价电子轨道表示式:
11.(2024秋 沙坪坝区校级期末)下列化学用语表示正确的是( )
A.Co3+的结构示意图
B.px轨道的电子云轮廓图
C.基态Cu原子的核外电子排布式为Ar]3d94s2
D.氟化镁的电子式
12.(2025 湖南开学)下列化学用语或图示表述错误的是( )
A.2—甲基—2—戊烯的键线式:
B.p﹣pπ键电子云轮廓图:
C.基态Fe2+的价层电子排布图:
D.用电子式表示NaCl的形成过程:
13.(2024秋 岳阳期末)化学用语是化学的“语言”,下列化学用语描述错误的是( )
A.次氯酸的电子式是
B.质量数为44、中子数为24的钙原子:Ca
C.CH4的分子结构模型是:
D.用电子式表示NaCl的形成过程:
14.(2024秋 重庆期末)下列化学用语的表达不正确的是( )
A.NaCl的形成过程 B.H2O的分子结构模型:
C.CO2的结构式:O—C—O D.1H、2H、3H互为同位素
15.(2024秋 黑龙江期末)下列化学用语表示不正确的是( )
A.中子数为16的磷原子:P
B.KNO3的摩尔质量:101g
C.S2﹣的结构示意图:
D.NaCl的电子式:
16.(2024秋 大连期末)下列化学用语或图示表达正确的是( )
A.中子数为10的氧原子:
B.NaHCO3的电离方程式:
C.图中1.008表示氢元素的相对原子质量
D.NaCl溶液中的水合离子:
17.(2024秋 海南期末)用化学用语表示反应2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:
B.H2中H元素的化合价:+1
C.Na+的结构示意图:
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
18.(2024秋 朝阳区期末)下列化学用语或图示表达不正确的是( )
A.HCl的电子式为
B.丙烯的分子结构模型为
C.2,3﹣二甲基己烷的结构简式为
D.氧的基态原子的轨道表示式为4ばば
19.(2024秋 山西期末)我国科学家在实验室成功制取了光学唱体——转角菱方氮化硼(BN)。下列说法错误的是( )
A.N原子的结构示意图为
B.BN的摩尔质量为25g mol﹣1
C.和的中子数之和为12
D.原子半径:B>N
20.(2024秋 大兴区期末)下列化学用语表示不正确的是( )
A.Mg2+的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
化学用语
参考答案与试题解析
一.选择题(共20小题)
1.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.不能表示四氯化碳分子
B.SiO2的电子式:
C.石墨的平行六面体晶胞:
D.2﹣甲基﹣1﹣丁醇的键线式:
【答案】A
【分析】A.氯原子半径大于C原子;
B.二氧化硅为共价晶体,每个硅原子和四个氧原子形成4个共价键;
C.石墨的平行六面体晶胞是其中一个平行六面体形成;
D.选取含羟基碳在内的最长碳链,羟基在主碳链的2号碳上,据此命名。
【解答】解:A.氯原子半径大于碳原子半径,四氯化碳的比例模型为,不能表示四氯化碳分子,故A正确;
B.二氧化硅为共价晶体,不能书写其电子式,故B错误;
C.不是1个晶胞结构,故C错误;
D.主链含有4个C原子,2号位上有个羟基,正确命名为2﹣丁醇,故D错误;
故选:A。
【点评】本题考查了化学用语的分析判断,注意知识的熟练掌握,题目难度不大。
2.(2025 陕西一模)化学用语的选择和书写是化学学习的基础,下列化学用语正确的是( )
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
【答案】C
【分析】A.C是6号元素;
B.NH3分子中中心原子N周围的价层电子对数为:34;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对;
D.质子数相同而中子数不同的原子互为同位素。
【解答】解:A.已知C是6号元素,基态C原子核外价电子的轨道表达式:,故A错误;
B.NH3分子中中心原子N周围的价层电子对数为:34,其VSEPR模型为:,故B错误;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对,故HClO的电子式为:,故C正确;
D.质子数相同而中子数不同的原子互为同位素;和是质子数相同而中子数不同的原子,故互为同位素,故D错误;
故选:C。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
3.(2025 四川模拟)下列化学用语正确的是( )
A.H元素的三种核素:1H2、2H2、3H2
B.一氟乙烷的空间填充模型:
C.聚丙烯的结构简式:
D.HClO的电离方程式:HClO H++ClO﹣
【答案】D
【分析】A.把具有一定数目质子和一定数目中子的一种原子叫作核素;
B.一氟乙烷的空间填充模型中氟原子的半径小于碳原子;
C.聚丙烯的结构简式为;
D.HClO为弱酸,部分电离生成氢离子和次氯酸根离子。
【解答】解:A.把具有一定数目质子和一定数目中子的一种原子叫作核素,H元素的三种核素:1H、2H、3H,故A错误;
B.一氟乙烷的空间填充模型中氟原子的半径小于碳原子,故B错误;
C.聚丙烯的结构简式为,故C错误;
D.HClO为弱酸,部分电离生成氢离子和次氯酸根离子,电离方程式:HClO H++ClO﹣,故D正确;
故选:D。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
4.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.NH4Cl的电子式:
B.顺式聚异戊二烯的结构简式:
C.SO3的VSEPR模型:
D.基态碳原子的轨道表示式:
【答案】B
【分析】A.没有标出Cl﹣的最外层电子数;
B.聚异戊二烯有顺式和反式两种异构体,两个相同原子或基团在双键同一侧的为顺式异构体,反之为反式异构体;
C.SO3的VSEPR模型为平面三角形;
D.该轨道表示式违背了洪特规则。
【解答】解:A.NH4Cl是离子化合物,其电子式,故A错误;
B.两个相同原子或基团在双键同一侧的为顺式异构体,反之为反式异构体,则顺式聚异戊二烯的结构简式为,故B正确;
C.SO3分子中S原子的价层电子对数为3(6﹣2×3)=3,无孤电子对,VSEPR模型为平面三角形,即,故C错误;
D.基态碳原子的电子排布式为1s22s22p2,其轨道表示式为,故D错误;
故选:B。
【点评】本题考查常见化学用语的正误判断,涉及轨道表示式、电子式、VSEPR模型、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的辨析能力及规范答题能力,题目难度中等。
5.(2024秋 德州期末)下列化学用语或图示正确的是( )
A.Mn的价电子排布图为
B.的空间构型为直线形
C.CS2的电子式为
D.NaCl溶液中的水合离子:
【答案】B
【分析】A.根据Mn的价电子排布图违背洪特规则,进行分析;
B.根据中N原子的价层电子对数为,无孤对电子,进行分析;
C.根据CS2的电子式进行分析;
D.根据钠离子带正电,水分子中的氧原子应该靠近,氯离子带负电,水分子中的氢原子应该靠近,进行分析。
【解答】解:A.Mn的价电子排布图违背洪特规则,Mn的价电子排布图为,故A错误;
B.中N原子的价层电子对数为,无孤对电子,所以空间构型为直线形,故B正确;
C.CS2的电子式为,故C错误;
D.Na+带正电,水分子中的O原子应该靠近,Cl﹣带负电,水分子中的氢原子应该靠近,且Cl﹣半径大于Na+半径,故D错误;
故选:B。
【点评】本题主要考查化学式或化学符号及名称的综合等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
6.(2024秋 佛山期末)侯氏制碱法原理之一为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。下列说法正确的是( )
A.NH3的电子式:
B.NH4Cl属于共价化合物
C.CO2的结构式:O—C—O
D.NaCl的形成过程:
【答案】D
【分析】A.NH3分子中N原子还含有1对孤电子对;
B.NH4Cl由和Cl﹣构成;
C.CO2分子中含有C=O键,无C—O键;
D.NaCl是离子化合物,又Na+和Cl﹣构成。
【解答】解:A.NH3分子中N、H原子共用1对电子对,N原子最外层电子数为8,其电子式为,故A错误;
B.NH4Cl由和Cl﹣构成,属于离子化合物,不属于共价化合物,故B错误;
C.CO2分子中含有C=O键,中心原子是C,其结构式为O=C=O,故C错误;
D.NaCl形成过程中Na失电子生成Na+、Cl得电子生成Cl﹣,Na+和Cl﹣构成NaCl晶体,其形成过程为,故D正确;
故选:D。
【点评】本题考查常见化学用语的正误判断,涉及电子式、结构式、化合物类型判断等知识,掌握常见化学用语的概念及表示方法即可解答,题目难度不大。
7.(2024秋 西城区期末)下列化学用语不正确的是( )
A.N的原子结构示意图:
B.NH3的电子式:
C.NaCl的形成过程:
D.Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3
【答案】B
【分析】A.N原子核内有7个质子、核外有7个电子;
B.漏写N原子上的孤电子对;
C.Na原子失去1个电子、Cl原子得到1个电子形成离子化合物NaCl;
D.Al2(SO4)3是强电解质,在水溶液中完全电离生成Al3+、。
【解答】解:A.N原子核内有7个质子、核外有7个电子,原子结构示意图为,故A正确;
B.漏写N原子上的孤电子对,NH3的电子式为,故B错误;
C.Na原子失去1个电子、Cl原子得到1个电子形成离子化合物NaCl,NaCl的形成过程:,故C正确;
D.Al2(SO4)3是强电解质,在水溶液中完全电离生成Al3+、,Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查基础知识的掌握和灵活运用能力,明确原子结构示意图、电子式、化合物的形成过程的表示方法是解本题关键,题目难度不大。
8.(2024秋 连云港期末)反应2Na2O2+2CO2═2Na2CO3+O2可作呼吸面具的供氧剂。下列说法正确的是( )
A.Na+的结构示意图为
B.CO2空间填充模型为
C.Na2CO3仅含离子键
D.中子数为10的氧原子可表示为
【答案】D
【分析】A.Na+的电子数为10,最外层电子数为8;
B.CO2分子中C原子半径大于O;
C.中还含有碳氧键;
D.元素符号左下角为质子数,左上角为质量数;质量数=质子数+中子数。
【解答】解:A.Na+的结构示意图为,是Na原子的结构示意图,故A错误;
B.CO2是直线形分子,且C原子半径大于O,其空间填充模型为,故B错误;
C.Na2CO3是离子化合物,中含有碳氧极性键,即Na2CO3中含离子键和共价键,故C错误;
D.质量数=质子数+中子数,中子数为10的氧原子的质量数为8+10=18,该核素为O,故D正确;
故选:D。
【点评】本题考查常见化学用语正误判断,侧重辨析能力和规范答题能力考查,把握常见化学用语概念及表示方法即可解答,题目难度不大。
9.(2024秋 石景山区期末)下列化学用语或图示表达正确的是( )
A.CO2的电子式:
B.基态N原子的价层电子轨道表示式:
C.HClO的结构式:H—Cl—O
D.反﹣2﹣丁烯的分子结构模型:
【答案】B
【分析】A.二氧化碳中碳原子与氧原子分别共用2对电子;
B.基态氮原子价电子排布式为2s22p3;
C.次氯酸中心原子为氧原子;
D.为顺﹣2﹣2丁烯。
【解答】解:A.二氧化碳电子式各原子满足最外层八电子结构,二氧化碳的电子式为:,故A错误;
B.基态氮原子价电子排布式为2s22p3,依据核外电子排布规律可知,基态N原子的价层电子轨道表示式:,故正确;
C.HClO的结构式:H—O—Cl,故C错误;
D.为顺﹣2﹣2丁烯,故D错误;
故选:B。
【点评】本题主要考查化学式或化学符号及名称的综合等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
10.(2024秋 济南期末)下列化学用语或图示正确的是( )
A.的系统命名:5﹣氟甲苯
B.苯的结构简式:C6H4
C.HCl的形成过程:
D.基态碳原子的价电子轨道表示式:
【答案】D
【分析】A.根据氟原子在2号碳上进行分析;
B.根据结构简式是结构式的简单表达式,进行分析;
C.根据氯化氢为共价化合物,存在共用电子对,进行分析;
D.根据泡利原理和洪特规则进行分析。
【解答】解:A. 的系统命名:2﹣氟甲苯,故A错误;
B.结构简式是结构式的简单表达式,苯的结构简式:,故B错误;
C.氯化氢为共价化合物,存在共用电子对,HCl的形成过程:,故C错误;
D.根据泡利原理和洪特规则,基态碳原子的价电子轨道表示式为:,故D正确;
故选:D。
【点评】本题主要考查用电子式表示简单的离子化合物和共价化合物的形成等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
11.(2024秋 沙坪坝区校级期末)下列化学用语表示正确的是( )
A.Co3+的结构示意图
B.px轨道的电子云轮廓图
C.基态Cu原子的核外电子排布式为Ar]3d94s2
D.氟化镁的电子式
【答案】A
【分析】A.基态钴电子排布式为:1s22s22p63s23p63d74s2;
B.p轨道电子云轮廓图为哑铃形;
C.违背鸿特规则特例;
D.氟离子不能合写。
【解答】解:A.基态钴电子排布式为:1s22s22p63s23p63d74s2,失去4s上2个电子和3d上1个电子得到三价钴离子,则Co3+的结构示意图,故A正确;
B.s轨道呈球形,p轨道的电子云轮廓图为哑铃形,故B错误;
C.基态Cu原子的核外电子排布式为Ar]3d104s1故C错误;
D.氟化镁属于离子化合物,化学式中含有1个镁离子和2个氟离子,其正确的电子式为,故D错误;
故选:A。
【点评】本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、电子排布式、离子结构示意等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的分析能力及规范答题能力。
12.(2025 湖南开学)下列化学用语或图示表述错误的是( )
A.2—甲基—2—戊烯的键线式:
B.p﹣pπ键电子云轮廓图:
C.基态Fe2+的价层电子排布图:
D.用电子式表示NaCl的形成过程:
【答案】C
【分析】A.2—甲基—2—戊烯,主链有5个碳原子的烯烃,从左端开始编号,2号碳上有1个甲基,有1个碳碳双键;
B.p﹣p轨道以肩并肩形式形成p﹣pπ键;
C.基态亚铁离子是基态铁原子失去4s上2个电子得到;
D.氯化钠为离子化合物,钠离子与氯离子通过离子键结合。
【解答】解:A.2—甲基—2—戊烯,主链有5个碳原子的烯烃,从左端开始编号,2号碳上有1个甲基,有1个碳碳双键,键线式为:,故A正确;
B.p﹣p轨道以肩并肩形式形成p﹣pπ键,p﹣pπ键电子云轮廓图:,故B正确;
C.基态Fe2+在基态Fe原子的基础上失去了4s轨道的两个电子,价层电子排布图为,故C错误;
D.氯化钠为离子化合物,钠离子与氯离子通过离子键结合,用电子式表示NaCl的形成过程:,故D正确;
故选:C。
【点评】本题考查化学用语,侧重考查基础知识的掌握和灵活运用能力,明确原子构造理论,把握基态原子电子排布规律是解本题关键,题目难度不大。
13.(2024秋 岳阳期末)化学用语是化学的“语言”,下列化学用语描述错误的是( )
A.次氯酸的电子式是
B.质量数为44、中子数为24的钙原子:Ca
C.CH4的分子结构模型是:
D.用电子式表示NaCl的形成过程:
【答案】B
【分析】A.次氯酸中氧、氯均达到8电子结构、氢达到2电子结构;
B.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;质量数=质子数+中子数;
C.甲烷分子式为CH4;
D.NaCl的形成是1个钠原子失去1个电子形成钠离子,而1个氯原子得到1个电子形成氯离子,二者都达到8电子的稳定体系,形成了离子化合物。
【解答】解:A.次氯酸中氧、氯均达到8电子结构、氢达到2电子结构,故电子式为:,故A正确;
B.质量数=质子数+中子数,核素的表示方法为:元素符号左下角为质子数,左上角为质量数;则质量数为44、中子数为24的钙原子,其质子数为44﹣24=20,可表示为:,故B错误;
C.甲烷分子式为CH4,碳原子和氢原子形成空间正四面体结构,故C正确;
D.NaCl的形成是1个钠原子失去1个电子形成钠离子,而1个氯原子得到1个电子形成氯离子,二者都达到8电子的稳定体系,形成了离子化合物,用电子式表示其形成过程为:,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
14.(2024秋 重庆期末)下列化学用语的表达不正确的是( )
A.NaCl的形成过程 B.H2O的分子结构模型:
C.CO2的结构式:O—C—O D.1H、2H、3H互为同位素
【答案】C
【分析】A.氯化钠为离子化合物,NaCl在形成时,钠原子失去电子,氯原子得到电子;
B.H2O分子为V形,氧原子半径大于氢原子;
C.二氧化碳分子中碳原子和两个氧原子分别形成碳氧双键;
D.质子数相同中子数不同的同种元素不同原子互为同位素。
【解答】解:A.NaCl为离子化合物,钠原子失去电子,氯原子得到电子,电子从钠原子转移到氯原子,用电子式表示NaCl的形成过程为,故A正确;
B.H2O的分子结构模型:,故B正确;
C.CO2的结构式O=C=O,故C错误;
D.1H、2H、3H是潜意识的三种核素,互为同位素,故D正确;
故选:C。
【点评】本题考查了化学用语的分析判断,注意电子式、分子模型、结构式等知识点的熟练掌握,题目难度不大。
15.(2024秋 黑龙江期末)下列化学用语表示不正确的是( )
A.中子数为16的磷原子:P
B.KNO3的摩尔质量:101g
C.S2﹣的结构示意图:
D.NaCl的电子式:
【答案】B
【分析】A.元素符号左下角的数字表示质子数、左上角的数字表示质量数,中子数为16的磷原子的质量数=15+16=31;
B.摩尔质量的单位是g/mol,KNO3的摩尔质量在数值上等于其相对分子质量;
C.硫离子核内有16个质子、核外有18个电子;
D.氯化钠是由钠离子和氯离子构成的离子化合物。
【解答】解:A.元素符号左下角的数字表示质子数、左上角的数字表示质量数,中子数为16的磷原子的质量数=15+16=31,中子数为16的磷原子:P,故A正确;
B.摩尔质量的单位是g/mol,KNO3的摩尔质量在数值上等于其相对分子质量,其摩尔质量是101g/mol,故B错误;
C.硫离子核内有16个质子、核外有18个电子,S2﹣的结构示意图为,故C正确;
D.氯化钠是由钠离子和氯离子构成的离子化合物,电子式为,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查基础知识的正误和灵活运用能力,明确摩尔质量的单位、离子结构示意图的书写规则、电子式的书写规则是解本题关键,题目难度不大。
16.(2024秋 大连期末)下列化学用语或图示表达正确的是( )
A.中子数为10的氧原子:
B.NaHCO3的电离方程式:
C.图中1.008表示氢元素的相对原子质量
D.NaCl溶液中的水合离子:
【答案】C
【分析】A.质量数=质子数+中子数,质量数标注于元素符号左上角,质子数标注于左下角;
B.NaHCO3电离过程中不拆分;
C.图中1.008表示氢元素的相对原子质量;
D.氯化钠溶液中钠离子带正电荷,吸引H2O中显负化合价的氧原子,氯离子带负电荷,吸引H2O中显正化合价的氢原子。
【解答】解:A.中子数为10的氧原子的质量数为8+10=18,符号为O,故A错误;
B.NaHCO3电离生成Na+和,电离方程式为NaHCO3=Na+,故B错误;
C.图中1.008表示氢元素的相对原子质量,故C正确;
D.氯化钠溶液中,钠离子带正电荷,吸引H2O中显负化合价的氧原子,氯离子带负电荷,吸引H2O中显正化合价的氢原子,且Na+结合5个水分子、Cl﹣结合6个水分子,即NaCl溶液中的水合离子:、,故D错误;
故选:C。
【点评】本题考查常见化学用语的正误判断,涉及核素、水合离子示意图、核素、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力,题目难度不大。
17.(2024秋 海南期末)用化学用语表示反应2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:
B.H2中H元素的化合价:+1
C.Na+的结构示意图:
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
【答案】C
【分析】A.H2O是由H和O构成的共价化合物;
B.H2中H元素的化合价为0;
C.Na+核内有11个质子,核外有2个电子层,第一层上有2个电子、第二层上有8个电子;
D.NaOH的电离方程式:NaOH═Na++OH﹣。
【解答】解:A.H2O是由H和O构成的共价化合物,只含有共价键,其电子式为,故A错误;
B.H2中H元素的化合价为0,故B错误;
C.Na+核内有11个质子,核外有2个电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图为,故C正确;
D.NaOH的电离方程式:NaOH═Na++OH﹣,故D错误;
故选:C。
【点评】本题考查化学用语,侧重考查分析、判断及知识综合运用能力,明确分子式、结构式的书写规则及同位素的概念是解本题关键,题目难度不大。
18.(2024秋 朝阳区期末)下列化学用语或图示表达不正确的是( )
A.HCl的电子式为
B.丙烯的分子结构模型为
C.2,3﹣二甲基己烷的结构简式为
D.氧的基态原子的轨道表示式为4ばば
【答案】A
【分析】A.氯化氢为共价化合物;
B.丙烯的结构简式为:CH2=CH—CH3,据此判断;
C.2,3﹣二甲基己烷,主链有6个碳原子的烷烃,2,3号碳上各有1个甲基;
D.基态氧原子电子排布式为:1s22s22p4。
【解答】解:A.氯化氢为共价化合物,电子式为:,故A错误;
B.丙烯的结构简式为:CH2=CH—CH3,丙烯的分子结构模型为,故B正确;
C.2,3﹣二甲基己烷,主链有6个碳原子的烷烃,2,3号碳上各有1个甲基,结构简式为:,故C正确;
D.基态氧原子电子排布式为:1s22s22p4,依据基态原子核外电子排布规律可知,其轨道表示式为:,故D正确;
故选:A。
【点评】本题考查了化学用语的使用,明确电子式、有机物结构简式、基态原子核外电子排布规律是解题关键,题目难度中等。
19.(2024秋 山西期末)我国科学家在实验室成功制取了光学唱体——转角菱方氮化硼(BN)。下列说法错误的是( )
A.N原子的结构示意图为
B.BN的摩尔质量为25g mol﹣1
C.和的中子数之和为12
D.原子半径:B>N
【答案】C
【分析】A.根据N是7号元素,核外含有7个电子,进行分析;
B.根据摩尔质量在以g/mol为单位时在数值上等于相对分子质量或相对原子质量,进行分析;
C.根据质量数=质子数+中子数,质量数标注于元素符号左上角、质子数标注于元素符号左下角进行分析;
D.根据同周期主族元素,从左往右原子半径依次减小,进行分析。
【解答】解:A.N是7号元素,核外含有7个电子,结构示意图为,故A正确;
B.摩尔质量在以g/mol为单位时在数值上等于相对分子质量或相对原子质量,BN的摩尔质量为(14+11)g mol﹣1=25g mol﹣1,故B正确;
C.质量数=质子数+中子数,质量数标注于元素符号左上角、质子数标注于元素符号左下角,含有11﹣5=6个中子,含有14﹣7=7个中子,和的中子数之和为13,故C错误;
D.同周期主族元素,从左往右原子半径依次减小,则原子半径:B>N,故D正确;
故选:C。
【点评】本题主要考查原子结构示意图、离子结构示意图等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
20.(2024秋 大兴区期末)下列化学用语表示不正确的是( )
A.Mg2+的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
【答案】B
【分析】A.镁离子的核内有12个质子,核外有10个电子;
B.水是共价化合物;
C.当轨道半充满、全充满时更稳定;
D.基态氧原子的电子排布式为1s22s22p6;
【解答】解:A.镁离子的核内有12个质子,核外有10个电子,故其结构示意图为,故A正确;
C.水是共价化合物,H与O原子之间是共价键,故其电子式为,故B错误;
D.基态铬原子(24Cr)的电子式排布式为1s22s22p63s23p63d54s1,其价层电子排布式:3d54s1,故C正确;
D.基态氧原子的电子排布式为1s22s22p6,根据洪特规则,当电子在同一能级的不同轨道上排布时,电子总是优先占据一个轨道,且自旋平行,故其轨道表示式为,故D正确;
故选:B。
【点评】本题考查了轨道表示式、价电子排布式以及电子式和结构式的正误判断,应注意铬和铜的价电子排布式的特殊性。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
高考化学考前冲刺押题预测 化学用语
一.选择题(共20小题)
1.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.不能表示四氯化碳分子
B.SiO2的电子式:
C.石墨的平行六面体晶胞:
D.2﹣甲基﹣1﹣丁醇的键线式:
2.(2025 陕西一模)化学用语的选择和书写是化学学习的基础,下列化学用语正确的是( )
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
3.(2025 四川模拟)下列化学用语正确的是( )
A.H元素的三种核素:1H2、2H2、3H2
B.一氟乙烷的空间填充模型:
C.聚丙烯的结构简式:
D.HClO的电离方程式:HClO H++ClO﹣
4.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.NH4Cl的电子式:
B.顺式聚异戊二烯的结构简式:
C.SO3的VSEPR模型:
D.基态碳原子的轨道表示式:
5.(2024秋 德州期末)下列化学用语或图示正确的是( )
A.Mn的价电子排布图为
B.的空间构型为直线形
C.CS2的电子式为
D.NaCl溶液中的水合离子:
6.(2024秋 佛山期末)侯氏制碱法原理之一为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。下列说法正确的是( )
A.NH3的电子式:
B.NH4Cl属于共价化合物
C.CO2的结构式:O—C—O
D.NaCl的形成过程:
7.(2024秋 西城区期末)下列化学用语不正确的是( )
A.N的原子结构示意图:
B.NH3的电子式:
C.NaCl的形成过程:
D.Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3
8.(2024秋 连云港期末)反应2Na2O2+2CO2═2Na2CO3+O2可作呼吸面具的供氧剂。下列说法正确的是( )
A.Na+的结构示意图为
B.CO2空间填充模型为
C.Na2CO3仅含离子键
D.中子数为10的氧原子可表示为
9.(2024秋 石景山区期末)下列化学用语或图示表达正确的是( )
A.CO2的电子式:
B.基态N原子的价层电子轨道表示式:
C.HClO的结构式:H—Cl—O
D.反﹣2﹣丁烯的分子结构模型:
10.(2024秋 济南期末)下列化学用语或图示正确的是( )
A.的系统命名:5﹣氟甲苯
B.苯的结构简式:C6H4
C.HCl的形成过程:
D.基态碳原子的价电子轨道表示式:
11.(2024秋 沙坪坝区校级期末)下列化学用语表示正确的是( )
A.Co3+的结构示意图
B.px轨道的电子云轮廓图
C.基态Cu原子的核外电子排布式为Ar]3d94s2
D.氟化镁的电子式
12.(2025 湖南开学)下列化学用语或图示表述错误的是( )
A.2—甲基—2—戊烯的键线式:
B.p﹣pπ键电子云轮廓图:
C.基态Fe2+的价层电子排布图:
D.用电子式表示NaCl的形成过程:
13.(2024秋 岳阳期末)化学用语是化学的“语言”,下列化学用语描述错误的是( )
A.次氯酸的电子式是
B.质量数为44、中子数为24的钙原子:Ca
C.CH4的分子结构模型是:
D.用电子式表示NaCl的形成过程:
14.(2024秋 重庆期末)下列化学用语的表达不正确的是( )
A.NaCl的形成过程 B.H2O的分子结构模型:
C.CO2的结构式:O—C—O D.1H、2H、3H互为同位素
15.(2024秋 黑龙江期末)下列化学用语表示不正确的是( )
A.中子数为16的磷原子:P
B.KNO3的摩尔质量:101g
C.S2﹣的结构示意图:
D.NaCl的电子式:
16.(2024秋 大连期末)下列化学用语或图示表达正确的是( )
A.中子数为10的氧原子:
B.NaHCO3的电离方程式:
C.图中1.008表示氢元素的相对原子质量
D.NaCl溶液中的水合离子:
17.(2024秋 海南期末)用化学用语表示反应2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:
B.H2中H元素的化合价:+1
C.Na+的结构示意图:
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
18.(2024秋 朝阳区期末)下列化学用语或图示表达不正确的是( )
A.HCl的电子式为
B.丙烯的分子结构模型为
C.2,3﹣二甲基己烷的结构简式为
D.氧的基态原子的轨道表示式为4ばば
19.(2024秋 山西期末)我国科学家在实验室成功制取了光学唱体——转角菱方氮化硼(BN)。下列说法错误的是( )
A.N原子的结构示意图为
B.BN的摩尔质量为25g mol﹣1
C.和的中子数之和为12
D.原子半径:B>N
20.(2024秋 大兴区期末)下列化学用语表示不正确的是( )
A.Mg2+的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
化学用语
参考答案与试题解析
一.选择题(共20小题)
1.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.不能表示四氯化碳分子
B.SiO2的电子式:
C.石墨的平行六面体晶胞:
D.2﹣甲基﹣1﹣丁醇的键线式:
【答案】A
【分析】A.氯原子半径大于C原子;
B.二氧化硅为共价晶体,每个硅原子和四个氧原子形成4个共价键;
C.石墨的平行六面体晶胞是其中一个平行六面体形成;
D.选取含羟基碳在内的最长碳链,羟基在主碳链的2号碳上,据此命名。
【解答】解:A.氯原子半径大于碳原子半径,四氯化碳的比例模型为,不能表示四氯化碳分子,故A正确;
B.二氧化硅为共价晶体,不能书写其电子式,故B错误;
C.不是1个晶胞结构,故C错误;
D.主链含有4个C原子,2号位上有个羟基,正确命名为2﹣丁醇,故D错误;
故选:A。
【点评】本题考查了化学用语的分析判断,注意知识的熟练掌握,题目难度不大。
2.(2025 陕西一模)化学用语的选择和书写是化学学习的基础,下列化学用语正确的是( )
A.基态C原子核外价电子的轨道表达式:
B.NH3分子的VSEPR模型:
C.HClO的电子式:
D.和互为同素异形体
【答案】C
【分析】A.C是6号元素;
B.NH3分子中中心原子N周围的价层电子对数为:34;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对;
D.质子数相同而中子数不同的原子互为同位素。
【解答】解:A.已知C是6号元素,基态C原子核外价电子的轨道表达式:,故A错误;
B.NH3分子中中心原子N周围的价层电子对数为:34,其VSEPR模型为:,故B错误;
C.已知HClO是共价化合物,H、Cl周围能够形成1对共用电子对,O周围能够形成2对共用电子对,故HClO的电子式为:,故C正确;
D.质子数相同而中子数不同的原子互为同位素;和是质子数相同而中子数不同的原子,故互为同位素,故D错误;
故选:C。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
3.(2025 四川模拟)下列化学用语正确的是( )
A.H元素的三种核素:1H2、2H2、3H2
B.一氟乙烷的空间填充模型:
C.聚丙烯的结构简式:
D.HClO的电离方程式:HClO H++ClO﹣
【答案】D
【分析】A.把具有一定数目质子和一定数目中子的一种原子叫作核素;
B.一氟乙烷的空间填充模型中氟原子的半径小于碳原子;
C.聚丙烯的结构简式为;
D.HClO为弱酸,部分电离生成氢离子和次氯酸根离子。
【解答】解:A.把具有一定数目质子和一定数目中子的一种原子叫作核素,H元素的三种核素:1H、2H、3H,故A错误;
B.一氟乙烷的空间填充模型中氟原子的半径小于碳原子,故B错误;
C.聚丙烯的结构简式为,故C错误;
D.HClO为弱酸,部分电离生成氢离子和次氯酸根离子,电离方程式:HClO H++ClO﹣,故D正确;
故选:D。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
4.(2025 湖北模拟)下列化学用语或图示表达正确的是( )
A.NH4Cl的电子式:
B.顺式聚异戊二烯的结构简式:
C.SO3的VSEPR模型:
D.基态碳原子的轨道表示式:
【答案】B
【分析】A.没有标出Cl﹣的最外层电子数;
B.聚异戊二烯有顺式和反式两种异构体,两个相同原子或基团在双键同一侧的为顺式异构体,反之为反式异构体;
C.SO3的VSEPR模型为平面三角形;
D.该轨道表示式违背了洪特规则。
【解答】解:A.NH4Cl是离子化合物,其电子式,故A错误;
B.两个相同原子或基团在双键同一侧的为顺式异构体,反之为反式异构体,则顺式聚异戊二烯的结构简式为,故B正确;
C.SO3分子中S原子的价层电子对数为3(6﹣2×3)=3,无孤电子对,VSEPR模型为平面三角形,即,故C错误;
D.基态碳原子的电子排布式为1s22s22p2,其轨道表示式为,故D错误;
故选:B。
【点评】本题考查常见化学用语的正误判断,涉及轨道表示式、电子式、VSEPR模型、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的辨析能力及规范答题能力,题目难度中等。
5.(2024秋 德州期末)下列化学用语或图示正确的是( )
A.Mn的价电子排布图为
B.的空间构型为直线形
C.CS2的电子式为
D.NaCl溶液中的水合离子:
【答案】B
【分析】A.根据Mn的价电子排布图违背洪特规则,进行分析;
B.根据中N原子的价层电子对数为,无孤对电子,进行分析;
C.根据CS2的电子式进行分析;
D.根据钠离子带正电,水分子中的氧原子应该靠近,氯离子带负电,水分子中的氢原子应该靠近,进行分析。
【解答】解:A.Mn的价电子排布图违背洪特规则,Mn的价电子排布图为,故A错误;
B.中N原子的价层电子对数为,无孤对电子,所以空间构型为直线形,故B正确;
C.CS2的电子式为,故C错误;
D.Na+带正电,水分子中的O原子应该靠近,Cl﹣带负电,水分子中的氢原子应该靠近,且Cl﹣半径大于Na+半径,故D错误;
故选:B。
【点评】本题主要考查化学式或化学符号及名称的综合等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
6.(2024秋 佛山期末)侯氏制碱法原理之一为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。下列说法正确的是( )
A.NH3的电子式:
B.NH4Cl属于共价化合物
C.CO2的结构式:O—C—O
D.NaCl的形成过程:
【答案】D
【分析】A.NH3分子中N原子还含有1对孤电子对;
B.NH4Cl由和Cl﹣构成;
C.CO2分子中含有C=O键,无C—O键;
D.NaCl是离子化合物,又Na+和Cl﹣构成。
【解答】解:A.NH3分子中N、H原子共用1对电子对,N原子最外层电子数为8,其电子式为,故A错误;
B.NH4Cl由和Cl﹣构成,属于离子化合物,不属于共价化合物,故B错误;
C.CO2分子中含有C=O键,中心原子是C,其结构式为O=C=O,故C错误;
D.NaCl形成过程中Na失电子生成Na+、Cl得电子生成Cl﹣,Na+和Cl﹣构成NaCl晶体,其形成过程为,故D正确;
故选:D。
【点评】本题考查常见化学用语的正误判断,涉及电子式、结构式、化合物类型判断等知识,掌握常见化学用语的概念及表示方法即可解答,题目难度不大。
7.(2024秋 西城区期末)下列化学用语不正确的是( )
A.N的原子结构示意图:
B.NH3的电子式:
C.NaCl的形成过程:
D.Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3
【答案】B
【分析】A.N原子核内有7个质子、核外有7个电子;
B.漏写N原子上的孤电子对;
C.Na原子失去1个电子、Cl原子得到1个电子形成离子化合物NaCl;
D.Al2(SO4)3是强电解质,在水溶液中完全电离生成Al3+、。
【解答】解:A.N原子核内有7个质子、核外有7个电子,原子结构示意图为,故A正确;
B.漏写N原子上的孤电子对,NH3的电子式为,故B错误;
C.Na原子失去1个电子、Cl原子得到1个电子形成离子化合物NaCl,NaCl的形成过程:,故C正确;
D.Al2(SO4)3是强电解质,在水溶液中完全电离生成Al3+、,Al2(SO4)3的电离方程式:Al2(SO4)3=2Al3++3,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查基础知识的掌握和灵活运用能力,明确原子结构示意图、电子式、化合物的形成过程的表示方法是解本题关键,题目难度不大。
8.(2024秋 连云港期末)反应2Na2O2+2CO2═2Na2CO3+O2可作呼吸面具的供氧剂。下列说法正确的是( )
A.Na+的结构示意图为
B.CO2空间填充模型为
C.Na2CO3仅含离子键
D.中子数为10的氧原子可表示为
【答案】D
【分析】A.Na+的电子数为10,最外层电子数为8;
B.CO2分子中C原子半径大于O;
C.中还含有碳氧键;
D.元素符号左下角为质子数,左上角为质量数;质量数=质子数+中子数。
【解答】解:A.Na+的结构示意图为,是Na原子的结构示意图,故A错误;
B.CO2是直线形分子,且C原子半径大于O,其空间填充模型为,故B错误;
C.Na2CO3是离子化合物,中含有碳氧极性键,即Na2CO3中含离子键和共价键,故C错误;
D.质量数=质子数+中子数,中子数为10的氧原子的质量数为8+10=18,该核素为O,故D正确;
故选:D。
【点评】本题考查常见化学用语正误判断,侧重辨析能力和规范答题能力考查,把握常见化学用语概念及表示方法即可解答,题目难度不大。
9.(2024秋 石景山区期末)下列化学用语或图示表达正确的是( )
A.CO2的电子式:
B.基态N原子的价层电子轨道表示式:
C.HClO的结构式:H—Cl—O
D.反﹣2﹣丁烯的分子结构模型:
【答案】B
【分析】A.二氧化碳中碳原子与氧原子分别共用2对电子;
B.基态氮原子价电子排布式为2s22p3;
C.次氯酸中心原子为氧原子;
D.为顺﹣2﹣2丁烯。
【解答】解:A.二氧化碳电子式各原子满足最外层八电子结构,二氧化碳的电子式为:,故A错误;
B.基态氮原子价电子排布式为2s22p3,依据核外电子排布规律可知,基态N原子的价层电子轨道表示式:,故正确;
C.HClO的结构式:H—O—Cl,故C错误;
D.为顺﹣2﹣2丁烯,故D错误;
故选:B。
【点评】本题主要考查化学式或化学符号及名称的综合等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
10.(2024秋 济南期末)下列化学用语或图示正确的是( )
A.的系统命名:5﹣氟甲苯
B.苯的结构简式:C6H4
C.HCl的形成过程:
D.基态碳原子的价电子轨道表示式:
【答案】D
【分析】A.根据氟原子在2号碳上进行分析;
B.根据结构简式是结构式的简单表达式,进行分析;
C.根据氯化氢为共价化合物,存在共用电子对,进行分析;
D.根据泡利原理和洪特规则进行分析。
【解答】解:A. 的系统命名:2﹣氟甲苯,故A错误;
B.结构简式是结构式的简单表达式,苯的结构简式:,故B错误;
C.氯化氢为共价化合物,存在共用电子对,HCl的形成过程:,故C错误;
D.根据泡利原理和洪特规则,基态碳原子的价电子轨道表示式为:,故D正确;
故选:D。
【点评】本题主要考查用电子式表示简单的离子化合物和共价化合物的形成等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
11.(2024秋 沙坪坝区校级期末)下列化学用语表示正确的是( )
A.Co3+的结构示意图
B.px轨道的电子云轮廓图
C.基态Cu原子的核外电子排布式为Ar]3d94s2
D.氟化镁的电子式
【答案】A
【分析】A.基态钴电子排布式为:1s22s22p63s23p63d74s2;
B.p轨道电子云轮廓图为哑铃形;
C.违背鸿特规则特例;
D.氟离子不能合写。
【解答】解:A.基态钴电子排布式为:1s22s22p63s23p63d74s2,失去4s上2个电子和3d上1个电子得到三价钴离子,则Co3+的结构示意图,故A正确;
B.s轨道呈球形,p轨道的电子云轮廓图为哑铃形,故B错误;
C.基态Cu原子的核外电子排布式为Ar]3d104s1故C错误;
D.氟化镁属于离子化合物,化学式中含有1个镁离子和2个氟离子,其正确的电子式为,故D错误;
故选:A。
【点评】本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、电子排布式、离子结构示意等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的分析能力及规范答题能力。
12.(2025 湖南开学)下列化学用语或图示表述错误的是( )
A.2—甲基—2—戊烯的键线式:
B.p﹣pπ键电子云轮廓图:
C.基态Fe2+的价层电子排布图:
D.用电子式表示NaCl的形成过程:
【答案】C
【分析】A.2—甲基—2—戊烯,主链有5个碳原子的烯烃,从左端开始编号,2号碳上有1个甲基,有1个碳碳双键;
B.p﹣p轨道以肩并肩形式形成p﹣pπ键;
C.基态亚铁离子是基态铁原子失去4s上2个电子得到;
D.氯化钠为离子化合物,钠离子与氯离子通过离子键结合。
【解答】解:A.2—甲基—2—戊烯,主链有5个碳原子的烯烃,从左端开始编号,2号碳上有1个甲基,有1个碳碳双键,键线式为:,故A正确;
B.p﹣p轨道以肩并肩形式形成p﹣pπ键,p﹣pπ键电子云轮廓图:,故B正确;
C.基态Fe2+在基态Fe原子的基础上失去了4s轨道的两个电子,价层电子排布图为,故C错误;
D.氯化钠为离子化合物,钠离子与氯离子通过离子键结合,用电子式表示NaCl的形成过程:,故D正确;
故选:C。
【点评】本题考查化学用语,侧重考查基础知识的掌握和灵活运用能力,明确原子构造理论,把握基态原子电子排布规律是解本题关键,题目难度不大。
13.(2024秋 岳阳期末)化学用语是化学的“语言”,下列化学用语描述错误的是( )
A.次氯酸的电子式是
B.质量数为44、中子数为24的钙原子:Ca
C.CH4的分子结构模型是:
D.用电子式表示NaCl的形成过程:
【答案】B
【分析】A.次氯酸中氧、氯均达到8电子结构、氢达到2电子结构;
B.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;质量数=质子数+中子数;
C.甲烷分子式为CH4;
D.NaCl的形成是1个钠原子失去1个电子形成钠离子,而1个氯原子得到1个电子形成氯离子,二者都达到8电子的稳定体系,形成了离子化合物。
【解答】解:A.次氯酸中氧、氯均达到8电子结构、氢达到2电子结构,故电子式为:,故A正确;
B.质量数=质子数+中子数,核素的表示方法为:元素符号左下角为质子数,左上角为质量数;则质量数为44、中子数为24的钙原子,其质子数为44﹣24=20,可表示为:,故B错误;
C.甲烷分子式为CH4,碳原子和氢原子形成空间正四面体结构,故C正确;
D.NaCl的形成是1个钠原子失去1个电子形成钠离子,而1个氯原子得到1个电子形成氯离子,二者都达到8电子的稳定体系,形成了离子化合物,用电子式表示其形成过程为:,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查学生基础知识的掌握情况,试题难度中等。
14.(2024秋 重庆期末)下列化学用语的表达不正确的是( )
A.NaCl的形成过程 B.H2O的分子结构模型:
C.CO2的结构式:O—C—O D.1H、2H、3H互为同位素
【答案】C
【分析】A.氯化钠为离子化合物,NaCl在形成时,钠原子失去电子,氯原子得到电子;
B.H2O分子为V形,氧原子半径大于氢原子;
C.二氧化碳分子中碳原子和两个氧原子分别形成碳氧双键;
D.质子数相同中子数不同的同种元素不同原子互为同位素。
【解答】解:A.NaCl为离子化合物,钠原子失去电子,氯原子得到电子,电子从钠原子转移到氯原子,用电子式表示NaCl的形成过程为,故A正确;
B.H2O的分子结构模型:,故B正确;
C.CO2的结构式O=C=O,故C错误;
D.1H、2H、3H是潜意识的三种核素,互为同位素,故D正确;
故选:C。
【点评】本题考查了化学用语的分析判断,注意电子式、分子模型、结构式等知识点的熟练掌握,题目难度不大。
15.(2024秋 黑龙江期末)下列化学用语表示不正确的是( )
A.中子数为16的磷原子:P
B.KNO3的摩尔质量:101g
C.S2﹣的结构示意图:
D.NaCl的电子式:
【答案】B
【分析】A.元素符号左下角的数字表示质子数、左上角的数字表示质量数,中子数为16的磷原子的质量数=15+16=31;
B.摩尔质量的单位是g/mol,KNO3的摩尔质量在数值上等于其相对分子质量;
C.硫离子核内有16个质子、核外有18个电子;
D.氯化钠是由钠离子和氯离子构成的离子化合物。
【解答】解:A.元素符号左下角的数字表示质子数、左上角的数字表示质量数,中子数为16的磷原子的质量数=15+16=31,中子数为16的磷原子:P,故A正确;
B.摩尔质量的单位是g/mol,KNO3的摩尔质量在数值上等于其相对分子质量,其摩尔质量是101g/mol,故B错误;
C.硫离子核内有16个质子、核外有18个电子,S2﹣的结构示意图为,故C正确;
D.氯化钠是由钠离子和氯离子构成的离子化合物,电子式为,故D正确;
故选:B。
【点评】本题考查化学用语,侧重考查基础知识的正误和灵活运用能力,明确摩尔质量的单位、离子结构示意图的书写规则、电子式的书写规则是解本题关键,题目难度不大。
16.(2024秋 大连期末)下列化学用语或图示表达正确的是( )
A.中子数为10的氧原子:
B.NaHCO3的电离方程式:
C.图中1.008表示氢元素的相对原子质量
D.NaCl溶液中的水合离子:
【答案】C
【分析】A.质量数=质子数+中子数,质量数标注于元素符号左上角,质子数标注于左下角;
B.NaHCO3电离过程中不拆分;
C.图中1.008表示氢元素的相对原子质量;
D.氯化钠溶液中钠离子带正电荷,吸引H2O中显负化合价的氧原子,氯离子带负电荷,吸引H2O中显正化合价的氢原子。
【解答】解:A.中子数为10的氧原子的质量数为8+10=18,符号为O,故A错误;
B.NaHCO3电离生成Na+和,电离方程式为NaHCO3=Na+,故B错误;
C.图中1.008表示氢元素的相对原子质量,故C正确;
D.氯化钠溶液中,钠离子带正电荷,吸引H2O中显负化合价的氧原子,氯离子带负电荷,吸引H2O中显正化合价的氢原子,且Na+结合5个水分子、Cl﹣结合6个水分子,即NaCl溶液中的水合离子:、,故D错误;
故选:C。
【点评】本题考查常见化学用语的正误判断,涉及核素、水合离子示意图、核素、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力,题目难度不大。
17.(2024秋 海南期末)用化学用语表示反应2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A.H2O的电子式:
B.H2中H元素的化合价:+1
C.Na+的结构示意图:
D.NaOH的电离方程式:NaOH═Na++O2﹣+H+
【答案】C
【分析】A.H2O是由H和O构成的共价化合物;
B.H2中H元素的化合价为0;
C.Na+核内有11个质子,核外有2个电子层,第一层上有2个电子、第二层上有8个电子;
D.NaOH的电离方程式:NaOH═Na++OH﹣。
【解答】解:A.H2O是由H和O构成的共价化合物,只含有共价键,其电子式为,故A错误;
B.H2中H元素的化合价为0,故B错误;
C.Na+核内有11个质子,核外有2个电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图为,故C正确;
D.NaOH的电离方程式:NaOH═Na++OH﹣,故D错误;
故选:C。
【点评】本题考查化学用语,侧重考查分析、判断及知识综合运用能力,明确分子式、结构式的书写规则及同位素的概念是解本题关键,题目难度不大。
18.(2024秋 朝阳区期末)下列化学用语或图示表达不正确的是( )
A.HCl的电子式为
B.丙烯的分子结构模型为
C.2,3﹣二甲基己烷的结构简式为
D.氧的基态原子的轨道表示式为4ばば
【答案】A
【分析】A.氯化氢为共价化合物;
B.丙烯的结构简式为:CH2=CH—CH3,据此判断;
C.2,3﹣二甲基己烷,主链有6个碳原子的烷烃,2,3号碳上各有1个甲基;
D.基态氧原子电子排布式为:1s22s22p4。
【解答】解:A.氯化氢为共价化合物,电子式为:,故A错误;
B.丙烯的结构简式为:CH2=CH—CH3,丙烯的分子结构模型为,故B正确;
C.2,3﹣二甲基己烷,主链有6个碳原子的烷烃,2,3号碳上各有1个甲基,结构简式为:,故C正确;
D.基态氧原子电子排布式为:1s22s22p4,依据基态原子核外电子排布规律可知,其轨道表示式为:,故D正确;
故选:A。
【点评】本题考查了化学用语的使用,明确电子式、有机物结构简式、基态原子核外电子排布规律是解题关键,题目难度中等。
19.(2024秋 山西期末)我国科学家在实验室成功制取了光学唱体——转角菱方氮化硼(BN)。下列说法错误的是( )
A.N原子的结构示意图为
B.BN的摩尔质量为25g mol﹣1
C.和的中子数之和为12
D.原子半径:B>N
【答案】C
【分析】A.根据N是7号元素,核外含有7个电子,进行分析;
B.根据摩尔质量在以g/mol为单位时在数值上等于相对分子质量或相对原子质量,进行分析;
C.根据质量数=质子数+中子数,质量数标注于元素符号左上角、质子数标注于元素符号左下角进行分析;
D.根据同周期主族元素,从左往右原子半径依次减小,进行分析。
【解答】解:A.N是7号元素,核外含有7个电子,结构示意图为,故A正确;
B.摩尔质量在以g/mol为单位时在数值上等于相对分子质量或相对原子质量,BN的摩尔质量为(14+11)g mol﹣1=25g mol﹣1,故B正确;
C.质量数=质子数+中子数,质量数标注于元素符号左上角、质子数标注于元素符号左下角,含有11﹣5=6个中子,含有14﹣7=7个中子,和的中子数之和为13,故C错误;
D.同周期主族元素,从左往右原子半径依次减小,则原子半径:B>N,故D正确;
故选:C。
【点评】本题主要考查原子结构示意图、离子结构示意图等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
20.(2024秋 大兴区期末)下列化学用语表示不正确的是( )
A.Mg2+的结构示意图:
B.水的电子式:
C.基态铬原子(24Cr)的价层电子排布式:3d54s1
D.基态氧原子的轨道表示式:
【答案】B
【分析】A.镁离子的核内有12个质子,核外有10个电子;
B.水是共价化合物;
C.当轨道半充满、全充满时更稳定;
D.基态氧原子的电子排布式为1s22s22p6;
【解答】解:A.镁离子的核内有12个质子,核外有10个电子,故其结构示意图为,故A正确;
C.水是共价化合物,H与O原子之间是共价键,故其电子式为,故B错误;
D.基态铬原子(24Cr)的电子式排布式为1s22s22p63s23p63d54s1,其价层电子排布式:3d54s1,故C正确;
D.基态氧原子的电子排布式为1s22s22p6,根据洪特规则,当电子在同一能级的不同轨道上排布时,电子总是优先占据一个轨道,且自旋平行,故其轨道表示式为,故D正确;
故选:B。
【点评】本题考查了轨道表示式、价电子排布式以及电子式和结构式的正误判断,应注意铬和铜的价电子排布式的特殊性。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
