【高考押题卷】2025年高考化学高频易错考前冲刺 化学实验方案的评价(含解析)
文档属性
| 名称 | 【高考押题卷】2025年高考化学高频易错考前冲刺 化学实验方案的评价(含解析) | 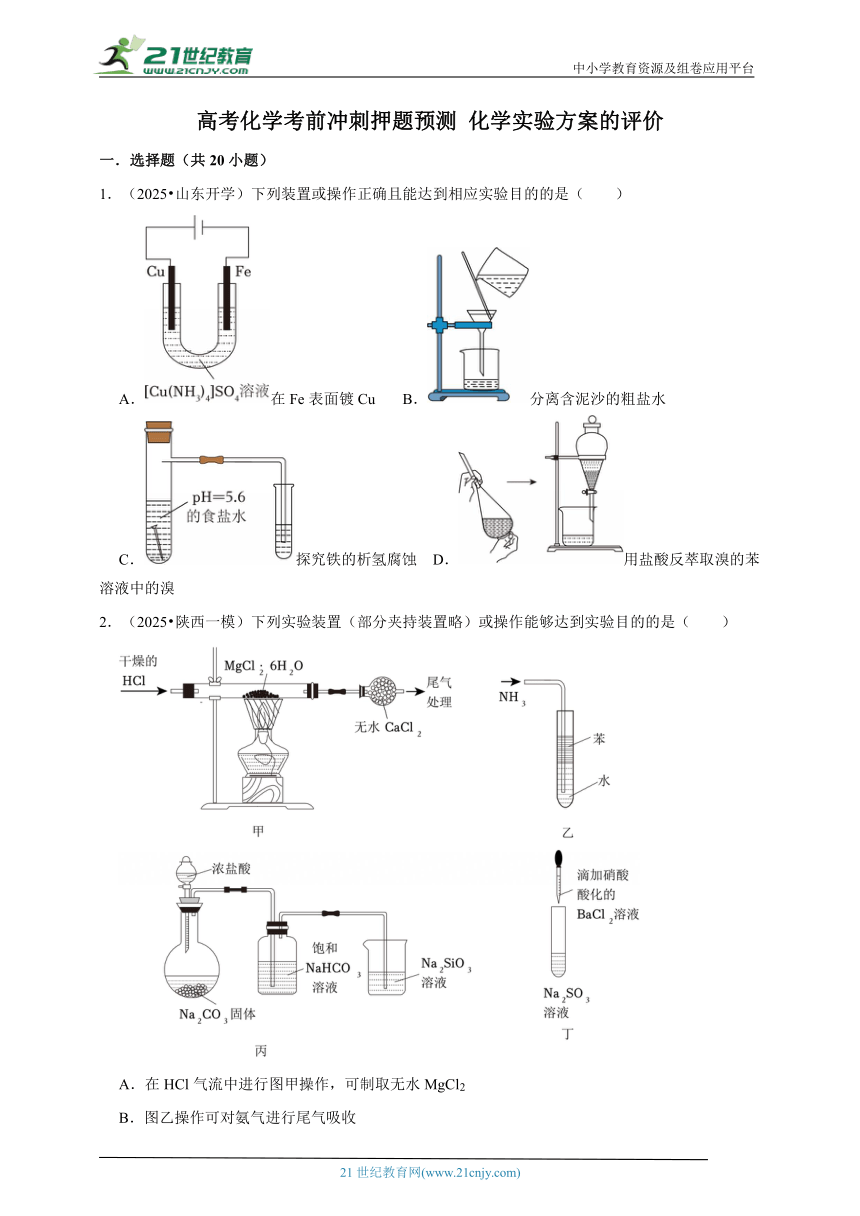 | |
| 格式 | docx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-28 18:04:16 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高考化学考前冲刺押题预测 化学实验方案的评价
一.选择题(共20小题)
1.(2025 山东开学)下列装置或操作正确且能达到相应实验目的的是( )
A.在Fe表面镀Cu B.分离含泥沙的粗盐水
C.探究铁的析氢腐蚀 D.用盐酸反萃取溴的苯溶液中的溴
2.(2025 陕西一模)下列实验装置(部分夹持装置略)或操作能够达到实验目的的是( )
A.在HCl气流中进行图甲操作,可制取无水MgCl2
B.图乙操作可对氨气进行尾气吸收
C.图丙操作可验证非金属性:Cl>C>Si
D.图丁操作可检验Na2SO3溶液是否变质
3.(2025 四川模拟)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向Na2CO3溶液中滴加稀硫酸,反应产生的气体直接通入Na2SiO3溶液中,观察现象 非金属性:C>Si
B 向K2CrO4溶液中缓慢滴加少量浓硫酸,观察溶液颜色的变化 溶液中存在平衡:(橙)+H2O (黄)+2H+
C 将NaClO溶液分别滴入品红溶液和滴加醋酸的品红溶液中,观察品红溶液颜色变化 pH对ClO﹣氧化性的影响
D 用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH Ka1(H2S)>Ka(HCN)
A.A B.B C.C D.D
4.(2025 昆明一模)下列实验操作、现象和结论都正确的是( )
A.向淀粉的水解产物中加碘水,溶液变蓝则证明淀粉没有水解完全
B.向K2CrO4溶液中加入稀盐酸,溶液变为橙色,证明K2CrO4具有强氧化性
C.向某溶液中加入稀盐酸,有白色沉淀生成,继续滴加沉淀不消失,证明溶液中存在
D.向铁和水蒸气反应后的固体中先加稀硫酸,再加KSCN溶液,溶液不变红,证明固体中没有Fe3O4
5.(2025 河北模拟)关于化学实验的下列说法,错误的是( )
A.苯酚沾到皮肤上时,立即用乙醇冲洗,再用水冲洗
B.屠呦呦用乙醚提取青蒿素采用了萃取的原理
C.某溶液中滴加AgNO3溶液时生成白色沉淀,则该溶液中含有Cl﹣
D.用NaOH标准溶液滴定盐酸,以酚酞试液做指示剂,终点时溶液变为粉红色
6.(2025 河北模拟)依据下列实验操作和现象能得出相应结论的是( )
实验操作 实验现象 实验结论
A 向Na2SO3粉末中滴加盐酸 产生使品红溶液褪色的气体 非金属性:S<Cl
B 将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水 溶液不变蓝 淀粉已经完全水解
C 向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液 酸性KMnO4溶液的紫色褪去 2﹣甲基苯甲醛中含有醛基
D 向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,振荡,然后滴加2滴KI溶液 先生成白色沉淀,后生成黄色沉淀 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
7.(2025 湖北模拟)下列实验操作和现象能得出相应结论的是( )
实验操作和现象 结论
A 室温下,分别测定0.1mol L﹣1的CH3COONa和NH4Cl溶液的pH,两者pH之和等于14 相同浓度的和的水解能力几乎相同
B 向Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成白色沉淀 与发生了双水解
C 向蔗糖溶液中滴加稀硫酸并水浴加热,再加入新制的氢氧化铜悬浊液,无砖红色沉淀生成 蔗糖未水解
D 向酸性KMnO4溶液中滴加FeCl2溶液,观察到溶液紫红色褪去 的氧化性强于Fe3+
A.A B.B C.C D.D
8.(2025 九江模拟)实验探究对于提高化学学科素养起到了非常关键的作用。下列方案设计、现象和结论均正确的是( )
实验目的 设计方案 现象和结论
A 判断淀粉的水解程度 在一支试管中加入1mL淀粉溶液和2mL10%稀硫酸,加热煮沸。再加入10%NaOH溶液至溶液呈碱性,再加入几滴新制的银氨溶液,水浴加热 产生银镜,不能说明淀粉已水解完全
B 探究压强对化学平衡的影响 向针筒中充入50mLHI(g),分解达到平衡后再压缩针筒内气体 气体颜色变深;增大压强,平衡正向移动
C 探究浓硝酸与炭在加热条件下能否反应 将红热的木炭投入浓硝酸中 产生红棕色气体;炭与浓硝酸在加热条件下反应生成NO2
D 探究Mg(OH)2、Fe(OH)3的溶解度的大小 向2mL1mol/LNaOH溶液中依次滴加0.1mol/L的MgCl2和FeCl3溶液各1mL 先产生白色沉淀,后产生红褐色沉淀,溶解度Mg(OH)2大于Fe(OH)3
A.A B.B C.C D.D
9.(2025 湖北模拟)下列实验装置不能达到实验目的的是( )
A.检验乙醇消去反应的产物
B.验证铁的吸氧腐蚀
C.制取并收集氨
D.制备明矾晶体
10.(2024秋 丰台区期末)下列实验装置不能达到实验目的的是( )
A.除去Cl2中少量HCl B.从NaCl溶液获得NaCl晶体
C.验证Cl2能与水反应 D.制备Fe(OH)2
A.A B.B C.C D.D
11.(2024秋 秦淮区校级期末)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向两支分别盛有2mL苯和2mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
A.A B.B C.C D.D
12.(2024秋 德州期末)下列图示实验中,操作规范且能达到实验目的的是( )
A.制取NaHCO3,从b口通入氨气 B.乙烯除杂
C.分离CH2Cl2和CCl4 D.用该装置制备无水MgCl2
A.A B.B C.C D.D
13.(2024秋 西城区期末)下列实验能达到实验目的的是( )
A B C D
验证Na2O2与水反应生成O2 比较Cl2、Br2、I2的氧化性 除去CO2中的少量HCl 制取纯净的Fe(OH)2沉淀
A.A B.B C.C D.D
14.(2024秋 连云港期末)室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
D 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
A.A B.B C.C D.D
15.(2024秋 重庆期末)下列实验原理、分析或结论正确的是( )
A.25℃时,向稀醋酸中加入少量醋酸钠固体,醋酸的电离程度增大
B.25℃时,2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和,溶液pH<7
C.向NaCl溶液中先通入CO2至饱和,再通入NH3可析出NaHCO3固体
D.0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)=c(I﹣)
16.(2024秋 重庆期末)下列各图所示装置及操作正确且能达到实验目的的是( )
A.用NaOH标准溶液测定盐酸浓度
B.用pH试纸测定盐酸的pH
C.中和反应反应热的测定
D.蒸干MgCl2溶液制取无水MgCl2
17.(2025 湖南开学)为达到对应的实验目的,下列实验设计或操作合理的是( )
选项 实验目的 实验设计或操作
A 证明氧化性:H2O2比Fe3+强 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,振荡
B 提纯含有少量氯化钠和泥沙的苯甲酸 加热溶解,趁热过滤,冷却结晶,过滤洗涤
C 检验CH2=CHCHO是否含有碳碳双键 向适量的CH2=CHCHO溶液中加入过量的银氨溶液,再加入少量溴水、振荡
D 检验Cu与浓硫酸的反应后出现的白色固体是否为CuSO4 直接向盛有反应液的试管中加入适量水,振荡
A.A B.B C.C D.D
18.(2025 广东开学)下列实验操作和现象,得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加几滴浓盐酸 盛NiO(OH)的试管中产生黄绿色气体 氧化性:NiO(OH)>Fe(OH)3
B 向CuSO4溶液中通入H2S气体 出现黑色沉淀(CuS) 酸性:H2S<H2SO4
C 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 溴水褪色 乙醇发生消去反应生成乙烯,乙烯与溴水发生加成反应
D 向Na2HPO4溶液中滴加AgNO3溶液 出现黄色沉淀(Ag3PO4) Na2HPO4发生了水解反应
A.A B.B C.C D.D
19.(2025 湖南模拟)下列实验装置及现象正确的是( )
A.图甲:浓氨水与浓硫酸反应
B.图乙:测量锌与稀硫酸反应的反应速率
C.图丙:滴定结束时的刻度,读数为12.20mL
D.图丁:验证FeCl3与KI的反应是可逆反应
20.(2024秋 岳阳期末)下列实验能达到相应实验目的的是( )
A B C D
制备氢氧化铁股体 加热Na2CO3和NaHCO3的混合物比较二者的热稳定性 制备Fe(OH)2能较长时间观察颜色 除去CO2中的少量HCl
A.A B.B C.C D.D
高考化学考前冲刺押题预测 化学实验方案的评价
参考答案与试题解析
一.选择题(共20小题)
1.(2025 山东开学)下列装置或操作正确且能达到相应实验目的的是( )
A.在Fe表面镀Cu
B.分离含泥沙的粗盐水
C.探究铁的析氢腐蚀
D.用盐酸反萃取溴的苯溶液中的溴
【答案】A
【分析】A.在Fe表面镀Cu,Cu与电源正极相连作阳极,阴极上铜离子得到电子生成Cu;
B.过滤时漏斗下端应紧靠烧杯内壁;
C.弱酸性溶液中,Fe发生吸氧腐蚀;
D.溴不易溶于盐酸,易溶于苯。
【解答】解:A.在Fe表面镀Cu,Cu与电源正极相连作阳极,阴极上铜离子得到电子生成Cu,可实现镀铜,故A正确;
B.过滤时漏斗下端应紧靠烧杯内壁,防止液滴飞溅,故B错误;
C.弱酸性溶液中,Fe发生吸氧腐蚀,酸性溶液中Fe发生析氢腐蚀,故C错误;
D.溴不易溶于盐酸,易溶于苯,则加盐酸不能反萃取苯溶液中的溴,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物的分离提纯、电化学、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
2.(2025 陕西一模)下列实验装置(部分夹持装置略)或操作能够达到实验目的的是( )
A.在HCl气流中进行图甲操作,可制取无水MgCl2
B.图乙操作可对氨气进行尾气吸收
C.图丙操作可验证非金属性:Cl>C>Si
D.图丁操作可检验Na2SO3溶液是否变质
【答案】A
【分析】A.根据MgCl2 6H2O在加热过程中容易水解,进行分析;
B.根据氨气直接通入水中,起不到防倒吸的作用进行分析;
C.根据浓盐酸与碳酸钠反应生成CO2,CO2和硅酸钠反应生成不溶性硅酸,进行分析;
D.根据硝酸具有强氧化性,能将亚硫酸根氧化生成硫酸根,进行分析。
【解答】解:A.MgCl2 6H2O在加热过程中容易水解,最终得不到氯化镁,故在HCl氛围中脱水,故A正确;
B.NH3直接通入水中,起不到防倒吸的作用,可以改用四氯化碳,故B错误;
C.浓盐酸与碳酸钠反应生成二氧化碳,通过饱和碳酸氢钠溶液除去二氧化碳中混有的HCl,二氧化碳和硅酸钠反应生成不溶性硅酸,说明酸性:HCl>H2CO3>H2SiO3,但盐酸不是最高价含氧酸,不能说明元素非金属性强弱,故C错误;
D.硝酸具有强氧化性,能将亚硫酸根氧化生成硫酸根,不能说明亚硫酸钠是否变质,故D错误;
故选:A。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
3.(2025 四川模拟)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向Na2CO3溶液中滴加稀硫酸,反应产生的气体直接通入Na2SiO3溶液中,观察现象 非金属性:C>Si
B 向K2CrO4溶液中缓慢滴加少量浓硫酸,观察溶液颜色的变化 溶液中存在平衡:(橙)+H2O (黄)+2H+
C 将NaClO溶液分别滴入品红溶液和滴加醋酸的品红溶液中,观察品红溶液颜色变化 pH对ClO﹣氧化性的影响
D 用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH Ka1(H2S)>Ka(HCN)
A.A B.B C.C D.D
【答案】D
【分析】A.根据最高价含氧酸的酸性越强则对于元素的非金属性越强,进行分析;
B.根据K2CrO4溶液中存在平衡(橙)+H2O (黄)+2H+,进行分析;
C.根据次氯酸钠和醋酸反应生成次氯酸,进行分析;
D.根据NaCN和Na2S均为强碱弱酸盐,水解后呈碱性,水解程度越大即pH值越大,进行分析。
【解答】解:A.CO2通入硅酸钠溶液中,溶液变浑浊,说明碳酸的酸性大于硅酸,最高价含氧酸的酸性越强则对于元素的非金属性越强,因此非金属性:C>Si,故A正确;
B.铬酸钾溶液中存在平衡(橙)+H2O (黄)+2H+,滴入少量浓硫酸,考虑的是氢离子浓度增大,平衡逆向移动,则浓度增大,溶液呈现橙色,故B正确;
C.NaClO和醋酸反应生成HClO,品红褪色较快,可知pH对ClO﹣的氧化性的影响,故C正确;
D.NaCN和硫酸钠均为强碱弱酸盐,水解后呈碱性,水解程度越大即pH值越大,水解后产生的酸的酸性越弱,用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH,证明的是Ka2(H2S)和Ka(HCN)相对大小,故D错误;
故选:D。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
4.(2025 昆明一模)下列实验操作、现象和结论都正确的是( )
A.向淀粉的水解产物中加碘水,溶液变蓝则证明淀粉没有水解完全
B.向K2CrO4溶液中加入稀盐酸,溶液变为橙色,证明K2CrO4具有强氧化性
C.向某溶液中加入稀盐酸,有白色沉淀生成,继续滴加沉淀不消失,证明溶液中存在
D.向铁和水蒸气反应后的固体中先加稀硫酸,再加KSCN溶液,溶液不变红,证明固体中没有Fe3O4
【答案】A
【分析】A.根据溶液变蓝说明溶液中含有淀粉,进行分析;
B.根据向铬酸钾溶液中加入稀盐酸发生的反应为铬酸钾溶液与稀盐酸反应生成氯化钾、氯化铬、氯气和水,进行分析;
C.根据溶液中的银离子能与氯离子反应生成不溶于盐酸的氯化银白色沉淀,进行分析;
D.根据四氧化三铁溶于稀硫酸得到的铁离子能与过量的铁反应生成亚铁离子,溶液中的亚铁离子不能与硫氰酸根离子反应,进行分析。
【解答】解:A.向淀粉的水解产物中加碘水,溶液变蓝说明溶液中含有淀粉,淀粉没有水解完全,故A正确;
B.向铬酸钾溶液中加入稀HCl发生的反应为铬酸钾溶液与稀盐酸反应生成KCl、氯化铬、氯气和H2O,氯化铬溶液为紫色,所以反应后溶液不可能为橙色,故B错误;
C.溶液中的Ag+能与Cl﹣反应生成不溶于盐酸的氯化银白色沉淀,则向某溶液中加入稀HCl,有白色沉淀生成,继续滴加沉淀不消失,不能证明溶液中存在硅酸根离子,故C错误;
D.Fe3O4溶于稀硫酸得到的铁离子能与过量的铁反应生成亚铁离子,溶液中的亚铁离子不能与硫氰酸根离子反应,所以向铁和水蒸气反应后的固体中先加稀H2SO4,再加硫氰化钾溶液,溶液不变红,不能证明固体中没有四氧化三铁,故D错误;
故选:A。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
5.(2025 河北模拟)关于化学实验的下列说法,错误的是( )
A.苯酚沾到皮肤上时,立即用乙醇冲洗,再用水冲洗
B.屠呦呦用乙醚提取青蒿素采用了萃取的原理
C.某溶液中滴加AgNO3溶液时生成白色沉淀,则该溶液中含有Cl﹣
D.用NaOH标准溶液滴定盐酸,以酚酞试液做指示剂,终点时溶液变为粉红色
【答案】C
【分析】A.苯酚易溶于乙醇;
B.利用乙醚萃取从青蒿中提取青蒿素;
C.溶液中含有硫酸根离子、碳酸根离子加入硝酸银后也会生成白色沉淀;
D.以酚酞为指示剂,遇碱溶液变红。
【解答】解:A.由于苯酚易溶于乙醇,不慎沾到皮肤上,为防止对皮肤造成伤害,应立即用乙醇冲洗,再用水冲洗,故A正确;
B.乙醚从青蒿中提取青蒿素,利用的是萃取的原理,故B正确;
C.溶液中含有硫酸根离子、碳酸根离子加入硝酸银后也会生成白色沉淀,不能说明溶液中含有Cl﹣,故C错误;
D.用NaOH标准溶液滴定盐酸,由于酚酞遇碱溶液变红,用酚酞作指示剂,滴定终点时,溶液颜色由无色变为粉红色,故D正确;
故选:C。
【点评】本题考查实验方案的设计,侧重考查学生基础知识的掌握情况,试题难度中等。
6.(2025 河北模拟)依据下列实验操作和现象能得出相应结论的是( )
实验操作 实验现象 实验结论
A 向Na2SO3粉末中滴加盐酸 产生使品红溶液褪色的气体 非金属性:S<Cl
B 将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水 溶液不变蓝 淀粉已经完全水解
C 向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液 酸性KMnO4溶液的紫色褪去 2﹣甲基苯甲醛中含有醛基
D 向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,振荡,然后滴加2滴KI溶液 先生成白色沉淀,后生成黄色沉淀 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
【答案】B
【分析】A.元素的非金属性越强,最高价含氧酸的酸性越强;
B.将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水,溶液不变蓝,说明溶液中已经没有淀粉;
C.苯环上的甲基也可能被酸性高锰酸钾溶液氧化为—COOH而导致溶液褪色,向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液,酸性KMnO4溶液的紫色褪去;
D.向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,生成AgCl白色沉淀,Ag+是过量的,振荡,然后滴加2滴KI溶液,生成AgI黄色沉淀,不能说明AgI是由AgCl转化过来的。
【解答】解:A.元素的非金属性越强,最高价含氧酸的酸性越强;向Na2SO3粉末中滴加盐酸,产生使品红溶液褪色的气体,该气体为SO2,说明HCl的酸性强于H2SO3,HCl、H2SO3均不是Cl、S的最高价含氧酸,不能通过酸性比较S、Cl的非金属性强弱,故A错误;
B.将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水,溶液不变蓝,说明溶液中已经没有淀粉,说明淀粉已经完全水解,故B正确;
C.苯环上的甲基也可能被酸性高锰酸钾溶液氧化为—COOH而导致溶液褪色,向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液,酸性KMnO4溶液的紫色褪去,不能说明2﹣甲基苯甲醛中含有醛基,故C错误;
D.不能说明AgI是由AgCl转化过来的,不能说明Ksp(AgCl)>Ksp(AgI),故D错误;
故选:B。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
7.(2025 湖北模拟)下列实验操作和现象能得出相应结论的是( )
实验操作和现象 结论
A 室温下,分别测定0.1mol L﹣1的CH3COONa和NH4Cl溶液的pH,两者pH之和等于14 相同浓度的和的水解能力几乎相同
B 向Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成白色沉淀 与发生了双水解
C 向蔗糖溶液中滴加稀硫酸并水浴加热,再加入新制的氢氧化铜悬浊液,无砖红色沉淀生成 蔗糖未水解
D 向酸性KMnO4溶液中滴加FeCl2溶液,观察到溶液紫红色褪去 的氧化性强于Fe3+
A.A B.B C.C D.D
【答案】A
【分析】A.CH3COONa溶液水解显碱性,NH4Cl溶液水解显酸性;
B.Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成氢氧化铝沉淀、碳酸钠;
C.蔗糖水解后,在碱性溶液中检验葡萄糖;
D.亚铁离子、氯离子均可被酸性高锰酸钾溶液氧化。
【解答】解:A.CH3COONa溶液水解显碱性,NH4Cl溶液水解显酸性,等浓度时两者pH之和等于14,可知相同浓度的和的水解能力几乎相同,故A正确;
B.Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成氢氧化铝沉淀、碳酸钠,则碳酸氢根离子的电离被促进,与水解无关,故B错误;
C.蔗糖水解后,没有加NaOH中和硫酸,不能检验葡萄糖,则不能证明蔗糖未水解,故C错误;
D.亚铁离子、氯离子均可被酸性高锰酸钾溶液氧化,紫色褪去,不能证明的氧化性强于Fe3+,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、盐类水解、物质的检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
8.(2025 九江模拟)实验探究对于提高化学学科素养起到了非常关键的作用。下列方案设计、现象和结论均正确的是( )
实验目的 设计方案 现象和结论
A 判断淀粉的水解程度 在一支试管中加入1mL淀粉溶液和2mL10%稀硫酸,加热煮沸。再加入10%NaOH溶液至溶液呈碱性,再加入几滴新制的银氨溶液,水浴加热 产生银镜,不能说明淀粉已水解完全
B 探究压强对化学平衡的影响 向针筒中充入50mLHI(g),分解达到平衡后再压缩针筒内气体 气体颜色变深;增大压强,平衡正向移动
C 探究浓硝酸与炭在加热条件下能否反应 将红热的木炭投入浓硝酸中 产生红棕色气体;炭与浓硝酸在加热条件下反应生成NO2
D 探究Mg(OH)2、Fe(OH)3的溶解度的大小 向2mL1mol/LNaOH溶液中依次滴加0.1mol/L的MgCl2和FeCl3溶液各1mL 先产生白色沉淀,后产生红褐色沉淀,溶解度Mg(OH)2大于Fe(OH)3
A.A B.B C.C D.D
【答案】A
【分析】A.需要向水解液中加碘水检验淀粉;
B.2HI(g) H2(g)+I2(g)为气体总物质的量不变的反应;
C.可能浓硝酸受热分解生成二氧化氮;
D.2mL1mol/LNaOH溶液中滴加0.1mol/L的MgCl2溶液1mL,产生白色沉淀后,溶液中有NaOH剩余。
【解答】解:A.需要向水解液中加碘水检验淀粉,只检验葡萄糖,没有检验淀粉,不能证明淀粉水解完全,故A正确;
B.2HI(g) H2(g)+I2(g)为气体总物质的量不变的反应,则压缩体积,各物质浓度均增大,气体颜色加深,平衡不移动,故B错误;
C.产生红棕色的气体NO2,可能由木炭与浓硝酸反应产生,也可能由浓硝酸自身分解产生,故C错误;
D.2mL1mol/LNaOH溶液中滴加0.1mol/L的MgCl2溶液1mL,产生白色沉淀后,溶液中有NaOH剩余,剩余的NaOH与氯化铁溶液反应生成红褐色沉淀,不能探究Mg(OH)2与Fe(OH)2的溶解度的大小,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、物质的检验、化学平衡、难溶电解质、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
9.(2025 湖北模拟)下列实验装置不能达到实验目的的是( )
A.检验乙醇消去反应的产物
B.验证铁的吸氧腐蚀
C.制取并收集氨
D.制备明矾晶体
【答案】A
【分析】A.乙烯中可能混有二氧化硫;
B.食盐水为中性,Fe发生吸氧腐蚀;
C.浓氨水与生石灰混合可制备氨气,氨气的密度比空气密度小;
D.轻触木棍,以结晶核为中心,可缓慢结晶。
【解答】解:A.乙烯中可能混有二氧化硫,均使溴水褪色,则不能证明生成乙烯,故A错误;
B.食盐水为中性,Fe发生吸氧腐蚀,水沿导管上升可证明,故B正确;
C.浓氨水与生石灰混合可制备氨气,氨气的密度比空气密度小,可选图中向下排空气法收集,故C正确;
D.轻触木棍,以结晶核为中心,可缓慢结晶,可制备明矾晶体,故D正确;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备及检验、电化学、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
10.(2024秋 丰台区期末)下列实验装置不能达到实验目的的是( )
A.除去Cl2中少量HCl B.从NaCl溶液获得NaCl晶体
C.验证Cl2能与水反应 D.制备Fe(OH)2
A.A B.B C.C D.D
【答案】D
【分析】A.根据氯化氢极易溶于水,氯气难溶于饱和食盐水,进行分析;
B.根据氯化钠性质稳定进行分析;
C.根据Cl2本身没有漂白性进行分析;
D.根据氢氧化亚铁易被空气中的氧气氧化进行分析。
【解答】解:A.HCl极易溶于水,Cl2难溶于饱和食盐水,饱和食盐水可除去Cl2中少量HCl,故A正确;
B.NaCl性质稳定,可通过蒸发结晶从NaCl溶液获得NaCl晶体,故B正确;
C.氯气本身没有漂白性,故红色干布条不会褪色,Cl2与H2O反应生成的HClO有强氧化性,Cl2+H2O HCl+HClO,可以漂白红色布条,故湿润的红色布条褪色,可验证Cl2能与水反应,故C正确;
D.氢氧化亚铁易被空气中的氧气氧化,制备氢氧化亚铁应在无氧环境中进行,本实验不能制备Fe(OH)2,故D错误;
故选:D。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
11.(2024秋 秦淮区校级期末)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向两支分别盛有2mL苯和2mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
A.A B.B C.C D.D
【答案】A
【分析】A.向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,在酸性溶液中,氧化性强弱为:Fe3+>I2;
B.通过用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH大小的不同(前者大于后者),即酸性前者小于后者;
C.苯不能使酸性高锰酸钾溶液褪色,而甲苯可以使酸性高锰酸钾溶液褪色;
D.向MgCl2溶液中先加入少量氢氧化钠溶液,先生成白色沉淀,充分反应后再加入少量CuSO4溶液,沉淀颜色变成蓝色。
【解答】解:A.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,在酸性溶液中,氧化性强弱为:Fe3+>I2,故而是氧化了I﹣而生成I2,故而不能达到探究目的,故A错误;
B.通过用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH大小的不同(前者大于后者),即酸性前者小于后者,故而能探究键的极性对羧酸酸性的影响,故B正确;
C.苯不能使酸性高锰酸钾溶液褪色,而甲苯可以使酸性高锰酸钾溶液褪色,说明有机物中基团间存在相互作用,故C正确;
D.向MgCl2溶液中先加入少量氢氧化钠溶液,先生成白色沉淀,充分反应后再加入少量CuSO4溶液,沉淀颜色变成蓝色,发生沉淀的转化,故而能探究Cu(OH)2与Mg(OH)2溶度积的大小,故D正确;
故选:A。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
12.(2024秋 德州期末)下列图示实验中,操作规范且能达到实验目的的是( )
A.制取NaHCO3,从b口通入氨气 B.乙烯除杂
C.分离CH2Cl2和CCl4 D.用该装置制备无水MgCl2
A.A B.B C.C D.D
【答案】D
【分析】A.氨气极易溶于水;
B.乙烯能被酸性高锰酸钾氧化;
C.蒸馏时温度计液泡应该在蒸馏烧瓶支管口处;
D.MgCl2易水解。
【解答】解:A.制取NaHCO3,氨气极易溶于水,为防止倒吸,应该从a口通入氨气,故A错误;
B.乙烯能被酸性高锰酸钾氧化,不能用酸性高锰酸钾除乙烯中的二氧化硫,故B错误;
C.蒸馏时温度计液泡应该在蒸馏烧瓶支管口处,用蒸馏法分离CH2Cl2和CCl4,温度计液泡应该在蒸馏烧瓶支管口处,故C错误;
D.为防止MgCl2水解,在氯化氢气流中加热氯化镁晶体制备无水MgCl2,故D正确;
故选:D。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
13.(2024秋 西城区期末)下列实验能达到实验目的的是( )
A B C D
验证Na2O2与水反应生成O2 比较Cl2、Br2、I2的氧化性 除去CO2中的少量HCl 制取纯净的Fe(OH)2沉淀
A.A B.B C.C D.D
【答案】A
【分析】A.O2能使带火星的木条复燃;
B.过量的氯气能氧化I﹣;
C.CO2、HCl都能和NaOH溶液反应;
D.Fe(OH)2不稳定,易被空气氧化。
【解答】解:A.O2能使带火星的木条复燃,根据带火星的木条是否复燃来验证Na2O2与水反应是否生成O2,故A正确;
B.过量的氯气能氧化I﹣,干扰Br2氧化I﹣,所以不能实现实验目的,故B错误;
C.CO2、HCl都能和NaOH溶液反应,应该用饱和的NaHCO3溶液除去CO2中的HCl,故C错误;
D.Fe(OH)2不稳定,易被空气氧化,为隔绝空气,应该将胶头滴管伸入液面下,故D错误;
故选:A。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质、实验操作规范性是解本题关键,题目难度不大。
14.(2024秋 连云港期末)室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
D 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
A.A B.B C.C D.D
【答案】C
【分析】A.该无色气体可能是SO2、CO2或H2S等,且碳酸盐、碳酸氢盐都能和稀盐酸反应生成CO2;
B.氯气没有漂白性,HClO具有漂白性;
C.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化硫具有刺激性气味;
D.K元素的焰色试验必须透过蓝色的钴玻璃观察。
【解答】解:A.该无色气体可能是SO2、CO2或H2S等,且碳酸盐、碳酸氢盐都能和稀盐酸反应生成CO2,根据实验现象无法判断溶液中是否含有碳酸根离子,故A错误;
B.氯气没有漂白性,HClO具有漂白性,氯气和水反应生成的HClO使有色布条褪色,故B错误;
C.浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应生成二氧化硫,由实验操作和现象可知,浓硫酸体现了吸水性、脱水性和强氧化性,故C正确;
D.K元素的焰色试验必须透过蓝色的钴玻璃观察,实验中没有透过蓝色的钴玻璃观察,所以无法判断是否含有钾元素,故D错误;
故选:C。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质是解本题关键,题目难度不大。
15.(2024秋 重庆期末)下列实验原理、分析或结论正确的是( )
A.25℃时,向稀醋酸中加入少量醋酸钠固体,醋酸的电离程度增大
B.25℃时,2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和,溶液pH<7
C.向NaCl溶液中先通入CO2至饱和,再通入NH3可析出NaHCO3固体
D.0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)=c(I﹣)
【答案】B
【分析】A.醋酸钠电离出醋酸根离子,抑制醋酸的电离;
B.2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和生成醋酸铵;
C.二氧化碳在水中溶解度不大;
D.AgI比AgCl更难溶。
【解答】解:A.醋酸钠电离出醋酸根离子,抑制醋酸的电离,则醋酸的电离程度减小,故A错误;
B.2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和生成醋酸铵,水解显酸性,则溶液pH<7,故B正确;
C.二氧化碳在水中溶解度不大,应向饱和食盐水中先通入氨气,再通入二氧化碳可析出NaHCO3固体,故C错误;
D.AgI比AgCl更难溶,则0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)>c(I﹣),故D错误;
故选:B。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、盐类水解、难溶电解质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
16.(2024秋 重庆期末)下列各图所示装置及操作正确且能达到实验目的的是( )
A.用NaOH标准溶液测定盐酸浓度
B.用pH试纸测定盐酸的pH
C.中和反应反应热的测定
D.蒸干MgCl2溶液制取无水MgCl2
【答案】C
【分析】A.NaOH溶液与玻璃中二氧化硅反应生成具有粘合性的硅酸钠;
B.pH试纸不能湿润;
C.图中保温好,温度计测定温度;
D.蒸发促进镁离子的水解,且生成的盐酸易挥发。
【解答】解:A.NaOH溶液与玻璃中二氧化硅反应生成具有粘合性的硅酸钠,应将图中酸式滴定管改为碱式滴定管,故A错误;
B.pH试纸不能湿润,应选干燥的pH试纸测定,故B错误;
C.图中保温好,温度计测定温度,可测定中和热,故C正确;
D.蒸发促进镁离子的水解,且生成的盐酸易挥发,应在HCl气流中蒸发制取无水MgCl2,故D错误;
故选:C。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、盐类水解、中和滴定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
17.(2025 湖南开学)为达到对应的实验目的,下列实验设计或操作合理的是( )
选项 实验目的 实验设计或操作
A 证明氧化性:H2O2比Fe3+强 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,振荡
B 提纯含有少量氯化钠和泥沙的苯甲酸 加热溶解,趁热过滤,冷却结晶,过滤洗涤
C 检验CH2=CHCHO是否含有碳碳双键 向适量的CH2=CHCHO溶液中加入过量的银氨溶液,再加入少量溴水、振荡
D 检验Cu与浓硫酸的反应后出现的白色固体是否为CuSO4 直接向盛有反应液的试管中加入适量水,振荡
A.A B.B C.C D.D
【答案】B
【分析】A.酸性溶液中可氧化Fe2+,干扰H2O2氧化Fe2+;
B.苯甲酸的溶解度随温度变化大,分离难溶性固体和溶液采用过滤的方法;
C.银氨溶液具有碱性,能和溴水反应;
D.试管中含有浓硫酸,浓硫酸稀释时,应该将浓硫酸倒入水中。
【解答】解:A.将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液呈酸性,酸性溶液中可氧化Fe2+,则不能判断是否发生H2O2与Fe2+的反应,故A错误;
B.苯甲酸的溶解度随温度变化大,取一定量样品加入适量的水,加热充分溶解,趁热过滤,冷却结晶,过滤,可除去粗苯甲酸样品中少量氯化钠和泥沙,故B正确;
C.银氨溶液呈碱性,过量的银氨溶液能和溴水反应,且该操作没有水浴加热,醛基不能被银氨溶液氧化为羧基,故C错误;
D.试管中含有剩余的浓硫酸,直接加水,容易造成液体飞溅,应该将反应后的溶液倒入水中并不断搅拌,故D错误;
故选:B。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质、实验操作规范性是解本题关键,C、D选项为解答易错点。
18.(2025 广东开学)下列实验操作和现象,得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加几滴浓盐酸 盛NiO(OH)的试管中产生黄绿色气体 氧化性:NiO(OH)>Fe(OH)3
B 向CuSO4溶液中通入H2S气体 出现黑色沉淀(CuS) 酸性:H2S<H2SO4
C 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 溴水褪色 乙醇发生消去反应生成乙烯,乙烯与溴水发生加成反应
D 向Na2HPO4溶液中滴加AgNO3溶液 出现黄色沉淀(Ag3PO4) Na2HPO4发生了水解反应
A.A B.B C.C D.D
【答案】A
【分析】A.NiO(OH)与浓盐酸发生氧化还原反应生成氯气,Fe(OH)3与浓盐酸发生中和反应;
B.CuSO4溶液中通入H2S气体,生成CuS沉淀和硫酸;
C.生成的乙烯中可能混有二氧化硫,均与溴水反应;
D.Na2HPO4溶液中滴加AgNO3溶液,生成Ag3PO4沉淀,可知AgNO3溶液促进的电离。
【解答】解:A.NiO(OH)与浓盐酸发生氧化还原反应生成氯气,Fe(OH)3与浓盐酸发生中和反应,可知氧化性:NiO(OH)>Fe(OH)3,故A正确;
B.CuSO4溶液中通入H2S气体,生成CuS沉淀和硫酸,CuS不溶于硫酸,不能比较H2S、H2SO4的酸性强弱,故B错误;
C.生成的乙烯中可能混有二氧化硫,均与溴水反应,则溴水褪色,不能证明乙烯发生了加成反应,故C错误;
D.Na2HPO4溶液中滴加AgNO3溶液,生成Ag3PO4沉淀,可知AgNO3溶液促进的电离,则不能证明发生水解,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
19.(2025 湖南模拟)下列实验装置及现象正确的是( )
A.图甲:浓氨水与浓硫酸反应
B.图乙:测量锌与稀硫酸反应的反应速率
C.图丙:滴定结束时的刻度,读数为12.20mL
D.图丁:验证FeCl3与KI的反应是可逆反应
【答案】B
【分析】A.根据浓硫酸难挥发进行分析;
B.根据分液漏斗上部连接一根橡胶管,可以平衡压强进行分析;
C.根据滴定管的零刻度在上,读数应该为11.80mL进行分析;
D.根据几滴KI太少进行分析。
【解答】解:A.浓H2SO4难挥发,不会在空气中与挥发的NH3产生白烟现象,故A错误;
B.分液漏斗上部连接一根橡胶管,可以平衡压强,能减小气体体积的测量误差,故B正确;
C.滴定管的零刻度在上,读数应该为11.80mL,故C错误;
D.几滴KI太少,无论是否可逆,均会看到红色溶液,故D错误;
故选:B。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
20.(2024秋 岳阳期末)下列实验能达到相应实验目的的是( )
A B C D
制备氢氧化铁股体 加热Na2CO3和NaHCO3的混合物比较二者的热稳定性 制备Fe(OH)2能较长时间观察颜色 除去CO2中的少量HCl
A.A B.B C.C D.D
【答案】C
【分析】A.氯化铁和NaOH反应生成Fe(OH)3沉淀;
B.应该分别加热NaHCO3、Na2CO3固体比较二者的热稳定性;
C.煤油能隔绝空气;
D.CO2、HCl都能和NaOH溶液反应。
【解答】解:A.氯化铁和NaOH反应生成Fe(OH)3沉淀,应该将饱和氯化铁溶液滴入沸水中制备氢氧化铁胶体,故A错误;
B.应该分别加热NaHCO3、Na2CO3固体比较二者的热稳定性,否则无法判断是哪种物质分解的,故B错误;
C.煤油能隔绝空气,防止生成的氢氧化亚铁被氧化,故C正确;
D.CO2、HCl都能和NaOH溶液反应,应该用饱和碳酸氢钠溶液除去CO2中的HCl,故D错误;
故选:C。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质是解本题关键,题目难度不大。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
高考化学考前冲刺押题预测 化学实验方案的评价
一.选择题(共20小题)
1.(2025 山东开学)下列装置或操作正确且能达到相应实验目的的是( )
A.在Fe表面镀Cu B.分离含泥沙的粗盐水
C.探究铁的析氢腐蚀 D.用盐酸反萃取溴的苯溶液中的溴
2.(2025 陕西一模)下列实验装置(部分夹持装置略)或操作能够达到实验目的的是( )
A.在HCl气流中进行图甲操作,可制取无水MgCl2
B.图乙操作可对氨气进行尾气吸收
C.图丙操作可验证非金属性:Cl>C>Si
D.图丁操作可检验Na2SO3溶液是否变质
3.(2025 四川模拟)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向Na2CO3溶液中滴加稀硫酸,反应产生的气体直接通入Na2SiO3溶液中,观察现象 非金属性:C>Si
B 向K2CrO4溶液中缓慢滴加少量浓硫酸,观察溶液颜色的变化 溶液中存在平衡:(橙)+H2O (黄)+2H+
C 将NaClO溶液分别滴入品红溶液和滴加醋酸的品红溶液中,观察品红溶液颜色变化 pH对ClO﹣氧化性的影响
D 用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH Ka1(H2S)>Ka(HCN)
A.A B.B C.C D.D
4.(2025 昆明一模)下列实验操作、现象和结论都正确的是( )
A.向淀粉的水解产物中加碘水,溶液变蓝则证明淀粉没有水解完全
B.向K2CrO4溶液中加入稀盐酸,溶液变为橙色,证明K2CrO4具有强氧化性
C.向某溶液中加入稀盐酸,有白色沉淀生成,继续滴加沉淀不消失,证明溶液中存在
D.向铁和水蒸气反应后的固体中先加稀硫酸,再加KSCN溶液,溶液不变红,证明固体中没有Fe3O4
5.(2025 河北模拟)关于化学实验的下列说法,错误的是( )
A.苯酚沾到皮肤上时,立即用乙醇冲洗,再用水冲洗
B.屠呦呦用乙醚提取青蒿素采用了萃取的原理
C.某溶液中滴加AgNO3溶液时生成白色沉淀,则该溶液中含有Cl﹣
D.用NaOH标准溶液滴定盐酸,以酚酞试液做指示剂,终点时溶液变为粉红色
6.(2025 河北模拟)依据下列实验操作和现象能得出相应结论的是( )
实验操作 实验现象 实验结论
A 向Na2SO3粉末中滴加盐酸 产生使品红溶液褪色的气体 非金属性:S<Cl
B 将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水 溶液不变蓝 淀粉已经完全水解
C 向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液 酸性KMnO4溶液的紫色褪去 2﹣甲基苯甲醛中含有醛基
D 向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,振荡,然后滴加2滴KI溶液 先生成白色沉淀,后生成黄色沉淀 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
7.(2025 湖北模拟)下列实验操作和现象能得出相应结论的是( )
实验操作和现象 结论
A 室温下,分别测定0.1mol L﹣1的CH3COONa和NH4Cl溶液的pH,两者pH之和等于14 相同浓度的和的水解能力几乎相同
B 向Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成白色沉淀 与发生了双水解
C 向蔗糖溶液中滴加稀硫酸并水浴加热,再加入新制的氢氧化铜悬浊液,无砖红色沉淀生成 蔗糖未水解
D 向酸性KMnO4溶液中滴加FeCl2溶液,观察到溶液紫红色褪去 的氧化性强于Fe3+
A.A B.B C.C D.D
8.(2025 九江模拟)实验探究对于提高化学学科素养起到了非常关键的作用。下列方案设计、现象和结论均正确的是( )
实验目的 设计方案 现象和结论
A 判断淀粉的水解程度 在一支试管中加入1mL淀粉溶液和2mL10%稀硫酸,加热煮沸。再加入10%NaOH溶液至溶液呈碱性,再加入几滴新制的银氨溶液,水浴加热 产生银镜,不能说明淀粉已水解完全
B 探究压强对化学平衡的影响 向针筒中充入50mLHI(g),分解达到平衡后再压缩针筒内气体 气体颜色变深;增大压强,平衡正向移动
C 探究浓硝酸与炭在加热条件下能否反应 将红热的木炭投入浓硝酸中 产生红棕色气体;炭与浓硝酸在加热条件下反应生成NO2
D 探究Mg(OH)2、Fe(OH)3的溶解度的大小 向2mL1mol/LNaOH溶液中依次滴加0.1mol/L的MgCl2和FeCl3溶液各1mL 先产生白色沉淀,后产生红褐色沉淀,溶解度Mg(OH)2大于Fe(OH)3
A.A B.B C.C D.D
9.(2025 湖北模拟)下列实验装置不能达到实验目的的是( )
A.检验乙醇消去反应的产物
B.验证铁的吸氧腐蚀
C.制取并收集氨
D.制备明矾晶体
10.(2024秋 丰台区期末)下列实验装置不能达到实验目的的是( )
A.除去Cl2中少量HCl B.从NaCl溶液获得NaCl晶体
C.验证Cl2能与水反应 D.制备Fe(OH)2
A.A B.B C.C D.D
11.(2024秋 秦淮区校级期末)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向两支分别盛有2mL苯和2mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
A.A B.B C.C D.D
12.(2024秋 德州期末)下列图示实验中,操作规范且能达到实验目的的是( )
A.制取NaHCO3,从b口通入氨气 B.乙烯除杂
C.分离CH2Cl2和CCl4 D.用该装置制备无水MgCl2
A.A B.B C.C D.D
13.(2024秋 西城区期末)下列实验能达到实验目的的是( )
A B C D
验证Na2O2与水反应生成O2 比较Cl2、Br2、I2的氧化性 除去CO2中的少量HCl 制取纯净的Fe(OH)2沉淀
A.A B.B C.C D.D
14.(2024秋 连云港期末)室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
D 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
A.A B.B C.C D.D
15.(2024秋 重庆期末)下列实验原理、分析或结论正确的是( )
A.25℃时,向稀醋酸中加入少量醋酸钠固体,醋酸的电离程度增大
B.25℃时,2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和,溶液pH<7
C.向NaCl溶液中先通入CO2至饱和,再通入NH3可析出NaHCO3固体
D.0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)=c(I﹣)
16.(2024秋 重庆期末)下列各图所示装置及操作正确且能达到实验目的的是( )
A.用NaOH标准溶液测定盐酸浓度
B.用pH试纸测定盐酸的pH
C.中和反应反应热的测定
D.蒸干MgCl2溶液制取无水MgCl2
17.(2025 湖南开学)为达到对应的实验目的,下列实验设计或操作合理的是( )
选项 实验目的 实验设计或操作
A 证明氧化性:H2O2比Fe3+强 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,振荡
B 提纯含有少量氯化钠和泥沙的苯甲酸 加热溶解,趁热过滤,冷却结晶,过滤洗涤
C 检验CH2=CHCHO是否含有碳碳双键 向适量的CH2=CHCHO溶液中加入过量的银氨溶液,再加入少量溴水、振荡
D 检验Cu与浓硫酸的反应后出现的白色固体是否为CuSO4 直接向盛有反应液的试管中加入适量水,振荡
A.A B.B C.C D.D
18.(2025 广东开学)下列实验操作和现象,得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加几滴浓盐酸 盛NiO(OH)的试管中产生黄绿色气体 氧化性:NiO(OH)>Fe(OH)3
B 向CuSO4溶液中通入H2S气体 出现黑色沉淀(CuS) 酸性:H2S<H2SO4
C 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 溴水褪色 乙醇发生消去反应生成乙烯,乙烯与溴水发生加成反应
D 向Na2HPO4溶液中滴加AgNO3溶液 出现黄色沉淀(Ag3PO4) Na2HPO4发生了水解反应
A.A B.B C.C D.D
19.(2025 湖南模拟)下列实验装置及现象正确的是( )
A.图甲:浓氨水与浓硫酸反应
B.图乙:测量锌与稀硫酸反应的反应速率
C.图丙:滴定结束时的刻度,读数为12.20mL
D.图丁:验证FeCl3与KI的反应是可逆反应
20.(2024秋 岳阳期末)下列实验能达到相应实验目的的是( )
A B C D
制备氢氧化铁股体 加热Na2CO3和NaHCO3的混合物比较二者的热稳定性 制备Fe(OH)2能较长时间观察颜色 除去CO2中的少量HCl
A.A B.B C.C D.D
高考化学考前冲刺押题预测 化学实验方案的评价
参考答案与试题解析
一.选择题(共20小题)
1.(2025 山东开学)下列装置或操作正确且能达到相应实验目的的是( )
A.在Fe表面镀Cu
B.分离含泥沙的粗盐水
C.探究铁的析氢腐蚀
D.用盐酸反萃取溴的苯溶液中的溴
【答案】A
【分析】A.在Fe表面镀Cu,Cu与电源正极相连作阳极,阴极上铜离子得到电子生成Cu;
B.过滤时漏斗下端应紧靠烧杯内壁;
C.弱酸性溶液中,Fe发生吸氧腐蚀;
D.溴不易溶于盐酸,易溶于苯。
【解答】解:A.在Fe表面镀Cu,Cu与电源正极相连作阳极,阴极上铜离子得到电子生成Cu,可实现镀铜,故A正确;
B.过滤时漏斗下端应紧靠烧杯内壁,防止液滴飞溅,故B错误;
C.弱酸性溶液中,Fe发生吸氧腐蚀,酸性溶液中Fe发生析氢腐蚀,故C错误;
D.溴不易溶于盐酸,易溶于苯,则加盐酸不能反萃取苯溶液中的溴,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物的分离提纯、电化学、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
2.(2025 陕西一模)下列实验装置(部分夹持装置略)或操作能够达到实验目的的是( )
A.在HCl气流中进行图甲操作,可制取无水MgCl2
B.图乙操作可对氨气进行尾气吸收
C.图丙操作可验证非金属性:Cl>C>Si
D.图丁操作可检验Na2SO3溶液是否变质
【答案】A
【分析】A.根据MgCl2 6H2O在加热过程中容易水解,进行分析;
B.根据氨气直接通入水中,起不到防倒吸的作用进行分析;
C.根据浓盐酸与碳酸钠反应生成CO2,CO2和硅酸钠反应生成不溶性硅酸,进行分析;
D.根据硝酸具有强氧化性,能将亚硫酸根氧化生成硫酸根,进行分析。
【解答】解:A.MgCl2 6H2O在加热过程中容易水解,最终得不到氯化镁,故在HCl氛围中脱水,故A正确;
B.NH3直接通入水中,起不到防倒吸的作用,可以改用四氯化碳,故B错误;
C.浓盐酸与碳酸钠反应生成二氧化碳,通过饱和碳酸氢钠溶液除去二氧化碳中混有的HCl,二氧化碳和硅酸钠反应生成不溶性硅酸,说明酸性:HCl>H2CO3>H2SiO3,但盐酸不是最高价含氧酸,不能说明元素非金属性强弱,故C错误;
D.硝酸具有强氧化性,能将亚硫酸根氧化生成硫酸根,不能说明亚硫酸钠是否变质,故D错误;
故选:A。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
3.(2025 四川模拟)室温下,下列实验探究方案不能达到探究目的的是( )
选项 探究方案 探究目的
A 向Na2CO3溶液中滴加稀硫酸,反应产生的气体直接通入Na2SiO3溶液中,观察现象 非金属性:C>Si
B 向K2CrO4溶液中缓慢滴加少量浓硫酸,观察溶液颜色的变化 溶液中存在平衡:(橙)+H2O (黄)+2H+
C 将NaClO溶液分别滴入品红溶液和滴加醋酸的品红溶液中,观察品红溶液颜色变化 pH对ClO﹣氧化性的影响
D 用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH Ka1(H2S)>Ka(HCN)
A.A B.B C.C D.D
【答案】D
【分析】A.根据最高价含氧酸的酸性越强则对于元素的非金属性越强,进行分析;
B.根据K2CrO4溶液中存在平衡(橙)+H2O (黄)+2H+,进行分析;
C.根据次氯酸钠和醋酸反应生成次氯酸,进行分析;
D.根据NaCN和Na2S均为强碱弱酸盐,水解后呈碱性,水解程度越大即pH值越大,进行分析。
【解答】解:A.CO2通入硅酸钠溶液中,溶液变浑浊,说明碳酸的酸性大于硅酸,最高价含氧酸的酸性越强则对于元素的非金属性越强,因此非金属性:C>Si,故A正确;
B.铬酸钾溶液中存在平衡(橙)+H2O (黄)+2H+,滴入少量浓硫酸,考虑的是氢离子浓度增大,平衡逆向移动,则浓度增大,溶液呈现橙色,故B正确;
C.NaClO和醋酸反应生成HClO,品红褪色较快,可知pH对ClO﹣的氧化性的影响,故C正确;
D.NaCN和硫酸钠均为强碱弱酸盐,水解后呈碱性,水解程度越大即pH值越大,水解后产生的酸的酸性越弱,用pH计分别测定浓度均为0.1mol L﹣1的NaCN和Na2S的pH,证明的是Ka2(H2S)和Ka(HCN)相对大小,故D错误;
故选:D。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
4.(2025 昆明一模)下列实验操作、现象和结论都正确的是( )
A.向淀粉的水解产物中加碘水,溶液变蓝则证明淀粉没有水解完全
B.向K2CrO4溶液中加入稀盐酸,溶液变为橙色,证明K2CrO4具有强氧化性
C.向某溶液中加入稀盐酸,有白色沉淀生成,继续滴加沉淀不消失,证明溶液中存在
D.向铁和水蒸气反应后的固体中先加稀硫酸,再加KSCN溶液,溶液不变红,证明固体中没有Fe3O4
【答案】A
【分析】A.根据溶液变蓝说明溶液中含有淀粉,进行分析;
B.根据向铬酸钾溶液中加入稀盐酸发生的反应为铬酸钾溶液与稀盐酸反应生成氯化钾、氯化铬、氯气和水,进行分析;
C.根据溶液中的银离子能与氯离子反应生成不溶于盐酸的氯化银白色沉淀,进行分析;
D.根据四氧化三铁溶于稀硫酸得到的铁离子能与过量的铁反应生成亚铁离子,溶液中的亚铁离子不能与硫氰酸根离子反应,进行分析。
【解答】解:A.向淀粉的水解产物中加碘水,溶液变蓝说明溶液中含有淀粉,淀粉没有水解完全,故A正确;
B.向铬酸钾溶液中加入稀HCl发生的反应为铬酸钾溶液与稀盐酸反应生成KCl、氯化铬、氯气和H2O,氯化铬溶液为紫色,所以反应后溶液不可能为橙色,故B错误;
C.溶液中的Ag+能与Cl﹣反应生成不溶于盐酸的氯化银白色沉淀,则向某溶液中加入稀HCl,有白色沉淀生成,继续滴加沉淀不消失,不能证明溶液中存在硅酸根离子,故C错误;
D.Fe3O4溶于稀硫酸得到的铁离子能与过量的铁反应生成亚铁离子,溶液中的亚铁离子不能与硫氰酸根离子反应,所以向铁和水蒸气反应后的固体中先加稀H2SO4,再加硫氰化钾溶液,溶液不变红,不能证明固体中没有四氧化三铁,故D错误;
故选:A。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
5.(2025 河北模拟)关于化学实验的下列说法,错误的是( )
A.苯酚沾到皮肤上时,立即用乙醇冲洗,再用水冲洗
B.屠呦呦用乙醚提取青蒿素采用了萃取的原理
C.某溶液中滴加AgNO3溶液时生成白色沉淀,则该溶液中含有Cl﹣
D.用NaOH标准溶液滴定盐酸,以酚酞试液做指示剂,终点时溶液变为粉红色
【答案】C
【分析】A.苯酚易溶于乙醇;
B.利用乙醚萃取从青蒿中提取青蒿素;
C.溶液中含有硫酸根离子、碳酸根离子加入硝酸银后也会生成白色沉淀;
D.以酚酞为指示剂,遇碱溶液变红。
【解答】解:A.由于苯酚易溶于乙醇,不慎沾到皮肤上,为防止对皮肤造成伤害,应立即用乙醇冲洗,再用水冲洗,故A正确;
B.乙醚从青蒿中提取青蒿素,利用的是萃取的原理,故B正确;
C.溶液中含有硫酸根离子、碳酸根离子加入硝酸银后也会生成白色沉淀,不能说明溶液中含有Cl﹣,故C错误;
D.用NaOH标准溶液滴定盐酸,由于酚酞遇碱溶液变红,用酚酞作指示剂,滴定终点时,溶液颜色由无色变为粉红色,故D正确;
故选:C。
【点评】本题考查实验方案的设计,侧重考查学生基础知识的掌握情况,试题难度中等。
6.(2025 河北模拟)依据下列实验操作和现象能得出相应结论的是( )
实验操作 实验现象 实验结论
A 向Na2SO3粉末中滴加盐酸 产生使品红溶液褪色的气体 非金属性:S<Cl
B 将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水 溶液不变蓝 淀粉已经完全水解
C 向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液 酸性KMnO4溶液的紫色褪去 2﹣甲基苯甲醛中含有醛基
D 向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,振荡,然后滴加2滴KI溶液 先生成白色沉淀,后生成黄色沉淀 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
【答案】B
【分析】A.元素的非金属性越强,最高价含氧酸的酸性越强;
B.将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水,溶液不变蓝,说明溶液中已经没有淀粉;
C.苯环上的甲基也可能被酸性高锰酸钾溶液氧化为—COOH而导致溶液褪色,向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液,酸性KMnO4溶液的紫色褪去;
D.向盛有2mL0.1mol L﹣1AgNO3溶液的试管中滴加2滴NaCl溶液,生成AgCl白色沉淀,Ag+是过量的,振荡,然后滴加2滴KI溶液,生成AgI黄色沉淀,不能说明AgI是由AgCl转化过来的。
【解答】解:A.元素的非金属性越强,最高价含氧酸的酸性越强;向Na2SO3粉末中滴加盐酸,产生使品红溶液褪色的气体,该气体为SO2,说明HCl的酸性强于H2SO3,HCl、H2SO3均不是Cl、S的最高价含氧酸,不能通过酸性比较S、Cl的非金属性强弱,故A错误;
B.将淀粉溶液和硫酸混合并加热5min,冷却后取样于试管中,滴加少量碘水,溶液不变蓝,说明溶液中已经没有淀粉,说明淀粉已经完全水解,故B正确;
C.苯环上的甲基也可能被酸性高锰酸钾溶液氧化为—COOH而导致溶液褪色,向2﹣甲基苯甲醛中滴加少量酸性KMnO4溶液,酸性KMnO4溶液的紫色褪去,不能说明2﹣甲基苯甲醛中含有醛基,故C错误;
D.不能说明AgI是由AgCl转化过来的,不能说明Ksp(AgCl)>Ksp(AgI),故D错误;
故选:B。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
7.(2025 湖北模拟)下列实验操作和现象能得出相应结论的是( )
实验操作和现象 结论
A 室温下,分别测定0.1mol L﹣1的CH3COONa和NH4Cl溶液的pH,两者pH之和等于14 相同浓度的和的水解能力几乎相同
B 向Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成白色沉淀 与发生了双水解
C 向蔗糖溶液中滴加稀硫酸并水浴加热,再加入新制的氢氧化铜悬浊液,无砖红色沉淀生成 蔗糖未水解
D 向酸性KMnO4溶液中滴加FeCl2溶液,观察到溶液紫红色褪去 的氧化性强于Fe3+
A.A B.B C.C D.D
【答案】A
【分析】A.CH3COONa溶液水解显碱性,NH4Cl溶液水解显酸性;
B.Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成氢氧化铝沉淀、碳酸钠;
C.蔗糖水解后,在碱性溶液中检验葡萄糖;
D.亚铁离子、氯离子均可被酸性高锰酸钾溶液氧化。
【解答】解:A.CH3COONa溶液水解显碱性,NH4Cl溶液水解显酸性,等浓度时两者pH之和等于14,可知相同浓度的和的水解能力几乎相同,故A正确;
B.Na[Al(OH)4]溶液中滴加NaHCO3溶液,生成氢氧化铝沉淀、碳酸钠,则碳酸氢根离子的电离被促进,与水解无关,故B错误;
C.蔗糖水解后,没有加NaOH中和硫酸,不能检验葡萄糖,则不能证明蔗糖未水解,故C错误;
D.亚铁离子、氯离子均可被酸性高锰酸钾溶液氧化,紫色褪去,不能证明的氧化性强于Fe3+,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、盐类水解、物质的检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
8.(2025 九江模拟)实验探究对于提高化学学科素养起到了非常关键的作用。下列方案设计、现象和结论均正确的是( )
实验目的 设计方案 现象和结论
A 判断淀粉的水解程度 在一支试管中加入1mL淀粉溶液和2mL10%稀硫酸,加热煮沸。再加入10%NaOH溶液至溶液呈碱性,再加入几滴新制的银氨溶液,水浴加热 产生银镜,不能说明淀粉已水解完全
B 探究压强对化学平衡的影响 向针筒中充入50mLHI(g),分解达到平衡后再压缩针筒内气体 气体颜色变深;增大压强,平衡正向移动
C 探究浓硝酸与炭在加热条件下能否反应 将红热的木炭投入浓硝酸中 产生红棕色气体;炭与浓硝酸在加热条件下反应生成NO2
D 探究Mg(OH)2、Fe(OH)3的溶解度的大小 向2mL1mol/LNaOH溶液中依次滴加0.1mol/L的MgCl2和FeCl3溶液各1mL 先产生白色沉淀,后产生红褐色沉淀,溶解度Mg(OH)2大于Fe(OH)3
A.A B.B C.C D.D
【答案】A
【分析】A.需要向水解液中加碘水检验淀粉;
B.2HI(g) H2(g)+I2(g)为气体总物质的量不变的反应;
C.可能浓硝酸受热分解生成二氧化氮;
D.2mL1mol/LNaOH溶液中滴加0.1mol/L的MgCl2溶液1mL,产生白色沉淀后,溶液中有NaOH剩余。
【解答】解:A.需要向水解液中加碘水检验淀粉,只检验葡萄糖,没有检验淀粉,不能证明淀粉水解完全,故A正确;
B.2HI(g) H2(g)+I2(g)为气体总物质的量不变的反应,则压缩体积,各物质浓度均增大,气体颜色加深,平衡不移动,故B错误;
C.产生红棕色的气体NO2,可能由木炭与浓硝酸反应产生,也可能由浓硝酸自身分解产生,故C错误;
D.2mL1mol/LNaOH溶液中滴加0.1mol/L的MgCl2溶液1mL,产生白色沉淀后,溶液中有NaOH剩余,剩余的NaOH与氯化铁溶液反应生成红褐色沉淀,不能探究Mg(OH)2与Fe(OH)2的溶解度的大小,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、物质的检验、化学平衡、难溶电解质、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
9.(2025 湖北模拟)下列实验装置不能达到实验目的的是( )
A.检验乙醇消去反应的产物
B.验证铁的吸氧腐蚀
C.制取并收集氨
D.制备明矾晶体
【答案】A
【分析】A.乙烯中可能混有二氧化硫;
B.食盐水为中性,Fe发生吸氧腐蚀;
C.浓氨水与生石灰混合可制备氨气,氨气的密度比空气密度小;
D.轻触木棍,以结晶核为中心,可缓慢结晶。
【解答】解:A.乙烯中可能混有二氧化硫,均使溴水褪色,则不能证明生成乙烯,故A错误;
B.食盐水为中性,Fe发生吸氧腐蚀,水沿导管上升可证明,故B正确;
C.浓氨水与生石灰混合可制备氨气,氨气的密度比空气密度小,可选图中向下排空气法收集,故C正确;
D.轻触木棍,以结晶核为中心,可缓慢结晶,可制备明矾晶体,故D正确;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备及检验、电化学、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
10.(2024秋 丰台区期末)下列实验装置不能达到实验目的的是( )
A.除去Cl2中少量HCl B.从NaCl溶液获得NaCl晶体
C.验证Cl2能与水反应 D.制备Fe(OH)2
A.A B.B C.C D.D
【答案】D
【分析】A.根据氯化氢极易溶于水,氯气难溶于饱和食盐水,进行分析;
B.根据氯化钠性质稳定进行分析;
C.根据Cl2本身没有漂白性进行分析;
D.根据氢氧化亚铁易被空气中的氧气氧化进行分析。
【解答】解:A.HCl极易溶于水,Cl2难溶于饱和食盐水,饱和食盐水可除去Cl2中少量HCl,故A正确;
B.NaCl性质稳定,可通过蒸发结晶从NaCl溶液获得NaCl晶体,故B正确;
C.氯气本身没有漂白性,故红色干布条不会褪色,Cl2与H2O反应生成的HClO有强氧化性,Cl2+H2O HCl+HClO,可以漂白红色布条,故湿润的红色布条褪色,可验证Cl2能与水反应,故C正确;
D.氢氧化亚铁易被空气中的氧气氧化,制备氢氧化亚铁应在无氧环境中进行,本实验不能制备Fe(OH)2,故D错误;
故选:D。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
11.(2024秋 秦淮区校级期末)室温下,下列实验方案不能达到探究目的的是( )
选项 实验方案 探究目的
A 向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,观察溶液颜色变化 探究I2与Fe3+氧化性强弱
B 用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH 探究键的极性对羧酸酸性的影响
C 向两支分别盛有2mL苯和2mL甲苯的试管中各加入几滴酸性高锰酸钾溶液,用力振荡,观察现象 探究有机物中基团间的相互作用
D 向MgCl2溶液中先加入少量氢氧化钠溶液,充分反应后再加入少量CuSO4溶液,观察沉淀颜色的变化 探究Cu(OH)2与Mg(OH)2溶度积的大小
A.A B.B C.C D.D
【答案】A
【分析】A.向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,在酸性溶液中,氧化性强弱为:Fe3+>I2;
B.通过用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH大小的不同(前者大于后者),即酸性前者小于后者;
C.苯不能使酸性高锰酸钾溶液褪色,而甲苯可以使酸性高锰酸钾溶液褪色;
D.向MgCl2溶液中先加入少量氢氧化钠溶液,先生成白色沉淀,充分反应后再加入少量CuSO4溶液,沉淀颜色变成蓝色。
【解答】解:A.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,向Fe(NO3)3溶液中滴入淀粉,再滴加HI溶液,在酸性溶液中,氧化性强弱为:Fe3+>I2,故而是氧化了I﹣而生成I2,故而不能达到探究目的,故A错误;
B.通过用pH计分别测定等物质的量浓度的CH3COOH溶液和CCl3COOH溶液的pH大小的不同(前者大于后者),即酸性前者小于后者,故而能探究键的极性对羧酸酸性的影响,故B正确;
C.苯不能使酸性高锰酸钾溶液褪色,而甲苯可以使酸性高锰酸钾溶液褪色,说明有机物中基团间存在相互作用,故C正确;
D.向MgCl2溶液中先加入少量氢氧化钠溶液,先生成白色沉淀,充分反应后再加入少量CuSO4溶液,沉淀颜色变成蓝色,发生沉淀的转化,故而能探究Cu(OH)2与Mg(OH)2溶度积的大小,故D正确;
故选:A。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
12.(2024秋 德州期末)下列图示实验中,操作规范且能达到实验目的的是( )
A.制取NaHCO3,从b口通入氨气 B.乙烯除杂
C.分离CH2Cl2和CCl4 D.用该装置制备无水MgCl2
A.A B.B C.C D.D
【答案】D
【分析】A.氨气极易溶于水;
B.乙烯能被酸性高锰酸钾氧化;
C.蒸馏时温度计液泡应该在蒸馏烧瓶支管口处;
D.MgCl2易水解。
【解答】解:A.制取NaHCO3,氨气极易溶于水,为防止倒吸,应该从a口通入氨气,故A错误;
B.乙烯能被酸性高锰酸钾氧化,不能用酸性高锰酸钾除乙烯中的二氧化硫,故B错误;
C.蒸馏时温度计液泡应该在蒸馏烧瓶支管口处,用蒸馏法分离CH2Cl2和CCl4,温度计液泡应该在蒸馏烧瓶支管口处,故C错误;
D.为防止MgCl2水解,在氯化氢气流中加热氯化镁晶体制备无水MgCl2,故D正确;
故选:D。
【点评】本题考查实验方案的设计,侧重考查学生无机实验的掌握情况,试题难度中等。
13.(2024秋 西城区期末)下列实验能达到实验目的的是( )
A B C D
验证Na2O2与水反应生成O2 比较Cl2、Br2、I2的氧化性 除去CO2中的少量HCl 制取纯净的Fe(OH)2沉淀
A.A B.B C.C D.D
【答案】A
【分析】A.O2能使带火星的木条复燃;
B.过量的氯气能氧化I﹣;
C.CO2、HCl都能和NaOH溶液反应;
D.Fe(OH)2不稳定,易被空气氧化。
【解答】解:A.O2能使带火星的木条复燃,根据带火星的木条是否复燃来验证Na2O2与水反应是否生成O2,故A正确;
B.过量的氯气能氧化I﹣,干扰Br2氧化I﹣,所以不能实现实验目的,故B错误;
C.CO2、HCl都能和NaOH溶液反应,应该用饱和的NaHCO3溶液除去CO2中的HCl,故C错误;
D.Fe(OH)2不稳定,易被空气氧化,为隔绝空气,应该将胶头滴管伸入液面下,故D错误;
故选:A。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质、实验操作规范性是解本题关键,题目难度不大。
14.(2024秋 连云港期末)室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 往某溶液中加入盐酸产生无色气体 该溶液一定含有
B 将湿润的有色布条放入干燥的氯气,布条褪色 氯气具有漂白性
C 向蔗糖中滴加几滴蒸馏水,再加入浓硫酸,产生海绵状黑色物质,并产生刺激性气味气体 浓硫酸体现了吸水性、脱水性和强氧化性
D 用洁净的铂丝蘸取某溶液灼烧,火焰呈黄色 溶液中不含钾元素
A.A B.B C.C D.D
【答案】C
【分析】A.该无色气体可能是SO2、CO2或H2S等,且碳酸盐、碳酸氢盐都能和稀盐酸反应生成CO2;
B.氯气没有漂白性,HClO具有漂白性;
C.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化硫具有刺激性气味;
D.K元素的焰色试验必须透过蓝色的钴玻璃观察。
【解答】解:A.该无色气体可能是SO2、CO2或H2S等,且碳酸盐、碳酸氢盐都能和稀盐酸反应生成CO2,根据实验现象无法判断溶液中是否含有碳酸根离子,故A错误;
B.氯气没有漂白性,HClO具有漂白性,氯气和水反应生成的HClO使有色布条褪色,故B错误;
C.浓硫酸使蔗糖脱水后,C与浓硫酸发生氧化还原反应生成二氧化硫,由实验操作和现象可知,浓硫酸体现了吸水性、脱水性和强氧化性,故C正确;
D.K元素的焰色试验必须透过蓝色的钴玻璃观察,实验中没有透过蓝色的钴玻璃观察,所以无法判断是否含有钾元素,故D错误;
故选:C。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质是解本题关键,题目难度不大。
15.(2024秋 重庆期末)下列实验原理、分析或结论正确的是( )
A.25℃时,向稀醋酸中加入少量醋酸钠固体,醋酸的电离程度增大
B.25℃时,2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和,溶液pH<7
C.向NaCl溶液中先通入CO2至饱和,再通入NH3可析出NaHCO3固体
D.0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)=c(I﹣)
【答案】B
【分析】A.醋酸钠电离出醋酸根离子,抑制醋酸的电离;
B.2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和生成醋酸铵;
C.二氧化碳在水中溶解度不大;
D.AgI比AgCl更难溶。
【解答】解:A.醋酸钠电离出醋酸根离子,抑制醋酸的电离,则醋酸的电离程度减小,故A错误;
B.2mL浓度均为0.1mol/L的硝酸与氨水混合,恰好中和生成醋酸铵,水解显酸性,则溶液pH<7,故B正确;
C.二氧化碳在水中溶解度不大,应向饱和食盐水中先通入氨气,再通入二氧化碳可析出NaHCO3固体,故C错误;
D.AgI比AgCl更难溶,则0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl﹣)>c(I﹣),故D错误;
故选:B。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、盐类水解、难溶电解质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
16.(2024秋 重庆期末)下列各图所示装置及操作正确且能达到实验目的的是( )
A.用NaOH标准溶液测定盐酸浓度
B.用pH试纸测定盐酸的pH
C.中和反应反应热的测定
D.蒸干MgCl2溶液制取无水MgCl2
【答案】C
【分析】A.NaOH溶液与玻璃中二氧化硅反应生成具有粘合性的硅酸钠;
B.pH试纸不能湿润;
C.图中保温好,温度计测定温度;
D.蒸发促进镁离子的水解,且生成的盐酸易挥发。
【解答】解:A.NaOH溶液与玻璃中二氧化硅反应生成具有粘合性的硅酸钠,应将图中酸式滴定管改为碱式滴定管,故A错误;
B.pH试纸不能湿润,应选干燥的pH试纸测定,故B错误;
C.图中保温好,温度计测定温度,可测定中和热,故C正确;
D.蒸发促进镁离子的水解,且生成的盐酸易挥发,应在HCl气流中蒸发制取无水MgCl2,故D错误;
故选:C。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、盐类水解、中和滴定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
17.(2025 湖南开学)为达到对应的实验目的,下列实验设计或操作合理的是( )
选项 实验目的 实验设计或操作
A 证明氧化性:H2O2比Fe3+强 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,振荡
B 提纯含有少量氯化钠和泥沙的苯甲酸 加热溶解,趁热过滤,冷却结晶,过滤洗涤
C 检验CH2=CHCHO是否含有碳碳双键 向适量的CH2=CHCHO溶液中加入过量的银氨溶液,再加入少量溴水、振荡
D 检验Cu与浓硫酸的反应后出现的白色固体是否为CuSO4 直接向盛有反应液的试管中加入适量水,振荡
A.A B.B C.C D.D
【答案】B
【分析】A.酸性溶液中可氧化Fe2+,干扰H2O2氧化Fe2+;
B.苯甲酸的溶解度随温度变化大,分离难溶性固体和溶液采用过滤的方法;
C.银氨溶液具有碱性,能和溴水反应;
D.试管中含有浓硫酸,浓硫酸稀释时,应该将浓硫酸倒入水中。
【解答】解:A.将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液呈酸性,酸性溶液中可氧化Fe2+,则不能判断是否发生H2O2与Fe2+的反应,故A错误;
B.苯甲酸的溶解度随温度变化大,取一定量样品加入适量的水,加热充分溶解,趁热过滤,冷却结晶,过滤,可除去粗苯甲酸样品中少量氯化钠和泥沙,故B正确;
C.银氨溶液呈碱性,过量的银氨溶液能和溴水反应,且该操作没有水浴加热,醛基不能被银氨溶液氧化为羧基,故C错误;
D.试管中含有剩余的浓硫酸,直接加水,容易造成液体飞溅,应该将反应后的溶液倒入水中并不断搅拌,故D错误;
故选:B。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质、实验操作规范性是解本题关键,C、D选项为解答易错点。
18.(2025 广东开学)下列实验操作和现象,得出的相应结论正确的是( )
选项 实验操作 现象 结论
A 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加几滴浓盐酸 盛NiO(OH)的试管中产生黄绿色气体 氧化性:NiO(OH)>Fe(OH)3
B 向CuSO4溶液中通入H2S气体 出现黑色沉淀(CuS) 酸性:H2S<H2SO4
C 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 溴水褪色 乙醇发生消去反应生成乙烯,乙烯与溴水发生加成反应
D 向Na2HPO4溶液中滴加AgNO3溶液 出现黄色沉淀(Ag3PO4) Na2HPO4发生了水解反应
A.A B.B C.C D.D
【答案】A
【分析】A.NiO(OH)与浓盐酸发生氧化还原反应生成氯气,Fe(OH)3与浓盐酸发生中和反应;
B.CuSO4溶液中通入H2S气体,生成CuS沉淀和硫酸;
C.生成的乙烯中可能混有二氧化硫,均与溴水反应;
D.Na2HPO4溶液中滴加AgNO3溶液,生成Ag3PO4沉淀,可知AgNO3溶液促进的电离。
【解答】解:A.NiO(OH)与浓盐酸发生氧化还原反应生成氯气,Fe(OH)3与浓盐酸发生中和反应,可知氧化性:NiO(OH)>Fe(OH)3,故A正确;
B.CuSO4溶液中通入H2S气体,生成CuS沉淀和硫酸,CuS不溶于硫酸,不能比较H2S、H2SO4的酸性强弱,故B错误;
C.生成的乙烯中可能混有二氧化硫,均与溴水反应,则溴水褪色,不能证明乙烯发生了加成反应,故C错误;
D.Na2HPO4溶液中滴加AgNO3溶液,生成Ag3PO4沉淀,可知AgNO3溶液促进的电离,则不能证明发生水解,故D错误;
故选:A。
【点评】本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
19.(2025 湖南模拟)下列实验装置及现象正确的是( )
A.图甲:浓氨水与浓硫酸反应
B.图乙:测量锌与稀硫酸反应的反应速率
C.图丙:滴定结束时的刻度,读数为12.20mL
D.图丁:验证FeCl3与KI的反应是可逆反应
【答案】B
【分析】A.根据浓硫酸难挥发进行分析;
B.根据分液漏斗上部连接一根橡胶管,可以平衡压强进行分析;
C.根据滴定管的零刻度在上,读数应该为11.80mL进行分析;
D.根据几滴KI太少进行分析。
【解答】解:A.浓H2SO4难挥发,不会在空气中与挥发的NH3产生白烟现象,故A错误;
B.分液漏斗上部连接一根橡胶管,可以平衡压强,能减小气体体积的测量误差,故B正确;
C.滴定管的零刻度在上,读数应该为11.80mL,故C错误;
D.几滴KI太少,无论是否可逆,均会看到红色溶液,故D错误;
故选:B。
【点评】本题主要考查化学实验方案的评价等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
20.(2024秋 岳阳期末)下列实验能达到相应实验目的的是( )
A B C D
制备氢氧化铁股体 加热Na2CO3和NaHCO3的混合物比较二者的热稳定性 制备Fe(OH)2能较长时间观察颜色 除去CO2中的少量HCl
A.A B.B C.C D.D
【答案】C
【分析】A.氯化铁和NaOH反应生成Fe(OH)3沉淀;
B.应该分别加热NaHCO3、Na2CO3固体比较二者的热稳定性;
C.煤油能隔绝空气;
D.CO2、HCl都能和NaOH溶液反应。
【解答】解:A.氯化铁和NaOH反应生成Fe(OH)3沉淀,应该将饱和氯化铁溶液滴入沸水中制备氢氧化铁胶体,故A错误;
B.应该分别加热NaHCO3、Na2CO3固体比较二者的热稳定性,否则无法判断是哪种物质分解的,故B错误;
C.煤油能隔绝空气,防止生成的氢氧化亚铁被氧化,故C正确;
D.CO2、HCl都能和NaOH溶液反应,应该用饱和碳酸氢钠溶液除去CO2中的HCl,故D错误;
故选:C。
【点评】本题考查化学实验方案评价,侧重考查分析、判断及知识综合运用能力,明确实验原理、物质的性质是解本题关键,题目难度不大。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
