【高考押题卷】2025年高考化学高频易错考前冲刺 化学反应速率与平衡(含解析)
文档属性
| 名称 | 【高考押题卷】2025年高考化学高频易错考前冲刺 化学反应速率与平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-28 18:13:55 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
高考化学考前冲刺押题预测 化学反应速率与平衡
一.选择题(共20小题)
1.(2025 珠海一模)已知反应R X或R Y,M为中间产物,其反应历程如图。在0℃和40℃下,平衡时产物n(X)/n(Y)分别为70:30和15:85。下列说法正确的是( )
A.稳定性:X>Y
B.两个总反应的决速步不同
C.从0℃升至40℃,反应速率增大程度:v正(X)<v逆(X)
D.从0℃升至40℃c平(X)/c平(R)增大,c平(M)/c平(R)减小
2.(2024秋 九龙坡区期末)1884年勒夏特列提出了平衡移动原理,下列现象或操作不能用该原理解释的是( )
A.接触法制硫酸时,充入适当过量的空气氧化SO2
B.使用铁触媒,使N2和H2混合气体有利于合成氨
C.实验室可用排饱和食盐水溶液的方法收集氯气
D.工业上选择高压条件(10﹣30Mpa)合成氨以提高原料的平衡转化率
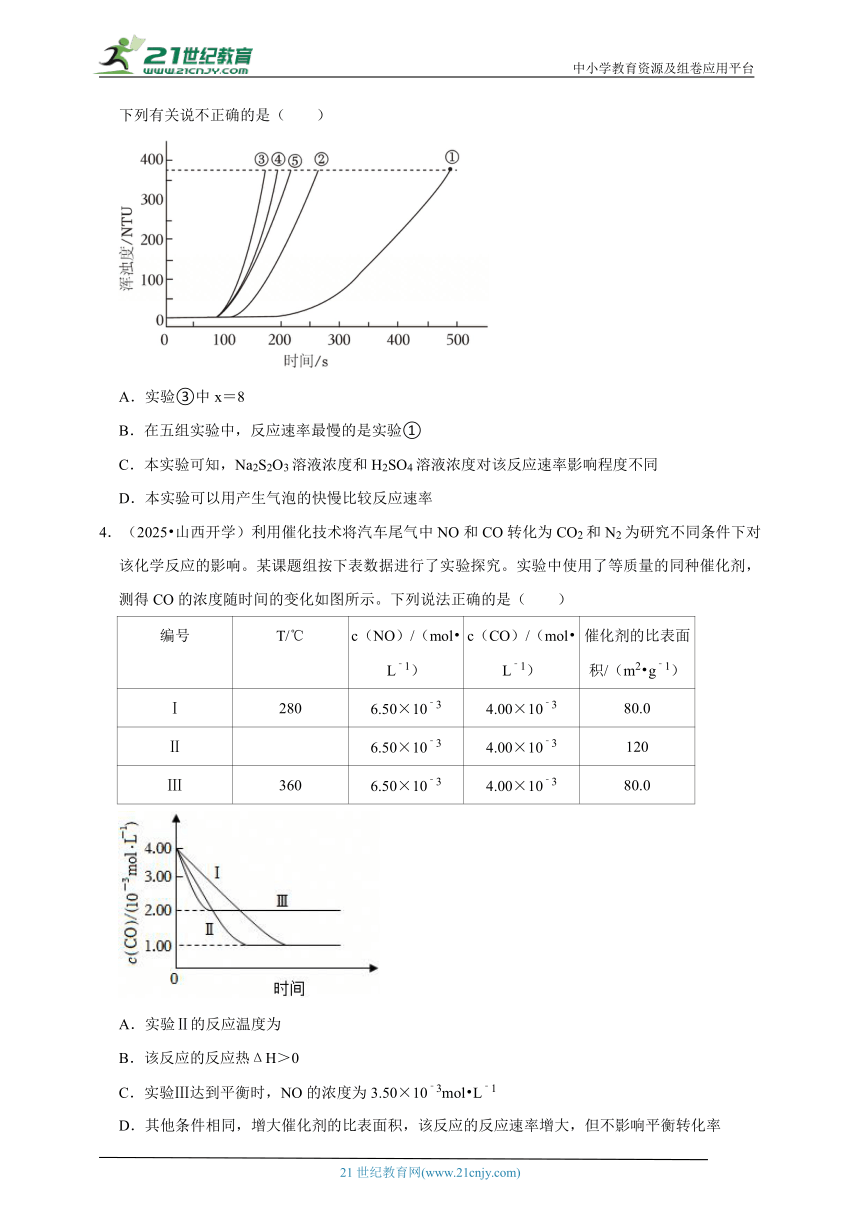
3.(2024秋 温州期末)室温下,用0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液和蒸馏水进行如下表所示的五组实验,分别测量浑浊度随时间的变化。(已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)
编号 Na2S2O3溶液 H2SO4溶液 蒸馏水
V/mL V/mL V/mL
① 1.5 3.5 10
② 2.5 3.5 9
③ 3.5 3.5 X
④ 3.5 2.5 9
⑤ 3.5 1.5 10
下列有关说不正确的是( )
A.实验③中x=8
B.在五组实验中,反应速率最慢的是实验①
C.本实验可知,Na2S2O3溶液浓度和H2SO4溶液浓度对该反应速率影响程度不同
D.本实验可以用产生气泡的快慢比较反应速率
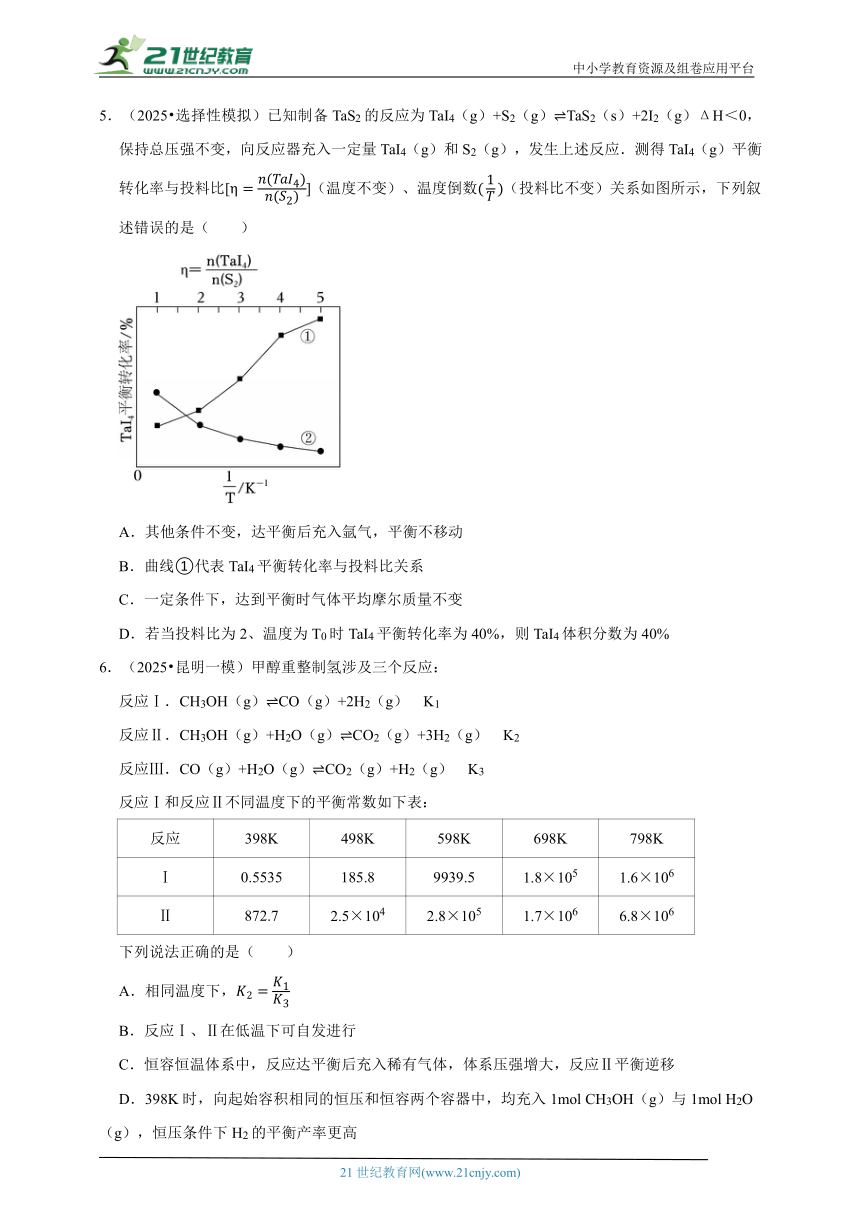
4.(2025 山西开学)利用催化技术将汽车尾气中NO和CO转化为CO2和N2为研究不同条件下对该化学反应的影响。某课题组按下表数据进行了实验探究。实验中使用了等质量的同种催化剂,测得CO的浓度随时间的变化如图所示。下列说法正确的是( )
编号 T/℃ c(NO)/(mol L﹣1) c(CO)/(mol L﹣1) 催化剂的比表面积/(m2 g﹣1)
Ⅰ 280 6.50×10﹣3 4.00×10﹣3 80.0
Ⅱ 6.50×10﹣3 4.00×10﹣3 120
Ⅲ 360 6.50×10﹣3 4.00×10﹣3 80.0
A.实验Ⅱ的反应温度为
B.该反应的反应热ΔH>0
C.实验Ⅲ达到平衡时,NO的浓度为3.50×10﹣3mol L﹣1
D.其他条件相同,增大催化剂的比表面积,该反应的反应速率增大,但不影响平衡转化率
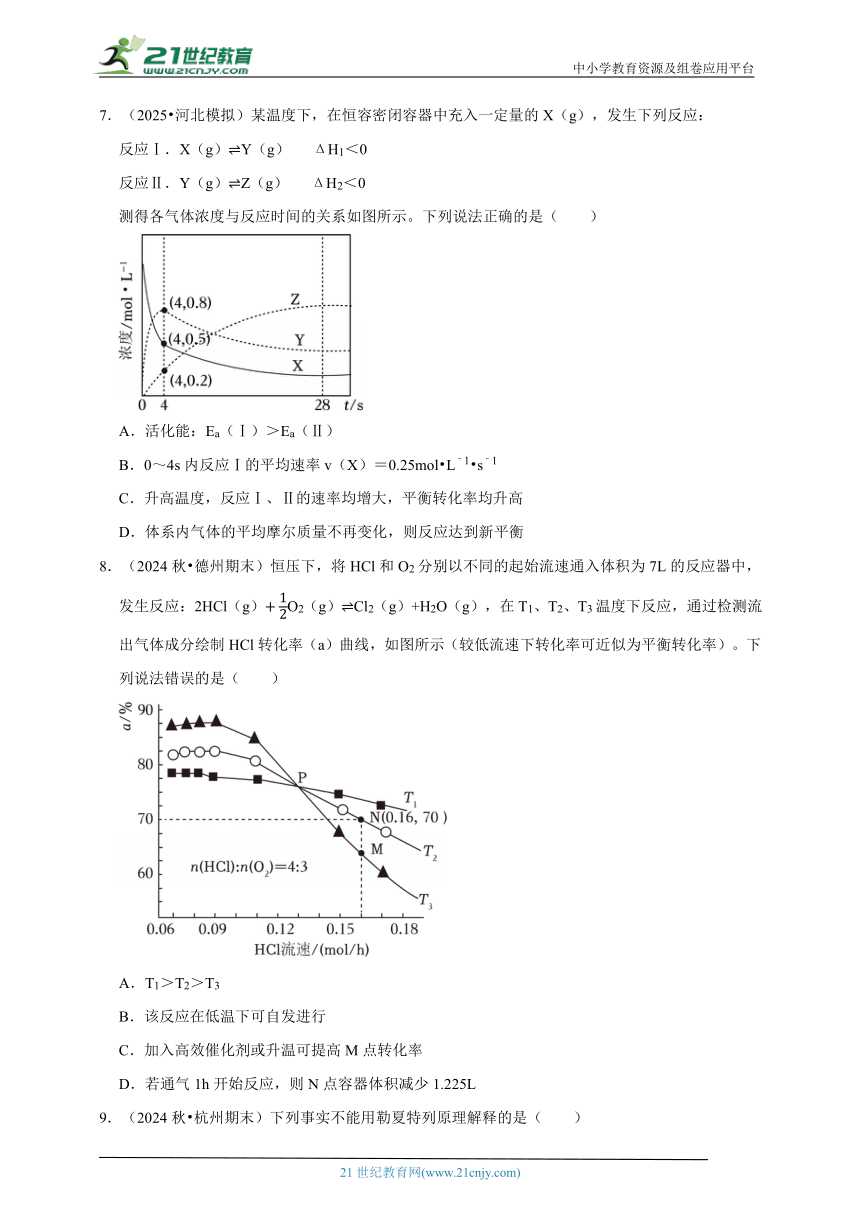
5.(2025 选择性模拟)已知制备TaS2的反应为TaI4(g)+S2(g) TaS2(s)+2I2(g)ΔH<0,保持总压强不变,向反应器充入一定量TaI4(g)和S2(g),发生上述反应.测得TaI4(g)平衡转化率与投料比[](温度不变)、温度倒数(投料比不变)关系如图所示,下列叙述错误的是( )
A.其他条件不变,达平衡后充入氩气,平衡不移动
B.曲线①代表TaI4平衡转化率与投料比关系
C.一定条件下,达到平衡时气体平均摩尔质量不变
D.若当投料比为2、温度为T0时TaI4平衡转化率为40%,则TaI4体积分数为40%
6.(2025 昆明一模)甲醇重整制氢涉及三个反应:
反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1
反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2
反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3
反应Ⅰ和反应Ⅱ不同温度下的平衡常数如下表:
反应 398K 498K 598K 698K 798K
Ⅰ 0.5535 185.8 9939.5 1.8×105 1.6×106
Ⅱ 872.7 2.5×104 2.8×105 1.7×106 6.8×106
下列说法正确的是( )
A.相同温度下,
B.反应Ⅰ、Ⅱ在低温下可自发进行
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,反应Ⅱ平衡逆移
D.398K时,向起始容积相同的恒压和恒容两个容器中,均充入1mol CH3OH(g)与1mol H2O(g),恒压条件下H2的平衡产率更高
7.(2025 河北模拟)某温度下,在恒容密闭容器中充入一定量的X(g),发生下列反应:
反应Ⅰ.X(g) Y(g) ΔH1<0
反应Ⅱ.Y(g) Z(g) ΔH2<0
测得各气体浓度与反应时间的关系如图所示。下列说法正确的是( )
A.活化能:Ea(Ⅰ)>Ea(Ⅱ)
B.0~4s内反应Ⅰ的平均速率v(X)=0.25mol L﹣1 s﹣1
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,平衡转化率均升高
D.体系内气体的平均摩尔质量不再变化,则反应达到新平衡
8.(2024秋 德州期末)恒压下,将HCl和O2分别以不同的起始流速通入体积为7L的反应器中,发生反应:2HCl(g)O2(g) Cl2(g)+H2O(g),在T1、T2、T3温度下反应,通过检测流出气体成分绘制HCl转化率(a)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。下列说法错误的是( )
A.T1>T2>T3
B.该反应在低温下可自发进行
C.加入高效催化剂或升温可提高M点转化率
D.若通气1h开始反应,则N点容器体积减少1.225L
9.(2024秋 杭州期末)下列事实不能用勒夏特列原理解释的是( )
A.甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色
B.由NO2和N2O4组成的平衡体系:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.实验室配制氯化铁溶液时,先将FeCl3晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
10.(2024秋 重庆期末)温度为TC时,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)(不考虑副反应)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( )
A.a点v正等于c点的v正
B.c点与b点相比,NO2转化率降低的原因是平衡向逆反应方向移动
C.T℃时,该反应的化学平衡常数
D.向a点的平衡体系中再加入等物质的量的NO2和CO2平衡向逆反应方向移动
11.(2024秋 深圳期末)丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下。
主反应Ⅰ:C2H4(g)+H2(g)+CO(g) CH3CH2CHO(g)ΔH1<0
副反应Ⅱ:C2H4(g)+H2(g) C2H6(g)ΔH2<0
在VL恒容容器中,通入1mol C2H4B2mol H2和1mol CO,相同时间(tmin)内,测得不同温度下C2H4的转化率(a)如图所示(曲线c)。CH3CH2CHO的选择性,已知生成物的选择性跟温度有关。下列说法正确的是( )
A.符合C2H4平衡转化率变化的是曲线a
B.C到D是两个平衡向逆反应方向移动的结果
C.从起始到B点的平均反应速率为
D.A、C两点的CH3CH2CHO的选择性相等
12.(2024秋 秦淮区校级期末)丁烷催化脱氢是工业制备丁烯的主要方法,反应如下:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH>0。为探究工业生产丁烯的合适温度,在体积为1L的容器中,充入10mol丁烷,使用SiO2—CrOx复合催化剂催化丁烷脱氢,相同时间内丁烷的转化率和主要产物的收率分布如题图所示。[收率=(生成某产物的量/参与反应的原料量)×100%]。下列说法不正确的是( )
A.590℃生成丁烯的物质的量为0.55mol
B.590℃以后,温度升高,丁烯的收率降低,原因是副产物增多
C.丁烷转化率增大的原因可能是温度升高平衡右移,丁烷的转化率增大
D.欲使工业生产丁烯的收率更高,应选用低温下选择性更好的高效催化剂
13.(2025 湖南开学)已知:反应aA(g)+bB(g) cC(g)+dD(g)的物质的量分数平衡常数,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。向某刚性密闭容器中加入CO2(g)和足量的C(s)发生反应CO2(g)+C(s) 2CO(g)ΔH>0,反应的正反应平衡常数Kx正和逆反应平衡常数Kx逆迪的lnKx随温度的变化如图所示。当温度为1000K时,下列叙述错误的是( )
A.表示Kx正随变化的曲线为L2
B.达到平衡时,CO2的体积分数大于50%
C.达到平衡时,升高温度,v正、v逆均增大,且平衡前v正>v逆
D.若向上述平衡体系中充入一定量的CO,再次平衡后容器内CO的物质的量分数变小
14.(2024秋 九龙坡区期末)向一恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:vb逆<vc逆
C.向b点所在体系充入惰性气体,平衡不发生移动
D.点a、b、c对应的平衡常数:Ka<Kb=Kc
15.(2025 湖南模拟)已知制备光气COCl2的反应为CO(g)+Cl2(g) COCl2(g)ΔH<0,将等物质的量的CO(g)和Cl2(g)充入密闭容器中,平衡体系中,平衡混合物的平均摩尔质量M在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:Ka=Kb<Kc
C.Cl2的平衡转化率:c>a=b
D.b点时,若M=80g mol﹣1,则CO的平衡转化率为50%
16.(2025 湖南模拟)在某催化剂作用下双氧水分解:2H2O2(aq)=2H2O(l)+O2(g)。向某容器中投入足量双氧水,测得双氧水浓度与反应时间关系如图所示。已知:双氧水浓度减小一半所用时间叫半衰期。下列叙述错误的是( )
A.温度升高,双氧水分解速率加快
B.反应速率:a>b
C.ab段平均速率:
D.此条件下,双氧水半衰期与初始浓度成正比
17.(2024秋 朝阳区期末)2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,它由两步反应组成:
ⅰ.H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1
ⅱ.SO3(g)分解。
反应ⅱ在927℃时SO3的实际转化率(曲线a)和727℃时SO3的平衡转化率(曲线b)如图所示。下列说法不正确的是( )
A.2SO3(g) 2SO2(g)+O2(g)ΔH=+196kJ mol﹣1
B.曲线a表示反应ⅱ已经处于化学平衡状态
C.图中X点所示条件下,延长反应时间能提高SO3的转化率
D.减小压强有利于提高H2SO4分解的平衡转化率
18.(2024秋 罗湖区期末)利用催化技术,通过反应2NOx+2xCO N2+2xCO2ΔH>0,可将汽车尾气中的NOx除去。在密闭容器中模拟该反应,下列措施中既能提高NOx的平衡去除率又能加快去除速率的是( )
A.适当升高温度
B.不断移走N2和CO2
C.恒容时充入一定量Ar(g)
D.增大催化剂比表面积
19.(2024秋 河东区期末)向体积均为1L的甲、乙两个恒容密闭容器中分别充入1mol O2和4mol HBr,发生反应:4HBr(g)+O2(g) 2Br2(g)+2H2O(g)ΔH。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是( )
A.乙在恒温条件下进行,ΔH<0
B.恒温过程比绝热过程的反应速率小
C.a点的正反应速率大于c点的正反应速率
D.平衡常数:K甲>K乙
20.(2025 湖南校级一模)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z。
反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30min时间段内,Y的平均反应速率为2.5×10﹣3mol L﹣1 min﹣1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时37.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
高考化学考前冲刺押题预测 化学反应速率与平衡
参考答案与试题解析
一.选择题(共20小题)
1.(2025 珠海一模)已知反应R X或R Y,M为中间产物,其反应历程如图。在0℃和40℃下,平衡时产物n(X)/n(Y)分别为70:30和15:85。下列说法正确的是( )
A.稳定性:X>Y
B.两个总反应的决速步不同
C.从0℃升至40℃,反应速率增大程度:v正(X)<v逆(X)
D.从0℃升至40℃c平(X)/c平(R)增大,c平(M)/c平(R)减小
【答案】C
【分析】A.物质能量越低,越稳定;
B.两个过程中,第一步活化能均大于第二步,而活化能越大,反应速率越小;
C.R转化为X的过程是放热反应,升高温度,平衡向吸热反应方向移动;
D.是R X的平衡常数,是R M的平衡常数,结合反应热效应,判断升高温度平衡移动方向,进而判断平衡常数变化。
【解答】解:A.X的能量比Y高,物质能量越低,越稳定,则稳定性:X<Y,故A错误;
B.两个过程中,第一步活化能均大于第二步,而活化能越大,反应速率越小,两个反应的决速步都是第一步,故B错误;
C.R X是放热反应,升高温度,平衡逆向移动,则升高温度,反应速率增大程度:v正(X)<v逆(X),故C正确;
D.是R X的平衡常数,该反应正反应是放热反应,升高温度,平衡逆向移动,则减小,而是R M平衡常数,该反应正反应是吸热反应,升高温度,平衡正向移动,增大,故D错误;
故选:C。
【点评】本题考查化学反应速率与化学平衡、化学反应中能量变化,题目比较综合,需要学生具备扎实的基础与灵活运用的能力。
2.(2024秋 九龙坡区期末)1884年勒夏特列提出了平衡移动原理,下列现象或操作不能用该原理解释的是( )
A.接触法制硫酸时,充入适当过量的空气氧化SO2
B.使用铁触媒,使N2和H2混合气体有利于合成氨
C.实验室可用排饱和食盐水溶液的方法收集氯气
D.工业上选择高压条件(10﹣30Mpa)合成氨以提高原料的平衡转化率
【答案】B
【分析】勒夏特列原理的内容是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释。
【解答】解:A.接触法制硫酸时,充入适当过量的空气增大了氧气浓度,平衡向着生成三氧化硫的方向移动,从而提高了SO2的转化率,能用勒夏特列原理解释,故A错误;
B.铁传媒为催化剂,催化剂能改变反应速率,但不影响该化学平衡,不能用勒夏特列原理解释,故B正确;
C.Cl2溶于水存在平衡:Cl2+H2O H++Cl﹣+HClO,饱和食盐水溶液中Cl﹣浓度增大,上述平衡逆向移动,导致Cl2的消耗量和溶解度减小,所以实验室可用排饱和食盐水溶液的方法收集氯气,能用勒夏特列原理解释,故C错误;
D.合成氨的正反应气体体积减小,增大压强平衡正向移动,所以工业上选择高压条件(10~30Mpa)合成氨以提高原料的平衡转化率,能用勒夏特列原理解释,故D错误;
故选:B。
【点评】本题考查勒夏特列原理的应用,明确勒夏特列原理的内容为解答关键,注意使用平衡移动原理的前提必须是可逆反应,题目难度不大。
3.(2024秋 温州期末)室温下,用0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液和蒸馏水进行如下表所示的五组实验,分别测量浑浊度随时间的变化。(已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)
编号 Na2S2O3溶液 H2SO4溶液 蒸馏水
V/mL V/mL V/mL
① 1.5 3.5 10
② 2.5 3.5 9
③ 3.5 3.5 X
④ 3.5 2.5 9
⑤ 3.5 1.5 10
下列有关说不正确的是( )
A.实验③中x=8
B.在五组实验中,反应速率最慢的是实验①
C.本实验可知,Na2S2O3溶液浓度和H2SO4溶液浓度对该反应速率影响程度不同
D.本实验可以用产生气泡的快慢比较反应速率
【答案】D
【分析】由图可知,实验③中反应速率最快,由控制变量法可知总体积为15mL,实验①、②、③中Na2S2O3溶液浓度不同,图中③、④、⑤速率接近,①、②、③速率差异大,据此分析解题。
【解答】解:A.本实验探究需控制单一变量,则2.5+3.5+9=3.5+3.5+x,解得:x=8,故A正确;
B.Na2S2O3溶液浓度的改变对速率影响更大,在五组实验中,实验①的Na2S2O3溶液浓度最小,则反应速率最慢的是实验①,故B正确;
C.实验①②③的变量为Na2S2O3溶液浓度,③④⑤的变量为H2SO4溶液浓度,Na2S2O3溶液浓度的改变对速率影响更大,该推断的证据是达到相同浑浊度时,实验①②③所需时间的改变量大于实验③④⑤所需时间的改变量,故C正确;
D.已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,产生S沉淀,溶液生成黄色硫单质的现象更明显,可以通过出现浑浊需要的时间来判断反应速率快慢,故D错误;
故选:D。
【点评】本题考查反应速率,侧重考查学生影响速率因素的掌握情况,试题难度中等。
4.(2025 山西开学)利用催化技术将汽车尾气中NO和CO转化为CO2和N2为研究不同条件下对该化学反应的影响。某课题组按下表数据进行了实验探究。实验中使用了等质量的同种催化剂,测得CO的浓度随时间的变化如图所示。下列说法正确的是( )
编号 T/℃ c(NO)/(mol L﹣1) c(CO)/(mol L﹣1) 催化剂的比表面积/(m2 g﹣1)
Ⅰ 280 6.50×10﹣3 4.00×10﹣3 80.0
Ⅱ 6.50×10﹣3 4.00×10﹣3 120
Ⅲ 360 6.50×10﹣3 4.00×10﹣3 80.0
A.实验Ⅱ的反应温度为
B.该反应的反应热ΔH>0
C.实验Ⅲ达到平衡时,NO的浓度为3.50×10﹣3mol L﹣1
D.其他条件相同,增大催化剂的比表面积,该反应的反应速率增大,但不影响平衡转化率
【答案】D
【分析】A.实验Ⅰ和Ⅱ催化剂比表面积不同,温度应相同;
B.温度升高,平衡时CO浓度升高,平衡逆向移动,该反应为放热反应;
C.实验Ⅲ达到平衡时,NO的浓度为4.50×10﹣3mol L﹣1;
D.增大催化剂的比表面积,化学反应速率增大,但平衡转化率不变;
【解答】解:A.根据单一变量原则,实验Ⅰ和Ⅱ催化剂比表面积不同,温度应该相同,则实验Ⅱ的反应温度为280℃,故A错误;
B.对比反应Ⅰ和Ⅲ,温度升高,平衡时CO浓度升高,平衡逆向移动,说明ΔH<0,故B错误;
C.化学方程式为2NO+2CO2CO2+N2,实验Ⅲ达到平衡时,NO的浓度为4.50×10﹣3mol L﹣1,故C错误;
D.实验Ⅰ、Ⅱ催化剂比表面积不同,增大催化剂的比表面积,化学反应速率增大,但平衡转化率不变,故D正确;
故选:D。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
5.(2025 选择性模拟)已知制备TaS2的反应为TaI4(g)+S2(g) TaS2(s)+2I2(g)ΔH<0,保持总压强不变,向反应器充入一定量TaI4(g)和S2(g),发生上述反应.测得TaI4(g)平衡转化率与投料比[](温度不变)、温度倒数(投料比不变)关系如图所示,下列叙述错误的是( )
A.其他条件不变,达平衡后充入氩气,平衡不移动
B.曲线①代表TaI4平衡转化率与投料比关系
C.一定条件下,达到平衡时气体平均摩尔质量不变
D.若当投料比为2、温度为T0时TaI4平衡转化率为40%,则TaI4体积分数为40%
【答案】B
【分析】A.该反应是气体分子数不变的反应,总压强不变,充入惰性气体,体积增大,相当于减压;
B.温度不变,投料比越大,TaI4平衡转化率越小,曲线②代表TaI4平衡转化率与投料比关系,投料比不变,降低温度,TaI4平衡转化率越大;
C.气体平均摩尔质量为,根据反应可知,反应后有固体存在,因此气体总质量发生改变,则气体平均摩尔质量在改变;
D.用三段式计算:投料比为2,平衡转化率为40%,则计算如下:
TaI4(g)+S2(g) TaS2(s)+2I2(g)
起始/mol:2 1 0 0
变化/mol:0.8 0.8 0.8 1.6
平衡/mol:1.2 0.2 0.8 1.6。
【解答】解:A.该反应是气体分子数不变的反应,总压强不变,充入惰性气体,体积增大,相当于减压,平衡不移动,故A正确;
B.温度不变,投料比越大,TaI4平衡转化率越小,曲线②代表TaI4平衡转化率与投料比关系,投料比不变,降低温度,TaI4平衡转化率越大,曲线①代表TaI4平衡转化率与的关系,故B错误;
C.气体平均摩尔质量为,根据反应可知,反应后有固体存在,因此气体总质量发生改变,则气体平均摩尔质量在改变,因此当气体平均摩尔质量保持不变时,达到平衡,故C正确;
D.用三段式计算:投料比为2,平衡转化率为40%,则计算如下:
TaI4(g)+S2(g) TaS2(s)+2I2(g)
起始/mol:2 1 0 0
变化/mol:0.8 0.8 0.8 1.6
平衡/mol:1.2 0.2 0.8 1.6
平衡时TaI4体积分数为,故D正确;
故选:B。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
6.(2025 昆明一模)甲醇重整制氢涉及三个反应:
反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1
反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2
反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3
反应Ⅰ和反应Ⅱ不同温度下的平衡常数如下表:
反应 398K 498K 598K 698K 798K
Ⅰ 0.5535 185.8 9939.5 1.8×105 1.6×106
Ⅱ 872.7 2.5×104 2.8×105 1.7×106 6.8×106
下列说法正确的是( )
A.相同温度下,
B.反应Ⅰ、Ⅱ在低温下可自发进行
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,反应Ⅱ平衡逆移
D.398K时,向起始容积相同的恒压和恒容两个容器中,均充入1mol CH3OH(g)与1mol H2O(g),恒压条件下H2的平衡产率更高
【答案】D
【分析】A.根据盖斯定律,Ⅱ=Ⅰ+Ⅲ;
B.反应Ⅰ温度升高,K增大,ΔH>0,ΔS>0,反应Ⅱ温度升高,K增大,ΔH>0,ΔS>0;
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大;
D.恒压条件下,随着反应进行,气体分子数增多,容器的体积增大,相当于减小压强。
【解答】解:A.反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1;反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2;反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3;根据盖斯定律,Ⅱ=Ⅰ+Ⅲ,所以,K2=K1×K3,故A错误;
B.反应Ⅰ温度升高,K增大,ΔH>0,ΔS>0,高温下能自发,反应Ⅱ温度升高,K增大,ΔH>0,ΔS>0,在高温下可自发进行,故B错误;
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,个组分浓度不变,反应Ⅱ平衡不移动,故C错误;
D.恒压条件下,随着反应进行,气体分子数增多,容器的体积增大,相当于减小压强,有利于气体分子数增多的反应,所以恒压条件下H2的平衡产率更高,故D正确;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
7.(2025 河北模拟)某温度下,在恒容密闭容器中充入一定量的X(g),发生下列反应:
反应Ⅰ.X(g) Y(g) ΔH1<0
反应Ⅱ.Y(g) Z(g) ΔH2<0
测得各气体浓度与反应时间的关系如图所示。下列说法正确的是( )
A.活化能:Ea(Ⅰ)>Ea(Ⅱ)
B.0~4s内反应Ⅰ的平均速率v(X)=0.25mol L﹣1 s﹣1
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,平衡转化率均升高
D.体系内气体的平均摩尔质量不再变化,则反应达到新平衡
【答案】B
【分析】A.活化能越大,反应越慢;
B.4s末时Y为0.8mol/L、Z为0.2mol/L,即0~4s内X减少了0.8+0.2=1.0mol/L,故0~4s内反应Ⅰ的平均速率;
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,由题干信息可知,两个反应均为放热反应,则升高温度平衡逆向移动;
D.由题干信息可知,两个反应前后气体的系数均保持不变,即反应体系中气体的总物质的量一直不变,混合气体的质量不变,即体系内气体的平均摩尔质量一直保持不变。
【解答】解:A.活化能越大,反应越慢;反应开始一段时间内Y的浓度变化快,Z的浓度变化慢,故反应①活化能低,反应②活化能高,即Ea(Ⅰ)<Ea(Ⅱ),故A错误;
B.4s末时Y为0.8mol/L、Z为0.2mol/L,故0~4s内反应Ⅰ的平均速率,故B正确;
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,由题干信息可知,两个反应均为放热反应,则升高温度平衡逆向移动,故平衡转化率均减小,故C错误;
D.由题干信息可知,两个反应前后气体的系数均保持不变,即反应体系中气体的总物质的量一直不变,混合气体的质量不变,即体系内气体的平均摩尔质量一直保持不变,故体系内气体的平均摩尔质量不再变化,不能说明反应达到新平衡,故D错误;
故选:B。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
8.(2024秋 德州期末)恒压下,将HCl和O2分别以不同的起始流速通入体积为7L的反应器中,发生反应:2HCl(g)O2(g) Cl2(g)+H2O(g),在T1、T2、T3温度下反应,通过检测流出气体成分绘制HCl转化率(a)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。下列说法错误的是( )
A.T1>T2>T3
B.该反应在低温下可自发进行
C.加入高效催化剂或升温可提高M点转化率
D.若通气1h开始反应,则N点容器体积减少1.225L
【答案】D
【分析】根据题给信息,较低流速下转化率视为平衡转化率,则由图可以看出,P点以后,流速较大,说明此时的转化率不是平衡转化率,此时反应未达到平衡状态。
【解答】解:根据题给信息,较低流速下转化率视为平衡转化率,则由图可以看出,P点以后,流速较大,说明此时的转化率不是平衡转化率,此时反应未达到平衡状态;
A.P点以后,流速较高,反应未达平衡状态,温度越高,反应速率越快,单位时间内氯化氢的转化率越高。在P点后,同一流速下,T1温度下的氯化氢的转化率最大,T3温度下的氯化氢的转化率最小,说明温度T1>T2>T3,故A正确;
B.根据题给信息,较低流速下转化率近似为平衡转化率,在较低流速时,T3转化率最大,T1转化率最小,温度T1>T2>T3,则此反应是放热反应,并且ΔS<0,根据ΔG=ΔH﹣TΔS<0是自发进行,所以此反应必须在低温下才能自发进行,故B正确;
C.M点未达到平衡状态,使用高效催化剂或升高温度,可以增大反应速率,使M点HCl的转化率增加,故加入高效催化剂或升温可提高M点转化率,故C正确;
D.由图可知,N点气流流速为0.16mol/h,以1h为单位带入气体流量,可知n(HCl)始为0.16mol,则n(O2)始为0.12mol。N点时HCl转化率为70%,N点时转化的HCl的物质的量=0.16mol×70%=0.112mol,根据“三段式”有:
2HCl(g)O2(g) Cl2(g)+H2O(g)
起始/mol:0.16 0.12 0 0
起始/mol:0.112 0.028 0.056 0.056
起始/mol:0.048 0.092 0.056 0.056
同温同压下,容器起始体积和N点时容器的体积关系为:,VN=6.3L,则N点容器体积减少7L﹣6.3L=0.7L,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
9.(2024秋 杭州期末)下列事实不能用勒夏特列原理解释的是( )
A.甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色
B.由NO2和N2O4组成的平衡体系:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.实验室配制氯化铁溶液时,先将FeCl3晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
【答案】B
【分析】A.甲基橙指示剂的变色范围为pH值3.1~4.4,pH<3.1为红色,pH>4.4为黄色;
B.恒温缩小容积,体系压强增大,反应2NO2(g) N2O4(g)正向移动,n(NO2)减少,气体颜色变深,是由于缩小容积后c(NO2)增大;
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,平衡正向移动;
D.氯化铁溶液中存在平衡Fe3++3H2O 3H++Fe(OH)3,先将其晶体溶于较浓盐酸中,抑制Fe3+水解。
【解答】解:A.甲基橙在中性或碱性溶液中是以磺酸钠盐的形式存在,在酸性溶液中转化为磺酸,甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色,可以用平衡移动原理解释,故A正确;
B.恒温缩小容积,体系压强增大,反应2NO2(g) N2O4(g)正向移动,n(NO2)减少,气体颜色变深,是由于缩小容积后c(NO2)增大,颜色变深,故不能用平衡移动原理解释,故B错误;
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,平衡正向移动,以制备金属钾,能用平衡移动原理解释,故C错误;
D.氯化铁溶液中存在平衡Fe3++3H2O 3H++Fe(OH)3,先将其晶体溶于较浓盐酸中,抑制Fe3+水解,能用平衡移动原理解释,故D错误;
故选:B。
【点评】本题考查了化学平衡移动原理的应用,题目难度不大,明确平衡移动原理的内容为解答关键,注意明确使用平衡移动原理的前提必须是可逆过程,且与平衡移动有关。
10.(2024秋 重庆期末)温度为TC时,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)(不考虑副反应)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( )
A.a点v正等于c点的v正
B.c点与b点相比,NO2转化率降低的原因是平衡向逆反应方向移动
C.T℃时,该反应的化学平衡常数
D.向a点的平衡体系中再加入等物质的量的NO2和CO2平衡向逆反应方向移动
【答案】D
【分析】图中b点NO2的转化率最高,则温度为T℃时,b点恰好达到平衡状态,由于ab曲线上对应容器的体积逐渐增大,NO2的起始浓度逐渐减小,但浓度均大于b点,NO2的浓度越大,反应速率越大,达到平衡的时间越短,所以ab曲线上反应均达到平衡状态,反应正向是气体体积增大的反应,随着容器体积的增大,NO2的转化率逐渐增大,b点达到最大;b点以后,随着容器体积的增大,NO2的起始浓度减小,反应速率减慢,达到平衡的时间延长,所以bc曲线上反应均未达到平衡状态,由于NO2的起始浓度低,则反应正向进行。
【解答】解:A.a点体积小于c点的体积,a点v正大于c点的v正,故A错误;
B.c点与b点相比,NO2转化率降低是因为还没有达到平衡状态,体积减小,反应速率加快,反应正向进行,故B错误;
C.T℃时,b点恰好达到化学平衡状态,NO2的转化率为80%,物质的量变化为0.8mol,剩余0.2mol,生成N2的物质的量为0.4mol,生成CO2的物质的量为0.8mol,化学平衡常数Kcmol/L,故C错误;
D.a点NO2的转化率为40%,物质的量变化为0.4mol,剩余0.6mol,生成N2的物质的量为0.2mol,生成CO2的物质的量为0.4mol,化学平衡常数Kcmol/L,加入等物质的量的NO2和CO2时,Q,此时Q>K平衡逆向移动,故D正确;
故选:D。
【点评】本题考查化学平衡的计算、化学平衡的影响因素和平衡图象分析判断,为高频考点,侧重学生的分析、计算和推理等综合运用能力的考查,明确外界因素对化学平衡的影响、把握图象信息分析是解题的关键,注意平衡常数的表达式和三段式格式在平衡计算中的应用,题目难度较大。
11.(2024秋 深圳期末)丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下。
主反应Ⅰ:C2H4(g)+H2(g)+CO(g) CH3CH2CHO(g)ΔH1<0
副反应Ⅱ:C2H4(g)+H2(g) C2H6(g)ΔH2<0
在VL恒容容器中,通入1mol C2H4B2mol H2和1mol CO,相同时间(tmin)内,测得不同温度下C2H4的转化率(a)如图所示(曲线c)。CH3CH2CHO的选择性,已知生成物的选择性跟温度有关。下列说法正确的是( )
A.符合C2H4平衡转化率变化的是曲线a
B.C到D是两个平衡向逆反应方向移动的结果
C.从起始到B点的平均反应速率为
D.A、C两点的CH3CH2CHO的选择性相等
【答案】C
【分析】A.放热反应,升温时平衡均逆向移动;
B.A、B、C、D均处于正向进行过程;
C.根据平均速率计算公式计算;
D.不同温度下CH3CH2CHO选择性有所不同;
【解答】解:A.由于反应Ⅰ、Ⅱ均为放热反应,升温时平衡均逆向移动,平衡转化率将减小,故A错误;
B.图中A、B、C、D的转化率均未达到相同温度时的平衡转化率,均处于正向进行过程,故B错误;
C.按照平均速率计算公式表示从起始到B点的平均反应速率为mol,故C正确;
D.A、C两点的C2H4的转化率相等,但是不同温度下CH3CH2CHO选择性有所不同,故D错误;
故选:C。
【点评】本题考查反应中的能量变化和化学平衡,侧重考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
12.(2024秋 秦淮区校级期末)丁烷催化脱氢是工业制备丁烯的主要方法,反应如下:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH>0。为探究工业生产丁烯的合适温度,在体积为1L的容器中,充入10mol丁烷,使用SiO2—CrOx复合催化剂催化丁烷脱氢,相同时间内丁烷的转化率和主要产物的收率分布如题图所示。[收率=(生成某产物的量/参与反应的原料量)×100%]。下列说法不正确的是( )
A.590℃生成丁烯的物质的量为0.55mol
B.590℃以后,温度升高,丁烯的收率降低,原因是副产物增多
C.丁烷转化率增大的原因可能是温度升高平衡右移,丁烷的转化率增大
D.欲使工业生产丁烯的收率更高,应选用低温下选择性更好的高效催化剂
【答案】D
【分析】A.590℃时,丁烯的收率为20%,丁烷转化率为27.5%;
B.590℃时丁烯的收率最高;
C.制备乙烯的反应为吸热反应,升高温度平衡正向移动;
D.低温下,丁烷的转化率较低,即使选用低温下选择性更好的高效催化剂。
【解答】解:A.590℃时,丁烯的收率为20%,丁烷转化率为27.5%,则生成的正丁烯的物质的量为10×20%×27.5%=0.55mol,故A正确;
B.590℃时丁烯的收率最高,温度升高,丁烯的收率降低,副产物增多,故B正确;
C.制备乙烯的反应为吸热反应,升高温度平衡正向移动,丁烷的转化率增大,故C正确;
D.低温下,丁烷的转化率较低,即使选用低温下选择性更好的高效催化剂,也不能使丁烯的收率更高,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
13.(2025 湖南开学)已知:反应aA(g)+bB(g) cC(g)+dD(g)的物质的量分数平衡常数,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。向某刚性密闭容器中加入CO2(g)和足量的C(s)发生反应CO2(g)+C(s) 2CO(g)ΔH>0,反应的正反应平衡常数Kx正和逆反应平衡常数Kx逆迪的lnKx随温度的变化如图所示。当温度为1000K时,下列叙述错误的是( )
A.表示Kx正随变化的曲线为L2
B.达到平衡时,CO2的体积分数大于50%
C.达到平衡时,升高温度,v正、v逆均增大,且平衡前v正>v逆
D.若向上述平衡体系中充入一定量的CO,再次平衡后容器内CO的物质的量分数变小
【答案】B
【分析】A.正反应为吸热反应,温度越高,平衡常数越大;
B.平衡时CO2的体积分数小于50%;
C.正反应为吸热反应,温度越高,v正、v逆均增大;
D.冲入CO加压再次平衡后容器内CO的物质的量分数较原平衡体系变小;
【解答】解:A.该反应的正反应为吸热反应,温度越高,平衡常数越大,所以表示Kx正随变化的曲线为L2,故A正确;
B.当CO2的体积分数等于50%时,Kx1,所以反应还会正向进行,平衡时CO2的体积分数小于50%,故B错误;
C.该反应的正反应为吸热反应,温度越高,v正、v逆均增大,且平衡前v正>v逆,故C正确;
D.向平衡体系中充入一定量的CO,相当于加压,再次平衡后容器内CO的物质的量分数较原平衡体系变小,故D正确;
故选:B。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
14.(2024秋 九龙坡区期末)向一恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:vb逆<vc逆
C.向b点所在体系充入惰性气体,平衡不发生移动
D.点a、b、c对应的平衡常数:Ka<Kb=Kc
【答案】B
【分析】A.投料比x越小,CH4平衡转化率就越大;
B.c点温度相同,b点中H2O(g)的浓度大于c点;
C.恒温恒容向体系的惰性气体,化学平衡不移动;
D.升高温度,甲烷转化率增大;
【解答】解:A.加入的H2O(g)量越大,投料比x越小,CH4平衡转化率就越大,所以x1<x2,故A正确;
B.c点温度相同,x1<x2,b点中H2O(g)的浓度大于c点,则vb逆>vc逆,故B错误;
C.恒温恒容条件下,向反应体系充入不参与反应的惰性气体,反应体系中各物质的浓度,化学平衡不移动,故C正确;
D.升高温度,甲烷转化率增大,说明反应为吸热反应,升高温度平衡常数增大,故D正确;
故选:B。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
15.(2025 湖南模拟)已知制备光气COCl2的反应为CO(g)+Cl2(g) COCl2(g)ΔH<0,将等物质的量的CO(g)和Cl2(g)充入密闭容器中,平衡体系中,平衡混合物的平均摩尔质量M在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:Ka=Kb<Kc
C.Cl2的平衡转化率:c>a=b
D.b点时,若M=80g mol﹣1,则CO的平衡转化率为50%
【答案】C
【分析】A.CO(g)+Cl2(g) COCl2(g) ΔH<0,升高温度,平衡左移;
B.a、c两点温度相同,平衡常数相同,Ka=Kc,升高温度,平衡左移;
C.M越大,混合气体中COCl2(g)的含量越高,反应物的转化率越大;
D.CO与Cl2等物质的量混合,设起始时n(CO)=n(Cl2)=1mol,设CO转化了xmol,则,解得x=0.7625。
【解答】解:A.升高温度,平衡左移,n增大,M减小,T1>T2,故A错误;
B.平衡常数只与温度有关,a、c两点温度相同,则Ka=Kc,升高温度,平衡左移,平衡常数减小,则Kb<Kc,故B错误;
C.M越大,混合气体中COCl2(g)的含量越高,反应物的转化率越大,Cl2的平衡转化率:c>b=a,故C正确;
D.CO与Cl2等物质的量混合,设起始时n(CO)=n(Cl2)=1mol,设CO转化了xmol,则,解得x=0.7625,即CO的转化率为76.25%,故D错误;
故选:C。
【点评】本题考查化学平衡,侧重考查学生平衡计算的掌握情况,试题难度中等。
16.(2025 湖南模拟)在某催化剂作用下双氧水分解:2H2O2(aq)=2H2O(l)+O2(g)。向某容器中投入足量双氧水,测得双氧水浓度与反应时间关系如图所示。已知:双氧水浓度减小一半所用时间叫半衰期。下列叙述错误的是( )
A.温度升高,双氧水分解速率加快
B.反应速率:a>b
C.ab段平均速率:
D.此条件下,双氧水半衰期与初始浓度成正比
【答案】D
【分析】A.温度升高,速率加快;
B.浓度增大,速率快;
C.ab段平均速率v(H2O2);
D.双氧水浓度减小一半所用时间均为20s,与起始浓度无关。
【解答】解:A.温度升高,速率加快;温度升高,双氧水分解速率加快,故A正确;
B.浓度增大,速率快;a点c(H2O2)大,反应速率快,故B正确;
C.ab段平均速率v(H2O2),故C正确;
D.由题图可知,双氧水浓度减小一半所用时间均为20s,即双氧水半衰期为20s,与起始浓度无关,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
17.(2024秋 朝阳区期末)2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,它由两步反应组成:
ⅰ.H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1
ⅱ.SO3(g)分解。
反应ⅱ在927℃时SO3的实际转化率(曲线a)和727℃时SO3的平衡转化率(曲线b)如图所示。下列说法不正确的是( )
A.2SO3(g) 2SO2(g)+O2(g)ΔH=+196kJ mol﹣1
B.曲线a表示反应ⅱ已经处于化学平衡状态
C.图中X点所示条件下,延长反应时间能提高SO3的转化率
D.减小压强有利于提高H2SO4分解的平衡转化率
【答案】B
【分析】A.①2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,②H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1,盖斯定律计算①﹣②×2得到2SO3(g) 2SO2(g)+O2(g)ΔH分析判断;
B.曲线a是反应ⅱ在927℃时SO3的实际转化率,一定温度下,随着压强变化,转化率发生变化;
C.图中X点所示条件下,反应未达到平衡状态,延长反应时间能提高SO3的转化率;
D.减小压强平衡向气体体积增大的方向进行。
【解答】解:A.①2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,②H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1,盖斯定律计算①﹣②×2得到2SO3(g) 2SO2(g)+O2(g)ΔH=(+550kJ mol﹣1)﹣(+177kJ mol﹣1)×2=+196kJ/mol,故A正确;
B.曲线a是反应ⅱ在927℃时SO3的实际转化率,随着压强变化,转化率变化,不能说明反应达到平衡状态,故B错误;
C.图中X点所示条件下,反应未达到平衡状态,延长反应时间可以提高SO3的转化率,故C正确;
D.2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,反应为前提条件增大的反应,减小压强有利于平衡正向进行,有利于提高H2SO4分解的平衡转化率,故D正确;
故选:B。
【点评】本题考查了化学平衡影响因素分析判断、热化学方程式的计算应用,注意知识的熟练掌握,题目难度中等。
18.(2024秋 罗湖区期末)利用催化技术,通过反应2NOx+2xCO N2+2xCO2ΔH>0,可将汽车尾气中的NOx除去。在密闭容器中模拟该反应,下列措施中既能提高NOx的平衡去除率又能加快去除速率的是( )
A.适当升高温度
B.不断移走N2和CO2
C.恒容时充入一定量Ar(g)
D.增大催化剂比表面积
【答案】A
【分析】提高NOx的平衡去除率可以使平衡正向移动,加快去除速率可以升温或者催化剂,据此进行解答。
【解答】解:A.适当升高温度既能提高NOx的平衡去除率又能加快去除速率,故A正确;
B.不断移走N2和CO2,不能加快去除速率,故B错误;
C.恒容时充入一定量Ar(g)对反应速率无影响,故C错误;
D.增大催化剂比表面积不能提高NOx的平衡去除率,故D错误;
故选:A。
【点评】本题考查化学反应速率和平衡移动的相关知识,题目比较简单。
19.(2024秋 河东区期末)向体积均为1L的甲、乙两个恒容密闭容器中分别充入1mol O2和4mol HBr,发生反应:4HBr(g)+O2(g) 2Br2(g)+2H2O(g)ΔH。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是( )
A.乙在恒温条件下进行,ΔH<0
B.恒温过程比绝热过程的反应速率小
C.a点的正反应速率大于c点的正反应速率
D.平衡常数:K甲>K乙
【答案】D
【分析】A.恒温恒容条件下,容器中气体的压强与气体的物质的量成正比,根据方程式知,反应前后气体的物质的量之和减小,则压强减小,所以曲线乙在恒温条件下进行;甲在绝热条件下进行,随着反应的进行,容器内压强先增大后减小,说明开始时温度对压强的影响大于气体的物质的量,该反应为放热反应;
B.温度越高、压强越大反应速率越快;
C.压强越大、温度越高反应速率越快;
D.该反应的正反应为放热反应,温度越高,化学平衡常数越小。
【解答】解:A.曲线甲恒容密闭容器中压强增大,说明甲在绝热过程进行,乙在恒温过程进行,故A正确;
B.温度越高、压强越大反应速率越快,绝热时温度、压强都比恒温时大,则恒温过程比绝热过程的反应速率小,故B正确;
C.压强越大、温度越高反应速率越快,a点温度和压强都大于c点,则a点的正反应速率大于c点的正反应速率,故C正确;
D.该反应的正反应为放热反应,温度越高,化学平衡常数越小,甲的温度大于乙,则平衡常数:K甲<K乙,故D错误;
故选:D。
【点评】本题考查化学平衡的影响因素,侧重考查图象分析判断及知识综合运用能力,明确外界条件对化学反应速率、化学平衡影响原理是解本题关键,题目难度不大。
20.(2025 湖南校级一模)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z。
反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30min时间段内,Y的平均反应速率为2.5×10﹣3mol L﹣1 min﹣1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时37.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】C
【分析】由图可知:M的起始浓度为0.5 mol/L,反应①的速率v1=k1c2(M),反应②的速率v2=k2c2(M)(k1、k2为速率常数)。则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变;①M+N=X+Y、②M+N=X+Z,则体系中始终有c(Y)+c(Z)=△c (M),由图可知:30 min时△c(M)=0.5 mol/L﹣0.300 mol/L=0.2 mol/L;c(Z)=0.125 mol/L,则c (Y)=0.2 mol/L﹣0.125 mol/L=0.075 mol/L,即反应开始后,体系中Y和Z的浓度之比为0.075 mol/L:0.125 mol/L=3:5;结合反应的活化能与反应速率关系比较反应①、②的活化能大小,根据v和转化率公式计算反应速率和转化率,据此分析解答。
【解答】解:A.30min时,M、Z的浓度分别为0.300mol L﹣1和0.125 mol L﹣1,则M的变化量为0.5mol L﹣1﹣0.300 mol L﹣1=0.200 mol L﹣1,其中转化为Y的变化量为0.200mol L﹣1﹣0.125 mol L﹣1=0.075 mol L﹣1,0~30min时间段内,Y的平均反应速率为 mol L﹣1 min﹣1,故A正确;
B.反应①和反应②的速率之比为,Y和Z分别为反应①和反应②的产物,且两者与M的化学计量数相同,因此反应开始后,体系中Y和Z的浓度之比等于 ,由于k1、k2为速率常数,故该比值保持不变,故B正确;
C.体系中Y和Z的浓度之比为3:5,所以反应能进行到底时,c(Y)+c(Z)=△c(M)=0.5 mol/L,则c(Z),反应结束时M转化为Z的转化率为,故C错误;
D.30 min时,c(Z)=0.125 mol/L,△c(M)=0.5 mol/L﹣0.300 mol/L=0.2 mol/L,则c(Y)=△c(M)﹣c(Z)=0.2 mol/L﹣0.125 mol/L=0.075 mol/L,则v(Y):v(Z)=0.075 mol/L:0.125 mol/L =3:5,即v(Y)<v(Z),v1<v2,反应的活化能越高,反应速率越慢,所以反应①的活化能大于反应②的活化能,故D正确;
故选:C。
【点评】本题主要考查物质的量或浓度随时间的变化曲线等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
高考化学考前冲刺押题预测 化学反应速率与平衡
一.选择题(共20小题)
1.(2025 珠海一模)已知反应R X或R Y,M为中间产物,其反应历程如图。在0℃和40℃下,平衡时产物n(X)/n(Y)分别为70:30和15:85。下列说法正确的是( )
A.稳定性:X>Y
B.两个总反应的决速步不同
C.从0℃升至40℃,反应速率增大程度:v正(X)<v逆(X)
D.从0℃升至40℃c平(X)/c平(R)增大,c平(M)/c平(R)减小
2.(2024秋 九龙坡区期末)1884年勒夏特列提出了平衡移动原理,下列现象或操作不能用该原理解释的是( )
A.接触法制硫酸时,充入适当过量的空气氧化SO2
B.使用铁触媒,使N2和H2混合气体有利于合成氨
C.实验室可用排饱和食盐水溶液的方法收集氯气
D.工业上选择高压条件(10﹣30Mpa)合成氨以提高原料的平衡转化率
3.(2024秋 温州期末)室温下,用0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液和蒸馏水进行如下表所示的五组实验,分别测量浑浊度随时间的变化。(已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)
编号 Na2S2O3溶液 H2SO4溶液 蒸馏水
V/mL V/mL V/mL
① 1.5 3.5 10
② 2.5 3.5 9
③ 3.5 3.5 X
④ 3.5 2.5 9
⑤ 3.5 1.5 10
下列有关说不正确的是( )
A.实验③中x=8
B.在五组实验中,反应速率最慢的是实验①
C.本实验可知,Na2S2O3溶液浓度和H2SO4溶液浓度对该反应速率影响程度不同
D.本实验可以用产生气泡的快慢比较反应速率
4.(2025 山西开学)利用催化技术将汽车尾气中NO和CO转化为CO2和N2为研究不同条件下对该化学反应的影响。某课题组按下表数据进行了实验探究。实验中使用了等质量的同种催化剂,测得CO的浓度随时间的变化如图所示。下列说法正确的是( )
编号 T/℃ c(NO)/(mol L﹣1) c(CO)/(mol L﹣1) 催化剂的比表面积/(m2 g﹣1)
Ⅰ 280 6.50×10﹣3 4.00×10﹣3 80.0
Ⅱ 6.50×10﹣3 4.00×10﹣3 120
Ⅲ 360 6.50×10﹣3 4.00×10﹣3 80.0
A.实验Ⅱ的反应温度为
B.该反应的反应热ΔH>0
C.实验Ⅲ达到平衡时,NO的浓度为3.50×10﹣3mol L﹣1
D.其他条件相同,增大催化剂的比表面积,该反应的反应速率增大,但不影响平衡转化率
5.(2025 选择性模拟)已知制备TaS2的反应为TaI4(g)+S2(g) TaS2(s)+2I2(g)ΔH<0,保持总压强不变,向反应器充入一定量TaI4(g)和S2(g),发生上述反应.测得TaI4(g)平衡转化率与投料比[](温度不变)、温度倒数(投料比不变)关系如图所示,下列叙述错误的是( )
A.其他条件不变,达平衡后充入氩气,平衡不移动
B.曲线①代表TaI4平衡转化率与投料比关系
C.一定条件下,达到平衡时气体平均摩尔质量不变
D.若当投料比为2、温度为T0时TaI4平衡转化率为40%,则TaI4体积分数为40%
6.(2025 昆明一模)甲醇重整制氢涉及三个反应:
反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1
反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2
反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3
反应Ⅰ和反应Ⅱ不同温度下的平衡常数如下表:
反应 398K 498K 598K 698K 798K
Ⅰ 0.5535 185.8 9939.5 1.8×105 1.6×106
Ⅱ 872.7 2.5×104 2.8×105 1.7×106 6.8×106
下列说法正确的是( )
A.相同温度下,
B.反应Ⅰ、Ⅱ在低温下可自发进行
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,反应Ⅱ平衡逆移
D.398K时,向起始容积相同的恒压和恒容两个容器中,均充入1mol CH3OH(g)与1mol H2O(g),恒压条件下H2的平衡产率更高
7.(2025 河北模拟)某温度下,在恒容密闭容器中充入一定量的X(g),发生下列反应:
反应Ⅰ.X(g) Y(g) ΔH1<0
反应Ⅱ.Y(g) Z(g) ΔH2<0
测得各气体浓度与反应时间的关系如图所示。下列说法正确的是( )
A.活化能:Ea(Ⅰ)>Ea(Ⅱ)
B.0~4s内反应Ⅰ的平均速率v(X)=0.25mol L﹣1 s﹣1
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,平衡转化率均升高
D.体系内气体的平均摩尔质量不再变化,则反应达到新平衡
8.(2024秋 德州期末)恒压下,将HCl和O2分别以不同的起始流速通入体积为7L的反应器中,发生反应:2HCl(g)O2(g) Cl2(g)+H2O(g),在T1、T2、T3温度下反应,通过检测流出气体成分绘制HCl转化率(a)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。下列说法错误的是( )
A.T1>T2>T3
B.该反应在低温下可自发进行
C.加入高效催化剂或升温可提高M点转化率
D.若通气1h开始反应,则N点容器体积减少1.225L
9.(2024秋 杭州期末)下列事实不能用勒夏特列原理解释的是( )
A.甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色
B.由NO2和N2O4组成的平衡体系:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.实验室配制氯化铁溶液时,先将FeCl3晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
10.(2024秋 重庆期末)温度为TC时,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)(不考虑副反应)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( )
A.a点v正等于c点的v正
B.c点与b点相比,NO2转化率降低的原因是平衡向逆反应方向移动
C.T℃时,该反应的化学平衡常数
D.向a点的平衡体系中再加入等物质的量的NO2和CO2平衡向逆反应方向移动
11.(2024秋 深圳期末)丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下。
主反应Ⅰ:C2H4(g)+H2(g)+CO(g) CH3CH2CHO(g)ΔH1<0
副反应Ⅱ:C2H4(g)+H2(g) C2H6(g)ΔH2<0
在VL恒容容器中,通入1mol C2H4B2mol H2和1mol CO,相同时间(tmin)内,测得不同温度下C2H4的转化率(a)如图所示(曲线c)。CH3CH2CHO的选择性,已知生成物的选择性跟温度有关。下列说法正确的是( )
A.符合C2H4平衡转化率变化的是曲线a
B.C到D是两个平衡向逆反应方向移动的结果
C.从起始到B点的平均反应速率为
D.A、C两点的CH3CH2CHO的选择性相等
12.(2024秋 秦淮区校级期末)丁烷催化脱氢是工业制备丁烯的主要方法,反应如下:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH>0。为探究工业生产丁烯的合适温度,在体积为1L的容器中,充入10mol丁烷,使用SiO2—CrOx复合催化剂催化丁烷脱氢,相同时间内丁烷的转化率和主要产物的收率分布如题图所示。[收率=(生成某产物的量/参与反应的原料量)×100%]。下列说法不正确的是( )
A.590℃生成丁烯的物质的量为0.55mol
B.590℃以后,温度升高,丁烯的收率降低,原因是副产物增多
C.丁烷转化率增大的原因可能是温度升高平衡右移,丁烷的转化率增大
D.欲使工业生产丁烯的收率更高,应选用低温下选择性更好的高效催化剂
13.(2025 湖南开学)已知:反应aA(g)+bB(g) cC(g)+dD(g)的物质的量分数平衡常数,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。向某刚性密闭容器中加入CO2(g)和足量的C(s)发生反应CO2(g)+C(s) 2CO(g)ΔH>0,反应的正反应平衡常数Kx正和逆反应平衡常数Kx逆迪的lnKx随温度的变化如图所示。当温度为1000K时,下列叙述错误的是( )
A.表示Kx正随变化的曲线为L2
B.达到平衡时,CO2的体积分数大于50%
C.达到平衡时,升高温度,v正、v逆均增大,且平衡前v正>v逆
D.若向上述平衡体系中充入一定量的CO,再次平衡后容器内CO的物质的量分数变小
14.(2024秋 九龙坡区期末)向一恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:vb逆<vc逆
C.向b点所在体系充入惰性气体,平衡不发生移动
D.点a、b、c对应的平衡常数:Ka<Kb=Kc
15.(2025 湖南模拟)已知制备光气COCl2的反应为CO(g)+Cl2(g) COCl2(g)ΔH<0,将等物质的量的CO(g)和Cl2(g)充入密闭容器中,平衡体系中,平衡混合物的平均摩尔质量M在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:Ka=Kb<Kc
C.Cl2的平衡转化率:c>a=b
D.b点时,若M=80g mol﹣1,则CO的平衡转化率为50%
16.(2025 湖南模拟)在某催化剂作用下双氧水分解:2H2O2(aq)=2H2O(l)+O2(g)。向某容器中投入足量双氧水,测得双氧水浓度与反应时间关系如图所示。已知:双氧水浓度减小一半所用时间叫半衰期。下列叙述错误的是( )
A.温度升高,双氧水分解速率加快
B.反应速率:a>b
C.ab段平均速率:
D.此条件下,双氧水半衰期与初始浓度成正比
17.(2024秋 朝阳区期末)2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,它由两步反应组成:
ⅰ.H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1
ⅱ.SO3(g)分解。
反应ⅱ在927℃时SO3的实际转化率(曲线a)和727℃时SO3的平衡转化率(曲线b)如图所示。下列说法不正确的是( )
A.2SO3(g) 2SO2(g)+O2(g)ΔH=+196kJ mol﹣1
B.曲线a表示反应ⅱ已经处于化学平衡状态
C.图中X点所示条件下,延长反应时间能提高SO3的转化率
D.减小压强有利于提高H2SO4分解的平衡转化率
18.(2024秋 罗湖区期末)利用催化技术,通过反应2NOx+2xCO N2+2xCO2ΔH>0,可将汽车尾气中的NOx除去。在密闭容器中模拟该反应,下列措施中既能提高NOx的平衡去除率又能加快去除速率的是( )
A.适当升高温度
B.不断移走N2和CO2
C.恒容时充入一定量Ar(g)
D.增大催化剂比表面积
19.(2024秋 河东区期末)向体积均为1L的甲、乙两个恒容密闭容器中分别充入1mol O2和4mol HBr,发生反应:4HBr(g)+O2(g) 2Br2(g)+2H2O(g)ΔH。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是( )
A.乙在恒温条件下进行,ΔH<0
B.恒温过程比绝热过程的反应速率小
C.a点的正反应速率大于c点的正反应速率
D.平衡常数:K甲>K乙
20.(2025 湖南校级一模)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z。
反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30min时间段内,Y的平均反应速率为2.5×10﹣3mol L﹣1 min﹣1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时37.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
高考化学考前冲刺押题预测 化学反应速率与平衡
参考答案与试题解析
一.选择题(共20小题)
1.(2025 珠海一模)已知反应R X或R Y,M为中间产物,其反应历程如图。在0℃和40℃下,平衡时产物n(X)/n(Y)分别为70:30和15:85。下列说法正确的是( )
A.稳定性:X>Y
B.两个总反应的决速步不同
C.从0℃升至40℃,反应速率增大程度:v正(X)<v逆(X)
D.从0℃升至40℃c平(X)/c平(R)增大,c平(M)/c平(R)减小
【答案】C
【分析】A.物质能量越低,越稳定;
B.两个过程中,第一步活化能均大于第二步,而活化能越大,反应速率越小;
C.R转化为X的过程是放热反应,升高温度,平衡向吸热反应方向移动;
D.是R X的平衡常数,是R M的平衡常数,结合反应热效应,判断升高温度平衡移动方向,进而判断平衡常数变化。
【解答】解:A.X的能量比Y高,物质能量越低,越稳定,则稳定性:X<Y,故A错误;
B.两个过程中,第一步活化能均大于第二步,而活化能越大,反应速率越小,两个反应的决速步都是第一步,故B错误;
C.R X是放热反应,升高温度,平衡逆向移动,则升高温度,反应速率增大程度:v正(X)<v逆(X),故C正确;
D.是R X的平衡常数,该反应正反应是放热反应,升高温度,平衡逆向移动,则减小,而是R M平衡常数,该反应正反应是吸热反应,升高温度,平衡正向移动,增大,故D错误;
故选:C。
【点评】本题考查化学反应速率与化学平衡、化学反应中能量变化,题目比较综合,需要学生具备扎实的基础与灵活运用的能力。
2.(2024秋 九龙坡区期末)1884年勒夏特列提出了平衡移动原理,下列现象或操作不能用该原理解释的是( )
A.接触法制硫酸时,充入适当过量的空气氧化SO2
B.使用铁触媒,使N2和H2混合气体有利于合成氨
C.实验室可用排饱和食盐水溶液的方法收集氯气
D.工业上选择高压条件(10﹣30Mpa)合成氨以提高原料的平衡转化率
【答案】B
【分析】勒夏特列原理的内容是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释。
【解答】解:A.接触法制硫酸时,充入适当过量的空气增大了氧气浓度,平衡向着生成三氧化硫的方向移动,从而提高了SO2的转化率,能用勒夏特列原理解释,故A错误;
B.铁传媒为催化剂,催化剂能改变反应速率,但不影响该化学平衡,不能用勒夏特列原理解释,故B正确;
C.Cl2溶于水存在平衡:Cl2+H2O H++Cl﹣+HClO,饱和食盐水溶液中Cl﹣浓度增大,上述平衡逆向移动,导致Cl2的消耗量和溶解度减小,所以实验室可用排饱和食盐水溶液的方法收集氯气,能用勒夏特列原理解释,故C错误;
D.合成氨的正反应气体体积减小,增大压强平衡正向移动,所以工业上选择高压条件(10~30Mpa)合成氨以提高原料的平衡转化率,能用勒夏特列原理解释,故D错误;
故选:B。
【点评】本题考查勒夏特列原理的应用,明确勒夏特列原理的内容为解答关键,注意使用平衡移动原理的前提必须是可逆反应,题目难度不大。
3.(2024秋 温州期末)室温下,用0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液和蒸馏水进行如下表所示的五组实验,分别测量浑浊度随时间的变化。(已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)
编号 Na2S2O3溶液 H2SO4溶液 蒸馏水
V/mL V/mL V/mL
① 1.5 3.5 10
② 2.5 3.5 9
③ 3.5 3.5 X
④ 3.5 2.5 9
⑤ 3.5 1.5 10
下列有关说不正确的是( )
A.实验③中x=8
B.在五组实验中,反应速率最慢的是实验①
C.本实验可知,Na2S2O3溶液浓度和H2SO4溶液浓度对该反应速率影响程度不同
D.本实验可以用产生气泡的快慢比较反应速率
【答案】D
【分析】由图可知,实验③中反应速率最快,由控制变量法可知总体积为15mL,实验①、②、③中Na2S2O3溶液浓度不同,图中③、④、⑤速率接近,①、②、③速率差异大,据此分析解题。
【解答】解:A.本实验探究需控制单一变量,则2.5+3.5+9=3.5+3.5+x,解得:x=8,故A正确;
B.Na2S2O3溶液浓度的改变对速率影响更大,在五组实验中,实验①的Na2S2O3溶液浓度最小,则反应速率最慢的是实验①,故B正确;
C.实验①②③的变量为Na2S2O3溶液浓度,③④⑤的变量为H2SO4溶液浓度,Na2S2O3溶液浓度的改变对速率影响更大,该推断的证据是达到相同浑浊度时,实验①②③所需时间的改变量大于实验③④⑤所需时间的改变量,故C正确;
D.已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,产生S沉淀,溶液生成黄色硫单质的现象更明显,可以通过出现浑浊需要的时间来判断反应速率快慢,故D错误;
故选:D。
【点评】本题考查反应速率,侧重考查学生影响速率因素的掌握情况,试题难度中等。
4.(2025 山西开学)利用催化技术将汽车尾气中NO和CO转化为CO2和N2为研究不同条件下对该化学反应的影响。某课题组按下表数据进行了实验探究。实验中使用了等质量的同种催化剂,测得CO的浓度随时间的变化如图所示。下列说法正确的是( )
编号 T/℃ c(NO)/(mol L﹣1) c(CO)/(mol L﹣1) 催化剂的比表面积/(m2 g﹣1)
Ⅰ 280 6.50×10﹣3 4.00×10﹣3 80.0
Ⅱ 6.50×10﹣3 4.00×10﹣3 120
Ⅲ 360 6.50×10﹣3 4.00×10﹣3 80.0
A.实验Ⅱ的反应温度为
B.该反应的反应热ΔH>0
C.实验Ⅲ达到平衡时,NO的浓度为3.50×10﹣3mol L﹣1
D.其他条件相同,增大催化剂的比表面积,该反应的反应速率增大,但不影响平衡转化率
【答案】D
【分析】A.实验Ⅰ和Ⅱ催化剂比表面积不同,温度应相同;
B.温度升高,平衡时CO浓度升高,平衡逆向移动,该反应为放热反应;
C.实验Ⅲ达到平衡时,NO的浓度为4.50×10﹣3mol L﹣1;
D.增大催化剂的比表面积,化学反应速率增大,但平衡转化率不变;
【解答】解:A.根据单一变量原则,实验Ⅰ和Ⅱ催化剂比表面积不同,温度应该相同,则实验Ⅱ的反应温度为280℃,故A错误;
B.对比反应Ⅰ和Ⅲ,温度升高,平衡时CO浓度升高,平衡逆向移动,说明ΔH<0,故B错误;
C.化学方程式为2NO+2CO2CO2+N2,实验Ⅲ达到平衡时,NO的浓度为4.50×10﹣3mol L﹣1,故C错误;
D.实验Ⅰ、Ⅱ催化剂比表面积不同,增大催化剂的比表面积,化学反应速率增大,但平衡转化率不变,故D正确;
故选:D。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
5.(2025 选择性模拟)已知制备TaS2的反应为TaI4(g)+S2(g) TaS2(s)+2I2(g)ΔH<0,保持总压强不变,向反应器充入一定量TaI4(g)和S2(g),发生上述反应.测得TaI4(g)平衡转化率与投料比[](温度不变)、温度倒数(投料比不变)关系如图所示,下列叙述错误的是( )
A.其他条件不变,达平衡后充入氩气,平衡不移动
B.曲线①代表TaI4平衡转化率与投料比关系
C.一定条件下,达到平衡时气体平均摩尔质量不变
D.若当投料比为2、温度为T0时TaI4平衡转化率为40%,则TaI4体积分数为40%
【答案】B
【分析】A.该反应是气体分子数不变的反应,总压强不变,充入惰性气体,体积增大,相当于减压;
B.温度不变,投料比越大,TaI4平衡转化率越小,曲线②代表TaI4平衡转化率与投料比关系,投料比不变,降低温度,TaI4平衡转化率越大;
C.气体平均摩尔质量为,根据反应可知,反应后有固体存在,因此气体总质量发生改变,则气体平均摩尔质量在改变;
D.用三段式计算:投料比为2,平衡转化率为40%,则计算如下:
TaI4(g)+S2(g) TaS2(s)+2I2(g)
起始/mol:2 1 0 0
变化/mol:0.8 0.8 0.8 1.6
平衡/mol:1.2 0.2 0.8 1.6。
【解答】解:A.该反应是气体分子数不变的反应,总压强不变,充入惰性气体,体积增大,相当于减压,平衡不移动,故A正确;
B.温度不变,投料比越大,TaI4平衡转化率越小,曲线②代表TaI4平衡转化率与投料比关系,投料比不变,降低温度,TaI4平衡转化率越大,曲线①代表TaI4平衡转化率与的关系,故B错误;
C.气体平均摩尔质量为,根据反应可知,反应后有固体存在,因此气体总质量发生改变,则气体平均摩尔质量在改变,因此当气体平均摩尔质量保持不变时,达到平衡,故C正确;
D.用三段式计算:投料比为2,平衡转化率为40%,则计算如下:
TaI4(g)+S2(g) TaS2(s)+2I2(g)
起始/mol:2 1 0 0
变化/mol:0.8 0.8 0.8 1.6
平衡/mol:1.2 0.2 0.8 1.6
平衡时TaI4体积分数为,故D正确;
故选:B。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
6.(2025 昆明一模)甲醇重整制氢涉及三个反应:
反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1
反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2
反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3
反应Ⅰ和反应Ⅱ不同温度下的平衡常数如下表:
反应 398K 498K 598K 698K 798K
Ⅰ 0.5535 185.8 9939.5 1.8×105 1.6×106
Ⅱ 872.7 2.5×104 2.8×105 1.7×106 6.8×106
下列说法正确的是( )
A.相同温度下,
B.反应Ⅰ、Ⅱ在低温下可自发进行
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,反应Ⅱ平衡逆移
D.398K时,向起始容积相同的恒压和恒容两个容器中,均充入1mol CH3OH(g)与1mol H2O(g),恒压条件下H2的平衡产率更高
【答案】D
【分析】A.根据盖斯定律,Ⅱ=Ⅰ+Ⅲ;
B.反应Ⅰ温度升高,K增大,ΔH>0,ΔS>0,反应Ⅱ温度升高,K增大,ΔH>0,ΔS>0;
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大;
D.恒压条件下,随着反应进行,气体分子数增多,容器的体积增大,相当于减小压强。
【解答】解:A.反应Ⅰ.CH3OH(g) CO(g)+2H2(g) K1;反应Ⅱ.CH3OH(g)+H2O(g) CO2(g)+3H2(g) K2;反应Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) K3;根据盖斯定律,Ⅱ=Ⅰ+Ⅲ,所以,K2=K1×K3,故A错误;
B.反应Ⅰ温度升高,K增大,ΔH>0,ΔS>0,高温下能自发,反应Ⅱ温度升高,K增大,ΔH>0,ΔS>0,在高温下可自发进行,故B错误;
C.恒容恒温体系中,反应达平衡后充入稀有气体,体系压强增大,个组分浓度不变,反应Ⅱ平衡不移动,故C错误;
D.恒压条件下,随着反应进行,气体分子数增多,容器的体积增大,相当于减小压强,有利于气体分子数增多的反应,所以恒压条件下H2的平衡产率更高,故D正确;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
7.(2025 河北模拟)某温度下,在恒容密闭容器中充入一定量的X(g),发生下列反应:
反应Ⅰ.X(g) Y(g) ΔH1<0
反应Ⅱ.Y(g) Z(g) ΔH2<0
测得各气体浓度与反应时间的关系如图所示。下列说法正确的是( )
A.活化能:Ea(Ⅰ)>Ea(Ⅱ)
B.0~4s内反应Ⅰ的平均速率v(X)=0.25mol L﹣1 s﹣1
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,平衡转化率均升高
D.体系内气体的平均摩尔质量不再变化,则反应达到新平衡
【答案】B
【分析】A.活化能越大,反应越慢;
B.4s末时Y为0.8mol/L、Z为0.2mol/L,即0~4s内X减少了0.8+0.2=1.0mol/L,故0~4s内反应Ⅰ的平均速率;
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,由题干信息可知,两个反应均为放热反应,则升高温度平衡逆向移动;
D.由题干信息可知,两个反应前后气体的系数均保持不变,即反应体系中气体的总物质的量一直不变,混合气体的质量不变,即体系内气体的平均摩尔质量一直保持不变。
【解答】解:A.活化能越大,反应越慢;反应开始一段时间内Y的浓度变化快,Z的浓度变化慢,故反应①活化能低,反应②活化能高,即Ea(Ⅰ)<Ea(Ⅱ),故A错误;
B.4s末时Y为0.8mol/L、Z为0.2mol/L,故0~4s内反应Ⅰ的平均速率,故B正确;
C.升高温度,反应Ⅰ、Ⅱ的速率均增大,由题干信息可知,两个反应均为放热反应,则升高温度平衡逆向移动,故平衡转化率均减小,故C错误;
D.由题干信息可知,两个反应前后气体的系数均保持不变,即反应体系中气体的总物质的量一直不变,混合气体的质量不变,即体系内气体的平均摩尔质量一直保持不变,故体系内气体的平均摩尔质量不再变化,不能说明反应达到新平衡,故D错误;
故选:B。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
8.(2024秋 德州期末)恒压下,将HCl和O2分别以不同的起始流速通入体积为7L的反应器中,发生反应:2HCl(g)O2(g) Cl2(g)+H2O(g),在T1、T2、T3温度下反应,通过检测流出气体成分绘制HCl转化率(a)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。下列说法错误的是( )
A.T1>T2>T3
B.该反应在低温下可自发进行
C.加入高效催化剂或升温可提高M点转化率
D.若通气1h开始反应,则N点容器体积减少1.225L
【答案】D
【分析】根据题给信息,较低流速下转化率视为平衡转化率,则由图可以看出,P点以后,流速较大,说明此时的转化率不是平衡转化率,此时反应未达到平衡状态。
【解答】解:根据题给信息,较低流速下转化率视为平衡转化率,则由图可以看出,P点以后,流速较大,说明此时的转化率不是平衡转化率,此时反应未达到平衡状态;
A.P点以后,流速较高,反应未达平衡状态,温度越高,反应速率越快,单位时间内氯化氢的转化率越高。在P点后,同一流速下,T1温度下的氯化氢的转化率最大,T3温度下的氯化氢的转化率最小,说明温度T1>T2>T3,故A正确;
B.根据题给信息,较低流速下转化率近似为平衡转化率,在较低流速时,T3转化率最大,T1转化率最小,温度T1>T2>T3,则此反应是放热反应,并且ΔS<0,根据ΔG=ΔH﹣TΔS<0是自发进行,所以此反应必须在低温下才能自发进行,故B正确;
C.M点未达到平衡状态,使用高效催化剂或升高温度,可以增大反应速率,使M点HCl的转化率增加,故加入高效催化剂或升温可提高M点转化率,故C正确;
D.由图可知,N点气流流速为0.16mol/h,以1h为单位带入气体流量,可知n(HCl)始为0.16mol,则n(O2)始为0.12mol。N点时HCl转化率为70%,N点时转化的HCl的物质的量=0.16mol×70%=0.112mol,根据“三段式”有:
2HCl(g)O2(g) Cl2(g)+H2O(g)
起始/mol:0.16 0.12 0 0
起始/mol:0.112 0.028 0.056 0.056
起始/mol:0.048 0.092 0.056 0.056
同温同压下,容器起始体积和N点时容器的体积关系为:,VN=6.3L,则N点容器体积减少7L﹣6.3L=0.7L,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
9.(2024秋 杭州期末)下列事实不能用勒夏特列原理解释的是( )
A.甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色
B.由NO2和N2O4组成的平衡体系:2NO2(g) N2O4(g),恒温缩小容积,平衡后气体颜色比原平衡深
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,以制备金属钾
D.实验室配制氯化铁溶液时,先将FeCl3晶体溶解在较浓的盐酸中,然后加水稀释到需要的浓度
【答案】B
【分析】A.甲基橙指示剂的变色范围为pH值3.1~4.4,pH<3.1为红色,pH>4.4为黄色;
B.恒温缩小容积,体系压强增大,反应2NO2(g) N2O4(g)正向移动,n(NO2)减少,气体颜色变深,是由于缩小容积后c(NO2)增大;
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,平衡正向移动;
D.氯化铁溶液中存在平衡Fe3++3H2O 3H++Fe(OH)3,先将其晶体溶于较浓盐酸中,抑制Fe3+水解。
【解答】解:A.甲基橙在中性或碱性溶液中是以磺酸钠盐的形式存在,在酸性溶液中转化为磺酸,甲基橙滴加到pH=2的溶液中呈红色,滴加到pH=6的溶液中呈黄色,可以用平衡移动原理解释,故A正确;
B.恒温缩小容积,体系压强增大,反应2NO2(g) N2O4(g)正向移动,n(NO2)减少,气体颜色变深,是由于缩小容积后c(NO2)增大,颜色变深,故不能用平衡移动原理解释,故B错误;
C.Na(l)+KCl(l) 2NaCl(l)+K(g),工业上将钾蒸气从反应混合体系中分离出来,平衡正向移动,以制备金属钾,能用平衡移动原理解释,故C错误;
D.氯化铁溶液中存在平衡Fe3++3H2O 3H++Fe(OH)3,先将其晶体溶于较浓盐酸中,抑制Fe3+水解,能用平衡移动原理解释,故D错误;
故选:B。
【点评】本题考查了化学平衡移动原理的应用,题目难度不大,明确平衡移动原理的内容为解答关键,注意明确使用平衡移动原理的前提必须是可逆过程,且与平衡移动有关。
10.(2024秋 重庆期末)温度为TC时,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)(不考虑副反应)。反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是( )
A.a点v正等于c点的v正
B.c点与b点相比,NO2转化率降低的原因是平衡向逆反应方向移动
C.T℃时,该反应的化学平衡常数
D.向a点的平衡体系中再加入等物质的量的NO2和CO2平衡向逆反应方向移动
【答案】D
【分析】图中b点NO2的转化率最高,则温度为T℃时,b点恰好达到平衡状态,由于ab曲线上对应容器的体积逐渐增大,NO2的起始浓度逐渐减小,但浓度均大于b点,NO2的浓度越大,反应速率越大,达到平衡的时间越短,所以ab曲线上反应均达到平衡状态,反应正向是气体体积增大的反应,随着容器体积的增大,NO2的转化率逐渐增大,b点达到最大;b点以后,随着容器体积的增大,NO2的起始浓度减小,反应速率减慢,达到平衡的时间延长,所以bc曲线上反应均未达到平衡状态,由于NO2的起始浓度低,则反应正向进行。
【解答】解:A.a点体积小于c点的体积,a点v正大于c点的v正,故A错误;
B.c点与b点相比,NO2转化率降低是因为还没有达到平衡状态,体积减小,反应速率加快,反应正向进行,故B错误;
C.T℃时,b点恰好达到化学平衡状态,NO2的转化率为80%,物质的量变化为0.8mol,剩余0.2mol,生成N2的物质的量为0.4mol,生成CO2的物质的量为0.8mol,化学平衡常数Kcmol/L,故C错误;
D.a点NO2的转化率为40%,物质的量变化为0.4mol,剩余0.6mol,生成N2的物质的量为0.2mol,生成CO2的物质的量为0.4mol,化学平衡常数Kcmol/L,加入等物质的量的NO2和CO2时,Q,此时Q>K平衡逆向移动,故D正确;
故选:D。
【点评】本题考查化学平衡的计算、化学平衡的影响因素和平衡图象分析判断,为高频考点,侧重学生的分析、计算和推理等综合运用能力的考查,明确外界因素对化学平衡的影响、把握图象信息分析是解题的关键,注意平衡常数的表达式和三段式格式在平衡计算中的应用,题目难度较大。
11.(2024秋 深圳期末)丙醛是一种重要的有机原料,在许多领域都有广泛的应用。在铑催化剂作用下,乙烯羰基合成丙醛涉及的反应如下。
主反应Ⅰ:C2H4(g)+H2(g)+CO(g) CH3CH2CHO(g)ΔH1<0
副反应Ⅱ:C2H4(g)+H2(g) C2H6(g)ΔH2<0
在VL恒容容器中,通入1mol C2H4B2mol H2和1mol CO,相同时间(tmin)内,测得不同温度下C2H4的转化率(a)如图所示(曲线c)。CH3CH2CHO的选择性,已知生成物的选择性跟温度有关。下列说法正确的是( )
A.符合C2H4平衡转化率变化的是曲线a
B.C到D是两个平衡向逆反应方向移动的结果
C.从起始到B点的平均反应速率为
D.A、C两点的CH3CH2CHO的选择性相等
【答案】C
【分析】A.放热反应,升温时平衡均逆向移动;
B.A、B、C、D均处于正向进行过程;
C.根据平均速率计算公式计算;
D.不同温度下CH3CH2CHO选择性有所不同;
【解答】解:A.由于反应Ⅰ、Ⅱ均为放热反应,升温时平衡均逆向移动,平衡转化率将减小,故A错误;
B.图中A、B、C、D的转化率均未达到相同温度时的平衡转化率,均处于正向进行过程,故B错误;
C.按照平均速率计算公式表示从起始到B点的平均反应速率为mol,故C正确;
D.A、C两点的C2H4的转化率相等,但是不同温度下CH3CH2CHO选择性有所不同,故D错误;
故选:C。
【点评】本题考查反应中的能量变化和化学平衡,侧重考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
12.(2024秋 秦淮区校级期末)丁烷催化脱氢是工业制备丁烯的主要方法,反应如下:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH>0。为探究工业生产丁烯的合适温度,在体积为1L的容器中,充入10mol丁烷,使用SiO2—CrOx复合催化剂催化丁烷脱氢,相同时间内丁烷的转化率和主要产物的收率分布如题图所示。[收率=(生成某产物的量/参与反应的原料量)×100%]。下列说法不正确的是( )
A.590℃生成丁烯的物质的量为0.55mol
B.590℃以后,温度升高,丁烯的收率降低,原因是副产物增多
C.丁烷转化率增大的原因可能是温度升高平衡右移,丁烷的转化率增大
D.欲使工业生产丁烯的收率更高,应选用低温下选择性更好的高效催化剂
【答案】D
【分析】A.590℃时,丁烯的收率为20%,丁烷转化率为27.5%;
B.590℃时丁烯的收率最高;
C.制备乙烯的反应为吸热反应,升高温度平衡正向移动;
D.低温下,丁烷的转化率较低,即使选用低温下选择性更好的高效催化剂。
【解答】解:A.590℃时,丁烯的收率为20%,丁烷转化率为27.5%,则生成的正丁烯的物质的量为10×20%×27.5%=0.55mol,故A正确;
B.590℃时丁烯的收率最高,温度升高,丁烯的收率降低,副产物增多,故B正确;
C.制备乙烯的反应为吸热反应,升高温度平衡正向移动,丁烷的转化率增大,故C正确;
D.低温下,丁烷的转化率较低,即使选用低温下选择性更好的高效催化剂,也不能使丁烯的收率更高,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡图像的掌握情况,试题难度中等。
13.(2025 湖南开学)已知:反应aA(g)+bB(g) cC(g)+dD(g)的物质的量分数平衡常数,其中x(A)、x(B)、x(C)、x(D)为各组分的物质的量分数。向某刚性密闭容器中加入CO2(g)和足量的C(s)发生反应CO2(g)+C(s) 2CO(g)ΔH>0,反应的正反应平衡常数Kx正和逆反应平衡常数Kx逆迪的lnKx随温度的变化如图所示。当温度为1000K时,下列叙述错误的是( )
A.表示Kx正随变化的曲线为L2
B.达到平衡时,CO2的体积分数大于50%
C.达到平衡时,升高温度,v正、v逆均增大,且平衡前v正>v逆
D.若向上述平衡体系中充入一定量的CO,再次平衡后容器内CO的物质的量分数变小
【答案】B
【分析】A.正反应为吸热反应,温度越高,平衡常数越大;
B.平衡时CO2的体积分数小于50%;
C.正反应为吸热反应,温度越高,v正、v逆均增大;
D.冲入CO加压再次平衡后容器内CO的物质的量分数较原平衡体系变小;
【解答】解:A.该反应的正反应为吸热反应,温度越高,平衡常数越大,所以表示Kx正随变化的曲线为L2,故A正确;
B.当CO2的体积分数等于50%时,Kx1,所以反应还会正向进行,平衡时CO2的体积分数小于50%,故B错误;
C.该反应的正反应为吸热反应,温度越高,v正、v逆均增大,且平衡前v正>v逆,故C正确;
D.向平衡体系中充入一定量的CO,相当于加压,再次平衡后容器内CO的物质的量分数较原平衡体系变小,故D正确;
故选:B。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
14.(2024秋 九龙坡区期末)向一恒容密闭容器中加入1mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是( )
A.x1<x2
B.反应速率:vb逆<vc逆
C.向b点所在体系充入惰性气体,平衡不发生移动
D.点a、b、c对应的平衡常数:Ka<Kb=Kc
【答案】B
【分析】A.投料比x越小,CH4平衡转化率就越大;
B.c点温度相同,b点中H2O(g)的浓度大于c点;
C.恒温恒容向体系的惰性气体,化学平衡不移动;
D.升高温度,甲烷转化率增大;
【解答】解:A.加入的H2O(g)量越大,投料比x越小,CH4平衡转化率就越大,所以x1<x2,故A正确;
B.c点温度相同,x1<x2,b点中H2O(g)的浓度大于c点,则vb逆>vc逆,故B错误;
C.恒温恒容条件下,向反应体系充入不参与反应的惰性气体,反应体系中各物质的浓度,化学平衡不移动,故C正确;
D.升高温度,甲烷转化率增大,说明反应为吸热反应,升高温度平衡常数增大,故D正确;
故选:B。
【点评】本题考查反应中的能量变化和化学平衡,考查平衡状态的判断和条件改变平衡移动的掌握情况,试题难度中等。
15.(2025 湖南模拟)已知制备光气COCl2的反应为CO(g)+Cl2(g) COCl2(g)ΔH<0,将等物质的量的CO(g)和Cl2(g)充入密闭容器中,平衡体系中,平衡混合物的平均摩尔质量M在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1<T2
B.平衡常数:Ka=Kb<Kc
C.Cl2的平衡转化率:c>a=b
D.b点时,若M=80g mol﹣1,则CO的平衡转化率为50%
【答案】C
【分析】A.CO(g)+Cl2(g) COCl2(g) ΔH<0,升高温度,平衡左移;
B.a、c两点温度相同,平衡常数相同,Ka=Kc,升高温度,平衡左移;
C.M越大,混合气体中COCl2(g)的含量越高,反应物的转化率越大;
D.CO与Cl2等物质的量混合,设起始时n(CO)=n(Cl2)=1mol,设CO转化了xmol,则,解得x=0.7625。
【解答】解:A.升高温度,平衡左移,n增大,M减小,T1>T2,故A错误;
B.平衡常数只与温度有关,a、c两点温度相同,则Ka=Kc,升高温度,平衡左移,平衡常数减小,则Kb<Kc,故B错误;
C.M越大,混合气体中COCl2(g)的含量越高,反应物的转化率越大,Cl2的平衡转化率:c>b=a,故C正确;
D.CO与Cl2等物质的量混合,设起始时n(CO)=n(Cl2)=1mol,设CO转化了xmol,则,解得x=0.7625,即CO的转化率为76.25%,故D错误;
故选:C。
【点评】本题考查化学平衡,侧重考查学生平衡计算的掌握情况,试题难度中等。
16.(2025 湖南模拟)在某催化剂作用下双氧水分解:2H2O2(aq)=2H2O(l)+O2(g)。向某容器中投入足量双氧水,测得双氧水浓度与反应时间关系如图所示。已知:双氧水浓度减小一半所用时间叫半衰期。下列叙述错误的是( )
A.温度升高,双氧水分解速率加快
B.反应速率:a>b
C.ab段平均速率:
D.此条件下,双氧水半衰期与初始浓度成正比
【答案】D
【分析】A.温度升高,速率加快;
B.浓度增大,速率快;
C.ab段平均速率v(H2O2);
D.双氧水浓度减小一半所用时间均为20s,与起始浓度无关。
【解答】解:A.温度升高,速率加快;温度升高,双氧水分解速率加快,故A正确;
B.浓度增大,速率快;a点c(H2O2)大,反应速率快,故B正确;
C.ab段平均速率v(H2O2),故C正确;
D.由题图可知,双氧水浓度减小一半所用时间均为20s,即双氧水半衰期为20s,与起始浓度无关,故D错误;
故选:D。
【点评】本题考查化学平衡,侧重考查学生平衡移动的掌握情况,试题难度中等。
17.(2024秋 朝阳区期末)2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,它由两步反应组成:
ⅰ.H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1
ⅱ.SO3(g)分解。
反应ⅱ在927℃时SO3的实际转化率(曲线a)和727℃时SO3的平衡转化率(曲线b)如图所示。下列说法不正确的是( )
A.2SO3(g) 2SO2(g)+O2(g)ΔH=+196kJ mol﹣1
B.曲线a表示反应ⅱ已经处于化学平衡状态
C.图中X点所示条件下,延长反应时间能提高SO3的转化率
D.减小压强有利于提高H2SO4分解的平衡转化率
【答案】B
【分析】A.①2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,②H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1,盖斯定律计算①﹣②×2得到2SO3(g) 2SO2(g)+O2(g)ΔH分析判断;
B.曲线a是反应ⅱ在927℃时SO3的实际转化率,一定温度下,随着压强变化,转化率发生变化;
C.图中X点所示条件下,反应未达到平衡状态,延长反应时间能提高SO3的转化率;
D.减小压强平衡向气体体积增大的方向进行。
【解答】解:A.①2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,②H2SO4(l) SO3(g)+H2O(g)ΔH=+177kJ mol﹣1,盖斯定律计算①﹣②×2得到2SO3(g) 2SO2(g)+O2(g)ΔH=(+550kJ mol﹣1)﹣(+177kJ mol﹣1)×2=+196kJ/mol,故A正确;
B.曲线a是反应ⅱ在927℃时SO3的实际转化率,随着压强变化,转化率变化,不能说明反应达到平衡状态,故B错误;
C.图中X点所示条件下,反应未达到平衡状态,延长反应时间可以提高SO3的转化率,故C正确;
D.2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)ΔH=+550kJ mol﹣1,反应为前提条件增大的反应,减小压强有利于平衡正向进行,有利于提高H2SO4分解的平衡转化率,故D正确;
故选:B。
【点评】本题考查了化学平衡影响因素分析判断、热化学方程式的计算应用,注意知识的熟练掌握,题目难度中等。
18.(2024秋 罗湖区期末)利用催化技术,通过反应2NOx+2xCO N2+2xCO2ΔH>0,可将汽车尾气中的NOx除去。在密闭容器中模拟该反应,下列措施中既能提高NOx的平衡去除率又能加快去除速率的是( )
A.适当升高温度
B.不断移走N2和CO2
C.恒容时充入一定量Ar(g)
D.增大催化剂比表面积
【答案】A
【分析】提高NOx的平衡去除率可以使平衡正向移动,加快去除速率可以升温或者催化剂,据此进行解答。
【解答】解:A.适当升高温度既能提高NOx的平衡去除率又能加快去除速率,故A正确;
B.不断移走N2和CO2,不能加快去除速率,故B错误;
C.恒容时充入一定量Ar(g)对反应速率无影响,故C错误;
D.增大催化剂比表面积不能提高NOx的平衡去除率,故D错误;
故选:A。
【点评】本题考查化学反应速率和平衡移动的相关知识,题目比较简单。
19.(2024秋 河东区期末)向体积均为1L的甲、乙两个恒容密闭容器中分别充入1mol O2和4mol HBr,发生反应:4HBr(g)+O2(g) 2Br2(g)+2H2O(g)ΔH。分别在绝热、恒温条件下进行,两反应体系的压强随时间的变化曲线如图所示。下列说法错误的是( )
A.乙在恒温条件下进行,ΔH<0
B.恒温过程比绝热过程的反应速率小
C.a点的正反应速率大于c点的正反应速率
D.平衡常数:K甲>K乙
【答案】D
【分析】A.恒温恒容条件下,容器中气体的压强与气体的物质的量成正比,根据方程式知,反应前后气体的物质的量之和减小,则压强减小,所以曲线乙在恒温条件下进行;甲在绝热条件下进行,随着反应的进行,容器内压强先增大后减小,说明开始时温度对压强的影响大于气体的物质的量,该反应为放热反应;
B.温度越高、压强越大反应速率越快;
C.压强越大、温度越高反应速率越快;
D.该反应的正反应为放热反应,温度越高,化学平衡常数越小。
【解答】解:A.曲线甲恒容密闭容器中压强增大,说明甲在绝热过程进行,乙在恒温过程进行,故A正确;
B.温度越高、压强越大反应速率越快,绝热时温度、压强都比恒温时大,则恒温过程比绝热过程的反应速率小,故B正确;
C.压强越大、温度越高反应速率越快,a点温度和压强都大于c点,则a点的正反应速率大于c点的正反应速率,故C正确;
D.该反应的正反应为放热反应,温度越高,化学平衡常数越小,甲的温度大于乙,则平衡常数:K甲<K乙,故D错误;
故选:D。
【点评】本题考查化学平衡的影响因素,侧重考查图象分析判断及知识综合运用能力,明确外界条件对化学反应速率、化学平衡影响原理是解本题关键,题目难度不大。
20.(2025 湖南校级一模)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z。
反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法错误的是( )
A.0~30min时间段内,Y的平均反应速率为2.5×10﹣3mol L﹣1 min﹣1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时37.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
【答案】C
【分析】由图可知:M的起始浓度为0.5 mol/L,反应①的速率v1=k1c2(M),反应②的速率v2=k2c2(M)(k1、k2为速率常数)。则同一反应体系中反应①、②的速率之比始终不变,所以Y、Z的浓度变化之比始终不变;①M+N=X+Y、②M+N=X+Z,则体系中始终有c(Y)+c(Z)=△c (M),由图可知:30 min时△c(M)=0.5 mol/L﹣0.300 mol/L=0.2 mol/L;c(Z)=0.125 mol/L,则c (Y)=0.2 mol/L﹣0.125 mol/L=0.075 mol/L,即反应开始后,体系中Y和Z的浓度之比为0.075 mol/L:0.125 mol/L=3:5;结合反应的活化能与反应速率关系比较反应①、②的活化能大小,根据v和转化率公式计算反应速率和转化率,据此分析解答。
【解答】解:A.30min时,M、Z的浓度分别为0.300mol L﹣1和0.125 mol L﹣1,则M的变化量为0.5mol L﹣1﹣0.300 mol L﹣1=0.200 mol L﹣1,其中转化为Y的变化量为0.200mol L﹣1﹣0.125 mol L﹣1=0.075 mol L﹣1,0~30min时间段内,Y的平均反应速率为 mol L﹣1 min﹣1,故A正确;
B.反应①和反应②的速率之比为,Y和Z分别为反应①和反应②的产物,且两者与M的化学计量数相同,因此反应开始后,体系中Y和Z的浓度之比等于 ,由于k1、k2为速率常数,故该比值保持不变,故B正确;
C.体系中Y和Z的浓度之比为3:5,所以反应能进行到底时,c(Y)+c(Z)=△c(M)=0.5 mol/L,则c(Z),反应结束时M转化为Z的转化率为,故C错误;
D.30 min时,c(Z)=0.125 mol/L,△c(M)=0.5 mol/L﹣0.300 mol/L=0.2 mol/L,则c(Y)=△c(M)﹣c(Z)=0.2 mol/L﹣0.125 mol/L=0.075 mol/L,则v(Y):v(Z)=0.075 mol/L:0.125 mol/L =3:5,即v(Y)<v(Z),v1<v2,反应的活化能越高,反应速率越慢,所以反应①的活化能大于反应②的活化能,故D正确;
故选:C。
【点评】本题主要考查物质的量或浓度随时间的变化曲线等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
