高中化学新人教版必修2 2.1化学能与热能(共24张PPT)
文档属性
| 名称 | 高中化学新人教版必修2 2.1化学能与热能(共24张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 345.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-14 23:06:24 | ||
图片预览





文档简介
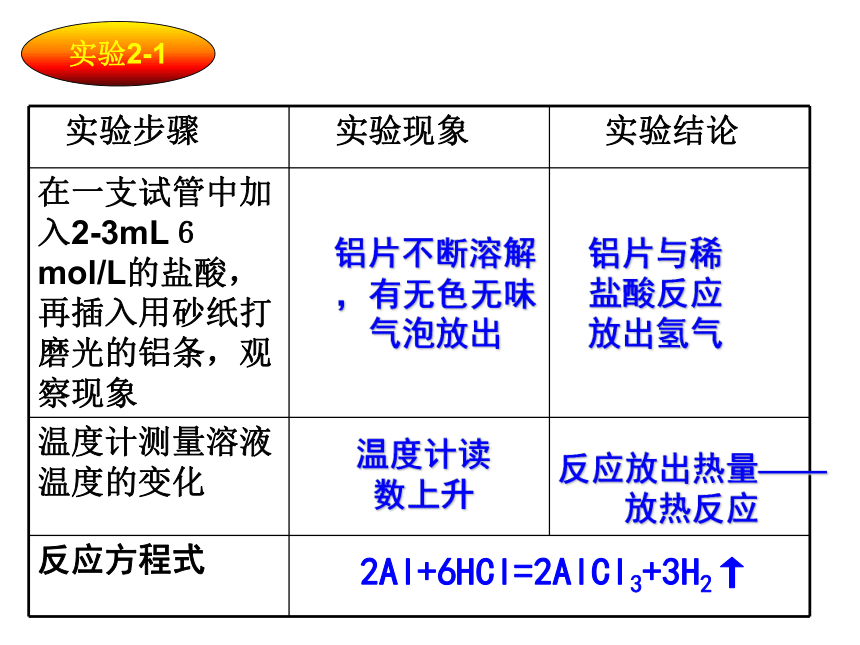
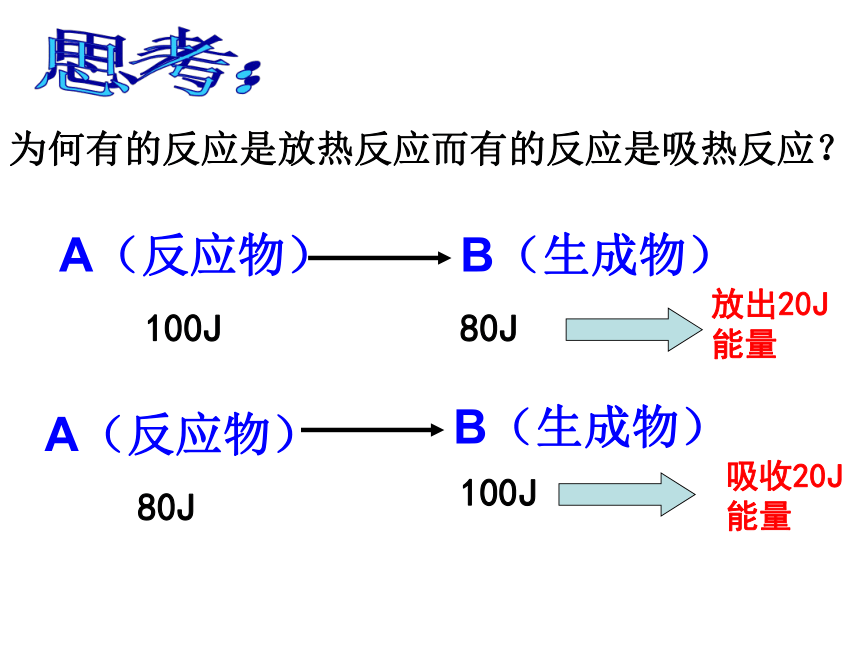
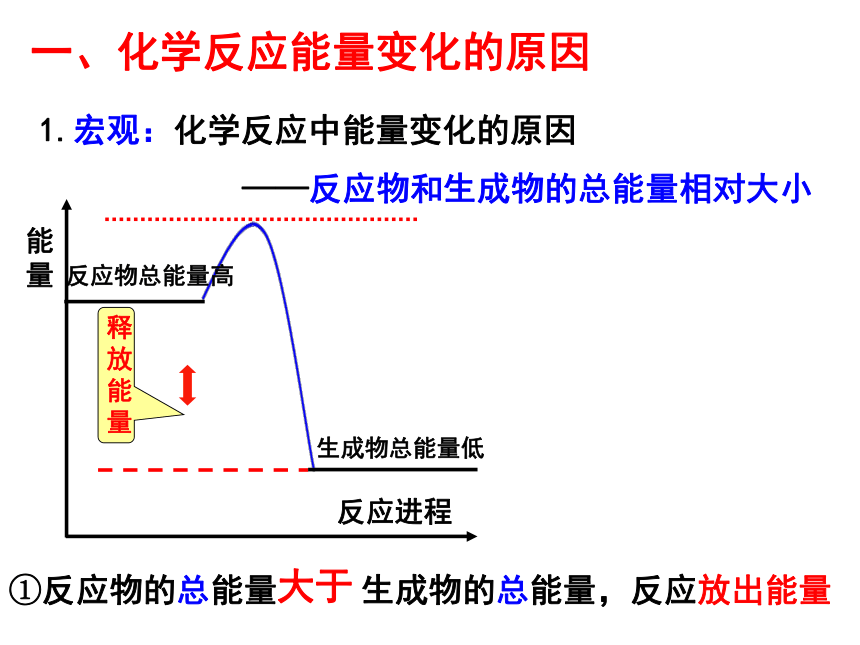
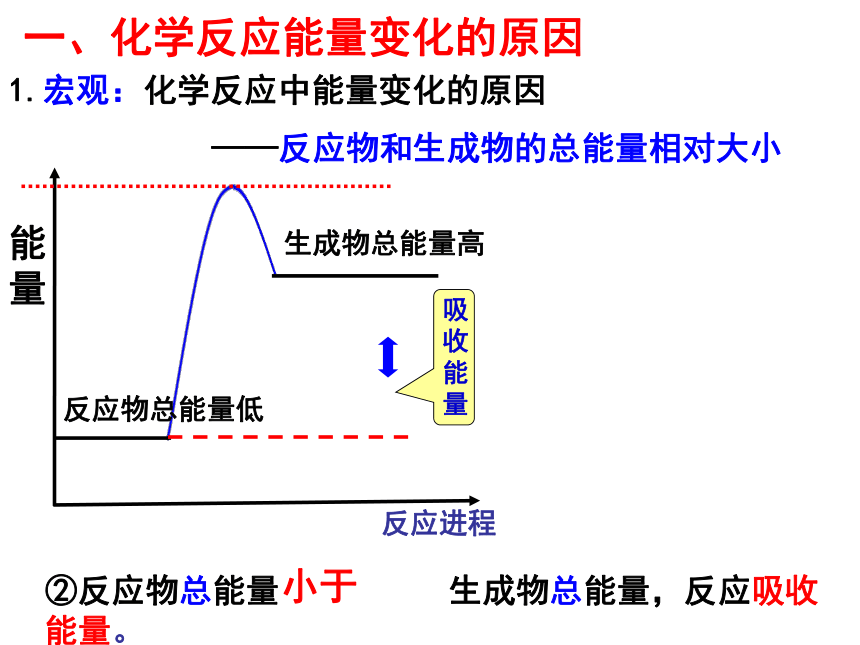
课件24张PPT。回忆Na2O2与CO2的实验——你能得出什么结论?过氧化钠粉末 物质发生化学变化生成新物质的同时还 伴随着能量的变化,而这种能量变化又通常表现为热能变化。结论:第一节 化学能与电能第二章 化学反应与能量实验2-1铝片不断溶解,有无色无味气泡放出铝片与稀盐酸反应放出氢气温度计读数上升反应放出热量——放热反应2Al+6HCl=2AlCl3+3H2↑实验2-2有刺激性气味气体产生有氨气产生玻璃片上的水结成冰,玻璃片与烧杯底被冰粘在了一起;用手触摸杯壁下部,有凉的感觉Ba(OH)2·8H2O与NH4Cl反应的过程吸收热量。Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O思考:为何有的反应是放热反应而有的反应是吸热反应?A(反应物)B(生成物)100J80J放出20J能量A(反应物)B(生成物)80J100J吸收20J能量①反应物的总能量 生成物的总能量,反应放出能量1.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小大于一、化学反应能量变化的原因能量反应进程②反应物总能量 生成物总能量,反应吸收能量。小于1.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小一、化学反应能量变化的原因思考:化学反应的本质是什么?能否从化学键微观角度解释为何有的反应是放热反应而有的是吸热反应?吸收能量断开断开吸收能量形成放出能量2.微观:化学反应中能量变化的原因
——化学键的断裂和形成①旧键断开所吸收的总能量 新键形成所释放出的总能量,反应放出能量。小于一、化学反应能量变化的原因大于②旧键断开所吸收的总能量 新键形成所释放出的总能量,反应放出能量。在25℃、101kPa条件下 H2 + Cl2 ═ 2HCl 反应为例断开1molH-H键和1molCl-Cl键吸收的总能量为(436+243)kJ =679kJ形成2mol H-Cl化学键放出的总能量为862kJ1mol H2和1molCl2反应放出能量(862-679)kJ=183kJ点燃已知:键能H-H=436KJ/mol已知:键能Cl-Cl=243KJ/mol已知:键能H-Cl=431KJ/mol【归纳小结】判断一个反应是吸热还是放热反应的方法有:反应物的总能量 >生成物的总能量反应物的总能量 <生成物的总能量方法一:根据反应物和生成物的总能量的相对大小放出反应:吸热反应:方法一:断键吸和成键放能量的相对大小断键吸收总能量 <成键放出总能量放出反应:吸热反应:断键吸收总能量 > 成键放出总能量课堂练习1、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量C2、氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B【归纳小结】判断一个反应是吸热还是放热反应的方法有:方法三:根据反应类型进行判断放出反应:吸热反应:所有的燃烧反应所有的酸碱中和反应所有的金属和酸大多数化合反应Ba(OH)2·8H2O+2NH4Cl
==BaCl2+2NH3↑+10H2O以C、H2 、 、CO为还原
剂的反应如:
C+CO2 = 2CO大多数分解反应3、 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C课堂练习4、 如右图所示,把试管放入盛有25℃时饱 和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量.(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体.
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体.
(3)Mg+2H+=Mg2++H2? (4)小于【思维误导】A.需要加热才能发生的反应一定是吸 热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热 D.吸热反应在一定条件下也能发生反应E.寻找合适的催化剂可使一个反应从吸热
反应变成放热反应结论:一个反应是吸热反应还是放热反应与反应
条件无关【思维误导】伴随着能量变化的一定发生了化学变化注意:1.浓硫酸、生石灰、氢氧化钠固体溶于水放热2.硝酸铵、氯化铵溶于水要吸热3.氯化钠、酒精等溶于水热效应不大【深入思考】下表的数据是各物质的键能(KJ)键能越来越大越来越稳定本身能量越来越低结论:键能越大物质越稳定本身具有能量越低教材P37 T7【深入思考】1.中和热:
在稀溶液中,酸跟碱发生中和反应
而生成1molH20,这时的反应热叫做中和热2.请你判断:1mol H2SO4 与 2 mol NaOH 完全反应放出114.6 KJ 的热量,此反应的中和热为114.6 KJ /mol。对吗? ?思考与交流(若要准确测定中和热)
你在设计实验装置和操作时应该注意哪些问题? 在稀溶液中,酸跟碱发生中和反应
而生成1molH20,这时的反应热叫做中和热【深入思考】1.中和热:
(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)注意控制反应时间(4)多做几次,取平均值科学视野1、社会发展与能源利用2、人类利用能源的三个阶段柴草时期中国古代制陶图化石能源时期
——反应物和生成物的总能量相对大小大于一、化学反应能量变化的原因能量反应进程②反应物总能量 生成物总能量,反应吸收能量。小于1.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小一、化学反应能量变化的原因思考:化学反应的本质是什么?能否从化学键微观角度解释为何有的反应是放热反应而有的是吸热反应?吸收能量断开断开吸收能量形成放出能量2.微观:化学反应中能量变化的原因
——化学键的断裂和形成①旧键断开所吸收的总能量 新键形成所释放出的总能量,反应放出能量。小于一、化学反应能量变化的原因大于②旧键断开所吸收的总能量 新键形成所释放出的总能量,反应放出能量。在25℃、101kPa条件下 H2 + Cl2 ═ 2HCl 反应为例断开1molH-H键和1molCl-Cl键吸收的总能量为(436+243)kJ =679kJ形成2mol H-Cl化学键放出的总能量为862kJ1mol H2和1molCl2反应放出能量(862-679)kJ=183kJ点燃已知:键能H-H=436KJ/mol已知:键能Cl-Cl=243KJ/mol已知:键能H-Cl=431KJ/mol【归纳小结】判断一个反应是吸热还是放热反应的方法有:反应物的总能量 >生成物的总能量反应物的总能量 <生成物的总能量方法一:根据反应物和生成物的总能量的相对大小放出反应:吸热反应:方法一:断键吸和成键放能量的相对大小断键吸收总能量 <成键放出总能量放出反应:吸热反应:断键吸收总能量 > 成键放出总能量课堂练习1、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量C2、氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO = O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是( )
A. 2Q1 + Q2 > 4Q3 B. 2Q1 + Q2 < 4Q3
C. Q1 + Q2 < Q3 D. Q1 + Q2 = Q3B【归纳小结】判断一个反应是吸热还是放热反应的方法有:方法三:根据反应类型进行判断放出反应:吸热反应:所有的燃烧反应所有的酸碱中和反应所有的金属和酸大多数化合反应Ba(OH)2·8H2O+2NH4Cl
==BaCl2+2NH3↑+10H2O以C、H2 、 、CO为还原
剂的反应如:
C+CO2 = 2CO大多数分解反应3、 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C课堂练习4、 如右图所示,把试管放入盛有25℃时饱 和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”)镁片和盐酸的总能量.(1)①镁片上有大量气泡产生;②镁片逐渐溶解;③烧杯中析出晶体.
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体.
(3)Mg+2H+=Mg2++H2? (4)小于【思维误导】A.需要加热才能发生的反应一定是吸 热反应B.任何放热反应在常温条件下一定能发生反应C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热 D.吸热反应在一定条件下也能发生反应E.寻找合适的催化剂可使一个反应从吸热
反应变成放热反应结论:一个反应是吸热反应还是放热反应与反应
条件无关【思维误导】伴随着能量变化的一定发生了化学变化注意:1.浓硫酸、生石灰、氢氧化钠固体溶于水放热2.硝酸铵、氯化铵溶于水要吸热3.氯化钠、酒精等溶于水热效应不大【深入思考】下表的数据是各物质的键能(KJ)键能越来越大越来越稳定本身能量越来越低结论:键能越大物质越稳定本身具有能量越低教材P37 T7【深入思考】1.中和热:
在稀溶液中,酸跟碱发生中和反应
而生成1molH20,这时的反应热叫做中和热2.请你判断:1mol H2SO4 与 2 mol NaOH 完全反应放出114.6 KJ 的热量,此反应的中和热为114.6 KJ /mol。对吗? ?思考与交流(若要准确测定中和热)
你在设计实验装置和操作时应该注意哪些问题? 在稀溶液中,酸跟碱发生中和反应
而生成1molH20,这时的反应热叫做中和热【深入思考】1.中和热:
(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)注意控制反应时间(4)多做几次,取平均值科学视野1、社会发展与能源利用2、人类利用能源的三个阶段柴草时期中国古代制陶图化石能源时期
