人教版高中化学必修二 课件2.3《化学反应的速率和限度第二课时》课件 (共32张PPT)
文档属性
| 名称 | 人教版高中化学必修二 课件2.3《化学反应的速率和限度第二课时》课件 (共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 07:47:54 | ||
图片预览










文档简介
课件32张PPT。化学反应限度第2课时行动,让梦想触手可及,
坚持,让自己与众不同。 练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10sA 的平均反应速率为0.12mol/L·s,则10s时,容器中B的物质的量为 。 2、一定温度下,向一容积为2L的真空容器中加入1mol氮气,3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内用氢气的变化来表示反应速率为 。3.2mol0.1mol/L·min 学科网对于反应:aA + Bb = cC + dD温故而知新2、比较化学反应速率的大小:
单位相同,同一物质3.把铝条放入盛有过量稀硫酸的试管中,不影响氢气产生速率的因素是A.浓硫酸 B.铝条的表面积
C.溶液的温度 D. 加少量的Na2SO4固体
E.加入少量 CuSO4 F. 加入水D知识应用4、下列反应,压强对反应速率无影响的( )
A、C(s) + H2O(g) = CO(g) + H2(g)
B 、 AgNO3(l) + HCl(l) = AgCl(s) + HNO3(l)
C 、CO2(g) + Ca(OH)2(l) = CaCO3(s) + H2O(l)
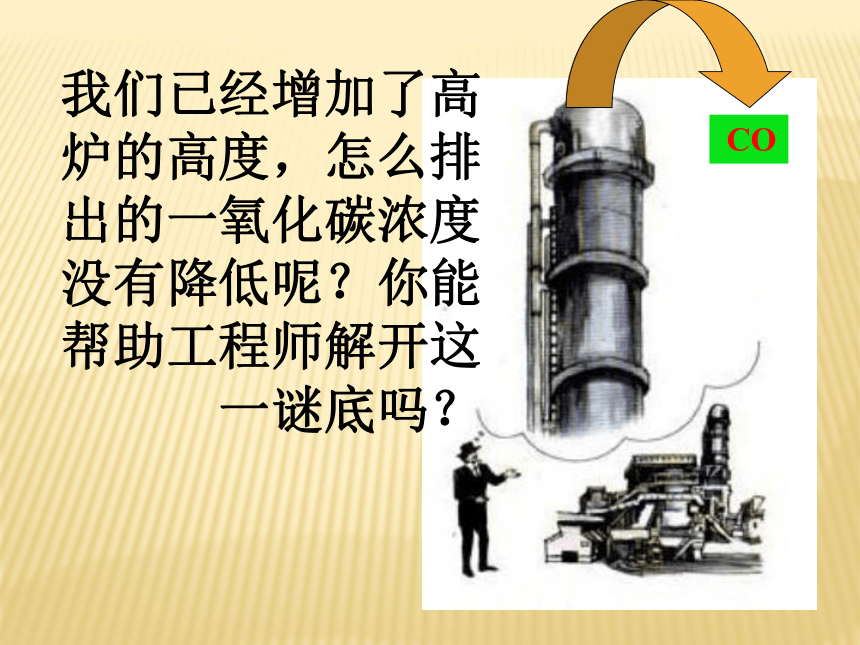
D 、2Al(s) + Fe2O3(s) = Al2O3(s) + 2Fe(s)BD一个化学反应在实际进行时,所有反应物能否完全(按照方程式中相应物质的量的关系)转变成生成物?二、化学反应的限度学科网 CO我们已经增加了高炉的高度,怎么排出的一氧化碳浓度没有降低呢?你能帮助工程师解开这一谜底吗?自学科学史话:炼铁高炉尾气之谜
阅读教材P50-51
从中你能得到什么启示?
C+CO2=2CO
是可逆反应,无论再什么条件下CO都不能反应完全。
总结什么是可逆反应1、可逆反应:在同一条件下,正反应方向和逆
反应方向均能进行的化学反应。分析:
1、 和
2、二、化学反应的限度注意:有的化学反应可逆性较弱, 通常不叫做可逆反应
有的可逆性很强,常见的典型的可逆反应有:正反应:从左到右进行 逆反应:从右到左进行2.可逆反应特点:②正反应和逆反应同时进行,反应物和生成物共存在于同一体系中;①反应物不能完全转化为产物,即可逆反应有一定的限度;特点:可逆反应不可能完全进行到底(如果对反应体系施加影响化学反应速率的措施,
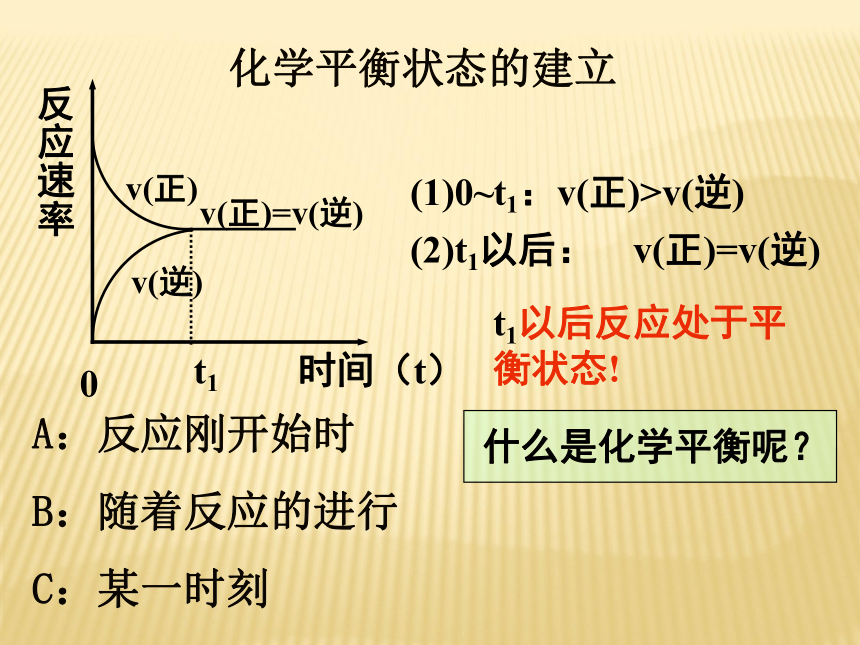
正反应的速率和逆反应的速率都受影响)0(1)0~t1:v(正)>v(逆)(2)t1以后: v(正)=v(逆)t1以后反应处于平衡状态! 什么是化学平衡呢?化学平衡状态的建立A:反应刚开始时
B:随着反应的进行
C:某一时刻3、化学平衡定义: 一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡理解:①前提:在一定条件下的可逆反应②实质:V正=V逆≠0
③标志:混合物中各组分的浓度保持不变v(正)=v(逆)是指指定某物质(反应物或生成物)的消耗速率与生成速率相等。4、化学平衡状态的特征:逆:研究对象——可逆反应
等:V正=v逆 时
动:动态平衡(V正=V逆≠0)
定:反应速率一定,
各组分的浓度、
百分含量保持不变(平衡标志)
变:平衡的建立是有条件的,
当条件发生改变时,平衡可能发生移动逆、等、动、定、变①一定平衡的:
V正=V逆、各物质的浓度、质量、质量分数、
气体体积分数、反应物的转化率不变、
体系的颜色、温度不再变化
②可能平衡:气体总的物质的量、压强、密度、气
体的平均摩尔质量不变(必须体积可变反应)5、达到平衡的标志:注意:1、转化率指反应掉的量与原来总的量之比
2、气体体积分数=物质的量分数
3、平均摩尔质量=气体总质量/ 气体总物质的量【课堂练习】1、可逆反应达到平衡的重要特征是:
A 反应停止了
B 正、逆反应的速率都为零
C 正、逆反应都还在继续进行
D 正、逆反应速率相等D【课堂练习】2、一定温度下,反应H2(g)+I2(g) 2HI(g)达到平衡的标志是( )
A 单位时间内生成nmolH2同时生成nmolHI。
B 单位时间内生成2nmolHI同时生成nmolI2。
C 单位时间内生成nmolH2同时生成nmolI2
D 1mol的H-H键断裂的同时,有1mol的I-I键断裂
E H2的体积分数不变B 3、下列哪种说法可以证明反应
N2 + 3H2 2NH3达到平衡状态
A.1个 键断裂的同时,有3个 键形成
B.1个 键断裂的同时,有3个 键断裂
C.1个 键断裂的同时,有6个 键断裂
D.1个 键断裂的同时,有6个 键形成( )AC【课堂练习】4、在一定温度下,
2NO2(g) N2O4 (g) (无色)的可逆反应中,下列情况属于平衡状态的是( )
A.N2O4不再分解 B.v(N2O4):v(NO2)=1:2
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1
E.混合气体的平均相对分子质量不变 C【课堂练习】【课堂练习】5、在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应
A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:( )
A 混合气体的压强 B 混合气体的密度
C 气体的总物质的量 D A的物质的量浓度B【练习6】 在温度体积不变情况下,下列叙述是
A(气)+3B(气) 2C(气)+2D(固)平衡标志的是
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A的转化率不再变化
⑤混合气体的总压强不再变化⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
⑨混合气体密度不再变化
⑩ A的体积分数不再变化√√√√√√××√√7、 某温度时,将1molNO2分解:
2NO2 2NO+O2,并达到平衡,
此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 2NO + O2始 1mol 0 0变 x x 0.5x【课堂练习】14CO2 + C CO,达到化学平衡后,
平衡混合物中含14C的粒子有 。14CO2、14C、14CO【课堂练习】 树 你看过建筑物的定向爆破吗?观察下面几幅图,你从中得到什么启示? 为什么控制的如此好呢?树角色扮演 现在,假设你是一名工程师,你要使到你工厂的煤尽可能的完全燃烧,提高煤的燃烧效率,你认为应该从哪些方面进行分析?怎样提高煤的燃烧效率?煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?
空气的用量对煤的充分燃烧有什么影响?原因是什么?
应选用什么样的炉膛材料?
如何充分利用煤燃烧后的废气中的热量? 三.化学反应条件的控制 1、提高燃料燃烧效率的措施尽可能的使煤充分燃烧,提高能量的转化率,关键是燃料与空气或氧气要尽可能充分的接触,且空气要适当过量。燃料与空气要有足够大的接触面积。
尽可能充分地利用燃料燃烧所放出来的热能,提高热能的利用率。
实质是从多方面控制燃烧反应的条件,它的意义在于节约能源,减少污染等。2、反应条件的控制:
(1)关于人类需要或对人类有利的化学反应—提高生产或工作效率,提高原料的利用率或转化率。
(2)关于有害或对人类不需要的化学反应—降低反应速率或隔离会引发反应的物质。
练习1 在一定温度下的固定体积的容器中反应,反应
N2 (g)+ 3H2 (g) 2NH3(g)达到平衡的标志是( )
A.3V(N2)正=V(H2)正
B.2 V(H2)正= 3V(NH3)逆
C单位时间内生成1 mol 氮气,同时生成2 mol氨气
D容器内反应混合物的总物质的量不随时间改变。
E容器内的总压强不随时间变化
F各物质浓度的比:1:3:2 BCDE练习2 在一定温度下,反应
A2 (g) + B2 (g) 2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2 的同时生成2 n molAB
B单位时间内生成n mol A2 同时生成n mol B 2
C容器内反应混合物的总物质的量不随时间改变。
D容器内的总压强不随时间变化
E各物质浓度的比c(A2):c(B2) :c(AB)=1:1:2A3.对于达到平衡状态的可逆反应:N2 +3H2 2NH3 ,下列有关叙述正确的是
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行
4.在2SO2+O2 2SO3的平衡体系中,加入18O2,当平衡发生移动后,SO2中18O的含量 (填增加、减少或不变),其原因是
_________________________________________。
在SO2与18O2反应生成S18O3的同时,S18O3又分解成S18O2 增加A
坚持,让自己与众不同。 练习: 1、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4mol,在前10sA 的平均反应速率为0.12mol/L·s,则10s时,容器中B的物质的量为 。 2、一定温度下,向一容积为2L的真空容器中加入1mol氮气,3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内用氢气的变化来表示反应速率为 。3.2mol0.1mol/L·min 学科网对于反应:aA + Bb = cC + dD温故而知新2、比较化学反应速率的大小:
单位相同,同一物质3.把铝条放入盛有过量稀硫酸的试管中,不影响氢气产生速率的因素是A.浓硫酸 B.铝条的表面积
C.溶液的温度 D. 加少量的Na2SO4固体
E.加入少量 CuSO4 F. 加入水D知识应用4、下列反应,压强对反应速率无影响的( )
A、C(s) + H2O(g) = CO(g) + H2(g)
B 、 AgNO3(l) + HCl(l) = AgCl(s) + HNO3(l)
C 、CO2(g) + Ca(OH)2(l) = CaCO3(s) + H2O(l)
D 、2Al(s) + Fe2O3(s) = Al2O3(s) + 2Fe(s)BD一个化学反应在实际进行时,所有反应物能否完全(按照方程式中相应物质的量的关系)转变成生成物?二、化学反应的限度学科网 CO我们已经增加了高炉的高度,怎么排出的一氧化碳浓度没有降低呢?你能帮助工程师解开这一谜底吗?自学科学史话:炼铁高炉尾气之谜
阅读教材P50-51
从中你能得到什么启示?
C+CO2=2CO
是可逆反应,无论再什么条件下CO都不能反应完全。
总结什么是可逆反应1、可逆反应:在同一条件下,正反应方向和逆
反应方向均能进行的化学反应。分析:
1、 和
2、二、化学反应的限度注意:有的化学反应可逆性较弱, 通常不叫做可逆反应
有的可逆性很强,常见的典型的可逆反应有:正反应:从左到右进行 逆反应:从右到左进行2.可逆反应特点:②正反应和逆反应同时进行,反应物和生成物共存在于同一体系中;①反应物不能完全转化为产物,即可逆反应有一定的限度;特点:可逆反应不可能完全进行到底(如果对反应体系施加影响化学反应速率的措施,
正反应的速率和逆反应的速率都受影响)0(1)0~t1:v(正)>v(逆)(2)t1以后: v(正)=v(逆)t1以后反应处于平衡状态! 什么是化学平衡呢?化学平衡状态的建立A:反应刚开始时
B:随着反应的进行
C:某一时刻3、化学平衡定义: 一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物浓度不再发生变化,这种状态称为化学平衡状态,简称化学平衡理解:①前提:在一定条件下的可逆反应②实质:V正=V逆≠0
③标志:混合物中各组分的浓度保持不变v(正)=v(逆)是指指定某物质(反应物或生成物)的消耗速率与生成速率相等。4、化学平衡状态的特征:逆:研究对象——可逆反应
等:V正=v逆 时
动:动态平衡(V正=V逆≠0)
定:反应速率一定,
各组分的浓度、
百分含量保持不变(平衡标志)
变:平衡的建立是有条件的,
当条件发生改变时,平衡可能发生移动逆、等、动、定、变①一定平衡的:
V正=V逆、各物质的浓度、质量、质量分数、
气体体积分数、反应物的转化率不变、
体系的颜色、温度不再变化
②可能平衡:气体总的物质的量、压强、密度、气
体的平均摩尔质量不变(必须体积可变反应)5、达到平衡的标志:注意:1、转化率指反应掉的量与原来总的量之比
2、气体体积分数=物质的量分数
3、平均摩尔质量=气体总质量/ 气体总物质的量【课堂练习】1、可逆反应达到平衡的重要特征是:
A 反应停止了
B 正、逆反应的速率都为零
C 正、逆反应都还在继续进行
D 正、逆反应速率相等D【课堂练习】2、一定温度下,反应H2(g)+I2(g) 2HI(g)达到平衡的标志是( )
A 单位时间内生成nmolH2同时生成nmolHI。
B 单位时间内生成2nmolHI同时生成nmolI2。
C 单位时间内生成nmolH2同时生成nmolI2
D 1mol的H-H键断裂的同时,有1mol的I-I键断裂
E H2的体积分数不变B 3、下列哪种说法可以证明反应
N2 + 3H2 2NH3达到平衡状态
A.1个 键断裂的同时,有3个 键形成
B.1个 键断裂的同时,有3个 键断裂
C.1个 键断裂的同时,有6个 键断裂
D.1个 键断裂的同时,有6个 键形成( )AC【课堂练习】4、在一定温度下,
2NO2(g) N2O4 (g) (无色)的可逆反应中,下列情况属于平衡状态的是( )
A.N2O4不再分解 B.v(N2O4):v(NO2)=1:2
C.体系的颜色不再改变
D.NO2的浓度与N2O4的浓度之比2:1
E.混合气体的平均相对分子质量不变 C【课堂练习】【课堂练习】5、在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应
A(s)+2B(g) C(g)+D(g)已达到平衡状态的是:( )
A 混合气体的压强 B 混合气体的密度
C 气体的总物质的量 D A的物质的量浓度B【练习6】 在温度体积不变情况下,下列叙述是
A(气)+3B(气) 2C(气)+2D(固)平衡标志的是
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A的转化率不再变化
⑤混合气体的总压强不再变化⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
⑨混合气体密度不再变化
⑩ A的体积分数不再变化√√√√√√××√√7、 某温度时,将1molNO2分解:
2NO2 2NO+O2,并达到平衡,
此时NO的体积分数为40%,求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。终 (1mol-x) x 0.5x解:设平衡时NO的物质的量为x,则: 2NO2 2NO + O2始 1mol 0 0变 x x 0.5x【课堂练习】14CO2 + C CO,达到化学平衡后,
平衡混合物中含14C的粒子有 。14CO2、14C、14CO【课堂练习】 树 你看过建筑物的定向爆破吗?观察下面几幅图,你从中得到什么启示? 为什么控制的如此好呢?树角色扮演 现在,假设你是一名工程师,你要使到你工厂的煤尽可能的完全燃烧,提高煤的燃烧效率,你认为应该从哪些方面进行分析?怎样提高煤的燃烧效率?煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?
空气的用量对煤的充分燃烧有什么影响?原因是什么?
应选用什么样的炉膛材料?
如何充分利用煤燃烧后的废气中的热量? 三.化学反应条件的控制 1、提高燃料燃烧效率的措施尽可能的使煤充分燃烧,提高能量的转化率,关键是燃料与空气或氧气要尽可能充分的接触,且空气要适当过量。燃料与空气要有足够大的接触面积。
尽可能充分地利用燃料燃烧所放出来的热能,提高热能的利用率。
实质是从多方面控制燃烧反应的条件,它的意义在于节约能源,减少污染等。2、反应条件的控制:
(1)关于人类需要或对人类有利的化学反应—提高生产或工作效率,提高原料的利用率或转化率。
(2)关于有害或对人类不需要的化学反应—降低反应速率或隔离会引发反应的物质。
练习1 在一定温度下的固定体积的容器中反应,反应
N2 (g)+ 3H2 (g) 2NH3(g)达到平衡的标志是( )
A.3V(N2)正=V(H2)正
B.2 V(H2)正= 3V(NH3)逆
C单位时间内生成1 mol 氮气,同时生成2 mol氨气
D容器内反应混合物的总物质的量不随时间改变。
E容器内的总压强不随时间变化
F各物质浓度的比:1:3:2 BCDE练习2 在一定温度下,反应
A2 (g) + B2 (g) 2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2 的同时生成2 n molAB
B单位时间内生成n mol A2 同时生成n mol B 2
C容器内反应混合物的总物质的量不随时间改变。
D容器内的总压强不随时间变化
E各物质浓度的比c(A2):c(B2) :c(AB)=1:1:2A3.对于达到平衡状态的可逆反应:N2 +3H2 2NH3 ,下列有关叙述正确的是
A.反应物和生成物浓度不再发生变化
B.反应物和生成物的浓度相等
C.N2和NH3的质量分数相等
D.正反应和逆反应不再进行
4.在2SO2+O2 2SO3的平衡体系中,加入18O2,当平衡发生移动后,SO2中18O的含量 (填增加、减少或不变),其原因是
_________________________________________。
在SO2与18O2反应生成S18O3的同时,S18O3又分解成S18O2 增加A
