人教版高中化学必修二 课件3.3《生活中两种常见的有机物》课件 (共38张PPT)
文档属性
| 名称 | 人教版高中化学必修二 课件3.3《生活中两种常见的有机物》课件 (共38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 852.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 07:52:02 | ||
图片预览









文档简介
课件38张PPT。第三节
生活中两种常见的有机物第一课时 乙醇活动一:
观察一瓶酒精,阅读课本内容,归纳和总结乙醇的物理性质。 物理性质
颜色:
气味:
状态:
密度:
熔点:
沸点:
溶解性:无色特殊香味比水小,20℃时,0.789g/cm378.5℃—117.3℃与水以任意比互溶液体练习:
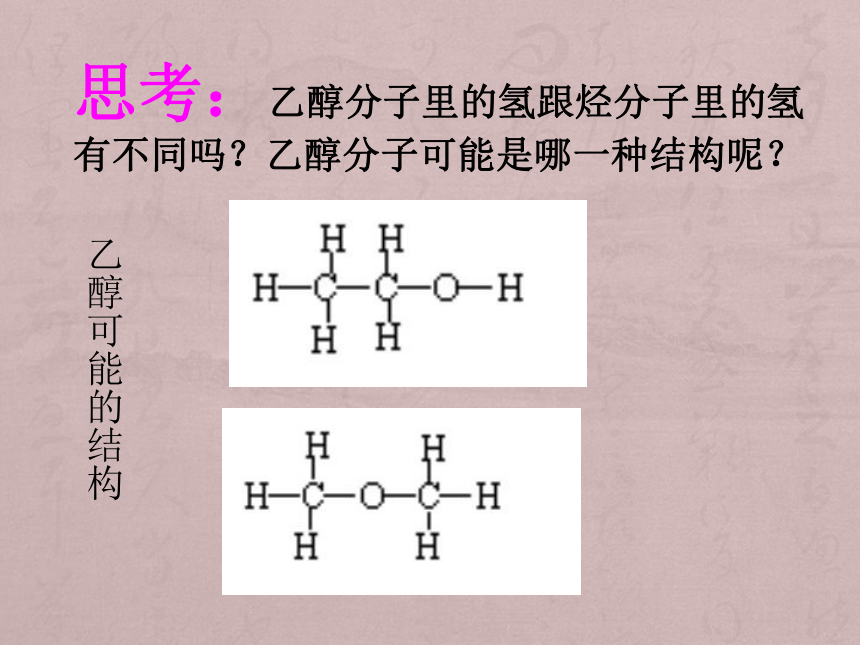
实验测得,4.6克乙醇完全燃烧后只生成0.2molCO2和0.3molH2O,且乙醇蒸汽对H2的相对密度为23,求乙醇的分子式?答案:C2H6O乙醇可能的结构思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可能是哪一种结构呢? 活动二:实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有针头的单孔塞,用小试管倒扣在针头之上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。比较前面做过的水与钠反应的实验,完成下表。“浮、熔、
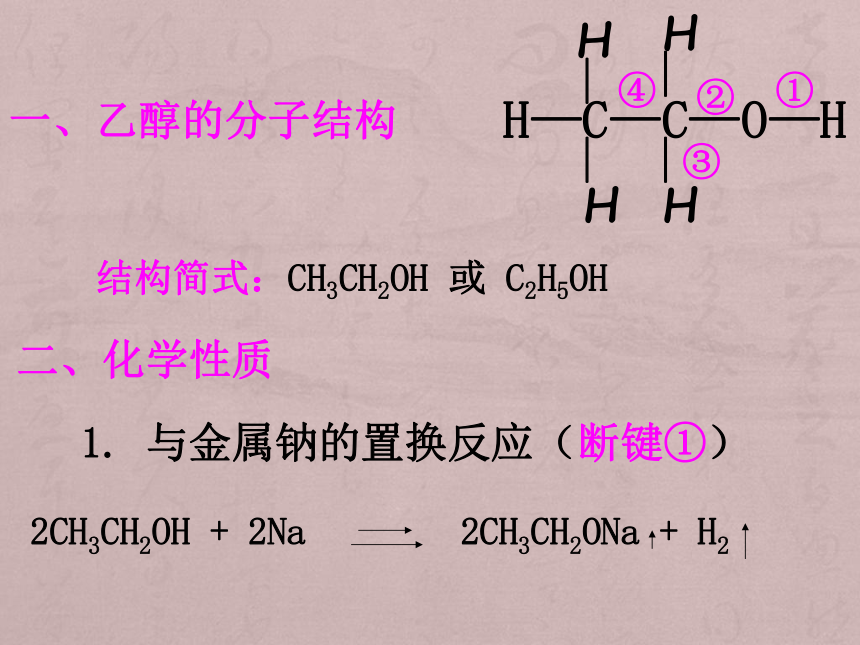
游、响” “沉、不熔、不响” 发出淡蓝色火焰。 安静燃烧,发出淡蓝色火焰,烧杯内壁有水珠加酚酞后溶液变红,说明有碱性物质(NaOH)生成。 加酚酞后溶液变红,说明有碱性物质生成;烧杯中石灰水无明显现象,说明无CO2生成。 比较水、乙醇与钠反应 经测定在0.1mol无水乙醇中加入足量的金属钠,收集到氢气1.12 L(标准状况)。根据以上能推断乙醇的结构是哪种吗?一、乙醇的分子结构 结构简式:CH3CH2OH 或 C2H5OH二、化学性质1. 与金属钠的置换反应(断键①)2CH3CH2OH + 2Na 2CH3CH2ONa + H2 2.氧化反应 (1)乙醇的燃烧 (全断)
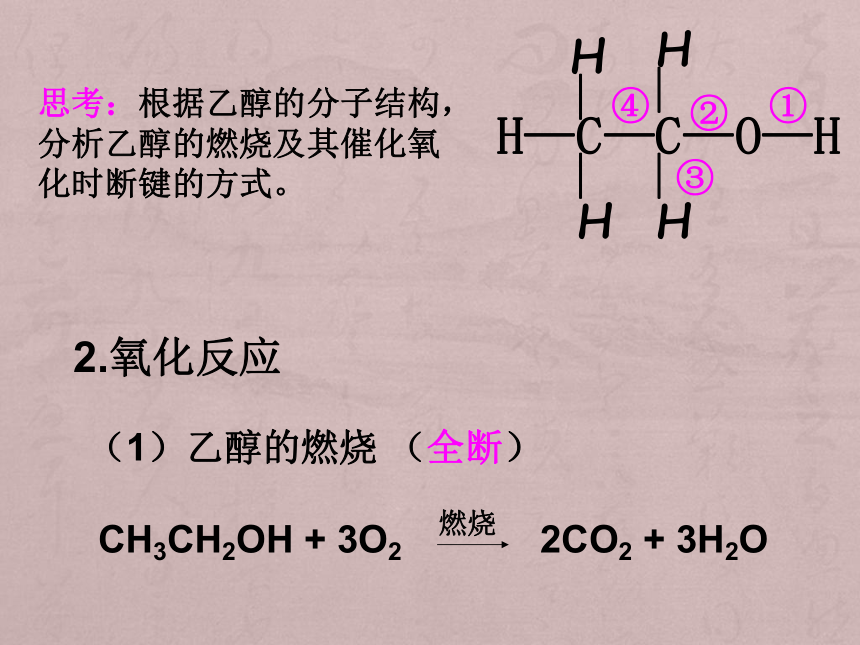
CH3CH2OH + 3O2 2CO2 + 3H2O 燃烧思考:根据乙醇的分子结构,分析乙醇的燃烧及其催化氧化时断键的方式。 向一支试管中加入3—5mL乙醇,取一根10—15cm长的铜丝,下端绕成螺旋状,在酒精灯上灼烧至红热,插入乙醇中,反复几次。观察铜丝的变化,小心闻试管中液体产生的气味。
现象:光亮的通丝加热到变黑,将灼热的铜丝迅速插入在乙醇中,铜丝由黑变红,同时产生刺激性气味。活动三:验证实验(2)乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O(3)可直接被氧化为乙酸
2CH3CHO + O2 2CH3COOHCu或Ag催化剂
CH3CH2OH CH2=CH2↑+H2O浓H2SO4170°3.乙醇的消去反应
浓硫酸的作用:脱水剂,催化剂⑤思考:
根据对课本上有关官能团、衍生物的理解,请你说说官能团与衍生物的性质之间的关系。课堂小结 1.掌握乙醇的组成、分子结构与主要化学性质,了解它们的主要用途。2.理解烃的衍生物及官能团的概念。3.通过建立乙醇分子的立体结构模型,从结构角度初步认识乙醇的氧化反应的原理。 练习 1.禁止用工业酒精配制饮料酒,这是因为酒精中含有少量有毒物质是( )
A.甘油 B.醋酸
C.甲醇 D. 乙醛C2.比较乙烷和乙醇的结构,下列说法中错误的是( )
A.两个碳原子都以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B3.可用于检验 乙醇中是否含有水的试剂是( )
A.无水硫酸铜 B.生石灰
C.金属钠 D.胆矾 A4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面的下面
B.钠熔化成小球
C.钠块在乙醇的液面上游动
D.钠块表面有气泡放出
AD5.能证明乙醇分子中含有一个羟基的事实是( )
A.乙醇完全燃烧生成水
B.0.1mol乙醇与足量金属钠反应生成0.05 mol氢气
C.乙醇能与水一任意比例互溶
D.乙醇容易挥发B6.将铜丝灼烧变黑后立即插入下列物质中,铜丝变红且质量不变的是( )
A.硫酸 B.乙醇
C.一氧化碳 D.硝酸
BC7.某有机物蒸气,完全燃烧时需要三倍于其体积的氧气,产生二倍于其体积的二氧化碳,该有机物可能是( )
A.C2H4 B.C2H5OH
C.CH3CHO D.CH3COOHAB8.在常压和100℃条件下,将乙醇汽化为蒸气,然后和乙烯以任意比混合,其混合气体为VL.若完全燃烧,需要相同条件下氧气的体积为( )
A.2V L B.2.5V L
C.3V L D.无法计算
C思考:
为什么醉酒后喝醋能解酒?
为什么厨师烧鱼时加点醋和酒,就能使鱼的味道变的无腥味,香醇还特别鲜美?
第二课时 乙酸 活动一
观察乙酸的分子模型,试写出乙酸的分子式和结构简式。结构简式: 分子式:C2H4O2官能团 : CH3COOH —COOH(羧基)结构式: 活动二
观察乙酸的颜色、状态、气味,观察冰醋酸,并看书总结乙酸的物理性质。 1.物理性质
颜色:
状态:
气味:
熔点:
沸点:
溶解性:无色液体强烈刺激性气味117.9℃16.6℃易溶于水和乙醇思考:
家庭中常用食醋浸泡有水垢(主要成分是CaCO3)的暖瓶或水壶,以清除水垢。这是利用了醋酸的什么性质?通过这个事实你能比较出醋酸和碳酸的酸性强弱吗? 2.乙酸的化学性质
乙酸的酸性
①与指示剂反应
②与碱反应
③与碱性氧化物反应
④与盐反应
⑤与金属反应
?通性CH3COOH CH3COO-+H+例.写出下列反应的离子方程式.
(1)乙酸溶液和氢氧化铜反应
(2)乙酸与氧化钙反应
(3)将锌粒投入乙酸溶液中
(4)用乙酸除水垢[CaCO3,Mg(OH)2]⑴.2CH3COOH +Cu(OH)2=2CH3COO-+Cu2++2H2O⑵. 2CH3COOH+CaO=2CH3COO-+Ca2++2H2O⑶. 2CH3COOH+Zn=2CH3COO-+Zn2++H2↑⑷. 2CH3COOH+CaCO3=2CH3COO-+Ca2++
CO2↑+H2O
2CH3COOH+Mg(OH)2=Mg2++2CH3COO-+2H2O思考:
为什么酒放的时间越长,质量越好? 活动三:实验探究
在一支试管中加入3mL乙醇,然后边振荡边慢慢加入2mL浓硫酸和 2mL乙酸;按图3—16连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上,观察现象。实验现象:实验结论:饱和碳酸钠溶液的液面上有透明的油状液体产生,并可闻到香味。在浓硫酸存在、加热的条件下,乙酸和乙醇发生反应,生成无色、透明、不溶于水、有香味的油状液体。该油状液体是乙酸乙酯。注意事项:
1.往大试管加入化学药品时,切莫先加浓硫酸。
2.加热要小心均匀的进行,防止液体剧烈沸腾,乙酸和乙醇大量挥发。
3.导气管末端不要进入液体内,以防止液体倒吸。
4.实验室制乙酸乙酯时用饱和碳酸钠溶液吸收,有利于乙酸乙酯与乙酸、乙醇的分离。CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O O酯化反应的概念:
特点: 酸与醇反应生成酯和水的反应。①反应很慢,即反应速率很低(为了提高反应
速率,一般要加入浓硫酸)
②反应是可逆的,即反应物不能完全变成生成
物反应的化学方程式:浓硫酸O 活动四
利用乙酸与乙醇的结构式分析在酯化反应中它们的断键方式。提示:如果用含氧的同位素188O的乙醇跟乙酸起反应,可发现生成物中乙酸乙酯分子中含有188O原子。CH3—C—OH + H—188O—C2H5 CH3—C—188O—C2H5 + H2O OO浓硫酸 一般过程是羧酸分子里的羟基与醇分子里羟基上的氢原子结合成水,其余部分相互结合生成酯。酯化反应又属于取代反应。酯化反应的机理:思考:从组成、作用上比较乙酸分子里羧基上羟基与乙醇分子里羟基的异同,体会官能团与性质的关系。课堂小结 1.掌握乙酸的组成、分子结构与主要化学性质,了解它的主要用途。 2.通过建立乙酸分子的立体结构模型,从结构角度初步认识乙酸的酯化反应的原理和实质。 3.从乙醇和乙酸的组成、结构和性质出发,学习由 “(组成)结构—性质—用途”研究烃的衍生物的方法。 练习1.乙酸是一种重要的有机酸,它是食醋的主要成分,所以乙酸又叫( ).乙酸的分子式为( ),结构式为( ),结构简式( ).乙酸分子中的官能团为( ).
醋酸C2H4O2 CH3COOH —COOH(羧基)2.乙酸分子的结构中不含有的原子团是( )
A.羧基 B.甲基 C.羟基 D.乙基
D3.只用水就能鉴别的一组物质是( )
A.苯,乙酸,四氯化碳
B.乙醇,乙醛,乙酸
C.乙醇,硝基苯,乙酸乙酯
D.己烷,乙醇,甲醇
AC4.下列物质中,不能由乙醇直接制取的是( )
A.乙醛 B.氢气
C.乙酸乙酯 D.乙烷D5.用一种试剂可以区分乙醇和乙酸的是( )
A.氢氧化钠溶液
B.氨水
C.碳酸钠溶液
D.氢氧化铜
C6.1mol有机物,充分燃烧后生成2molCO2 和3mol H2O.此有机物可能是( ),
( )CH3CH3CH3CH2OH
生活中两种常见的有机物第一课时 乙醇活动一:
观察一瓶酒精,阅读课本内容,归纳和总结乙醇的物理性质。 物理性质
颜色:
气味:
状态:
密度:
熔点:
沸点:
溶解性:无色特殊香味比水小,20℃时,0.789g/cm378.5℃—117.3℃与水以任意比互溶液体练习:
实验测得,4.6克乙醇完全燃烧后只生成0.2molCO2和0.3molH2O,且乙醇蒸汽对H2的相对密度为23,求乙醇的分子式?答案:C2H6O乙醇可能的结构思考:乙醇分子里的氢跟烃分子里的氢有不同吗?乙醇分子可能是哪一种结构呢? 活动二:实验探究
在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有针头的单孔塞,用小试管倒扣在针头之上,收集并验纯气体;然后点燃气体,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清的石灰水,观察实验现象。比较前面做过的水与钠反应的实验,完成下表。“浮、熔、
游、响” “沉、不熔、不响” 发出淡蓝色火焰。 安静燃烧,发出淡蓝色火焰,烧杯内壁有水珠加酚酞后溶液变红,说明有碱性物质(NaOH)生成。 加酚酞后溶液变红,说明有碱性物质生成;烧杯中石灰水无明显现象,说明无CO2生成。 比较水、乙醇与钠反应 经测定在0.1mol无水乙醇中加入足量的金属钠,收集到氢气1.12 L(标准状况)。根据以上能推断乙醇的结构是哪种吗?一、乙醇的分子结构 结构简式:CH3CH2OH 或 C2H5OH二、化学性质1. 与金属钠的置换反应(断键①)2CH3CH2OH + 2Na 2CH3CH2ONa + H2 2.氧化反应 (1)乙醇的燃烧 (全断)
CH3CH2OH + 3O2 2CO2 + 3H2O 燃烧思考:根据乙醇的分子结构,分析乙醇的燃烧及其催化氧化时断键的方式。 向一支试管中加入3—5mL乙醇,取一根10—15cm长的铜丝,下端绕成螺旋状,在酒精灯上灼烧至红热,插入乙醇中,反复几次。观察铜丝的变化,小心闻试管中液体产生的气味。
现象:光亮的通丝加热到变黑,将灼热的铜丝迅速插入在乙醇中,铜丝由黑变红,同时产生刺激性气味。活动三:验证实验(2)乙醇的催化氧化(断键①③ )
2CH3CH2OH + O2 CH3CHO + 2H2O(3)可直接被氧化为乙酸
2CH3CHO + O2 2CH3COOHCu或Ag催化剂
CH3CH2OH CH2=CH2↑+H2O浓H2SO4170°3.乙醇的消去反应
浓硫酸的作用:脱水剂,催化剂⑤思考:
根据对课本上有关官能团、衍生物的理解,请你说说官能团与衍生物的性质之间的关系。课堂小结 1.掌握乙醇的组成、分子结构与主要化学性质,了解它们的主要用途。2.理解烃的衍生物及官能团的概念。3.通过建立乙醇分子的立体结构模型,从结构角度初步认识乙醇的氧化反应的原理。 练习 1.禁止用工业酒精配制饮料酒,这是因为酒精中含有少量有毒物质是( )
A.甘油 B.醋酸
C.甲醇 D. 乙醛C2.比较乙烷和乙醇的结构,下列说法中错误的是( )
A.两个碳原子都以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B3.可用于检验 乙醇中是否含有水的试剂是( )
A.无水硫酸铜 B.生石灰
C.金属钠 D.胆矾 A4.向装有乙醇的烧杯中投入一小块金属钠,下列对实验现象的描述中正确的是( )
A.钠块沉在乙醇液面的下面
B.钠熔化成小球
C.钠块在乙醇的液面上游动
D.钠块表面有气泡放出
AD5.能证明乙醇分子中含有一个羟基的事实是( )
A.乙醇完全燃烧生成水
B.0.1mol乙醇与足量金属钠反应生成0.05 mol氢气
C.乙醇能与水一任意比例互溶
D.乙醇容易挥发B6.将铜丝灼烧变黑后立即插入下列物质中,铜丝变红且质量不变的是( )
A.硫酸 B.乙醇
C.一氧化碳 D.硝酸
BC7.某有机物蒸气,完全燃烧时需要三倍于其体积的氧气,产生二倍于其体积的二氧化碳,该有机物可能是( )
A.C2H4 B.C2H5OH
C.CH3CHO D.CH3COOHAB8.在常压和100℃条件下,将乙醇汽化为蒸气,然后和乙烯以任意比混合,其混合气体为VL.若完全燃烧,需要相同条件下氧气的体积为( )
A.2V L B.2.5V L
C.3V L D.无法计算
C思考:
为什么醉酒后喝醋能解酒?
为什么厨师烧鱼时加点醋和酒,就能使鱼的味道变的无腥味,香醇还特别鲜美?
第二课时 乙酸 活动一
观察乙酸的分子模型,试写出乙酸的分子式和结构简式。结构简式: 分子式:C2H4O2官能团 : CH3COOH —COOH(羧基)结构式: 活动二
观察乙酸的颜色、状态、气味,观察冰醋酸,并看书总结乙酸的物理性质。 1.物理性质
颜色:
状态:
气味:
熔点:
沸点:
溶解性:无色液体强烈刺激性气味117.9℃16.6℃易溶于水和乙醇思考:
家庭中常用食醋浸泡有水垢(主要成分是CaCO3)的暖瓶或水壶,以清除水垢。这是利用了醋酸的什么性质?通过这个事实你能比较出醋酸和碳酸的酸性强弱吗? 2.乙酸的化学性质
乙酸的酸性
①与指示剂反应
②与碱反应
③与碱性氧化物反应
④与盐反应
⑤与金属反应
?通性CH3COOH CH3COO-+H+例.写出下列反应的离子方程式.
(1)乙酸溶液和氢氧化铜反应
(2)乙酸与氧化钙反应
(3)将锌粒投入乙酸溶液中
(4)用乙酸除水垢[CaCO3,Mg(OH)2]⑴.2CH3COOH +Cu(OH)2=2CH3COO-+Cu2++2H2O⑵. 2CH3COOH+CaO=2CH3COO-+Ca2++2H2O⑶. 2CH3COOH+Zn=2CH3COO-+Zn2++H2↑⑷. 2CH3COOH+CaCO3=2CH3COO-+Ca2++
CO2↑+H2O
2CH3COOH+Mg(OH)2=Mg2++2CH3COO-+2H2O思考:
为什么酒放的时间越长,质量越好? 活动三:实验探究
在一支试管中加入3mL乙醇,然后边振荡边慢慢加入2mL浓硫酸和 2mL乙酸;按图3—16连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上,观察现象。实验现象:实验结论:饱和碳酸钠溶液的液面上有透明的油状液体产生,并可闻到香味。在浓硫酸存在、加热的条件下,乙酸和乙醇发生反应,生成无色、透明、不溶于水、有香味的油状液体。该油状液体是乙酸乙酯。注意事项:
1.往大试管加入化学药品时,切莫先加浓硫酸。
2.加热要小心均匀的进行,防止液体剧烈沸腾,乙酸和乙醇大量挥发。
3.导气管末端不要进入液体内,以防止液体倒吸。
4.实验室制乙酸乙酯时用饱和碳酸钠溶液吸收,有利于乙酸乙酯与乙酸、乙醇的分离。CH3—C—OH + H—O—C2H5 CH3—C—O—C2H5 + H2O O酯化反应的概念:
特点: 酸与醇反应生成酯和水的反应。①反应很慢,即反应速率很低(为了提高反应
速率,一般要加入浓硫酸)
②反应是可逆的,即反应物不能完全变成生成
物反应的化学方程式:浓硫酸O 活动四
利用乙酸与乙醇的结构式分析在酯化反应中它们的断键方式。提示:如果用含氧的同位素188O的乙醇跟乙酸起反应,可发现生成物中乙酸乙酯分子中含有188O原子。CH3—C—OH + H—188O—C2H5 CH3—C—188O—C2H5 + H2O OO浓硫酸 一般过程是羧酸分子里的羟基与醇分子里羟基上的氢原子结合成水,其余部分相互结合生成酯。酯化反应又属于取代反应。酯化反应的机理:思考:从组成、作用上比较乙酸分子里羧基上羟基与乙醇分子里羟基的异同,体会官能团与性质的关系。课堂小结 1.掌握乙酸的组成、分子结构与主要化学性质,了解它的主要用途。 2.通过建立乙酸分子的立体结构模型,从结构角度初步认识乙酸的酯化反应的原理和实质。 3.从乙醇和乙酸的组成、结构和性质出发,学习由 “(组成)结构—性质—用途”研究烃的衍生物的方法。 练习1.乙酸是一种重要的有机酸,它是食醋的主要成分,所以乙酸又叫( ).乙酸的分子式为( ),结构式为( ),结构简式( ).乙酸分子中的官能团为( ).
醋酸C2H4O2 CH3COOH —COOH(羧基)2.乙酸分子的结构中不含有的原子团是( )
A.羧基 B.甲基 C.羟基 D.乙基
D3.只用水就能鉴别的一组物质是( )
A.苯,乙酸,四氯化碳
B.乙醇,乙醛,乙酸
C.乙醇,硝基苯,乙酸乙酯
D.己烷,乙醇,甲醇
AC4.下列物质中,不能由乙醇直接制取的是( )
A.乙醛 B.氢气
C.乙酸乙酯 D.乙烷D5.用一种试剂可以区分乙醇和乙酸的是( )
A.氢氧化钠溶液
B.氨水
C.碳酸钠溶液
D.氢氧化铜
C6.1mol有机物,充分燃烧后生成2molCO2 和3mol H2O.此有机物可能是( ),
( )CH3CH3CH3CH2OH
