人教版高中化学必修一 2.1《物质的分类》课件(共49张PPT)
文档属性
| 名称 | 人教版高中化学必修一 2.1《物质的分类》课件(共49张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 08:00:19 | ||
图片预览







文档简介
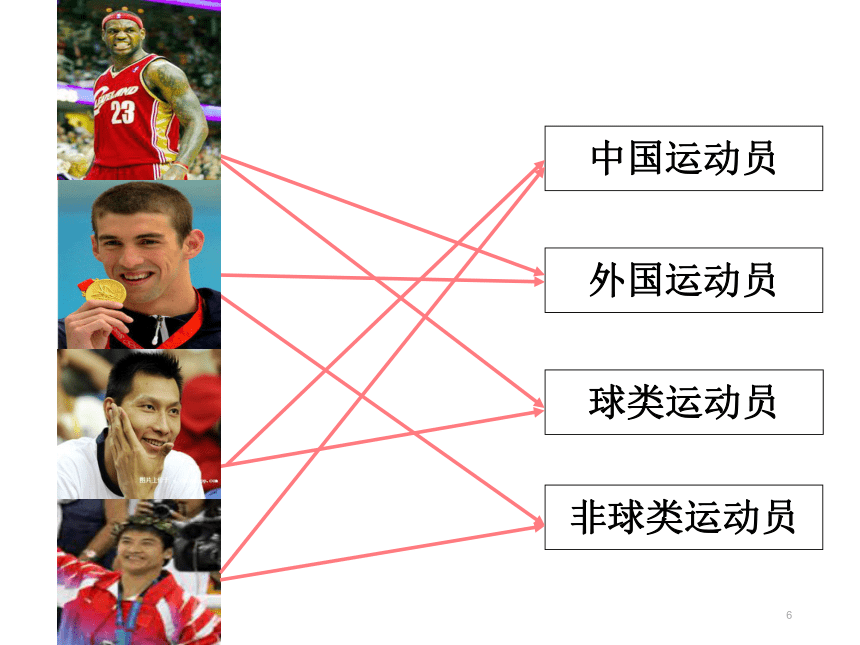
课件49张PPT。第1课时 简单的分类方法及其应用物质的分类超市里成千上万种商品,如何能够迅速找到某种商品?思考图书馆里有许多书籍,如何很快就找到几米《我的心中每天开出一朵花》?思考1.请从其他方面收集一些应用分类法的例子,讨论对它们进行分类的目的和意义。意义:能够提高人们工作、学习的效率,使人们更快、更便捷地达到目的等。思考与交流简单分类法及其应用每组物质中都有一种与其他物质在分类上不同,将这种物质找出来。1、NaCl、KCl、NaClO、BaCl2 ( )
2、HClO3、KClO3、Cl2、NaClO3 ( )
3、H3PO4、H2SiO3、HCl、H2SO4 ( )
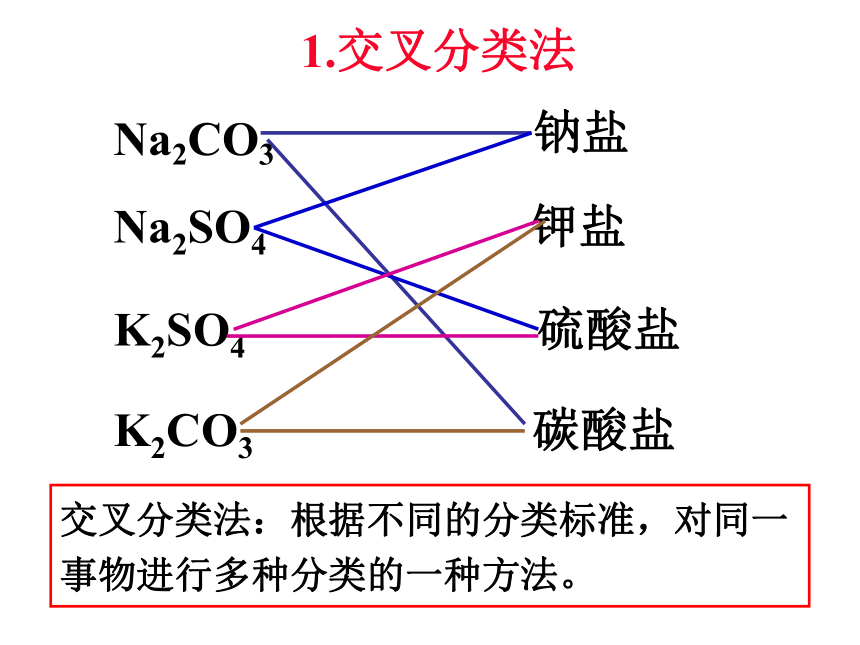
4、空气、氮气、氯化氢、碳酸钠 ( )NaClOCl2HCl空气试一试1中国运动员外国运动员球类运动员非球类运动员1.交叉分类法
?
Na2SO4 钾盐
?
K2SO4 硫酸盐
?
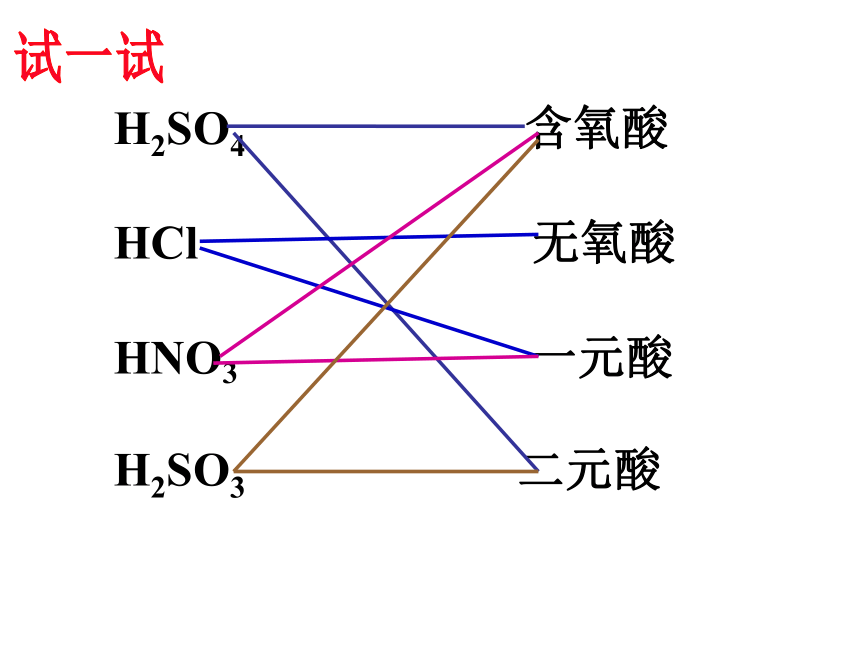
K2CO3交叉分类法:根据不同的分类标准,对同一事物进行多种分类的一种方法。Na2CO3钠盐 碳酸盐H2SO4 含氧酸
?
HCl 无氧酸
?
HNO3 一元酸
?
H2SO3 二元酸
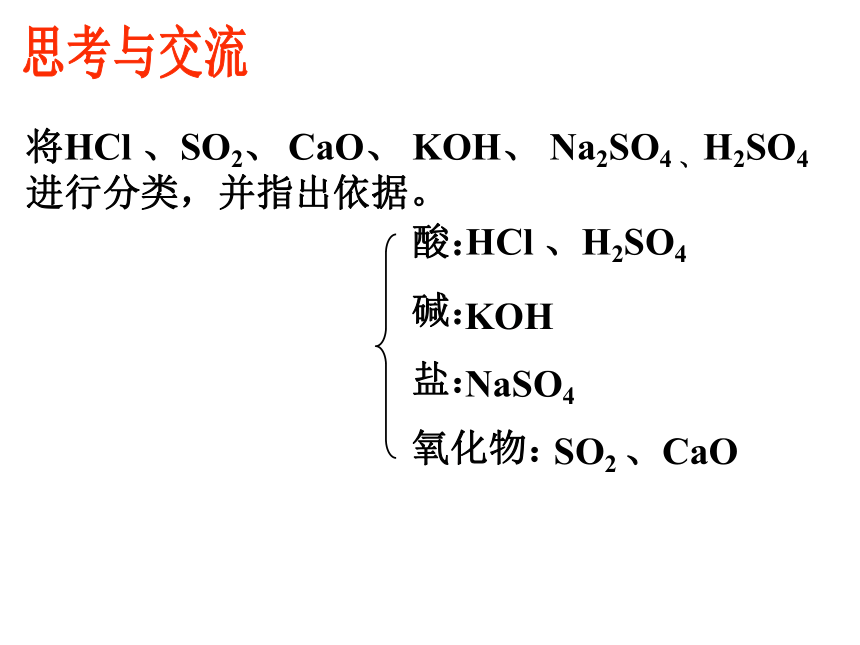
?试一试将HCl 、SO2、 CaO、 KOH、 Na2SO4 、H2SO4进行分类,并指出依据。思考与交流酸:
碱:
盐:
氧化物:HCl 、H2SO4 KOH NaSO4SO2 、CaO物质 纯净物混合物均匀混合物非均匀混合物单质 化合物金属单质非金属单质酸
碱
盐
氧化物2.树状分类法分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。化合反应 A+B+ … =C
分解反应 A=B+C+…
置换反应 A+BC=AC+B
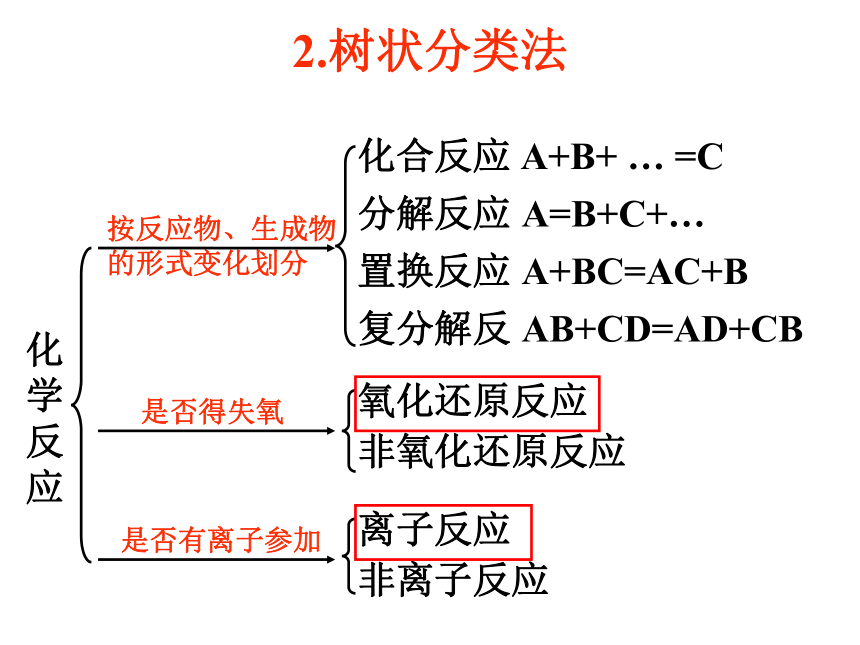
复分解反 AB+CD=AD+CB按反应物、生成物的形式变化划分是否得失氧氧化还原反应
非氧化还原反应是否有离子参加离子反应
非离子反应化学反应2.树状分类法1.分类是学习和研究化学物质及其变化的一种常用的基本方法。2.分类要有一定的标准,根据不同的标准可以进行不同的分类。交叉分类法、树状分类法
是常见的物质分类法。小结图书馆里有许许多多的书籍,为什么你很快就找到你需要的书? 分类方法的应用在日常生活中是非常普遍的,我们应该善于发现和学会使用,以提高我们工作和学习的效率。
在化学方面,为了更好地获得和利用物质,科学家同样也会将众多的化学物质进行分类研究。分类:即根据事物的特点分别归类。1【交流与讨论】 请将下列物质进行分类,并说明分类的依据。
空气、乙醇(C2H5OH)、硫酸铵、铜、碘酒、碘、 氢气、石墨 、食盐水1 空气、碘酒、食盐水
乙醇、硫酸铵、铜、
碘、氢气、石墨 硫酸铵、铜、碘、石墨
乙醇、碘酒、食盐水
空气、氢气
物质的简单分类方法 1.单一分类法:被分对象只用一种标准进行归类的方法化学物质纯净物混合物单质金属单质非金属单质(据所含物质的种数)(据所含元素的性质)单一分类法有很明显的局限性2、交叉分类法:将被分类的对象应用多种不同的单一分类法进行分类13、树状分类法: 是对同类物质按照属性进一步细分类的方法1 例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类HCl H2SO4 NaOH Ca(OH)2 Na2SO4 CaCO3 CO2 CaO 化学物质非均匀
混合物均匀
混合物(按物质的组成分类)酸 碱 盐 氧化物……1 学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时地归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。11.对若干物质分类,下列说法错误的是
A.可能有多种标准
B.一定只有一种标准
C.可能用交叉分类法进行分类
D.可能用树状分类法进行分类 2.下列物质属于纯净物的是
A.稀硫酸 B.NaOH
C.NaOH溶液 D.天然气
练习:√√3.填表CaOH2SO4CuSO4NeFeCl3NH4HCO3NaOH氧化物酸盐单质盐盐碱 酸1,按是否含有氧元素:含氧酸:H2SO4 HNO3 H2CO3 H3PO4 无氧酸: HCl H2S HBr HF
2,按电离时生成氢离子的个数一元酸:HNO3 HCl HF 二元酸:H2SO4 H2CO3 H2S 三元酸:H3PO4 3,按性质分:易挥发酸:难挥发性酸:易分解酸:强氧化性酸: HNO3 HCl H2SO4 H3PO4 H2CO3 H2SO3 (浓)H2SO4 HNO3 碱按其在水溶液中是否溶解:1,可溶性碱:2,难溶性碱:KOH NaOH Ba(OH)2 Ca(OH)2 Cu(OH)2 Fe(OH)3 Mg(OH)2 Zn(OH)2 可溶性碱的氧化物 + 水===碱 如: Na2O +H2O==2NaOH 如: Cu(OH)2===CuO +H2O 难溶性碱 加热易分解盐1,按组成分为:正 盐酸式盐碱式盐NaCl FeS MgCl2 某化某NaNO3 CuSO4 CaCO3 某酸某NaHCO3 Ca(HCO3)2 某酸氢某 NaH2PO4 某酸几氢某Cu2(OH)2CO3 MgOHCl 碱式某酸某2,按是否可溶于水:可溶性盐:难溶性盐: NaCl MgCl2 CuSO4 CaCO3 AgCl BaSO4 3,按阴、阳离子来分:阳离子:阴离子:K+ Na+ NH4+ Cu2+ Ca2+ NO3-- SO42-- Cl— CO32-- PO43-- 化学反应按反应物和生成物的类别以及反应前后物质的多少化合反应分解反应置换反应复分解反应按反应中是否有离子参加离子反应非离子反应按反应中是否有电子转移氧化还原反应非氧化还原反应第2课时 分散系及其分类初中时所学“溶液”的概念:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液.
溶剂:能溶解其他物质的物质.
溶质:被溶解的物质分散系及其分类分散系:分散质:分散剂:把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系。被分散的物质起容纳分散质作用的物质气固液固液气分散质分散剂按照分散质或分散剂的聚集状态(气、液、固)
来分,有9种类型。分散系的分类
【思考与交流】
阅读课本,然后画出分散系的树状分类图?分散系胶体浊液溶液悬浊液乳浊液分散系依据分散质微粒直径大小
分散系可分为溶液、浊液、胶体三类< 1nm1 ~100 nm >100 nm 【科学探究】:
1、取三个烧杯,分别加入25ml蒸馏水、25mlCuSO4溶液和25ml泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1-2mlFeCl3饱和溶液。继续煮沸至溶液呈红色,停止加热。观察制得得Fe(OH)3胶体,并与CuSO4溶液和泥水比较。
2、把盛有溶液和胶体得烧杯置于暗处,分别用手电筒照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
3、将胶体和泥水分别进行过滤,观察并记录实验现象。
形成一条光亮的通路胶体的直径在1-100nm之间,能使光波发生散射无光路现象产生溶液中粒子的直径小于1nm,散射极其微弱无变化由浑浊变澄清它们的分散质粒子大小﹑性质有何区别?丁达尔现象在光的传播过程中,光线照射到微粒时,如果微粒大于入射光波长很多倍,则发生光的反射;如果微粒小于入射光波长,则发生光的散射,此时的光向四周放射,称为散射光或乳光现象。
溶胶粒子大小一般不超过100nm(1nm~100nm),小于可见光的波长(400nm~700nm),因此可见光透过溶胶会产生明显的散射作用。这种现象也被称为丁达尔现象。而对于溶液,虽然分子或离子更小,但散射光的强度随散射粒子体积的减小而明显减小。胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。是胶体稳定性的主要原因
胶粒带电情况:金属氢氧化物 —— 带(+)电荷
土壤胶粒—— 带(-)电荷淀粉胶粒——不带电。
胶体的聚沉
原因:当破坏胶体微粒原来带有相同电荷的特点时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:
⑴加热
⑵加电解质溶液
⑶加带相反电荷的胶体<1n m1~100n m>100n m分子或离子分子的集合体或高分子小液滴或固体小颗粒
均一、稳定、透明 不均一、不稳定、不透明
均一、稳定、透明能 能 不能可通过无光路可通过形成光路 透光性差 能 不能 不能蔗糖水、食盐水蛋白溶液、淀粉溶液
石灰乳、油水混合物
1、用特殊方法把固体物质加 工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液
C、胶体 D、乳浊液
c目标测试
2、下列各组物质中,常用渗析法分离
的是 ( )
A、CaCO3和Na2CO3固体
B、I2和K2CO3固体
C、CCl4和水
D、Fe(OH)3胶体和FeCl3溶液D目标测试氧化物酸性氧化物
碱性氧化物
概念
凡是跟碱起反应生成盐和水的
凡是跟酸起反应生成盐和水的
制
法
1, C +O2====CO2
1, 2Cu +O2====2CuO2,(难溶性)的含氧酸盐分解
CaCO3===CaO +CO2↑2,(难溶性)的含氧酸盐分解 MgCO3===MgO +CO2↑ 3,含氧酸加热分解
H2CO3===H2O +CO2↑3,难溶性的碱加热分解
Cu(OH)2===CuO +H2O
点燃1,酸性氧化物+碱=盐+水 CO2+2NaOH==Na2CO3+H2O 1,碱性氧化物+酸=盐+水CuO+2HCl====CuCl2+H2O
SO3+H2O==H2SO4
2,酸性氧化物+水=酸
2,碱性氧化物+水=碱
Na2O+H2O==2NaOH
酸性氧化物+碱性氧化物===含氧酸盐SiO2+CaO====CaSiO3
大多数非金属氧化物(CO、H2O 等除
外)和少数金属氧化物(Mn2O7 )
大多数金属氧化物(Al2O3 ,Mn2O7 等除外)
主要
化学
性质
范围
2、HClO3、KClO3、Cl2、NaClO3 ( )
3、H3PO4、H2SiO3、HCl、H2SO4 ( )
4、空气、氮气、氯化氢、碳酸钠 ( )NaClOCl2HCl空气试一试1中国运动员外国运动员球类运动员非球类运动员1.交叉分类法
?
Na2SO4 钾盐
?
K2SO4 硫酸盐
?
K2CO3交叉分类法:根据不同的分类标准,对同一事物进行多种分类的一种方法。Na2CO3钠盐 碳酸盐H2SO4 含氧酸
?
HCl 无氧酸
?
HNO3 一元酸
?
H2SO3 二元酸
?试一试将HCl 、SO2、 CaO、 KOH、 Na2SO4 、H2SO4进行分类,并指出依据。思考与交流酸:
碱:
盐:
氧化物:HCl 、H2SO4 KOH NaSO4SO2 、CaO物质 纯净物混合物均匀混合物非均匀混合物单质 化合物金属单质非金属单质酸
碱
盐
氧化物2.树状分类法分类原则:同一层次的物质类别间一般是相互独立,没有交叉的。化合反应 A+B+ … =C
分解反应 A=B+C+…
置换反应 A+BC=AC+B
复分解反 AB+CD=AD+CB按反应物、生成物的形式变化划分是否得失氧氧化还原反应
非氧化还原反应是否有离子参加离子反应
非离子反应化学反应2.树状分类法1.分类是学习和研究化学物质及其变化的一种常用的基本方法。2.分类要有一定的标准,根据不同的标准可以进行不同的分类。交叉分类法、树状分类法
是常见的物质分类法。小结图书馆里有许许多多的书籍,为什么你很快就找到你需要的书? 分类方法的应用在日常生活中是非常普遍的,我们应该善于发现和学会使用,以提高我们工作和学习的效率。
在化学方面,为了更好地获得和利用物质,科学家同样也会将众多的化学物质进行分类研究。分类:即根据事物的特点分别归类。1【交流与讨论】 请将下列物质进行分类,并说明分类的依据。
空气、乙醇(C2H5OH)、硫酸铵、铜、碘酒、碘、 氢气、石墨 、食盐水1 空气、碘酒、食盐水
乙醇、硫酸铵、铜、
碘、氢气、石墨 硫酸铵、铜、碘、石墨
乙醇、碘酒、食盐水
空气、氢气
物质的简单分类方法 1.单一分类法:被分对象只用一种标准进行归类的方法化学物质纯净物混合物单质金属单质非金属单质(据所含物质的种数)(据所含元素的性质)单一分类法有很明显的局限性2、交叉分类法:将被分类的对象应用多种不同的单一分类法进行分类13、树状分类法: 是对同类物质按照属性进一步细分类的方法1 例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类HCl H2SO4 NaOH Ca(OH)2 Na2SO4 CaCO3 CO2 CaO 化学物质非均匀
混合物均匀
混合物(按物质的组成分类)酸 碱 盐 氧化物……1 学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时地归纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研究来了解这类物质的性质,从而提高我们化学学习的效率。11.对若干物质分类,下列说法错误的是
A.可能有多种标准
B.一定只有一种标准
C.可能用交叉分类法进行分类
D.可能用树状分类法进行分类 2.下列物质属于纯净物的是
A.稀硫酸 B.NaOH
C.NaOH溶液 D.天然气
练习:√√3.填表CaOH2SO4CuSO4NeFeCl3NH4HCO3NaOH氧化物酸盐单质盐盐碱 酸1,按是否含有氧元素:含氧酸:H2SO4 HNO3 H2CO3 H3PO4 无氧酸: HCl H2S HBr HF
2,按电离时生成氢离子的个数一元酸:HNO3 HCl HF 二元酸:H2SO4 H2CO3 H2S 三元酸:H3PO4 3,按性质分:易挥发酸:难挥发性酸:易分解酸:强氧化性酸: HNO3 HCl H2SO4 H3PO4 H2CO3 H2SO3 (浓)H2SO4 HNO3 碱按其在水溶液中是否溶解:1,可溶性碱:2,难溶性碱:KOH NaOH Ba(OH)2 Ca(OH)2 Cu(OH)2 Fe(OH)3 Mg(OH)2 Zn(OH)2 可溶性碱的氧化物 + 水===碱 如: Na2O +H2O==2NaOH 如: Cu(OH)2===CuO +H2O 难溶性碱 加热易分解盐1,按组成分为:正 盐酸式盐碱式盐NaCl FeS MgCl2 某化某NaNO3 CuSO4 CaCO3 某酸某NaHCO3 Ca(HCO3)2 某酸氢某 NaH2PO4 某酸几氢某Cu2(OH)2CO3 MgOHCl 碱式某酸某2,按是否可溶于水:可溶性盐:难溶性盐: NaCl MgCl2 CuSO4 CaCO3 AgCl BaSO4 3,按阴、阳离子来分:阳离子:阴离子:K+ Na+ NH4+ Cu2+ Ca2+ NO3-- SO42-- Cl— CO32-- PO43-- 化学反应按反应物和生成物的类别以及反应前后物质的多少化合反应分解反应置换反应复分解反应按反应中是否有离子参加离子反应非离子反应按反应中是否有电子转移氧化还原反应非氧化还原反应第2课时 分散系及其分类初中时所学“溶液”的概念:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液.
溶剂:能溶解其他物质的物质.
溶质:被溶解的物质分散系及其分类分散系:分散质:分散剂:把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系。被分散的物质起容纳分散质作用的物质气固液固液气分散质分散剂按照分散质或分散剂的聚集状态(气、液、固)
来分,有9种类型。分散系的分类
【思考与交流】
阅读课本,然后画出分散系的树状分类图?分散系胶体浊液溶液悬浊液乳浊液分散系依据分散质微粒直径大小
分散系可分为溶液、浊液、胶体三类< 1nm1 ~100 nm >100 nm 【科学探究】:
1、取三个烧杯,分别加入25ml蒸馏水、25mlCuSO4溶液和25ml泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1-2mlFeCl3饱和溶液。继续煮沸至溶液呈红色,停止加热。观察制得得Fe(OH)3胶体,并与CuSO4溶液和泥水比较。
2、把盛有溶液和胶体得烧杯置于暗处,分别用手电筒照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
3、将胶体和泥水分别进行过滤,观察并记录实验现象。
形成一条光亮的通路胶体的直径在1-100nm之间,能使光波发生散射无光路现象产生溶液中粒子的直径小于1nm,散射极其微弱无变化由浑浊变澄清它们的分散质粒子大小﹑性质有何区别?丁达尔现象在光的传播过程中,光线照射到微粒时,如果微粒大于入射光波长很多倍,则发生光的反射;如果微粒小于入射光波长,则发生光的散射,此时的光向四周放射,称为散射光或乳光现象。
溶胶粒子大小一般不超过100nm(1nm~100nm),小于可见光的波长(400nm~700nm),因此可见光透过溶胶会产生明显的散射作用。这种现象也被称为丁达尔现象。而对于溶液,虽然分子或离子更小,但散射光的强度随散射粒子体积的减小而明显减小。胶体的电泳
原因:带电的胶体微粒在电场作用下发生了定向移动。是胶体稳定性的主要原因
胶粒带电情况:金属氢氧化物 —— 带(+)电荷
土壤胶粒—— 带(-)电荷淀粉胶粒——不带电。
胶体的聚沉
原因:当破坏胶体微粒原来带有相同电荷的特点时,就会使它从不容易凝聚的状态变成聚集状态而沉淀
胶体凝聚的方法:
⑴加热
⑵加电解质溶液
⑶加带相反电荷的胶体<1n m1~100n m>100n m分子或离子分子的集合体或高分子小液滴或固体小颗粒
均一、稳定、透明 不均一、不稳定、不透明
均一、稳定、透明能 能 不能可通过无光路可通过形成光路 透光性差 能 不能 不能蔗糖水、食盐水蛋白溶液、淀粉溶液
石灰乳、油水混合物
1、用特殊方法把固体物质加 工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液
C、胶体 D、乳浊液
c目标测试
2、下列各组物质中,常用渗析法分离
的是 ( )
A、CaCO3和Na2CO3固体
B、I2和K2CO3固体
C、CCl4和水
D、Fe(OH)3胶体和FeCl3溶液D目标测试氧化物酸性氧化物
碱性氧化物
概念
凡是跟碱起反应生成盐和水的
凡是跟酸起反应生成盐和水的
制
法
1, C +O2====CO2
1, 2Cu +O2====2CuO2,(难溶性)的含氧酸盐分解
CaCO3===CaO +CO2↑2,(难溶性)的含氧酸盐分解 MgCO3===MgO +CO2↑ 3,含氧酸加热分解
H2CO3===H2O +CO2↑3,难溶性的碱加热分解
Cu(OH)2===CuO +H2O
点燃1,酸性氧化物+碱=盐+水 CO2+2NaOH==Na2CO3+H2O 1,碱性氧化物+酸=盐+水CuO+2HCl====CuCl2+H2O
SO3+H2O==H2SO4
2,酸性氧化物+水=酸
2,碱性氧化物+水=碱
Na2O+H2O==2NaOH
酸性氧化物+碱性氧化物===含氧酸盐SiO2+CaO====CaSiO3
大多数非金属氧化物(CO、H2O 等除
外)和少数金属氧化物(Mn2O7 )
大多数金属氧化物(Al2O3 ,Mn2O7 等除外)
主要
化学
性质
范围
