人教版高中化学必修一 2.3《氧化还原反应》课件(共63张PPT)
文档属性
| 名称 | 人教版高中化学必修一 2.3《氧化还原反应》课件(共63张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 903.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 08:04:34 | ||
图片预览










文档简介
课件63张PPT。第二章 化学物质及变化氧化还原反应(第1课时)想一想铁塞为何变得锈迹斑斑?请判断该反应的反应类型
判断的依据是什么?
通过分析你有什么新的发现?
发生氧化反应和还原反应的物质分别是什么?为什么?【思考与交流1】氧化反应和还原反应都是同时进行的,这样的反应就叫氧化还原反应为什么?是氧化还原反应吗?
发生氧化反应和还原反应的物质分别是什么?为什么?
被氧化和被还原的物质分别是什么?【思考与交流2】被氧化:得到氧的物质
被还原:失去氧的物质C
O2氧化还原反应的有关概念物质失去氧的反应 物质得到氧的反应 有氧得失的反应一、氧化还原反应上述几个氧化还原反应除了有氧得失之外还有什么共同点?
各种元素的化合价在反应前后有无变化?
你认为氧化反应、还原反应与元素化合价的升降有什么关系?【思考与交流3】化合价升高, 氧化反应化合价降低,还原反应+200+1氧化还原反应:元素的化合价在反应前后有变化
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应,被氧化,被还原 化合价升高,氧化反应化合价降低,还原反应Zn + CuSO4 = ZnSO4 + Cu 0+2+20该反应是氧化还原反应吗?
若是请标明化合价的升降与氧化反应、还原反应的关系
请仔细分析化学价的升降,你有什么新的发现?,被氧化,被还原氧化还原反应概念失氧的反应得氧的反应有氧得失的反应化合价降低的反应化合价升高的反应有元素化合价升降的反应有电子失去或偏离的反应有电子得到或偏向的反应有电子转移(得失或偏移)的反应化合价升降观点电子转移观点特征本质【小结】氧化还原反应:元素的化合价有变化非氧化还原反应:元素的化合价没有变化化学反应 【课堂反馈】
请从化合价升降的角度判断以下反应哪些属于氧化还原反应?其中发生氧化反应和发生还原反应的物质分别是什么?为什么?
①Fe2O3+3CO 2Fe+3CO2
②CuO+2HCl=CuCl2+H2O
③CaCl2+Na2CO3=CaCO3↓+2NaCl
④Fe+CuCl2=FeCl2+Cu
⑤2Na+Cl2 2NaCl氧化还原反应氧化还原反应氧化还原反应思考?[问题]
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?请从微观粒子的角度分析2Na + Cl2 = 2NaCl(条件略),你认为发生氧化反应的本质是什么?发生还原反应的本质又是什么?通过分析你有什么发现?
NaCl中存在的微粒是什么?
反应物中的微粒是什么?
他们是如何转变的?【思考与交流4】电子转移●NaCl●Cl-Na+还原反应失去 一个电子得到 一个电子氧化反应【思考与交流5】
通过对氯气与金属钠反应分析,请预测氯气还能与哪些物质反应?
反应中氯气将如何变化?
为什么氯气能发生这些反应?请从微观的角度进行解释。
请以氯气与氢气反应生成氯化氢为例进行说明HClHClHCl 的形成过程化合价升降的原因:电子的偏移化
学
反
应化合反应分解反应置换反应复分解反应从反应物和生成物的组成及种类分非氧化还原反应氧化还原反应有无化合价变化你认为以下说法正确吗? 举例说明1.置换反应全部属于氧化还原反应。2. 复分解反应全部属于非氧化还原反应。3. 有单质参加的化合反应都是氧化还原反应
4 .有单质生成的分解反应都是氧化还原反应非氧化还原反应第二章 化学物质及变化氧化还原反应(第2课时)1、下列哪个反应表示二氧化硫被还原 ( )
A、SO2+2H2O+Cl2 = H2SO4+2HCl
B、SO2+2H2S = 2H2O+3S↓
C、SO2+2NaOH = Na2SO3+H2O
D、SO2+Na2CO3 = Na2SO3+CO2↑B课前小测2、当化合物中的元素被转化成单质中的元素时,该元素 ( )
A、一定被氧化;
B、一定被还原;
C、可能被氧化,也可能被还原;
D、化合价降低为0。C3、已知反应①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2 ↑
⑤ SiO2+2NaOH=Na2SiO3+H2O
其中不属于氧化还原反应的有 ,
H2O被氧化的是________,
H2O被还原的是_________,
属于氧化还原反应,但水既不被氧化又不被还原的是________。① ⑤③④②2Na + Cl2 = 2NaCl请表示出化合价的升降、电子得失与氧化反应、还原反应之间的关系化合价升高,失去2×e-, 氧化反应, 被氧化化合价降低,得到2×e-, 还原反应, 被还原 0+10-1Cl2:
具有氧化性
氧化剂
Na:
具有还原性
还原剂氧化剂还原剂得到电子,被还原失去电子,被氧化n个e-二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化。遵循两个守恒注意失电子总数=得电子总数化合价升高总数=化合价降低总数氧化剂还原剂氧化反应化合价升高失电子化合价降低得电子还原反应还原产物氧化产物特征反应物生成物实质被氧化被还原学会总结a. 氧化还原反应的判断依据:元素化合价的升降。b.氧化还原反应的本质:电子的转移c.氧化还原反应的规律:得失电子守恒失电子,化合价升高,氧化反应
得电子,化合价降低,还原反应
HClO Na2O2
H2O2 MnO2 等KMnO4 FeCl3 KClO3HNO3 H2SO4(浓)Cl2 O2 活泼的
非金属单质含较高价态元素的含氧酸含较高价态元素的盐常 见 的 氧 化 剂2. 常见的氧化剂和还原剂:Na、Zn、Fe 等H2 C 等CO SO2 Na2SO3KI Na2S较低价态元素的氧化物和盐非金属单质 活泼的
金属单质FeSO4常 见 的 还原 剂双线桥法:(1)箭头由反应物指向生成物
(2)箭头连接反应前后不同价态的同种元素。
(3)标明电子得失和数目.2CuO + C 2 Cu + CO2高温失去4e-,化合价升高,被氧化得到2× 2e-,化合价降低,被还原表示反应物转变为生成物时得失
电子情况(不代表电子转移方向)三. 氧化还原反应中电子转移情况的表示方法单线桥法:表示反应过程中电子由还原剂转移给氧化剂的情况(电子转移方向和数目)画法:箭头箭头在反应物之间,由还原剂指向氧化剂,只标明电子转移数目和方向,不标得失 4e-四. 正确标出电子转移方向和数目 1、金属的腐蚀与防护 钢铁腐蚀的现象 防锈方法 2、金属的冶炼(炼铁熔炉中发生的氧化还原反应) 3、化学电源与电解 4、火箭助推器中的氧化还原反应: 2 N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) 2 NH?ClO?==== N?↑+ Cl?↑+ 4H?O+ 2O?↑ 1、在反应 MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+2H2O
中,当有1molCl2生成时,有 molHCl
被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。练习2222、当反应 2Na + 2H2O = 2NaOH + H2↑中转移了
0.5mol电子时,参加反应的Na是 mol。0. 5第二章 化学物质及变化氧化还原反应(第3课时)复习1. 氧化还原反应的判断依据:元素化合价的升降。2.氧化还原反应的本质:电子的转移3.氧化还原反应的规律:得失电子守恒失电子,化合价升高,氧化反应
得电子,化合价降低,还原反应
五、物质氧化性、还原性强弱判断决定因素: 得失电子的难易,而非多少!1.根据金属、非金属活动性顺序比较:原子还原性渐弱单质(原子)氧化性逐渐减弱,
阴离子的还原逐渐增强氧化性逐渐增强2.根据氧化还原反应比较 氧化剂 + 还原剂 = 还原产物 + 氧化产物化合价降低被还原化合价升高被氧化氧化性:氧化剂>氧化产物还原性:还原剂>还原产物( 强氧化剂+强还原剂= 弱还原性物质 +弱氧化性物质) 例:2Fe2++Cl2 =2Fe3+2Cl-
2Fe3++2I- = 2Fe2+ + I23.根据反应式:
(1)2Fe3+ + 2I- = 2Fe2+ + I2,
(2)Br2 +2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是(?? ? )。
A.Br- > Fe2+ > I-
B.I- > Fe2+ > Br-
C.Br- > I- > Fe2+
D.Fe2+ > I- > Br-B-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 失去e- ,化合价升高,被氧化,作还原剂得到e- ,作氧化剂化合价降低,被还原,六、氧化还原反应的重要规律及应用 -2 0 +4 +6
S -- S -- - - S -- -- -- -- -- - SS2- S SO2 H2SO3 SO32- H2SO4只能做还原剂只能做氧化剂既能做氧化剂,又能做还原剂
处于最高价态
处于最低价态
处于中间价态——只具氧化性
——只具还原性
——两者皆有元素运用在Fe3+、Fe2+、 Al3+、H+、S、Cl- 等粒子中
只有氧化性的是_____,只有还原性的是__ ,二者兼有的是____。 Fe3+Al3+H+Cl-S、 Fe2+1.价态规律(价态与氧化性、还原性的关系)归中定律:不同价态的同一元素的化合物间反应,遵循:高价降,低价升,只靠拢, 不交叉,最多到同价。指出下列反应中的氧化产物和还原产物:
⑴KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O⑵H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O+5-10-1-2+60+4氧化产物还原产物氧化产物还原产物2、价态的转换(变化)规律歧化: Cl2+H2O===HCl+HClO高氧低还中两性,归中靠拢不交叉;
歧化反应价升降,相邻价态不反应。●记忆口诀:练习:
对于H-+H2O===H2+OH-说法正确的是 ( )
A.该反应属于置换反应
B.若该反应中有1 mol电子转移,则生成H2一定是
22.4 L
C.水是氧化剂
D.H2只是氧化产物答案:C 常见氧化剂、还原剂及其产物氧化剂
Cl2
Fe3+
HNO3 (浓)
HNO3 (稀)
H2SO4(浓)
KMnO4
H2O2主要还原产物
Cl–
Fe2+
NO2
NO
SO2
Mn2+ 或MnO2
H2O还原剂
金属单质
H2S、 S2-
SO2、SO32-
HI、I-
CO、C
H2
Fe2+
H2O2主要氧化产物
金属离子
S
SO42-
I2
CO2
H2O
Fe3+
O23、反应进行的次序规律 同一氧化剂与多种还原剂反应时,首先被氧化的是还原性较强的物质;
同一还原剂与多种氧化剂反应时,首先被还原的是氧化性较强的物质。如:在含有Ag+、Fe2+的溶液中通入Zn,先析出哪种金属?先析出Ag,因为氧化性:Ag+ >Fe2+. 今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2===2FeCl3,
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而
不氧化Fe2+和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl[答案] C4、得失电子守恒规律氧化剂得电子数=还原剂失电子数应用:
(1).氧化还原反应方程式的配平
(2).有关计算例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3++3S↓+7H2O,则M2O7 x-中的M的化合价为 ( )
A.+2价 B.+3价
C.+4价 D.+6价DCuS+ HNO3 (浓)— Cu(NO3)2+ H2SO4+ NO2 + H2O-281×1×810+5+6+4 升高 8降低1 84跟我学方法氧化还原反应方程式的配平
氧化还原反应方程式的配平技巧1.配平三原则2.配平要点(口诀)
一标化合价,二看价变化。三求升降数,数字相交叉。
再查其他物,配平靠观察。系数有分母,最后消去它。(3).配平四技巧
a、正向配平法
适合反应物分别是氧化剂、还原剂的反应,配平按以下5步进行。标明反应前后化合价有变化的元素的化合价
通过求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
观察法配平其他物质的化学计量数
检查质量、电荷、电子是否分别守恒示例如下: Fe + HNO3(稀) — Fe(NO3 )2 + NO + H2O 03 423×3×28升高 降低 +5 +2 +23 2 享受配平乐趣例如: 由于S的化合价既升又降,而且升降总数要相等,所以K2S的化学计量数为2,K2SO3的化学计量数为1,然后确定S的化学计量数为3。b、逆向配平法
适用于一种元素的化合价既升高又降低的反应和分解反应中的氧化还原反应。
先确定生成物的化学计量数,然后再确定反应物的化学计量数。 c、奇数配偶法
适用于物质种类少且分子组成简单的氧化还原反应。
如S+C+KNO3——CO2+N2+K2S,反应物KNO3中三种元素原子数均为奇数,而生成物中三种元素的原子数均为偶数,故可将KNO3乘以2,然后用观察法配平得:
S+3C+2KNO3 ===3CO2+N2+K2S答案 ⑤ 3 2 4 OH- 3 2 5
⑥ 2 5 6 H+ 2 5 8 d、缺项配平:
对于化学反应方程式,所缺物质往往是酸、碱或水;如果是离子方程式,所缺物质往往是H+、OH-或水。可先依据元素化合价的升降相等原则将已知的物质配平,然后再根据质量守恒确定所缺物质的化学式及化学计量数。探究思考
回答下列问题
1.根据FeS2+O2―→Fe2O3+SO2
(1)氧化剂________,还原剂________,氧化产物________,还原产物________。
(2)元素化合价升高的元素为________,元素化合价降低的元素为________。
(3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。
(4)配平后各物质的系数依次为______________。
答案 (1)O2 FeS2 Fe2O3、SO2 Fe2O3、SO2
(2)Fe、S O (3)11 4 (4)4 11 2 8
判断的依据是什么?
通过分析你有什么新的发现?
发生氧化反应和还原反应的物质分别是什么?为什么?【思考与交流1】氧化反应和还原反应都是同时进行的,这样的反应就叫氧化还原反应为什么?是氧化还原反应吗?
发生氧化反应和还原反应的物质分别是什么?为什么?
被氧化和被还原的物质分别是什么?【思考与交流2】被氧化:得到氧的物质
被还原:失去氧的物质C
O2氧化还原反应的有关概念物质失去氧的反应 物质得到氧的反应 有氧得失的反应一、氧化还原反应上述几个氧化还原反应除了有氧得失之外还有什么共同点?
各种元素的化合价在反应前后有无变化?
你认为氧化反应、还原反应与元素化合价的升降有什么关系?【思考与交流3】化合价升高, 氧化反应化合价降低,还原反应+200+1氧化还原反应:元素的化合价在反应前后有变化
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应,被氧化,被还原 化合价升高,氧化反应化合价降低,还原反应Zn + CuSO4 = ZnSO4 + Cu 0+2+20该反应是氧化还原反应吗?
若是请标明化合价的升降与氧化反应、还原反应的关系
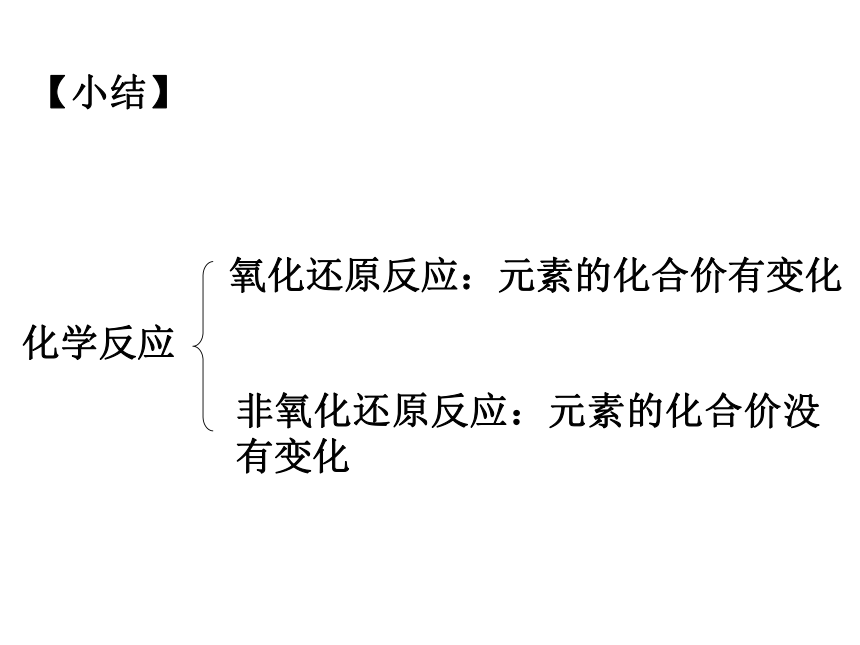
请仔细分析化学价的升降,你有什么新的发现?,被氧化,被还原氧化还原反应概念失氧的反应得氧的反应有氧得失的反应化合价降低的反应化合价升高的反应有元素化合价升降的反应有电子失去或偏离的反应有电子得到或偏向的反应有电子转移(得失或偏移)的反应化合价升降观点电子转移观点特征本质【小结】氧化还原反应:元素的化合价有变化非氧化还原反应:元素的化合价没有变化化学反应 【课堂反馈】
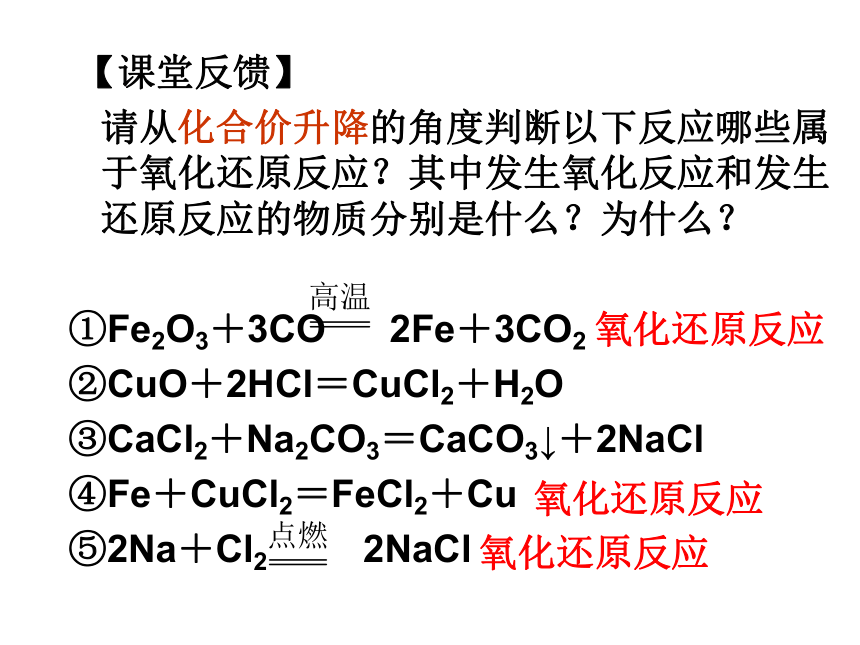
请从化合价升降的角度判断以下反应哪些属于氧化还原反应?其中发生氧化反应和发生还原反应的物质分别是什么?为什么?
①Fe2O3+3CO 2Fe+3CO2
②CuO+2HCl=CuCl2+H2O
③CaCl2+Na2CO3=CaCO3↓+2NaCl
④Fe+CuCl2=FeCl2+Cu
⑤2Na+Cl2 2NaCl氧化还原反应氧化还原反应氧化还原反应思考?[问题]
元素为什么会发生化合价变化?化合价的升降是什么原因引起的?请从微观粒子的角度分析2Na + Cl2 = 2NaCl(条件略),你认为发生氧化反应的本质是什么?发生还原反应的本质又是什么?通过分析你有什么发现?
NaCl中存在的微粒是什么?
反应物中的微粒是什么?
他们是如何转变的?【思考与交流4】电子转移●NaCl●Cl-Na+还原反应失去 一个电子得到 一个电子氧化反应【思考与交流5】
通过对氯气与金属钠反应分析,请预测氯气还能与哪些物质反应?
反应中氯气将如何变化?
为什么氯气能发生这些反应?请从微观的角度进行解释。
请以氯气与氢气反应生成氯化氢为例进行说明HClHClHCl 的形成过程化合价升降的原因:电子的偏移化
学
反
应化合反应分解反应置换反应复分解反应从反应物和生成物的组成及种类分非氧化还原反应氧化还原反应有无化合价变化你认为以下说法正确吗? 举例说明1.置换反应全部属于氧化还原反应。2. 复分解反应全部属于非氧化还原反应。3. 有单质参加的化合反应都是氧化还原反应
4 .有单质生成的分解反应都是氧化还原反应非氧化还原反应第二章 化学物质及变化氧化还原反应(第2课时)1、下列哪个反应表示二氧化硫被还原 ( )
A、SO2+2H2O+Cl2 = H2SO4+2HCl
B、SO2+2H2S = 2H2O+3S↓
C、SO2+2NaOH = Na2SO3+H2O
D、SO2+Na2CO3 = Na2SO3+CO2↑B课前小测2、当化合物中的元素被转化成单质中的元素时,该元素 ( )
A、一定被氧化;
B、一定被还原;
C、可能被氧化,也可能被还原;
D、化合价降低为0。C3、已知反应①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④2Na+2H2O=2NaOH+H2 ↑
⑤ SiO2+2NaOH=Na2SiO3+H2O
其中不属于氧化还原反应的有 ,
H2O被氧化的是________,
H2O被还原的是_________,
属于氧化还原反应,但水既不被氧化又不被还原的是________。① ⑤③④②2Na + Cl2 = 2NaCl请表示出化合价的升降、电子得失与氧化反应、还原反应之间的关系化合价升高,失去2×e-, 氧化反应, 被氧化化合价降低,得到2×e-, 还原反应, 被还原 0+10-1Cl2:
具有氧化性
氧化剂
Na:
具有还原性
还原剂氧化剂还原剂得到电子,被还原失去电子,被氧化n个e-二、氧化剂和还原剂
1. 定义:
氧化剂:得到电子(元素化合价降低)的物质——被还原。
还原剂:失去电子(元素化合价升高)的物质——被氧化。遵循两个守恒注意失电子总数=得电子总数化合价升高总数=化合价降低总数氧化剂还原剂氧化反应化合价升高失电子化合价降低得电子还原反应还原产物氧化产物特征反应物生成物实质被氧化被还原学会总结a. 氧化还原反应的判断依据:元素化合价的升降。b.氧化还原反应的本质:电子的转移c.氧化还原反应的规律:得失电子守恒失电子,化合价升高,氧化反应
得电子,化合价降低,还原反应
HClO Na2O2
H2O2 MnO2 等KMnO4 FeCl3 KClO3HNO3 H2SO4(浓)Cl2 O2 活泼的
非金属单质含较高价态元素的含氧酸含较高价态元素的盐常 见 的 氧 化 剂2. 常见的氧化剂和还原剂:Na、Zn、Fe 等H2 C 等CO SO2 Na2SO3KI Na2S较低价态元素的氧化物和盐非金属单质 活泼的
金属单质FeSO4常 见 的 还原 剂双线桥法:(1)箭头由反应物指向生成物
(2)箭头连接反应前后不同价态的同种元素。
(3)标明电子得失和数目.2CuO + C 2 Cu + CO2高温失去4e-,化合价升高,被氧化得到2× 2e-,化合价降低,被还原表示反应物转变为生成物时得失
电子情况(不代表电子转移方向)三. 氧化还原反应中电子转移情况的表示方法单线桥法:表示反应过程中电子由还原剂转移给氧化剂的情况(电子转移方向和数目)画法:箭头箭头在反应物之间,由还原剂指向氧化剂,只标明电子转移数目和方向,不标得失 4e-四. 正确标出电子转移方向和数目 1、金属的腐蚀与防护 钢铁腐蚀的现象 防锈方法 2、金属的冶炼(炼铁熔炉中发生的氧化还原反应) 3、化学电源与电解 4、火箭助推器中的氧化还原反应: 2 N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) 2 NH?ClO?==== N?↑+ Cl?↑+ 4H?O+ 2O?↑ 1、在反应 MnO2 + 4HCl(浓) = MnCl2 +Cl2↑+2H2O
中,当有1molCl2生成时,有 molHCl
被氧化,MnO2得到 mol电子,反应中共转
移了 mol电子。练习2222、当反应 2Na + 2H2O = 2NaOH + H2↑中转移了
0.5mol电子时,参加反应的Na是 mol。0. 5第二章 化学物质及变化氧化还原反应(第3课时)复习1. 氧化还原反应的判断依据:元素化合价的升降。2.氧化还原反应的本质:电子的转移3.氧化还原反应的规律:得失电子守恒失电子,化合价升高,氧化反应
得电子,化合价降低,还原反应
五、物质氧化性、还原性强弱判断决定因素: 得失电子的难易,而非多少!1.根据金属、非金属活动性顺序比较:原子还原性渐弱单质(原子)氧化性逐渐减弱,
阴离子的还原逐渐增强氧化性逐渐增强2.根据氧化还原反应比较 氧化剂 + 还原剂 = 还原产物 + 氧化产物化合价降低被还原化合价升高被氧化氧化性:氧化剂>氧化产物还原性:还原剂>还原产物( 强氧化剂+强还原剂= 弱还原性物质 +弱氧化性物质) 例:2Fe2++Cl2 =2Fe3+2Cl-
2Fe3++2I- = 2Fe2+ + I23.根据反应式:
(1)2Fe3+ + 2I- = 2Fe2+ + I2,
(2)Br2 +2Fe2+=2Br-+2Fe3+,可判断出离子的还原性从强到弱的顺序是(?? ? )。
A.Br- > Fe2+ > I-
B.I- > Fe2+ > Br-
C.Br- > I- > Fe2+
D.Fe2+ > I- > Br-B-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 失去e- ,化合价升高,被氧化,作还原剂得到e- ,作氧化剂化合价降低,被还原,六、氧化还原反应的重要规律及应用 -2 0 +4 +6
S -- S -- - - S -- -- -- -- -- - SS2- S SO2 H2SO3 SO32- H2SO4只能做还原剂只能做氧化剂既能做氧化剂,又能做还原剂
处于最高价态
处于最低价态
处于中间价态——只具氧化性
——只具还原性
——两者皆有元素运用在Fe3+、Fe2+、 Al3+、H+、S、Cl- 等粒子中
只有氧化性的是_____,只有还原性的是__ ,二者兼有的是____。 Fe3+Al3+H+Cl-S、 Fe2+1.价态规律(价态与氧化性、还原性的关系)归中定律:不同价态的同一元素的化合物间反应,遵循:高价降,低价升,只靠拢, 不交叉,最多到同价。指出下列反应中的氧化产物和还原产物:
⑴KClO3 + 6HCl = 3Cl2 ↑+ KCl + 3H2O⑵H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O+5-10-1-2+60+4氧化产物还原产物氧化产物还原产物2、价态的转换(变化)规律歧化: Cl2+H2O===HCl+HClO高氧低还中两性,归中靠拢不交叉;
歧化反应价升降,相邻价态不反应。●记忆口诀:练习:
对于H-+H2O===H2+OH-说法正确的是 ( )
A.该反应属于置换反应
B.若该反应中有1 mol电子转移,则生成H2一定是
22.4 L
C.水是氧化剂
D.H2只是氧化产物答案:C 常见氧化剂、还原剂及其产物氧化剂
Cl2
Fe3+
HNO3 (浓)
HNO3 (稀)
H2SO4(浓)
KMnO4
H2O2主要还原产物
Cl–
Fe2+
NO2
NO
SO2
Mn2+ 或MnO2
H2O还原剂
金属单质
H2S、 S2-
SO2、SO32-
HI、I-
CO、C
H2
Fe2+
H2O2主要氧化产物
金属离子
S
SO42-
I2
CO2
H2O
Fe3+
O23、反应进行的次序规律 同一氧化剂与多种还原剂反应时,首先被氧化的是还原性较强的物质;
同一还原剂与多种氧化剂反应时,首先被还原的是氧化性较强的物质。如:在含有Ag+、Fe2+的溶液中通入Zn,先析出哪种金属?先析出Ag,因为氧化性:Ag+ >Fe2+. 今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2,
②2FeCl2+Cl2===2FeCl3,
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而
不氧化Fe2+和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl[答案] C4、得失电子守恒规律氧化剂得电子数=还原剂失电子数应用:
(1).氧化还原反应方程式的配平
(2).有关计算例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3++3S↓+7H2O,则M2O7 x-中的M的化合价为 ( )
A.+2价 B.+3价
C.+4价 D.+6价DCuS+ HNO3 (浓)— Cu(NO3)2+ H2SO4+ NO2 + H2O-281×1×810+5+6+4 升高 8降低1 84跟我学方法氧化还原反应方程式的配平
氧化还原反应方程式的配平技巧1.配平三原则2.配平要点(口诀)
一标化合价,二看价变化。三求升降数,数字相交叉。
再查其他物,配平靠观察。系数有分母,最后消去它。(3).配平四技巧
a、正向配平法
适合反应物分别是氧化剂、还原剂的反应,配平按以下5步进行。标明反应前后化合价有变化的元素的化合价
通过求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
观察法配平其他物质的化学计量数
检查质量、电荷、电子是否分别守恒示例如下: Fe + HNO3(稀) — Fe(NO3 )2 + NO + H2O 03 423×3×28升高 降低 +5 +2 +23 2 享受配平乐趣例如: 由于S的化合价既升又降,而且升降总数要相等,所以K2S的化学计量数为2,K2SO3的化学计量数为1,然后确定S的化学计量数为3。b、逆向配平法
适用于一种元素的化合价既升高又降低的反应和分解反应中的氧化还原反应。
先确定生成物的化学计量数,然后再确定反应物的化学计量数。 c、奇数配偶法
适用于物质种类少且分子组成简单的氧化还原反应。
如S+C+KNO3——CO2+N2+K2S,反应物KNO3中三种元素原子数均为奇数,而生成物中三种元素的原子数均为偶数,故可将KNO3乘以2,然后用观察法配平得:
S+3C+2KNO3 ===3CO2+N2+K2S答案 ⑤ 3 2 4 OH- 3 2 5
⑥ 2 5 6 H+ 2 5 8 d、缺项配平:
对于化学反应方程式,所缺物质往往是酸、碱或水;如果是离子方程式,所缺物质往往是H+、OH-或水。可先依据元素化合价的升降相等原则将已知的物质配平,然后再根据质量守恒确定所缺物质的化学式及化学计量数。探究思考
回答下列问题
1.根据FeS2+O2―→Fe2O3+SO2
(1)氧化剂________,还原剂________,氧化产物________,还原产物________。
(2)元素化合价升高的元素为________,元素化合价降低的元素为________。
(3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。
(4)配平后各物质的系数依次为______________。
答案 (1)O2 FeS2 Fe2O3、SO2 Fe2O3、SO2
(2)Fe、S O (3)11 4 (4)4 11 2 8
