人教版高中化学必修一3.1《金属的化学性质》课件(共28张PPT)
文档属性
| 名称 | 人教版高中化学必修一3.1《金属的化学性质》课件(共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 826.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 14:30:55 | ||
图片预览







文档简介
课件28张PPT。第三章 金属及其化合物第一节 金属的化学性质
第一课时思考与交流(1)2Al + 3CuSO4 = Al2(SO4)3 + 3Cu 点燃
(2)2Mg + O2 = 2 MgO(3)Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(4)Mg + 2HCl = MgCl2 + H2↑一、金属与非金属的反应 取一小块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,这时可以看到钠的真面目。观察钠表面的光泽和颜色。
钠能用小刀切开。硬度小(软)切口银白色。钠是银白色金属。切口迅速变暗,
表面灰黄色。易被空气中的氧气氧化。
【常温下】
4Na + O2 = 2Na2O 保存在石蜡油
或煤油中钠密度比煤油大,
防止钠与空气接触,
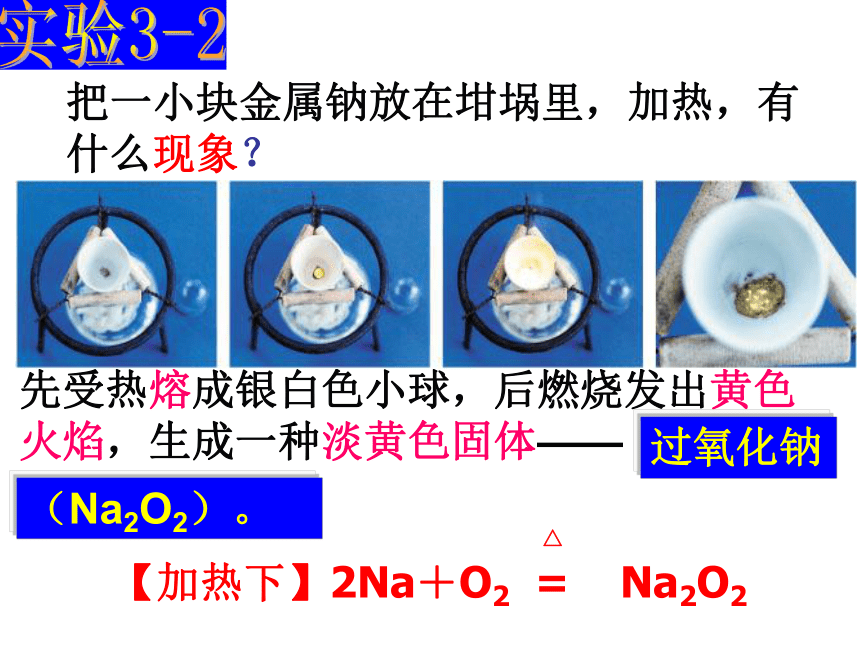
被氧气氧化。把一小块金属钠放在坩埚里,加热,有
什么现象?先受热熔成银白色小球,后燃烧发出黄色火焰,生成一种淡黄色固体—— △
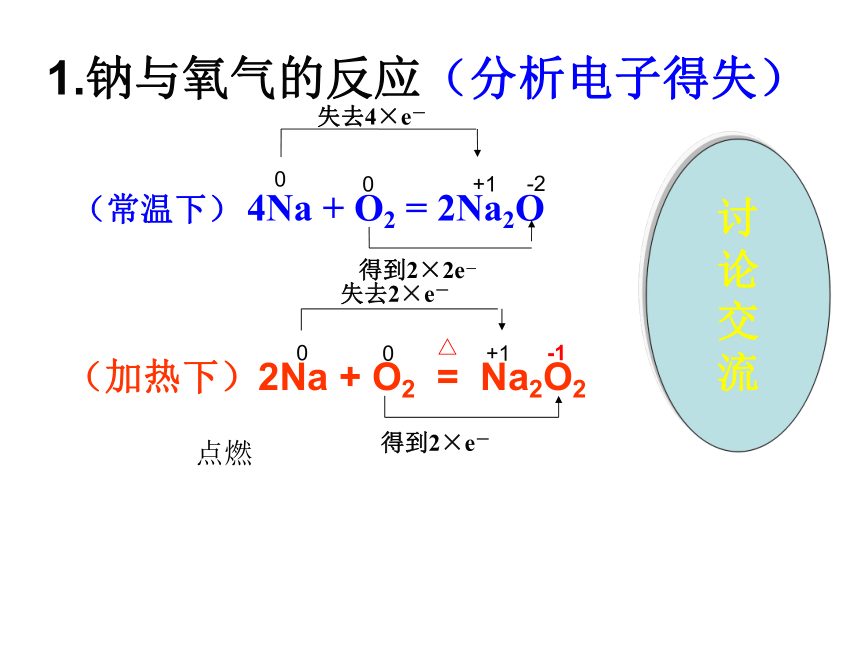
【加热下】2Na+O2 = Na2O21.钠与氧气的反应(分析电子得失)(常温下) 4Na + O2 = 2Na2O
失去4×e- 得到2×2e-00+1-2 点燃失去2×e-得到2×e-00+1-1讨
论
交
流科学探究现象:
铝箔熔化,并且失去了光泽,但是熔化的铝并没有脱落下来,好象有一层膜兜着。
原因:
铝表面的氧化膜保护了铝。 用砂纸打磨后,仍出现上述现象,这又是为什么呢?科学探究熔点:Al2O3(2050℃)> Al(660 ℃)二、金属与酸和水的反应 1、金属与水的反应 在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中。你看到什么现象? 钠浮在水面上ρ(钠)< ρ(水)钠熔成光亮的小球1、反应放热;2、钠熔点小小球在液面上迅速游动反应生成了气体,气体反推小球游动。发出嘶嘶响声,偶
尔有火花或爆鸣。1、反应剧烈;
2、生成了可燃性气体。加有酚酞的溶液变红钠与水反应生成了碱性的物质。讨论交流化学方程式:2Na + 2H2O == 2NaOH + H2↑失2×e-得2×e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑【练习】请标出钠与水反应的电子转移;请写出钠与水反应的离子方程式 。实验:加热湿棉花酒精
喷灯吹肥皂泡点燃小结:金属活动性顺序表中(H前面)的金属能与水反应。
金属越活泼,反应越易发生(越剧烈)。Na、Fe与水的反应哪个容易发生? 2、金属与酸的反应
(自学练习册p44:要点3:2)[补充实验]把一小块金属钠投入到硫酸铜溶液中,观察发生的现象。探究实验:钠与盐溶液的反应[实验现象]浮、熔、游、响、蓝↓钠先与水反应,而不直接置换金属钠与CuSO4溶液反应:2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 3、钠与盐的反应2Na + 2H2O +CuSO4==Cu(OH)2↓+Na2SO4+H2↑同学们:这节课我们学了些什么? 2、金属与水的反应(常温下) 4Na + O2 = 2Na2O
1、金属与氧气的反应2Na + 2H2O == 2NaOH + H2↑ 3、钠与盐的反应2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4第三章 金属及其化合物第一节 金属的化学性质
第二课时物质的量在化学方程式计算中的应用计算的依据: 2Na + 2H2O= 2NaOH+ H2↑化学计量数之比:2 : 2 : 2 : 1扩大NA倍 2×6.02×1023 : 2×6.02×1023 : 2×6.02×1023 : 1×6.02×1023 物质的量之比 2mol : 2mol : 2mol : 1mol 结 论:
化学方程式中各物质的化学计量之比等于各物质 的粒子数之比,因而也等于各物质的物质的量之比。物质的量与其它物理量之间的联系结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。物 质 的 量
(n) 质 量
(m)微 粒 个 数
(N) 体 积
(V) 浓 度 (c) 把6.5gZn放入足量的盐酸中,Zn完全反应。计算:例题1:2、参加反应的HCl的物质的量;1、 6.5gZn的物质的量;3、生成H2的体积(标准状况)。1、已知条件是什么;解题思路:2、要求的是什么?3、应该找什么关系?解n(Zn)0.1mol(1)Zn的摩尔质量是65g/mol(2)Zn + 2HCl =ZnCl2+H2↑1mol 0.1mol n(HCl) 2mol方程式计算“三段式”(3)Zn + 2HCl =ZnCl2+H2↑1 mol 0.1mol V(H2) 1mol=2.24L22.4L方程式计算“三段式”将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。 例题2:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-54g 2mol 22.4L 6mol8.1g xmol yL zmolX=0.3molY=3.36LZ=0.9mol∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。 作业: 有一块表面被氧化成氧化钠的金属钠,质量是10.8g,将它投入到100g水中完全反应后,收集到0.1mol氢气,试计算:
1、未被氧化的金属钠的质量是多少克?
2、被氧化的金属钠的质量是多少克?
3、反应后所得溶液中溶质的质量分数?
第一课时思考与交流(1)2Al + 3CuSO4 = Al2(SO4)3 + 3Cu 点燃
(2)2Mg + O2 = 2 MgO(3)Cu + 2AgNO3 = Cu(NO3)2 + 2Ag(4)Mg + 2HCl = MgCl2 + H2↑一、金属与非金属的反应 取一小块金属钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,这时可以看到钠的真面目。观察钠表面的光泽和颜色。
钠能用小刀切开。硬度小(软)切口银白色。钠是银白色金属。切口迅速变暗,
表面灰黄色。易被空气中的氧气氧化。
【常温下】
4Na + O2 = 2Na2O 保存在石蜡油
或煤油中钠密度比煤油大,
防止钠与空气接触,
被氧气氧化。把一小块金属钠放在坩埚里,加热,有
什么现象?先受热熔成银白色小球,后燃烧发出黄色火焰,生成一种淡黄色固体—— △
【加热下】2Na+O2 = Na2O21.钠与氧气的反应(分析电子得失)(常温下) 4Na + O2 = 2Na2O
失去4×e- 得到2×2e-00+1-2 点燃失去2×e-得到2×e-00+1-1讨
论
交
流科学探究现象:
铝箔熔化,并且失去了光泽,但是熔化的铝并没有脱落下来,好象有一层膜兜着。
原因:
铝表面的氧化膜保护了铝。 用砂纸打磨后,仍出现上述现象,这又是为什么呢?科学探究熔点:Al2O3(2050℃)> Al(660 ℃)二、金属与酸和水的反应 1、金属与水的反应 在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中。你看到什么现象? 钠浮在水面上ρ(钠)< ρ(水)钠熔成光亮的小球1、反应放热;2、钠熔点小小球在液面上迅速游动反应生成了气体,气体反推小球游动。发出嘶嘶响声,偶
尔有火花或爆鸣。1、反应剧烈;
2、生成了可燃性气体。加有酚酞的溶液变红钠与水反应生成了碱性的物质。讨论交流化学方程式:2Na + 2H2O == 2NaOH + H2↑失2×e-得2×e-还原剂氧化剂离子方程式:2Na + 2H2O ==2Na+ + 2OH- +H2↑【练习】请标出钠与水反应的电子转移;请写出钠与水反应的离子方程式 。实验:加热湿棉花酒精
喷灯吹肥皂泡点燃小结:金属活动性顺序表中(H前面)的金属能与水反应。
金属越活泼,反应越易发生(越剧烈)。Na、Fe与水的反应哪个容易发生? 2、金属与酸的反应
(自学练习册p44:要点3:2)[补充实验]把一小块金属钠投入到硫酸铜溶液中,观察发生的现象。探究实验:钠与盐溶液的反应[实验现象]浮、熔、游、响、蓝↓钠先与水反应,而不直接置换金属钠与CuSO4溶液反应:2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 3、钠与盐的反应2Na + 2H2O +CuSO4==Cu(OH)2↓+Na2SO4+H2↑同学们:这节课我们学了些什么? 2、金属与水的反应(常温下) 4Na + O2 = 2Na2O
1、金属与氧气的反应2Na + 2H2O == 2NaOH + H2↑ 3、钠与盐的反应2Na + 2H2O == 2NaOH + H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4第三章 金属及其化合物第一节 金属的化学性质
第二课时物质的量在化学方程式计算中的应用计算的依据: 2Na + 2H2O= 2NaOH+ H2↑化学计量数之比:2 : 2 : 2 : 1扩大NA倍 2×6.02×1023 : 2×6.02×1023 : 2×6.02×1023 : 1×6.02×1023 物质的量之比 2mol : 2mol : 2mol : 1mol 结 论:
化学方程式中各物质的化学计量之比等于各物质 的粒子数之比,因而也等于各物质的物质的量之比。物质的量与其它物理量之间的联系结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。物 质 的 量
(n) 质 量
(m)微 粒 个 数
(N) 体 积
(V) 浓 度 (c) 把6.5gZn放入足量的盐酸中,Zn完全反应。计算:例题1:2、参加反应的HCl的物质的量;1、 6.5gZn的物质的量;3、生成H2的体积(标准状况)。1、已知条件是什么;解题思路:2、要求的是什么?3、应该找什么关系?解n(Zn)0.1mol(1)Zn的摩尔质量是65g/mol(2)Zn + 2HCl =ZnCl2+H2↑1mol 0.1mol n(HCl) 2mol方程式计算“三段式”(3)Zn + 2HCl =ZnCl2+H2↑1 mol 0.1mol V(H2) 1mol=2.24L22.4L方程式计算“三段式”将8.1g铝与足量的氢氧化钠反应,计算生成氢气 ___ L,需要氢氧化钠 __ mol,有__ mol电子发生转移。 例题2:2Al+2NaOH+2H2O=2NaAlO2+ 3H2 ↑ ~ 6e-54g 2mol 22.4L 6mol8.1g xmol yL zmolX=0.3molY=3.36LZ=0.9mol∴生成氢气3.36 L,需要氢氧化钠 0.3 mol,有0.9 mol电子发生转移。 作业: 有一块表面被氧化成氧化钠的金属钠,质量是10.8g,将它投入到100g水中完全反应后,收集到0.1mol氢气,试计算:
1、未被氧化的金属钠的质量是多少克?
2、被氧化的金属钠的质量是多少克?
3、反应后所得溶液中溶质的质量分数?
