人教版高中化学必修一课件2.3《氧化还原反应》课件 (共31张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件2.3《氧化还原反应》课件 (共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 136.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 00:00:00 | ||
图片预览








文档简介
课件31张PPT。第二章 化学物质及其变化第三节 氧化还原反应复习引入:思考1:在初中阶段我们学过哪四种基本反应类型?各举一个反应实例。
思考2:这四种基本反应类型分类的依据是什么?思考3: 让我
想一想?一、氧化还原反应思考与交流1: 1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?分类标准:得氧失氧氧化反应: 还原反应:一、氧化还原反应分组讨论:氧化反应和还原反应是分别独立进行的吗?为什么?
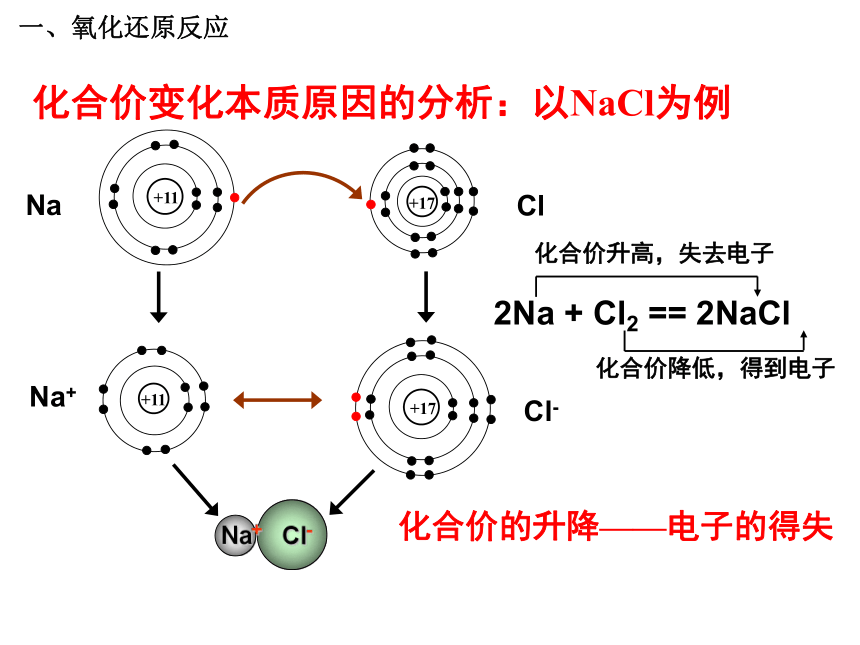
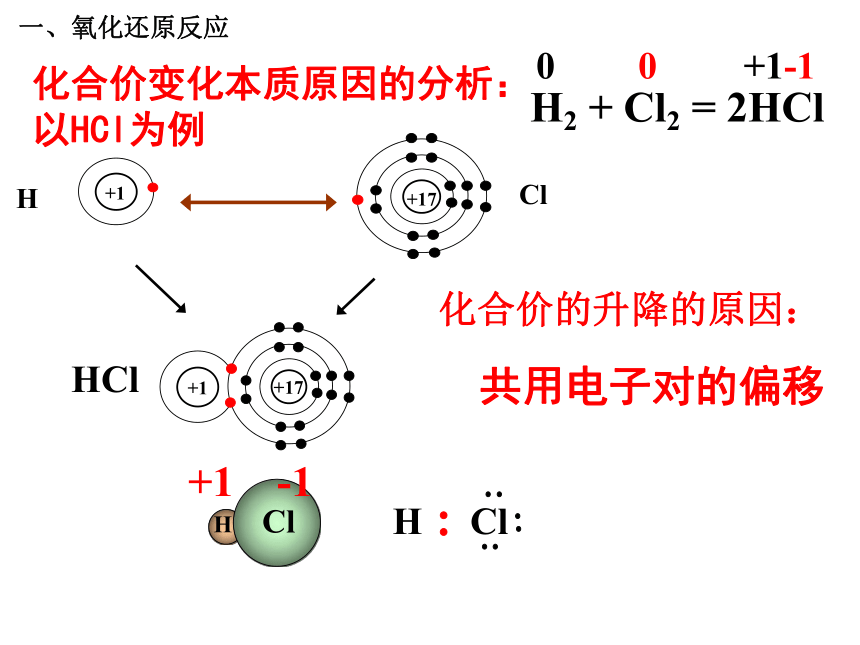
分析反应:结论1:在同一个反应中:氧化反应和还原反应是同时发生的。这一类反应统称为-------氧化还原反应。问题探究1:怎样判断一个反应是不是氧化还原反应?一、氧化还原反应 请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。思考与交流2+2 -2 0 0 +4-2 +1 -2 0 0 +2-2+2 -2 0 0 +1 -2一、氧化还原反应 结论2:
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应有元素化合价升降的化学反应是氧化还原反应 氧化还原反应的判断依据:是否有元素化合价升降【学以致用】分析反应: H2+Cl2 = 2HCl
Fe + CuSO4 = FeSO4 + Cu
2Na+Cl2 = 2NaCl
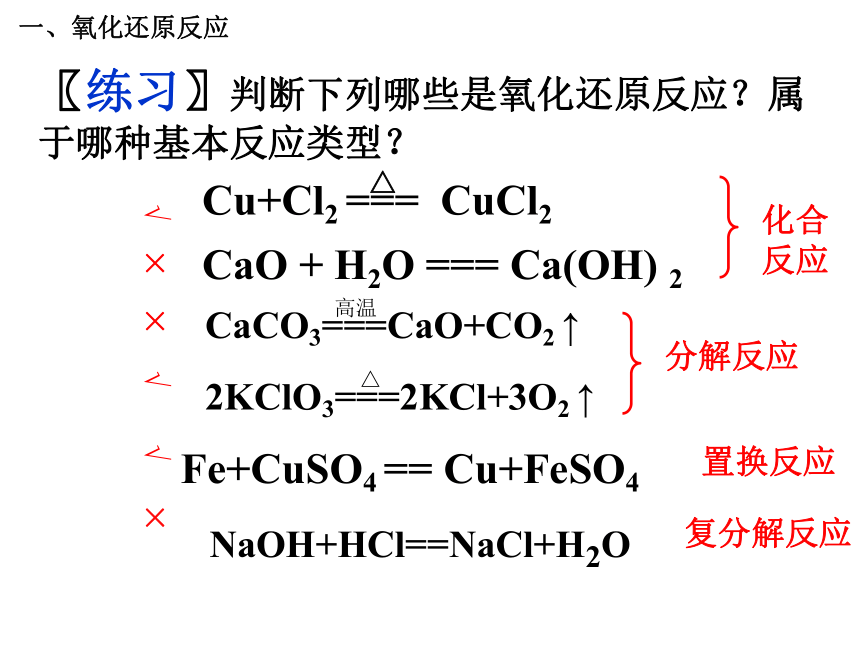
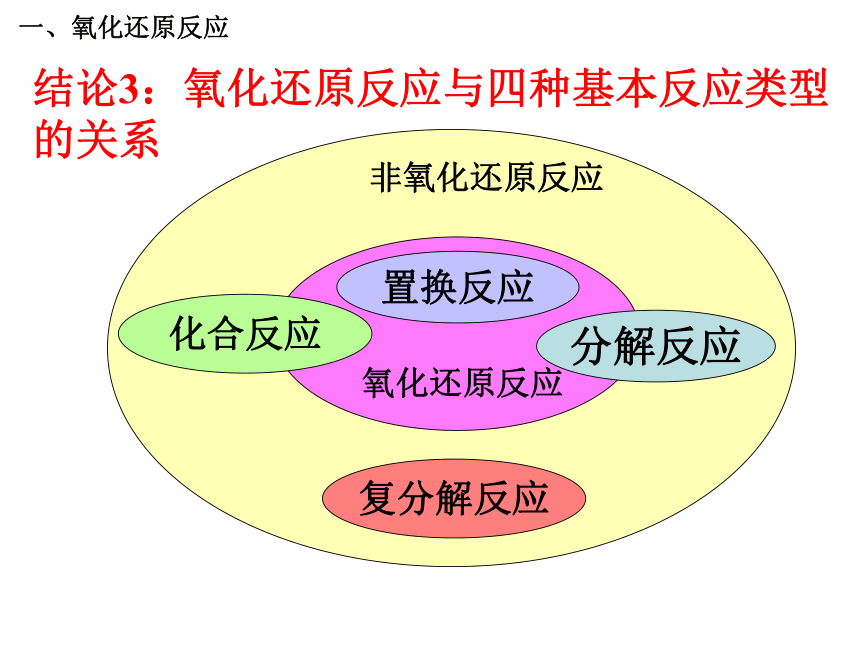
是不是氧化还原反应,为什么?一、氧化还原反应问题探究2:在氧化还原反应中,元素化合价发生改变的本质原因是什么?(阅读教材36页) 一、氧化还原反应化合价变化本质原因的分析:以NaCl为例化合价的升降——电子的得失一、氧化还原反应H Cl+1 -1 HCl化合价的升降的原因: H2 + Cl2 = 2HCl 00+1-1共用电子对的偏移化合价变化本质原因的分析:以HCl为例一、氧化还原反应问题探究3:氧化还原反应与四种基本类型反应有什么联系 ?一、氧化还原反应CaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?属于哪种基本反应类型?NaOH+HCl==NaCl+H2O√ × × √ √ × 一、氧化还原反应化学反应结论3:氧化还原反应与四种基本反应类型的关系复分解反应分解反应化合反应置换反应一、氧化还原反应1、下列反应属于氧化还原反应的是( )
A. CuO+2HCl=CuCl2+H2O
B. 2Na2O2+2H2O=4NaOH+O2↑
C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3↓ + H2O BC分层训练1:必做题2、下列四种基本类型的反应中,一定是氧化还原反应的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应C一、氧化还原反应3、下列叙述正确的是( )
A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低
B. 凡是有元素化合价升降的化学反应都是氧化还原反应
C. 在氧化还原反应中一定所有的元素化合价都发生变化
D. 氧化还原反应的本质是电子的转移(得失或偏移)BD一、氧化还原反应C1、某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是分层训练2:选做题2、下列变化属于氧化反应的是( )
A. Fe2O3 Fe B. Zn ZnCl2
C. Na2CO3 CO2 D. Al Al2O3 BD一、氧化还原反应规律:高、失、氧;降、得、还小结一、氧化还原反应实践活动:通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应的认识。作业:
1、教材P38: 1、5、6
2、预习氧化剂和还原剂部分知识一、氧化还原反应〖做一做〗 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
降低了?指出含有这些元素的具体物质。二、氧化剂和还原剂〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 二、氧化剂和还原剂 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧化剂?哪些是还原剂?
〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应二、氧化剂和还原剂〖交流·探究〗从电子转移的观点说明氧化
剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
二、氧化剂和还原剂步骤:1.先标化合价,双线桥从左指
向右连接不同价态的同种元素
2.线上标明电子得失数
3.指出氧化还原类型1、双线桥法:2Na+Cl2 == 2Na Cl得2e-,化合价降低,被还原失2e-,化合价升高,被氧化〖做一做〗:怎样表示氧化还原反应中电子的转移?氧化剂还原剂1、双线桥法二、氧化剂和还原剂〖学以致用〗 : 用双线桥法分析氧化还原反应并标明氧化剂和还原剂规律:1.电子得失的总数相等
2.电子得失总数与化合价升
降总数相等1. Zn + H2SO4 = ZnSO4 + H2↑
2. C + 2CuO 2Cu + CO2 ↑ 二、氧化剂和还原剂2、单线桥法方法: 1.单箭号
2.箭号起点为被氧化元素(失电子)
元素。终点为被还原(得电子)元素
3.只标转移电子总数,不标得与失MnO2 + 4HCl MnCl2 + Cl2↑+2H2O+4 -1 +2 02e-注意:得电子数=失电子数=转移的电子数二、氧化剂和还原剂〖学以致用〗 : 用单线桥法分析氧化还原反应,标明氧化剂和还原剂,哪个物质发生氧化反应,哪个物质发生还原反应?1.Zn + H2SO4 = ZnSO4 + H2↑
2. C + 2CuO 2Cu + CO2 ↑ 3、2KClO3 2KCl + 3O2↑二、氧化剂和还原剂试判断下列元素所处价态的氧化性、还原性:C C Fe Fe S S S H Cl Cl N【思考与探究】元素价态与氧化性还原性的关系元素处于最低价:只有还原性,无氧化性元素处于最高价:只有氧化性,无还原性元素处于中间价态:既有氧化性,又有还原性二、氧化剂和还原剂常见的氧化剂和还原剂有哪些?常见氧化剂:O2 、Cl2、浓硫酸、 HNO3、
KMnO4、FeCl3等
常见还原剂:Na、Mg、Al、Zn、Fe、H2、
C、CO等〖迁移·应用〗二、氧化剂和还原剂 1、窗户上的铁栏杆常刷上油漆,这样做的目的是什么?2、一些容易变质食品常采用真空包装或往包装袋中装入一小包铁粉,这样做的目的又是为啥? 3、通过上述问题,你是如何理解氧化还原反应的?氧化还原反应在工农业生产和日常生活之间有何应用?你还能举出哪些例子说明氧化还原反应在工农业生产和日常生活中的应用。 〖 思考与交流 〗氧化还原反应的应用二、氧化剂和还原剂【分层训练】必做题 2、下列反应中,SO2作还原剂的是( )
A.2H2S+SO2=3S↓+2H2O
B.SO2+2Mg=2MgO+S
C.Cl2+SO2+2H2O=H2SO4+2HCl D.SO2+2NaOH=Na2SO3+H2OC1 、实现下列变化,一定要加入其它物质作氧化剂的是:( )
A.CaCO3 → CO2 B. NaCl → NaNO3
C.Zn → ZnCl2 D. CuO → CuSO4C二、氧化剂和还原剂3、在K2Cr2O7 + 14 HCl == 2KCl + 2CrCl3
+ 3Cl2↑ + 7H2O反应中, 元素得电子,
化合价 , 是氧化剂;
元素失电子,化合价 , 是还原剂; 被氧化, 被还原。Cr降低K2Cr2O7 Cl升高HClHClK2Cr2O7【分层训练】选做题二、氧化剂和还原剂〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应对立统
一关系的两根推断线作业:教材P38:2、3、7、8、9、10二、氧化剂和还原剂
思考2:这四种基本反应类型分类的依据是什么?思考3: 让我
想一想?一、氧化还原反应思考与交流1: 1.请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么?分类标准:得氧失氧氧化反应: 还原反应:一、氧化还原反应分组讨论:氧化反应和还原反应是分别独立进行的吗?为什么?
分析反应:结论1:在同一个反应中:氧化反应和还原反应是同时发生的。这一类反应统称为-------氧化还原反应。问题探究1:怎样判断一个反应是不是氧化还原反应?一、氧化还原反应 请分析下列3个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。思考与交流2+2 -2 0 0 +4-2 +1 -2 0 0 +2-2+2 -2 0 0 +1 -2一、氧化还原反应 结论2:
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应有元素化合价升降的化学反应是氧化还原反应 氧化还原反应的判断依据:是否有元素化合价升降【学以致用】分析反应: H2+Cl2 = 2HCl
Fe + CuSO4 = FeSO4 + Cu
2Na+Cl2 = 2NaCl
是不是氧化还原反应,为什么?一、氧化还原反应问题探究2:在氧化还原反应中,元素化合价发生改变的本质原因是什么?(阅读教材36页) 一、氧化还原反应化合价变化本质原因的分析:以NaCl为例化合价的升降——电子的得失一、氧化还原反应H Cl+1 -1 HCl化合价的升降的原因: H2 + Cl2 = 2HCl 00+1-1共用电子对的偏移化合价变化本质原因的分析:以HCl为例一、氧化还原反应问题探究3:氧化还原反应与四种基本类型反应有什么联系 ?一、氧化还原反应CaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?属于哪种基本反应类型?NaOH+HCl==NaCl+H2O√ × × √ √ × 一、氧化还原反应化学反应结论3:氧化还原反应与四种基本反应类型的关系复分解反应分解反应化合反应置换反应一、氧化还原反应1、下列反应属于氧化还原反应的是( )
A. CuO+2HCl=CuCl2+H2O
B. 2Na2O2+2H2O=4NaOH+O2↑
C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3↓ + H2O BC分层训练1:必做题2、下列四种基本类型的反应中,一定是氧化还原反应的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应C一、氧化还原反应3、下列叙述正确的是( )
A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低
B. 凡是有元素化合价升降的化学反应都是氧化还原反应
C. 在氧化还原反应中一定所有的元素化合价都发生变化
D. 氧化还原反应的本质是电子的转移(得失或偏移)BD一、氧化还原反应C1、某元素在化学反应中由化合态(化合物)变为游离态(单质),则该元素( )
A.一定被氧化 B.一定被还原
C.可能被氧化,也可能被还原
D.以上都不是分层训练2:选做题2、下列变化属于氧化反应的是( )
A. Fe2O3 Fe B. Zn ZnCl2
C. Na2CO3 CO2 D. Al Al2O3 BD一、氧化还原反应规律:高、失、氧;降、得、还小结一、氧化还原反应实践活动:通过报纸、杂志、书籍或互联网等,查阅有关氧化还原反应在日常生活、工农业生产和科学技术中应用的几个具体事例,讨论并交流你对氧化还原反应的认识。作业:
1、教材P38: 1、5、6
2、预习氧化剂和还原剂部分知识一、氧化还原反应〖做一做〗 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
降低了?指出含有这些元素的具体物质。二、氧化剂和还原剂〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 二、氧化剂和还原剂 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧化剂?哪些是还原剂?
〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应二、氧化剂和还原剂〖交流·探究〗从电子转移的观点说明氧化
剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
二、氧化剂和还原剂步骤:1.先标化合价,双线桥从左指
向右连接不同价态的同种元素
2.线上标明电子得失数
3.指出氧化还原类型1、双线桥法:2Na+Cl2 == 2Na Cl得2e-,化合价降低,被还原失2e-,化合价升高,被氧化〖做一做〗:怎样表示氧化还原反应中电子的转移?氧化剂还原剂1、双线桥法二、氧化剂和还原剂〖学以致用〗 : 用双线桥法分析氧化还原反应并标明氧化剂和还原剂规律:1.电子得失的总数相等
2.电子得失总数与化合价升
降总数相等1. Zn + H2SO4 = ZnSO4 + H2↑
2. C + 2CuO 2Cu + CO2 ↑ 二、氧化剂和还原剂2、单线桥法方法: 1.单箭号
2.箭号起点为被氧化元素(失电子)
元素。终点为被还原(得电子)元素
3.只标转移电子总数,不标得与失MnO2 + 4HCl MnCl2 + Cl2↑+2H2O+4 -1 +2 02e-注意:得电子数=失电子数=转移的电子数二、氧化剂和还原剂〖学以致用〗 : 用单线桥法分析氧化还原反应,标明氧化剂和还原剂,哪个物质发生氧化反应,哪个物质发生还原反应?1.Zn + H2SO4 = ZnSO4 + H2↑
2. C + 2CuO 2Cu + CO2 ↑ 3、2KClO3 2KCl + 3O2↑二、氧化剂和还原剂试判断下列元素所处价态的氧化性、还原性:C C Fe Fe S S S H Cl Cl N【思考与探究】元素价态与氧化性还原性的关系元素处于最低价:只有还原性,无氧化性元素处于最高价:只有氧化性,无还原性元素处于中间价态:既有氧化性,又有还原性二、氧化剂和还原剂常见的氧化剂和还原剂有哪些?常见氧化剂:O2 、Cl2、浓硫酸、 HNO3、
KMnO4、FeCl3等
常见还原剂:Na、Mg、Al、Zn、Fe、H2、
C、CO等〖迁移·应用〗二、氧化剂和还原剂 1、窗户上的铁栏杆常刷上油漆,这样做的目的是什么?2、一些容易变质食品常采用真空包装或往包装袋中装入一小包铁粉,这样做的目的又是为啥? 3、通过上述问题,你是如何理解氧化还原反应的?氧化还原反应在工农业生产和日常生活之间有何应用?你还能举出哪些例子说明氧化还原反应在工农业生产和日常生活中的应用。 〖 思考与交流 〗氧化还原反应的应用二、氧化剂和还原剂【分层训练】必做题 2、下列反应中,SO2作还原剂的是( )
A.2H2S+SO2=3S↓+2H2O
B.SO2+2Mg=2MgO+S
C.Cl2+SO2+2H2O=H2SO4+2HCl D.SO2+2NaOH=Na2SO3+H2OC1 、实现下列变化,一定要加入其它物质作氧化剂的是:( )
A.CaCO3 → CO2 B. NaCl → NaNO3
C.Zn → ZnCl2 D. CuO → CuSO4C二、氧化剂和还原剂3、在K2Cr2O7 + 14 HCl == 2KCl + 2CrCl3
+ 3Cl2↑ + 7H2O反应中, 元素得电子,
化合价 , 是氧化剂;
元素失电子,化合价 , 是还原剂; 被氧化, 被还原。Cr降低K2Cr2O7 Cl升高HClHClK2Cr2O7【分层训练】选做题二、氧化剂和还原剂〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 氧化还原反应对立统
一关系的两根推断线作业:教材P38:2、3、7、8、9、10二、氧化剂和还原剂
