人教版高中化学必修一课件4.4《氨 硝酸 硫酸》课件 (共26张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件4.4《氨 硝酸 硫酸》课件 (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 149.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 22:52:57 | ||
图片预览







文档简介
课件26张PPT。第四节 氨 硝酸 硫酸 1、氮的固定:
将游离态的氮转变为氮的化合物的方法。自然固氮:豆科植物固氮 人工固氮:工业合成氨雷雨天产生一氧化氮气体 一、氨2、氨的物理性质 氨在自然界中,是动物体,特别是蛋白质
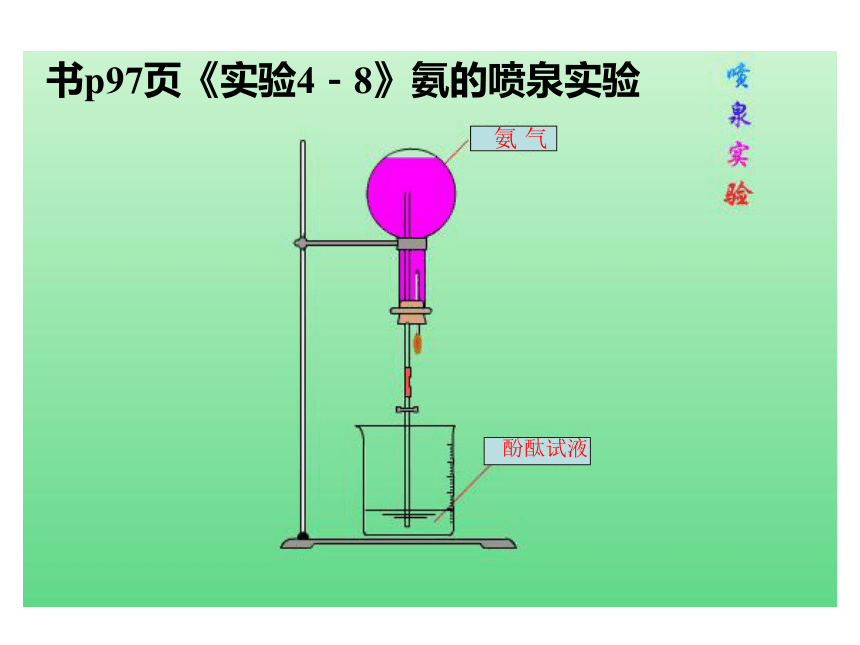
腐败的产物。 无色、有剌激性气味的气体 比空气轻 极易溶于水(1:700) 氨常作致冷剂为什么氨常用作致冷剂? 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)还有哪些物质也可作致冷剂?实验步骤:见书实验现象:形成红色的喷泉实验结论(1)氨气极易溶于水;氨气溶于水
后,使得烧瓶内的压强减小,
外部压强增大;外面的液体被压
入烧瓶内形成喷泉。书p97页 《实验4-8》 氨的喷泉实验
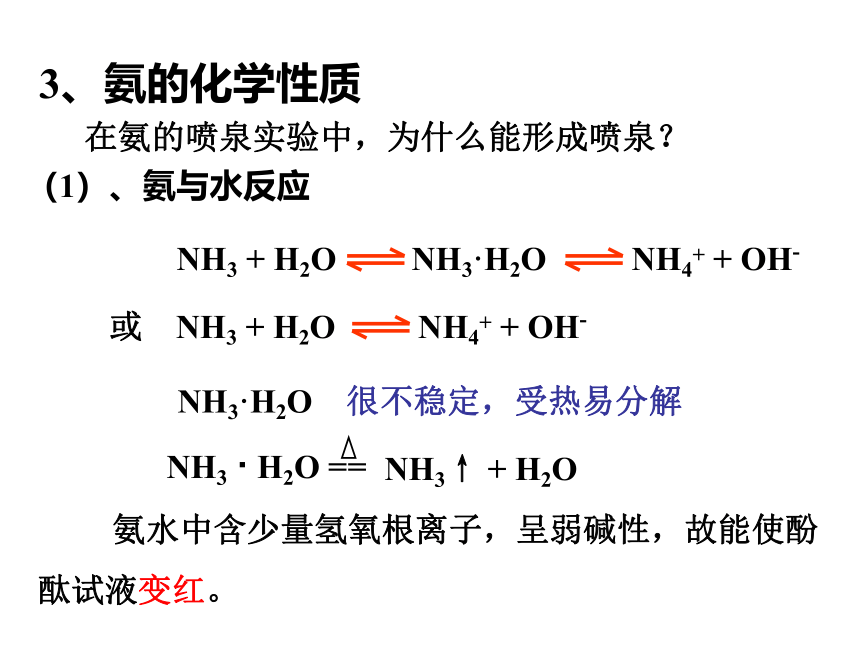
填写空白处(2)氨气溶于水显碱性,酚酞试液变红。3、氨的化学性质 在氨的喷泉实验中,为什么能形成喷泉? 氨水中含少量氢氧根离子,呈弱碱性,故能使酚
酞试液变红。(1)、氨与水反应 NH3·H2O 很不稳定,受热易分解 氨水和液氨有什么不同?氨水中含有哪些微粒?氨水是氨气的水溶液,是混合物。氨溶于水中,大部份与水结合成一水合氨。 一水合氨小部份电离成铵根离子和氢氧根离子 故氨水中含氨分子,水分子,一水合氨分子 液氨是液态的氨,是纯净物。少量的铵根离子,氢氧根离子(还有氢离子)。一水合氨浓度大于铵根离子和氢氧根离子浓度。 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水溶液物质的量浓度为
(V/22.4)/V= 0.045 mol/L(2)、氨与酸反应书p98页 (图4-28) 氨与氯化氢的反应实验步骤:用两根玻璃棒分别在浓氨水和浓
盐酸里蘸一下,然后使两根玻璃
棒接近(不要接触);观察现象实验现象:产生大量的白烟实验结论:氨水挥发的NH3与盐酸挥发的HCl
化合生成固体小颗粒NH4Cl的缘故。NH3+ HCl =NH4Cl(2)、氨与酸反应NH3+ HNO3=NH4NO32NH3+ H2SO4=(NH4)2SO4NH3+ H2O+CO2=NH4HCO34、铵盐(1)物理性质:铵盐均溶于水,为白色固体(3)、氨的催化氧化①、铵盐不稳定②、铵盐与碱反应(2)化学性质:5、氨的用途①工业制化肥
②有机合成的重要化工原料
③作制冷剂6、氨的制备(1)、氨的工业制备实验装置:如图所示 (书p99)收集方法:向下排空气法(2)、氨的实验室制备实验步骤:给试管里的氯化铵和消石灰的混合物加热,用向下排空气法收集气体,用润湿的红色石蕊试纸检验。
(类似O2) 反应原理:(2)、氨的实验室制备检验:①用湿润的红色石蕊试纸检验
试纸变蓝
②用蘸有浓盐酸的玻璃棒检验
产生白烟思考:用氢氧化钠代替氢氧化钙好吗? 氢氧化钠易吸水,易结块,不易产生NH3;
热的氢氧化钠对玻璃有腐蚀作用。二、硫酸和硝酸的氧化性1、稀硫酸和硝酸的通性使指示剂变色:与活泼金属反应放出氢气 (硝酸除外)与碱发生中和反应:与碱性氧化物反应:与某些盐反应:稀硝酸使紫色石蕊试液变红H++ OH -= H2O2H++ CuO = Cu2++ H2O2H++ CO32- = + H2O + CO2↑2、浓硫酸 (1)浓硫酸脱水性 滴有浓硫酸的纸(或木条)
炭化变黑。 滤纸(或木条)的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。结论:浓硫酸有脱水性解释: 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水问题?现象: 蔗糖变黑,体积膨胀,放出大
量热,放出有刺激性气味的气体。反应:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2△ (1)浓硫酸脱水性现象: 加热能反应,产生的气
体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。 (2) 浓硫酸氧化性
①与金属反应结论:浓硫酸既有氧化性
又有酸性 Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O△0+6+6+4+2还原剂氧化剂请用单线桥标出电子的转移方向数目,指出氧化剂、还原剂 ①与金属反应2e-② 与某些非金属反应
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。思考题无水硫酸铜品红
溶液品红
溶液酸性高锰酸钾溶液澄清石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水变蓝色褪色褪色不褪色变浑浊3、硝酸
(1)硝酸的物理性质 纯硝酸 无色
有刺激性气味
易挥发 反应激烈,产生红棕色气体,
溶液由无色变为蓝绿色。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O结论:硝酸具有强的氧化性,能氧化不活泼金属。3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O 反应较缓慢,产生无色气体,逸
至试管口变为红棕色, 溶液由无色变
为蓝绿色。(2)硝酸的化学性质 ①与金属反应 硝酸具有强的氧化性,也能跟许多非金属(如碳)反应4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O ②与非金属反应 硝酸浓度越大,氧化性越强。 氧化性:浓HNO3 > 稀HNO3 硝酸+5价的氮得电子,被还原成较低价的氮 NO2 HNO2 NO N2O N2 NH3+4+3+2+10-3 常温下,把铝、铁放在浓硫酸或浓硝酸里无明显变化。 常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。(3)浓硝酸、浓硫酸钝化反应 所以,可以用铁、铝制的容器盛装浓硫酸或浓硝酸4、硫酸、硝酸的用途 p102
将游离态的氮转变为氮的化合物的方法。自然固氮:豆科植物固氮 人工固氮:工业合成氨雷雨天产生一氧化氮气体 一、氨2、氨的物理性质 氨在自然界中,是动物体,特别是蛋白质
腐败的产物。 无色、有剌激性气味的气体 比空气轻 极易溶于水(1:700) 氨常作致冷剂为什么氨常用作致冷剂? 氨易液化(沸点-33. 35 ℃) 还有氯气(沸点-34. 6 ℃) 二氧化硫(沸点-10 ℃)还有哪些物质也可作致冷剂?实验步骤:见书实验现象:形成红色的喷泉实验结论(1)氨气极易溶于水;氨气溶于水
后,使得烧瓶内的压强减小,
外部压强增大;外面的液体被压
入烧瓶内形成喷泉。书p97页 《实验4-8》 氨的喷泉实验
填写空白处(2)氨气溶于水显碱性,酚酞试液变红。3、氨的化学性质 在氨的喷泉实验中,为什么能形成喷泉? 氨水中含少量氢氧根离子,呈弱碱性,故能使酚
酞试液变红。(1)、氨与水反应 NH3·H2O 很不稳定,受热易分解 氨水和液氨有什么不同?氨水中含有哪些微粒?氨水是氨气的水溶液,是混合物。氨溶于水中,大部份与水结合成一水合氨。 一水合氨小部份电离成铵根离子和氢氧根离子 故氨水中含氨分子,水分子,一水合氨分子 液氨是液态的氨,是纯净物。少量的铵根离子,氢氧根离子(还有氢离子)。一水合氨浓度大于铵根离子和氢氧根离子浓度。 在氨的喷泉实验中,烧瓶内溶液的物质的量浓度是多少?(假设实验是在标准状况下进行) 氨气体积设为VL 注意:氨水中溶质是NH3,不是NH3·H2O 氨气物质的量为(V/22.4)mol 氨水溶液体积也是VL 氨水溶液物质的量浓度为
(V/22.4)/V= 0.045 mol/L(2)、氨与酸反应书p98页 (图4-28) 氨与氯化氢的反应实验步骤:用两根玻璃棒分别在浓氨水和浓
盐酸里蘸一下,然后使两根玻璃
棒接近(不要接触);观察现象实验现象:产生大量的白烟实验结论:氨水挥发的NH3与盐酸挥发的HCl
化合生成固体小颗粒NH4Cl的缘故。NH3+ HCl =NH4Cl(2)、氨与酸反应NH3+ HNO3=NH4NO32NH3+ H2SO4=(NH4)2SO4NH3+ H2O+CO2=NH4HCO34、铵盐(1)物理性质:铵盐均溶于水,为白色固体(3)、氨的催化氧化①、铵盐不稳定②、铵盐与碱反应(2)化学性质:5、氨的用途①工业制化肥
②有机合成的重要化工原料
③作制冷剂6、氨的制备(1)、氨的工业制备实验装置:如图所示 (书p99)收集方法:向下排空气法(2)、氨的实验室制备实验步骤:给试管里的氯化铵和消石灰的混合物加热,用向下排空气法收集气体,用润湿的红色石蕊试纸检验。
(类似O2) 反应原理:(2)、氨的实验室制备检验:①用湿润的红色石蕊试纸检验
试纸变蓝
②用蘸有浓盐酸的玻璃棒检验
产生白烟思考:用氢氧化钠代替氢氧化钙好吗? 氢氧化钠易吸水,易结块,不易产生NH3;
热的氢氧化钠对玻璃有腐蚀作用。二、硫酸和硝酸的氧化性1、稀硫酸和硝酸的通性使指示剂变色:与活泼金属反应放出氢气 (硝酸除外)与碱发生中和反应:与碱性氧化物反应:与某些盐反应:稀硝酸使紫色石蕊试液变红H++ OH -= H2O2H++ CuO = Cu2++ H2O2H++ CO32- = + H2O + CO2↑2、浓硫酸 (1)浓硫酸脱水性 滴有浓硫酸的纸(或木条)
炭化变黑。 滤纸(或木条)的主要成份是纤维素,由碳、氢、氧三种元素组成,浓硫酸能把滤纸中的氢、氧元素按水的比例脱去。结论:浓硫酸有脱水性解释: 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水问题?现象: 蔗糖变黑,体积膨胀,放出大
量热,放出有刺激性气味的气体。反应:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2△ (1)浓硫酸脱水性现象: 加热能反应,产生的气
体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。 (2) 浓硫酸氧化性
①与金属反应结论:浓硫酸既有氧化性
又有酸性 Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O△0+6+6+4+2还原剂氧化剂请用单线桥标出电子的转移方向数目,指出氧化剂、还原剂 ①与金属反应2e-② 与某些非金属反应
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。思考题无水硫酸铜品红
溶液品红
溶液酸性高锰酸钾溶液澄清石灰水证明含SO2除去SO2证明无SO2证明含CO2证明含水变蓝色褪色褪色不褪色变浑浊3、硝酸
(1)硝酸的物理性质 纯硝酸 无色
有刺激性气味
易挥发 反应激烈,产生红棕色气体,
溶液由无色变为蓝绿色。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O结论:硝酸具有强的氧化性,能氧化不活泼金属。3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O 反应较缓慢,产生无色气体,逸
至试管口变为红棕色, 溶液由无色变
为蓝绿色。(2)硝酸的化学性质 ①与金属反应 硝酸具有强的氧化性,也能跟许多非金属(如碳)反应4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O ②与非金属反应 硝酸浓度越大,氧化性越强。 氧化性:浓HNO3 > 稀HNO3 硝酸+5价的氮得电子,被还原成较低价的氮 NO2 HNO2 NO N2O N2 NH3+4+3+2+10-3 常温下,把铝、铁放在浓硫酸或浓硝酸里无明显变化。 常温下,浓硫酸能使铁、铝等金属表面生成一层致密的氧化物保护膜,阻止内部金属继续跟硫酸起反应。此现象称 “钝化”。(3)浓硝酸、浓硫酸钝化反应 所以,可以用铁、铝制的容器盛装浓硫酸或浓硝酸4、硫酸、硝酸的用途 p102
