湖北省襄阳市、随州市八校2025届高三下学期三模化学试卷(含答案)
文档属性
| 名称 | 湖北省襄阳市、随州市八校2025届高三下学期三模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 691.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-28 21:59:10 | ||
图片预览



文档简介
2025届湖北省襄阳随州八校三模联考
高三化学试题
本试卷共8页,19题,全卷满分100分,考试用时75分钟。
★祝考试顺利★
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1.化学与生活、生产密切相关,下列说法正确的是( )
A.为增强84消毒液的消杀病毒效果,可加入浓盐酸
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.油脂、糖类以及蛋白质在人体内均能发生水解反应
D.嫦娥五号返回器带回的月壤中含有3He,它与地球上的4He属于同位素
2.“空气变面包,氨功不可没”。下列说法错误的是( )
A.液氨可用作制冷剂 B.NH3是平面三角形的极性分子
C.NH3可以还原CuO D.合成氨是人工固氮最重要途径
3.化学在生产生活中有着广泛的应用,下列两项内容说法正确且存在因果关系的是( )
物质性质 实际应用
A 硅为半导体材料 SiO2用于光纤通讯
B Cl2具有氧化性 氯水可以漂白有色布条
C Al表面易形成致密的氧化物薄膜 可以用铝槽车运送热的浓硫酸
D 乙醇可以使蛋白质变性 乙醇用于制作医用酒精
4.湖北名菜“洪山菜薹”含有丰富的花青素,具有良好的抗氧化活性。其中矢车菊色素的结构如图所示。下列有关该物质的说法正确的是( )
A.化学式为C15H9O6Cl
B.与苯酚互为同系物
C.能与Fe3+发生显色反应
D.能发生氧化反应、取代反应和消去反应
5.下列说法错误的是( )
A.CH4分子球棍模型:
B.基态Si原子价电子排布图:
C.第一电离能:N>O>C
D.石墨质软的原因是其层间作用力微弱
6.中国科学院研究员研究双层电容器中储能行为时,运用到某种离子化合物结构如图所示。其中X、Y、Z、M、L、Q均为短周期主族元素,且原子序数依次增大。M、Q同族且两种元素组成的某种阴离子在强酸性溶液环境下可以产生淡黄色沉淀;Y是有机物的基本骨架元素。下列结论正确的是( )
A.Y的氢化物沸点一定高于Z的氢化物
B.Z的含氧酸不一定属于强酸
C.简单离子半径大小的顺序为: Q>X>M>L
D.L的铵盐溶液能存放在玻璃试剂瓶中
7.阴离子PO和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是( )
二脲基分子 阴离子配合物空间结构
A.PO的空间构型为正四面体
B.二脲基分子中N—H的H和PO离子的O形成氢键
C.所含元素原子的杂化轨道类型均相同
D.所含元素基态原子的第一电离能最大的是N
8.咔唑()是一种新型有机液体储氢介质。下列说法正确的是( )
A.电负性:N>H>C
B.咔唑的沸点比的沸点高
C.同周期元素中第一电离能小于N的有4种
D.基态氮原子的价层电子轨道表示式不能写为,因为违背了泡利不相容原理
9.下列有关说法正确的是( )
A.Na2O和Na2O2固体中阳离子和阴离子个数比都是2∶1
B.CO2和SiO2的化学键类型和晶体类型相同
C.NH和NH3都可以作为配合物的配体
D.Al和N的原子轨道都有3个单电子
10.双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极Ⅰ为掺杂Na2S2的电极,电极Ⅱ为碳电极。电池工作原理如下图所示。下列说法错误的是( )
A.离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜
B.放电时,中间储液器中NaOH的浓度不断变大
C.充电时,电极Ⅰ的电极反应式为:2S-2e-===S
D.充电时,电路中每通过1 mol电子,阳极室溶液质量理论上增加9 g
11.聚碳酸酯(L)可用于制作滑雪镜镜片,透明性好、强度高、不易碎,其结构简式如图:
已知:2R′OH++2R″OH。L可由两种链状单体经该反应制备。下列关于L的说法错误的是( )
A.制备L的反应是缩聚反应
B.1 mol L中sp3杂化的碳原子数目为3NA
C.制备L的单体分子中均含两个苯环
D.分离出苯酚可促进L的合成
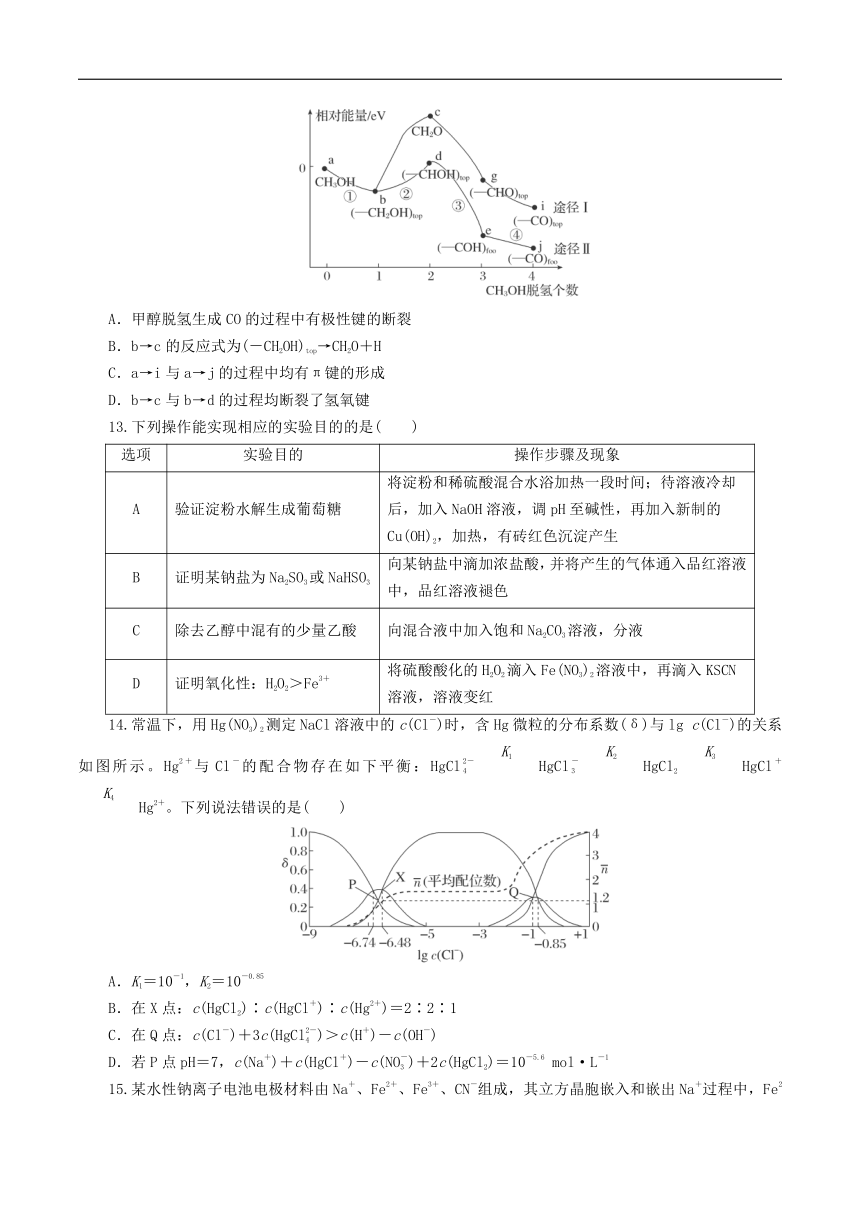
12.吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步脱氢产物及其相对能量如图,下列说法错误的是( )
A.甲醇脱氢生成CO的过程中有极性键的断裂
B.b→c的反应式为(-CH2OH)top→CH2O+H
C.a→i与a→j的过程中均有π键的形成
D.b→c与b→d的过程均断裂了氢氧键
13.下列操作能实现相应的实验目的的是( )
选项 实验目的 操作步骤及现象
A 验证淀粉水解生成葡萄糖 将淀粉和稀硫酸混合水浴加热一段时间;待溶液冷却后,加入NaOH溶液,调pH至碱性,再加入新制的Cu(OH)2,加热,有砖红色沉淀产生
B 证明某钠盐为Na2SO3或NaHSO3 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液中,品红溶液褪色
C 除去乙醇中混有的少量乙酸 向混合液中加入饱和Na2CO3溶液,分液
D 证明氧化性:H2O2>Fe3+ 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中,再滴入KSCN溶液,溶液变红
14.常温下,用Hg(NO3)2测定NaCl溶液中的c(Cl-)时,含Hg微粒的分布系数(δ)与lg c(Cl-)的关系如图所示。Hg2+与Cl-的配合物存在如下平衡:HgClHgClHgCl2HgCl+Hg2+。下列说法错误的是( )
A.K1=10-1,K2=10-0.85
B.在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶2∶1
C.在Q点:c(Cl-)+3c(HgCl)>c(H+)-c(OH-)
D.若P点pH=7,c(Na+)+c(HgCl+)-c(NO)+2c(HgCl2)=10-5.6 mol·L-1
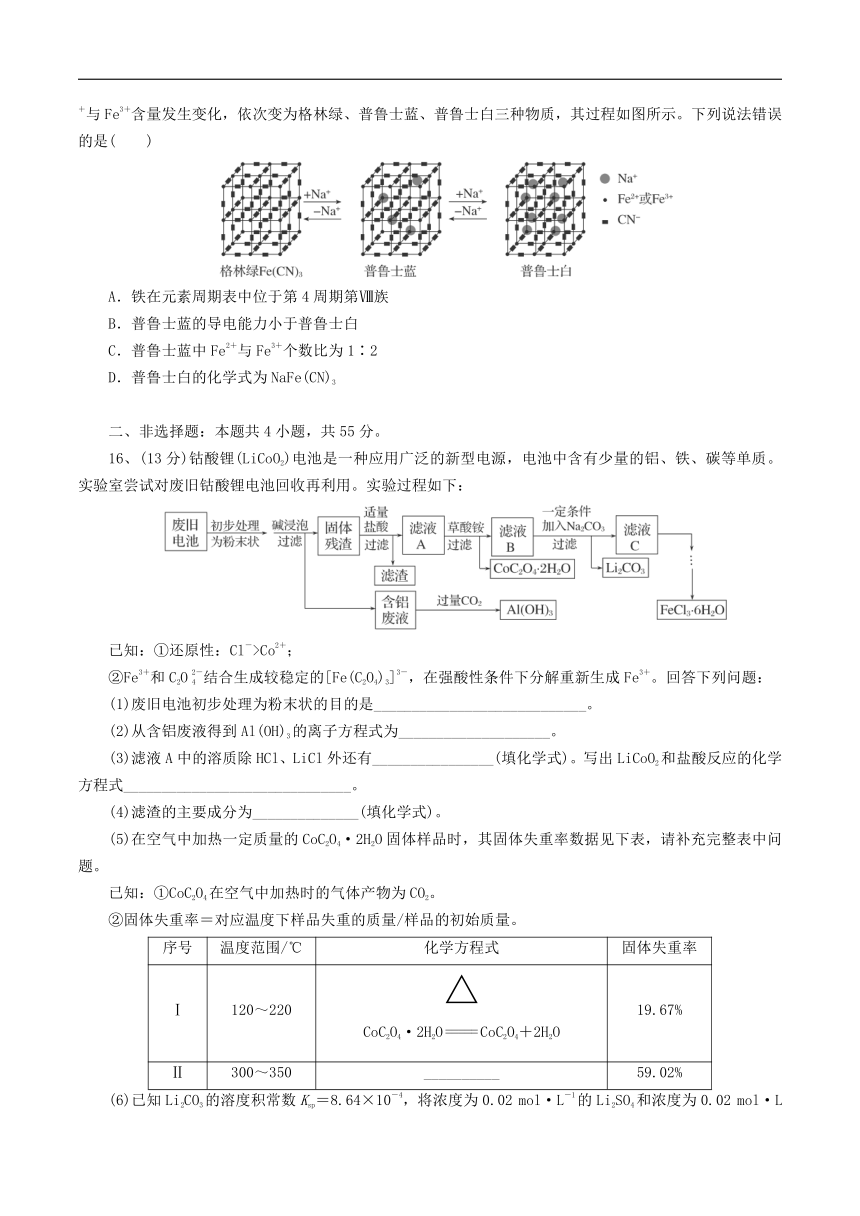
15.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是( )
A.铁在元素周期表中位于第4周期第Ⅷ族
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
D.普鲁士白的化学式为NaFe(CN)3
二、非选择题:本题共4小题,共55分。
16、(13分)钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
已知:①还原性:Cl->Co2+;
②Fe3+和C2O结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是____________________________。
(2)从含铝废液得到Al(OH)3的离子方程式为____________________。
(3)滤液A中的溶质除HCl、LiCl外还有________________(填化学式)。写出LiCoO2和盐酸反应的化学方程式______________________________。
(4)滤渣的主要成分为______________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 温度范围/℃ 化学方程式 固体失重率
Ⅰ 120~220 CoC2O4·2H2OCoC2O4+2H2O 19.67%
Ⅱ 300~350 __________ 59.02%
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
17.(14分)姜酮酚是从生姜中提取得到的天然产物,具有多种重要的生物活性。姜酮酚合成路线如图所示:
回答下列问题:
(1)A→B反应类型为________________,B→C的化学方程式为_________________________________________________________________。
(2)1 mol物质G能与__________mol Na反应,由H制备姜酮酚的反应条件为______________________________________________________________。
(3)符合下列条件的A的同分异构体有__________种(不考虑立体异构)。
①能发生水解反应 ②能与三氯化铁溶液发生显色反应 ③能发生银镜反应
(4)在合成化合物F的步骤中,使用D2O代替H2O得到的化合物结构简式为_____________________________________________________________。
(5)结合姜酮酚的合成路线与已知信息,以苯甲醛为反应物,选择不超过4个碳原子的有机物,其他试剂任选,设计化合物的合成路线_______________________________________________________。
18.(14分)过碳酸钠(2Na2CO3·3H2O2)是一种易溶于水,易分解的强氧化剂。它的一种“常温结晶”制备方法的原理为:2Na2CO3(s)+3H2O2(l)===2Na2CO3·3H2O2(s) ΔH<0,实验装置如图所示(夹持装置略去)。
已知:通常以活性氧质量分数[ω(活性氧)=×100%]来衡量过碳酸钠产品的优劣。
实验步骤:
ⅰ.称取一定量无水碳酸钠,置于烧杯中,加蒸馏水溶解,将溶液转移到三颈烧瓶内,加入稳定剂,搅拌混匀。
ⅱ.控制温度为25 ℃,边搅拌边向三颈烧瓶中缓慢滴加30%的H2O2溶液。
ⅲ.再向三颈烧瓶中加入一定量的无水乙醇,反应一段时间。
ⅳ.静置、真空抽滤、干燥得粗产品,冷却称重。
回答下列问题:
(1)仪器a的名称为________________。
(2)实验过程中产生的气体副产物是_________________(填化学式),装置中玻璃导管的作用是_______________________。
(3)步骤ⅱ中,可采取的控温措施是________________。滴加H2O2溶液速度不能太快,原因是____________________。
(4)步骤ⅲ中,加入乙醇的目的是________________________。反应时间与产率、活性氧质量分数(ω)的关系如下图所示,最适宜的反应时间为__________min左右。
(5)现将0.50 g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL。则粗产品中活性氧质量分数是________________。
19.(14分)将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
(1)已知:①2H2(g)+O2(g)2H2O(g) ΔH=-484 kJ·mol-1
②2CH3OH(g)+3O2(g)2CO2(g)+4H2O(g) ΔH =-1353 kJ·mol-1
则CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH =__________kJ·mol-1。
(2)在恒压密闭容器中通入CO2和H2的混合气体,制备甲醇过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
T/℃ 170 180 190 200 210 220 230
STY/[mol/(mol·h)] 0.10 0.15 0.20 0.25 0.28 0.20 0.15
①该反应最适宜的温度是__________。
②在220 ℃和170 ℃条件下,该反应速率之比: v(220 ℃)∶v(170 ℃)=____________。
③随温度升高,甲醇的时空收率先增大后减小,可能的原因是___________________。
(3)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: CO2(g)+H2(g)CO(g)+H2O(g) ΔH =+41 kJ·mol-1。在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[x(CH3OH)%=×100%]随着温度变化关系如下图所示。
①分析温度高于236 ℃时图中曲线下降的原因______________________。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244 ℃时反应生成CH3OH的物质的量为__________mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp=______________(列出计算式即可)。
高三化学试题答案
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
题号 1 2 3 4 5 6 7 8
答案 D B D C A B C B
题号 9 10 11 12 13 14 15
答案 A C B D A D C
二、非选择题:本题共4小题,共55分。
16、(13分)
答案:(1)增大接触面积,加快反应速率,提高浸出率 (2) AlO+CO2+2H2O===Al(OH)3↓+HCO (3)FeCl3、CoCl2 2LiCoO2+8HCl===2CoCl2+ Cl2↑+4H2O+2LiCl (4)C (5)2CoC2O4+O22CoO+4CO2 (6) 0.02
17.(14分)
18.(14分)
答案:(1)分液漏斗 (2)O2 平衡分压,使得液体顺利滴下 (3)冰水浴 该反应为放热反应,加入H2O2溶液的速度过快会导致大量放热,造成过氧化氢和过碳酸钠的分解
(4)降低2Na2CO3·3H2O2的溶解度,使得2Na2CO3·3H2O2结晶析出 60 (5)12%
19.(14分)
答案:(1)-49.5 (2)① 210 ℃ ②2∶1 ③随温度升高,反应速率加快,甲醇时空收率增大;继续升高温度,催化剂活性降低(或者放热反应平衡逆向移动或有副反应发生等),使甲醇时空收率降低 (3)① 主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使CO2转化率、甲醇选择性均下降 ②0.061 ③
高三化学试题
本试卷共8页,19题,全卷满分100分,考试用时75分钟。
★祝考试顺利★
注意事项:
1、答题前,请将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的制定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题作答:用黑色签字笔直接答在答题卡对应的答题区域内,写在试卷、草稿纸和答题卡上的非答题区域均无效。
4、考试结束后,请将答题卡上交。
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
1.化学与生活、生产密切相关,下列说法正确的是( )
A.为增强84消毒液的消杀病毒效果,可加入浓盐酸
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.油脂、糖类以及蛋白质在人体内均能发生水解反应
D.嫦娥五号返回器带回的月壤中含有3He,它与地球上的4He属于同位素
2.“空气变面包,氨功不可没”。下列说法错误的是( )
A.液氨可用作制冷剂 B.NH3是平面三角形的极性分子
C.NH3可以还原CuO D.合成氨是人工固氮最重要途径
3.化学在生产生活中有着广泛的应用,下列两项内容说法正确且存在因果关系的是( )
物质性质 实际应用
A 硅为半导体材料 SiO2用于光纤通讯
B Cl2具有氧化性 氯水可以漂白有色布条
C Al表面易形成致密的氧化物薄膜 可以用铝槽车运送热的浓硫酸
D 乙醇可以使蛋白质变性 乙醇用于制作医用酒精
4.湖北名菜“洪山菜薹”含有丰富的花青素,具有良好的抗氧化活性。其中矢车菊色素的结构如图所示。下列有关该物质的说法正确的是( )
A.化学式为C15H9O6Cl
B.与苯酚互为同系物
C.能与Fe3+发生显色反应
D.能发生氧化反应、取代反应和消去反应
5.下列说法错误的是( )
A.CH4分子球棍模型:
B.基态Si原子价电子排布图:
C.第一电离能:N>O>C
D.石墨质软的原因是其层间作用力微弱
6.中国科学院研究员研究双层电容器中储能行为时,运用到某种离子化合物结构如图所示。其中X、Y、Z、M、L、Q均为短周期主族元素,且原子序数依次增大。M、Q同族且两种元素组成的某种阴离子在强酸性溶液环境下可以产生淡黄色沉淀;Y是有机物的基本骨架元素。下列结论正确的是( )
A.Y的氢化物沸点一定高于Z的氢化物
B.Z的含氧酸不一定属于强酸
C.简单离子半径大小的顺序为: Q>X>M>L
D.L的铵盐溶液能存放在玻璃试剂瓶中
7.阴离子PO和二脲基分子能通过氢键作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法错误的是( )
二脲基分子 阴离子配合物空间结构
A.PO的空间构型为正四面体
B.二脲基分子中N—H的H和PO离子的O形成氢键
C.所含元素原子的杂化轨道类型均相同
D.所含元素基态原子的第一电离能最大的是N
8.咔唑()是一种新型有机液体储氢介质。下列说法正确的是( )
A.电负性:N>H>C
B.咔唑的沸点比的沸点高
C.同周期元素中第一电离能小于N的有4种
D.基态氮原子的价层电子轨道表示式不能写为,因为违背了泡利不相容原理
9.下列有关说法正确的是( )
A.Na2O和Na2O2固体中阳离子和阴离子个数比都是2∶1
B.CO2和SiO2的化学键类型和晶体类型相同
C.NH和NH3都可以作为配合物的配体
D.Al和N的原子轨道都有3个单电子
10.双膜碱性多硫化物空气液流二次电池可用于再生能源储能和智能电网的备用电源等,电极Ⅰ为掺杂Na2S2的电极,电极Ⅱ为碳电极。电池工作原理如下图所示。下列说法错误的是( )
A.离子交换膜a为阳离子交换膜,离子交换膜b为阴离子交换膜
B.放电时,中间储液器中NaOH的浓度不断变大
C.充电时,电极Ⅰ的电极反应式为:2S-2e-===S
D.充电时,电路中每通过1 mol电子,阳极室溶液质量理论上增加9 g
11.聚碳酸酯(L)可用于制作滑雪镜镜片,透明性好、强度高、不易碎,其结构简式如图:
已知:2R′OH++2R″OH。L可由两种链状单体经该反应制备。下列关于L的说法错误的是( )
A.制备L的反应是缩聚反应
B.1 mol L中sp3杂化的碳原子数目为3NA
C.制备L的单体分子中均含两个苯环
D.分离出苯酚可促进L的合成
12.吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步脱氢产物及其相对能量如图,下列说法错误的是( )
A.甲醇脱氢生成CO的过程中有极性键的断裂
B.b→c的反应式为(-CH2OH)top→CH2O+H
C.a→i与a→j的过程中均有π键的形成
D.b→c与b→d的过程均断裂了氢氧键
13.下列操作能实现相应的实验目的的是( )
选项 实验目的 操作步骤及现象
A 验证淀粉水解生成葡萄糖 将淀粉和稀硫酸混合水浴加热一段时间;待溶液冷却后,加入NaOH溶液,调pH至碱性,再加入新制的Cu(OH)2,加热,有砖红色沉淀产生
B 证明某钠盐为Na2SO3或NaHSO3 向某钠盐中滴加浓盐酸,并将产生的气体通入品红溶液中,品红溶液褪色
C 除去乙醇中混有的少量乙酸 向混合液中加入饱和Na2CO3溶液,分液
D 证明氧化性:H2O2>Fe3+ 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中,再滴入KSCN溶液,溶液变红
14.常温下,用Hg(NO3)2测定NaCl溶液中的c(Cl-)时,含Hg微粒的分布系数(δ)与lg c(Cl-)的关系如图所示。Hg2+与Cl-的配合物存在如下平衡:HgClHgClHgCl2HgCl+Hg2+。下列说法错误的是( )
A.K1=10-1,K2=10-0.85
B.在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶2∶1
C.在Q点:c(Cl-)+3c(HgCl)>c(H+)-c(OH-)
D.若P点pH=7,c(Na+)+c(HgCl+)-c(NO)+2c(HgCl2)=10-5.6 mol·L-1
15.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是( )
A.铁在元素周期表中位于第4周期第Ⅷ族
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+个数比为1∶2
D.普鲁士白的化学式为NaFe(CN)3
二、非选择题:本题共4小题,共55分。
16、(13分)钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
已知:①还原性:Cl->Co2+;
②Fe3+和C2O结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是____________________________。
(2)从含铝废液得到Al(OH)3的离子方程式为____________________。
(3)滤液A中的溶质除HCl、LiCl外还有________________(填化学式)。写出LiCoO2和盐酸反应的化学方程式______________________________。
(4)滤渣的主要成分为______________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 温度范围/℃ 化学方程式 固体失重率
Ⅰ 120~220 CoC2O4·2H2OCoC2O4+2H2O 19.67%
Ⅱ 300~350 __________ 59.02%
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
17.(14分)姜酮酚是从生姜中提取得到的天然产物,具有多种重要的生物活性。姜酮酚合成路线如图所示:
回答下列问题:
(1)A→B反应类型为________________,B→C的化学方程式为_________________________________________________________________。
(2)1 mol物质G能与__________mol Na反应,由H制备姜酮酚的反应条件为______________________________________________________________。
(3)符合下列条件的A的同分异构体有__________种(不考虑立体异构)。
①能发生水解反应 ②能与三氯化铁溶液发生显色反应 ③能发生银镜反应
(4)在合成化合物F的步骤中,使用D2O代替H2O得到的化合物结构简式为_____________________________________________________________。
(5)结合姜酮酚的合成路线与已知信息,以苯甲醛为反应物,选择不超过4个碳原子的有机物,其他试剂任选,设计化合物的合成路线_______________________________________________________。
18.(14分)过碳酸钠(2Na2CO3·3H2O2)是一种易溶于水,易分解的强氧化剂。它的一种“常温结晶”制备方法的原理为:2Na2CO3(s)+3H2O2(l)===2Na2CO3·3H2O2(s) ΔH<0,实验装置如图所示(夹持装置略去)。
已知:通常以活性氧质量分数[ω(活性氧)=×100%]来衡量过碳酸钠产品的优劣。
实验步骤:
ⅰ.称取一定量无水碳酸钠,置于烧杯中,加蒸馏水溶解,将溶液转移到三颈烧瓶内,加入稳定剂,搅拌混匀。
ⅱ.控制温度为25 ℃,边搅拌边向三颈烧瓶中缓慢滴加30%的H2O2溶液。
ⅲ.再向三颈烧瓶中加入一定量的无水乙醇,反应一段时间。
ⅳ.静置、真空抽滤、干燥得粗产品,冷却称重。
回答下列问题:
(1)仪器a的名称为________________。
(2)实验过程中产生的气体副产物是_________________(填化学式),装置中玻璃导管的作用是_______________________。
(3)步骤ⅱ中,可采取的控温措施是________________。滴加H2O2溶液速度不能太快,原因是____________________。
(4)步骤ⅲ中,加入乙醇的目的是________________________。反应时间与产率、活性氧质量分数(ω)的关系如下图所示,最适宜的反应时间为__________min左右。
(5)现将0.50 g粗产品(杂质不参与反应)置于锥形瓶中,加水溶解,再加入足量稀H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL。则粗产品中活性氧质量分数是________________。
19.(14分)将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
(1)已知:①2H2(g)+O2(g)2H2O(g) ΔH=-484 kJ·mol-1
②2CH3OH(g)+3O2(g)2CO2(g)+4H2O(g) ΔH =-1353 kJ·mol-1
则CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH =__________kJ·mol-1。
(2)在恒压密闭容器中通入CO2和H2的混合气体,制备甲醇过程中测得甲醇的时空收率(STY)(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度(T)变化如下表:
T/℃ 170 180 190 200 210 220 230
STY/[mol/(mol·h)] 0.10 0.15 0.20 0.25 0.28 0.20 0.15
①该反应最适宜的温度是__________。
②在220 ℃和170 ℃条件下,该反应速率之比: v(220 ℃)∶v(170 ℃)=____________。
③随温度升高,甲醇的时空收率先增大后减小,可能的原因是___________________。
(3)CO2催化加氢制甲醇过程中,存在竞争的副反应主要是: CO2(g)+H2(g)CO(g)+H2O(g) ΔH =+41 kJ·mol-1。在恒温密闭容器中,CO2的平衡转化率[α(CO2)%]和甲醇选择性[x(CH3OH)%=×100%]随着温度变化关系如下图所示。
①分析温度高于236 ℃时图中曲线下降的原因______________________。
②按1 mol CO2(g)、3 mol H2(g)投料反应,计算 244 ℃时反应生成CH3OH的物质的量为__________mol。 (保留两位有效数字)
③在压强为p的反应条件下,1 mol CO2(g)和3 mol H2(g)反应并达到平衡状态,CO2平衡转化率为20%,甲醇选择性为50%,该温度下主反应的平衡常数Kp=______________(列出计算式即可)。
高三化学试题答案
一、选择题:本题共15小题,每题3分,共45分,每小题仅有一项是符合题意。
题号 1 2 3 4 5 6 7 8
答案 D B D C A B C B
题号 9 10 11 12 13 14 15
答案 A C B D A D C
二、非选择题:本题共4小题,共55分。
16、(13分)
答案:(1)增大接触面积,加快反应速率,提高浸出率 (2) AlO+CO2+2H2O===Al(OH)3↓+HCO (3)FeCl3、CoCl2 2LiCoO2+8HCl===2CoCl2+ Cl2↑+4H2O+2LiCl (4)C (5)2CoC2O4+O22CoO+4CO2 (6) 0.02
17.(14分)
18.(14分)
答案:(1)分液漏斗 (2)O2 平衡分压,使得液体顺利滴下 (3)冰水浴 该反应为放热反应,加入H2O2溶液的速度过快会导致大量放热,造成过氧化氢和过碳酸钠的分解
(4)降低2Na2CO3·3H2O2的溶解度,使得2Na2CO3·3H2O2结晶析出 60 (5)12%
19.(14分)
答案:(1)-49.5 (2)① 210 ℃ ②2∶1 ③随温度升高,反应速率加快,甲醇时空收率增大;继续升高温度,催化剂活性降低(或者放热反应平衡逆向移动或有副反应发生等),使甲醇时空收率降低 (3)① 主反应是放热反应,副反应是吸热反应,升高温度,主反应平衡逆向移动,副反应平衡正向移动,且主反应平衡移动程度占主要因素,因而使CO2转化率、甲醇选择性均下降 ②0.061 ③
同课章节目录
