人教版高中化学必修一课件1.2 《化学计量在实验中的应用》课件(共72张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件1.2 《化学计量在实验中的应用》课件(共72张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 23:02:58 | ||
图片预览








文档简介
课件72张PPT。1g水约含有
3.34×1022个水分子 2H2 + O2 = 2 H2O 2个氢气分子 1个氧气分子 1个水分子 ——— 微观粒子 4g32g36g ——— 宏观质量
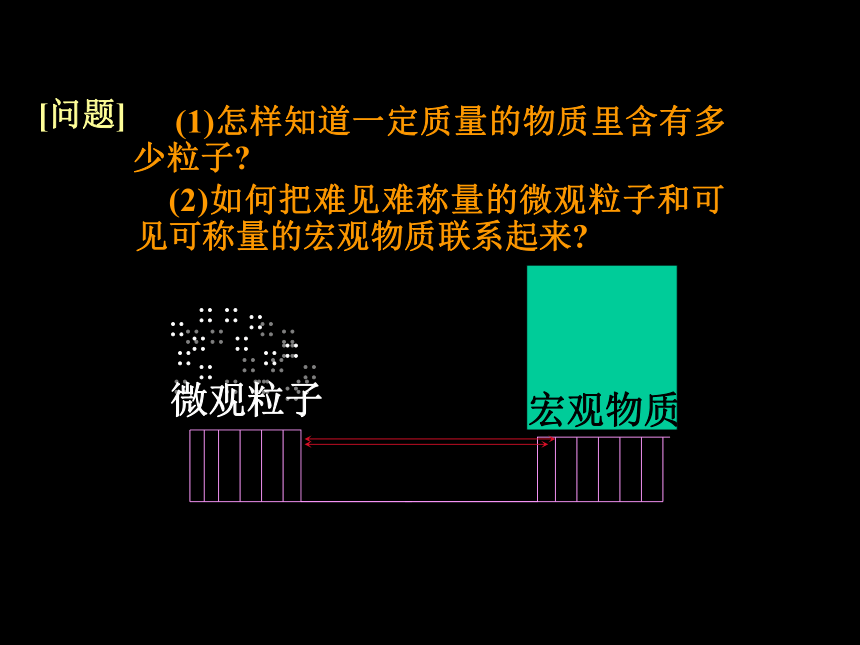
[问题] (1)怎样知道一定质量的物质里含有多少粒子? (2)如何把难见难称量的微观粒子和可见可称量的宏观物质联系起来?方法:称量一定数量的微观粒子的质量———思考1. 如何用托盘天平称出一粒大米的质量?化零为整的方法
2.假设1000粒米的质量为50g,则2000粒米的质
量为多少?
思路:1000粒米=50g建立粒子的数目与一定数目粒子的集体质量的联系思考4.已知 一个12C质量为1.993?10-23g ,求12克
12C含多少个原子 ? 12g =6.0210737×1023
≈6.02 ? 1023 1.993?10-23g将宏观质量和微观粒子的数目之间联系起来3.如何称出一个碳原子的质量?6.02 ? 1023个12C的质量=12g方法:称量一定数量的碳原子的质量———
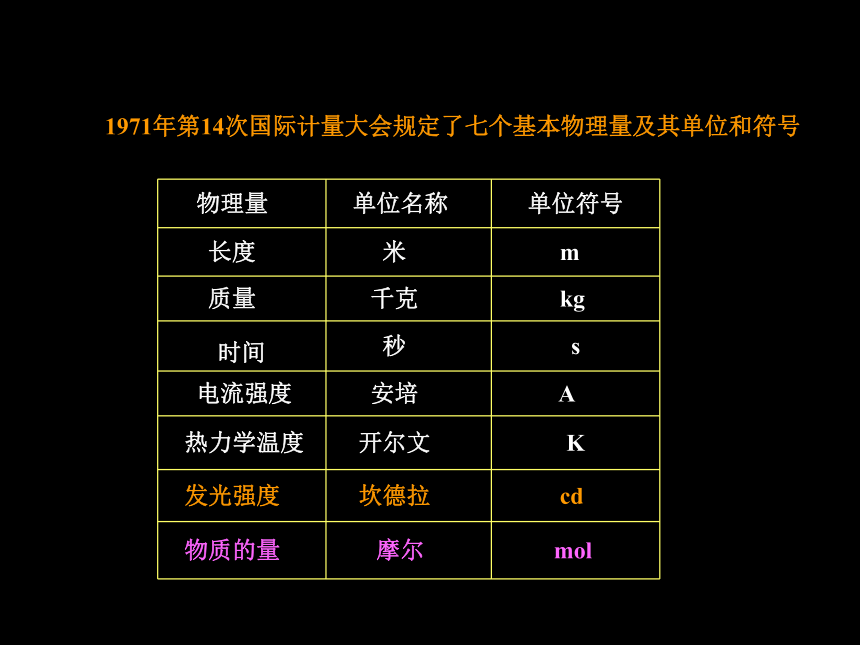
化零为整 1971年第14次国际计量大会规定了七个基本物理量及其单位和符号一、物质的量及其单位1、物质的量(n):表示含有一定数目粒子的集体2、摩尔(mol) :物质的量的单位 简称“摩”3、阿伏加德罗常数(NA):1mol任何粒子的粒子数
叫阿伏加德罗常数NA 的基准值为:12克12C所含的原子数目
近似值为:6.02 ? 1023mol-1 2.量度对象:微观粒子(分子、原子、离子、质子、中子、
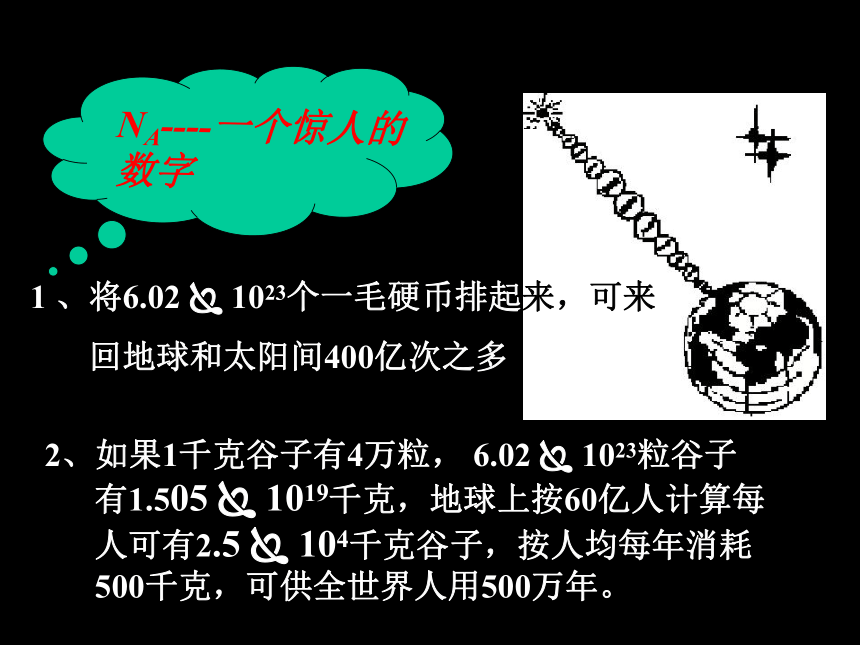
电子等或它们的特定组合),不能表示宏观物体 3.必须指明微观粒子的具体名称或符号注意理解1.基本物理量之一,是专有名词,不能拆或添加任何字12克12C所含有碳原子的数目=1mol(通常用化学式来表示防产生歧义)NA----一个惊人的
数字1 、将6.02 ? 1023个一毛硬币排起来,可来
回地球和太阳间400亿次之多
2、如果1千克谷子有4万粒, 6.02 ? 1023粒谷子
有1.505 ? 1019千克,地球上按60亿人计算每
人可有2.5 ? 104千克谷子,按人均每年消耗
500千克,可供全世界人用500万年。 2.使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。 注意: 1.物质的量只适用于微观粒子,不能用来说明宏观物质.辨 析判断下列说法是否正确,并加以说明理由
1、1mol米
2、1molO
3、 1molNaCl
4、 1mol氧
5 、1mol水
6、 1mol分子氧
7、 1mol钠元素
8、12克碳所含的原子数为阿伏加的罗常数不对,指代不明,且没用化学式对,特定组合不对,研究对象是微观粒子或特定组合对,指氧原子不对,应用化学式表示——1molH2O不对不对,指代不明不对,指12克12C 概念辨析
1.判断下列说法是否正确?
(1)每摩物质含有6.02×1023个粒子。
(2)摩尔是七个物理量之一。
错误。每摩尔物质含有阿伏加德罗常数个粒子,近似值为6.02×1023,但不能认为6.02×1023就是阿伏德罗常数。 错误。“物质的量”是七个物理量之一,“摩尔”是物质的量的单位,不可将这两个概念混为一谈。
堂上练习(3)摩尔是物质的质量单位。
(4)摩尔是物质的数量单位。
(5)1 molCO2
(6)1摩尔小麦约含6.02×1023个麦粒。
(7)1 mol氢
(3)和(4)错误 摩尔既不是物质的质量单位,也不是物质的数量单位,它是物质的量的单位。
正确错误。物质的量只适用于微观粒子,不能用来说明宏观物质。
错误. 没有指出是分子、原子或离子.
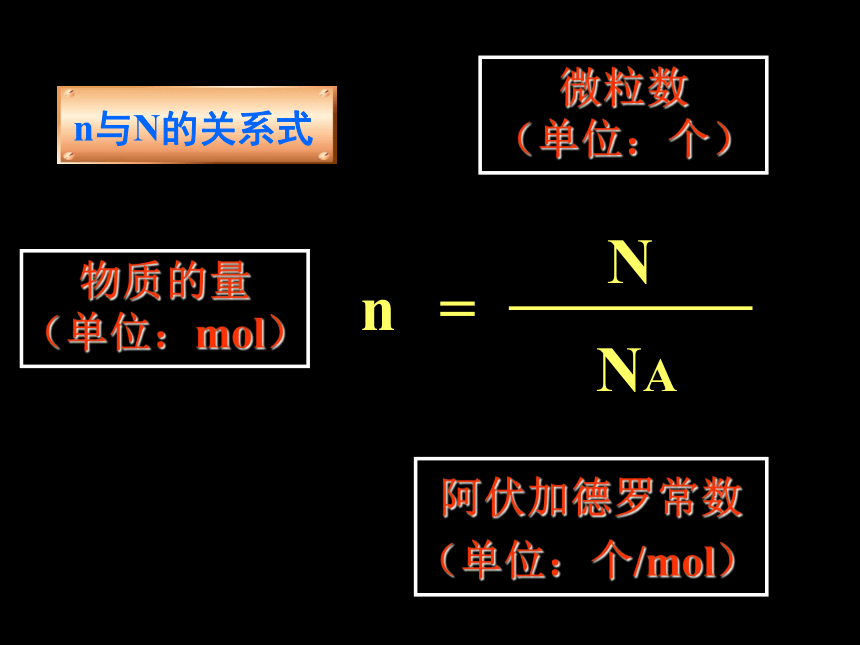
n=NNA物质的量
(单位:mol)微粒数
(单位:个)阿伏加德罗常数
(单位:个/mol)n与N的关系式
填写下列空白
(1)1molO中约含有 个O;
(2)3molH2SO4中约含有 个H2SO4;
(3)4molO2中约含有 个O2;
(4)10molNa+中约含有 个Na+;
(5)28mol电子中约含有 个电子;
(6)1.204×1024个水分子,其物质的量为 ; 6.02×10233×6.02×10234×6.02×102310×6.02×102328×6.02×10232mol物质的量(n)
质量(m)?试试看:1.物质的量与摩尔的区别和联系表示物质所含粒子数目多少的物理量是物质的量的单位摩尔是物质的量的单位2.阿伏加德罗常数与6.02×1023mol-1的区别和联系
精确值
近似值
阿伏加德罗常数的近似值为6.02×1023mol-1
辨 析表示物质所含粒子数目多少物理量,单位是摩尔0.012kg12C所含的原子数,单位是mol-1阿伏加德罗常数的近似值为6.02×1023mol-1
辨 析
3. 物质的的量与阿伏加德罗常数1、5mol的O2中含有 个氧气分子;5NA2、1.204×1024个H
是 mol ;1.204×1024/NA23、x 个水分子的物质的量是 mol;
其中H原子的物质的量是 mol。2x/NAx/NA4、1个H2O分子中有 个电子,1mol H2O中有 个电子。
1010NA堂上练习微粒 C H O H2O12 1 16 18相对原子(分子)质量1个原子或分子的质量比12 : 1 : 16 : 18同时扩大6.02×1023倍质量比12 : 1 : 16 : 181mol原子或分子 1mol的质量12克1克16克18克 1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量物质的量(n)
?质量(m)摩尔质量定义:单位物质的量的物质的质量符号: M定义式:每 摩 尔单位: g / mol数值: 等于相对原子(分子)质量辨 析相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg / mol小结n物质的量N微粒数m质量÷NA×NA÷M×M试试看:1、24.5克硫酸的物质的量是 mol;2、1.5mol 硫酸的质量是 克,其中含有 mol O ,其质量是 克;3、0.01 mol 某物质的质量是1.08克,此物质的摩尔质量为 ;4、71克Na2SO4中含Na+ mol, 个.气体摩尔体积质量(m)物质的量(n)微粒数(N)物质的体积(V)? 7.2×10-3 10×10-3 18×10-3 58.3×10-3
结论:在相同的温度和压强下,
1mol 固体和液体的体积是不同的。
填写下表:6.02x10236.02x10236.02x10232.01632.0044.0122.422.422.30。C,101kPa(即标准状况) 结论:在相同的温度和压强下,
1mol 任何气体的体积是相同的。为什么1mol固体、液体体积不同?而在0℃,101KPa的条件下, 1mol气体的体积却基本相同呢?1个乒乓球所占的体积和1个篮球所占的体积哪个大?10个乒乓球所占的体积和1个乒乓球所占的体积哪个大?10个紧密排列在一起的乒乓球所占的体积和10个松散排列在一起的乒乓球所占的体积哪个大? [讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同,而相同条件(标准状况)下,1mol不同的气体体积基本相同呢? 固体物质液体物质分子直径气体物质分子间的平均距离 分子的直径为0.4nm分子之间的平均距离为4nm[小结]
固体、液体物质粒子间间隔很小,在
粒子数目相同的情况下,固体、液体的
体积主要由粒子本身大小决定。
气体粒子间间隔很大,在粒子数目相
同的情况下,气体的体积主要由粒子间
距离决定。
?气体分子间的平均距离由什么决定?温度固
体气
体压强固
体气
体4.结论:在标准状况下(0。C,101kPa) ,1mol任何气体的体积都约为22.4L。
(体积既可指单一气体又可指混合气体).
【例1 】标况下,112mlCO2 的物质的量是多少?
【例2 】标况下,2.2gCO2 的体积是多少?
练习题:
下列说法正确的是( )
A. 1mol任何气体的体积都是22.4L
B. 在标况下,任何气体的体积都是22.4L
C.在标准状况下,1mol水所占的体积约是22.4L
D.在标准状况下,1molH2和O2所占的体积都约是22.4L
D填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(5)标况下,16gO2 的体积为 L
(6)标况下, 11.2LN2 中含有N2分子的个数是11.244.80.21.511.23.01×1023个[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都 约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等[答案] (D) NA代表阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4 L氦气与22.4 L氧气所含原子数均为2 NA
B.1 mol MgCl2中含有的离子数为2 NA
C.在常温常压下,11.2L氮气所含的原子数为NA
D.17g氨气所含电子数目为10NA(D)阿伏加德罗定律:1.内容:
相同温度相同压强下,相同体积的
任何气体都含有相同数目的粒子。2.概括:三同推一同。推论:
(1)同T、P时,V1/V2=?
(2)同T、V时,P1/P2=?
(3)同T、P时, ρ1/ρ2=?1、在相同的温度条件下,将2.2g
CO2和5.6g的N2分别充入体积相
同的两个容器中,两容器中的密度
之比为 ,压强之比为 ,
分子数目之比为 2、将氧气和氢气混合得到气体的密度
是同温同压下CO密度的0.5倍,则该混
合气体的平均摩尔质量为 ,
所得气体中氧气和氢气的体积之比为
。物质的量浓度zxxkw一、物质的量浓度: 1.概念:以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
2.表达式:CB=
(单位:mol/L) 1.溶质是用物质的量表示而不是用
质量表示.
2.是溶液的体积而不是溶剂的体积.注意:⑴ 1mol NaOH固体溶于水,配制成体积
为1L的溶液。
⑵ 4g NaOH固体溶于水,配制成体积
为1L的溶液。
⑶ 1mol NaOH固体溶于1L水配制的溶液。练习和讨论:1.计算下列溶液的物质的量浓度: 1 mol/L0.1 mol/L必须用溶液的密度求体积2.请计算2210.22001.12 3.从1L1mol/L H2SO4溶液中分别取出100mL、50mL、20mL,所取出溶液的物质的量浓度分别是多少? 所含溶质的物质的量又是多少?都是1mol/L0.1mol 0.05mol 0.02mol 4.下列各溶液中,c(Na+) 最大的是( )
(A)4L 0.5 mol/L NaCl 溶液
(B)1L 0.3 mol/L Na2SO4 溶液
(C)0. 8L 0.4 mol/L NaOH 溶液
(D)2L 0.15 mol/L Na3PO4 溶液
B5. (1) 200mL 0.5 mol·L-1Na2SO4溶液中,
c(SO42-)= c(Na+)=
(2) 100mL 0.2 mol·L-1Ba(OH)2溶液中,
Ba2+和OH-的物质的量浓度的比值为
,500mL溶液中Ba2+和OH-的物质
的量的比值为 0.5mol·L-11mol·L-11:21:2⑴ 下列各溶液中与50mL 3mol/L KCl溶液n(Cl-)相同的是 ⑵ 与50mL 3mol/L KCl溶液c(Cl-)相同的是 A. 50mL 1mol/L KCl溶液
B. 150mL 1mol/L KCl溶液
C. 10mL 3mol/L NaCl溶液
D. 50mL 1mol/L AlCl3溶液(BD)(CD)练习6物质的质量 物质的量 物质含粒子数
(m) (n) (N)÷M×M÷NA (V)
气体体积 (S、T、P)×Vm×NA÷Vm物质的量浓度
(c)×V (aq)÷V(aq)如何配制100mL 1mol/L的NaCl溶液主要仪器:容量瓶容量瓶的使用构造:细颈、平底玻璃瓶,瓶口配有磨口玻璃
塞或塑料塞2. 特点:①容量瓶上标有温度和容积
②容量瓶上有刻线而无刻度3. 用途:用来配制一定体积
一定浓度的溶液4. 注意事项:
①使用前要检查是否漏水②溶解或稀释的操作不能在容量瓶中进行③不能长期存放溶液或进行化学反应配制100mL 1mol/L溶液的步骤: ①计算 ②称量③溶解④转移⑤洗涤⑦定容⑧摇匀⑨装瓶贴好标签托盘天平、药匙、滤纸等烧杯、玻璃棒胶头滴管仪器容量瓶冷却5.9 g⑥摇匀⑴称量时左盘高,右盘低⑵称量时称量物放在右盘,而砝码放在左盘1.称量产生误差2. 溶解、转移、洗涤产生误差⑵未洗涤溶解用的玻璃棒和烧杯⑶洗涤液未转入容量瓶中而倒入废液缸中⑴溶解过程中有少量液体溅出烧杯(仰视定容俯视定容溶液体积增大,
浓度变小溶液体积减小,
浓度变大(⑵定容时俯视刻度⑶定容时液面低于刻度线⑷未等溶液冷却就定容
⑴定容时仰视刻度⑸定容后发现液面高于刻度线后,用滴管吸出少量溶液3.定容误差⑹摇匀后发现液面低于刻度再加水误差分析练习
1.天平的砝码上占有其他物质或已锈蚀( )
2.试剂与砝码的左右位置搞错( )
3.量取液体溶质时,俯视读数( )
4.定容时俯视刻度线( )
5.所配溶液未冷却至室温即转入容量瓶定容( )偏高可能偏低偏高偏高偏低下列操作对溶液浓度造成的误差是6. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转
入容量瓶( ) 溶解、转移、洗涤时有溶液流出容器外,使溶质
减小( )容量瓶在使用前,用蒸馏水洗净,在瓶内有少
量水残留( )
9. 定匀摇匀后,静止时发现液面低于刻度线,再加
水到刻度线( )
定容时加水过量越过刻度线,又取出部分溶液,
使液面降至刻度线( )
偏低偏低偏低偏低无影响练习1 .用18 mol/L浓硫酸配制 100 mL 1.0mol/L 硫酸,选用哪些实验仪器?
(A)100 mL量筒 (B)托盘天平
(C)玻璃棒 (D)50 mL容量瓶
(E) 10 mL量筒 (F)胶头滴管
(G)50 ml 烧杯 (H) 100 mL容量瓶√√√√√简单计算例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4molm(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g答:需要NaCl的质量为23.4g。例3:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。 解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
C(HNO3) = 22.4mol/L答:该硝酸中HNO3的物质的量浓度为22.4mol/L
3.34×1022个水分子 2H2 + O2 = 2 H2O 2个氢气分子 1个氧气分子 1个水分子 ——— 微观粒子 4g32g36g ——— 宏观质量
[问题] (1)怎样知道一定质量的物质里含有多少粒子? (2)如何把难见难称量的微观粒子和可见可称量的宏观物质联系起来?方法:称量一定数量的微观粒子的质量———思考1. 如何用托盘天平称出一粒大米的质量?化零为整的方法
2.假设1000粒米的质量为50g,则2000粒米的质
量为多少?
思路:1000粒米=50g建立粒子的数目与一定数目粒子的集体质量的联系思考4.已知 一个12C质量为1.993?10-23g ,求12克
12C含多少个原子 ? 12g =6.0210737×1023
≈6.02 ? 1023 1.993?10-23g将宏观质量和微观粒子的数目之间联系起来3.如何称出一个碳原子的质量?6.02 ? 1023个12C的质量=12g方法:称量一定数量的碳原子的质量———
化零为整 1971年第14次国际计量大会规定了七个基本物理量及其单位和符号一、物质的量及其单位1、物质的量(n):表示含有一定数目粒子的集体2、摩尔(mol) :物质的量的单位 简称“摩”3、阿伏加德罗常数(NA):1mol任何粒子的粒子数
叫阿伏加德罗常数NA 的基准值为:12克12C所含的原子数目
近似值为:6.02 ? 1023mol-1 2.量度对象:微观粒子(分子、原子、离子、质子、中子、
电子等或它们的特定组合),不能表示宏观物体 3.必须指明微观粒子的具体名称或符号注意理解1.基本物理量之一,是专有名词,不能拆或添加任何字12克12C所含有碳原子的数目=1mol(通常用化学式来表示防产生歧义)NA----一个惊人的
数字1 、将6.02 ? 1023个一毛硬币排起来,可来
回地球和太阳间400亿次之多
2、如果1千克谷子有4万粒, 6.02 ? 1023粒谷子
有1.505 ? 1019千克,地球上按60亿人计算每
人可有2.5 ? 104千克谷子,按人均每年消耗
500千克,可供全世界人用500万年。 2.使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。 注意: 1.物质的量只适用于微观粒子,不能用来说明宏观物质.辨 析判断下列说法是否正确,并加以说明理由
1、1mol米
2、1molO
3、 1molNaCl
4、 1mol氧
5 、1mol水
6、 1mol分子氧
7、 1mol钠元素
8、12克碳所含的原子数为阿伏加的罗常数不对,指代不明,且没用化学式对,特定组合不对,研究对象是微观粒子或特定组合对,指氧原子不对,应用化学式表示——1molH2O不对不对,指代不明不对,指12克12C 概念辨析
1.判断下列说法是否正确?
(1)每摩物质含有6.02×1023个粒子。
(2)摩尔是七个物理量之一。
错误。每摩尔物质含有阿伏加德罗常数个粒子,近似值为6.02×1023,但不能认为6.02×1023就是阿伏德罗常数。 错误。“物质的量”是七个物理量之一,“摩尔”是物质的量的单位,不可将这两个概念混为一谈。
堂上练习(3)摩尔是物质的质量单位。
(4)摩尔是物质的数量单位。
(5)1 molCO2
(6)1摩尔小麦约含6.02×1023个麦粒。
(7)1 mol氢
(3)和(4)错误 摩尔既不是物质的质量单位,也不是物质的数量单位,它是物质的量的单位。
正确错误。物质的量只适用于微观粒子,不能用来说明宏观物质。
错误. 没有指出是分子、原子或离子.
n=NNA物质的量
(单位:mol)微粒数
(单位:个)阿伏加德罗常数
(单位:个/mol)n与N的关系式
填写下列空白
(1)1molO中约含有 个O;
(2)3molH2SO4中约含有 个H2SO4;
(3)4molO2中约含有 个O2;
(4)10molNa+中约含有 个Na+;
(5)28mol电子中约含有 个电子;
(6)1.204×1024个水分子,其物质的量为 ; 6.02×10233×6.02×10234×6.02×102310×6.02×102328×6.02×10232mol物质的量(n)
质量(m)?试试看:1.物质的量与摩尔的区别和联系表示物质所含粒子数目多少的物理量是物质的量的单位摩尔是物质的量的单位2.阿伏加德罗常数与6.02×1023mol-1的区别和联系
精确值
近似值
阿伏加德罗常数的近似值为6.02×1023mol-1
辨 析表示物质所含粒子数目多少物理量,单位是摩尔0.012kg12C所含的原子数,单位是mol-1阿伏加德罗常数的近似值为6.02×1023mol-1
辨 析
3. 物质的的量与阿伏加德罗常数1、5mol的O2中含有 个氧气分子;5NA2、1.204×1024个H
是 mol ;1.204×1024/NA23、x 个水分子的物质的量是 mol;
其中H原子的物质的量是 mol。2x/NAx/NA4、1个H2O分子中有 个电子,1mol H2O中有 个电子。
1010NA堂上练习微粒 C H O H2O12 1 16 18相对原子(分子)质量1个原子或分子的质量比12 : 1 : 16 : 18同时扩大6.02×1023倍质量比12 : 1 : 16 : 181mol原子或分子 1mol的质量12克1克16克18克 1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量物质的量(n)
?质量(m)摩尔质量定义:单位物质的量的物质的质量符号: M定义式:每 摩 尔单位: g / mol数值: 等于相对原子(分子)质量辨 析相对原子质量
相对分子质量1mol物质的质量摩尔质量单位数值相
同1gg / mol小结n物质的量N微粒数m质量÷NA×NA÷M×M试试看:1、24.5克硫酸的物质的量是 mol;2、1.5mol 硫酸的质量是 克,其中含有 mol O ,其质量是 克;3、0.01 mol 某物质的质量是1.08克,此物质的摩尔质量为 ;4、71克Na2SO4中含Na+ mol, 个.气体摩尔体积质量(m)物质的量(n)微粒数(N)物质的体积(V)? 7.2×10-3 10×10-3 18×10-3 58.3×10-3
结论:在相同的温度和压强下,
1mol 固体和液体的体积是不同的。
填写下表:6.02x10236.02x10236.02x10232.01632.0044.0122.422.422.30。C,101kPa(即标准状况) 结论:在相同的温度和压强下,
1mol 任何气体的体积是相同的。为什么1mol固体、液体体积不同?而在0℃,101KPa的条件下, 1mol气体的体积却基本相同呢?1个乒乓球所占的体积和1个篮球所占的体积哪个大?10个乒乓球所占的体积和1个乒乓球所占的体积哪个大?10个紧密排列在一起的乒乓球所占的体积和10个松散排列在一起的乒乓球所占的体积哪个大? [讨论] 对于1mol不同的固体和液体物质,为什么它们的体积各不相同,而相同条件(标准状况)下,1mol不同的气体体积基本相同呢? 固体物质液体物质分子直径气体物质分子间的平均距离 分子的直径为0.4nm分子之间的平均距离为4nm[小结]
固体、液体物质粒子间间隔很小,在
粒子数目相同的情况下,固体、液体的
体积主要由粒子本身大小决定。
气体粒子间间隔很大,在粒子数目相
同的情况下,气体的体积主要由粒子间
距离决定。
?气体分子间的平均距离由什么决定?温度固
体气
体压强固
体气
体4.结论:在标准状况下(0。C,101kPa) ,1mol任何气体的体积都约为22.4L。
(体积既可指单一气体又可指混合气体).
【例1 】标况下,112mlCO2 的物质的量是多少?
【例2 】标况下,2.2gCO2 的体积是多少?
练习题:
下列说法正确的是( )
A. 1mol任何气体的体积都是22.4L
B. 在标况下,任何气体的体积都是22.4L
C.在标准状况下,1mol水所占的体积约是22.4L
D.在标准状况下,1molH2和O2所占的体积都约是22.4L
D填写下列空白:
(1)标况下,0.5molH2占有的体积是 L
(2)标况下, 2molO2占有的体积是 L
(3)标况下,4.48LCO2的物质的量是 mol
(4)标况下,33.6LH2 的物质的量是 mol
(5)标况下,16gO2 的体积为 L
(6)标况下, 11.2LN2 中含有N2分子的个数是11.244.80.21.511.23.01×1023个[练习]下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都 约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等[答案] (D) NA代表阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4 L氦气与22.4 L氧气所含原子数均为2 NA
B.1 mol MgCl2中含有的离子数为2 NA
C.在常温常压下,11.2L氮气所含的原子数为NA
D.17g氨气所含电子数目为10NA(D)阿伏加德罗定律:1.内容:
相同温度相同压强下,相同体积的
任何气体都含有相同数目的粒子。2.概括:三同推一同。推论:
(1)同T、P时,V1/V2=?
(2)同T、V时,P1/P2=?
(3)同T、P时, ρ1/ρ2=?1、在相同的温度条件下,将2.2g
CO2和5.6g的N2分别充入体积相
同的两个容器中,两容器中的密度
之比为 ,压强之比为 ,
分子数目之比为 2、将氧气和氢气混合得到气体的密度
是同温同压下CO密度的0.5倍,则该混
合气体的平均摩尔质量为 ,
所得气体中氧气和氢气的体积之比为
。物质的量浓度zxxkw一、物质的量浓度: 1.概念:以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
2.表达式:CB=
(单位:mol/L) 1.溶质是用物质的量表示而不是用
质量表示.
2.是溶液的体积而不是溶剂的体积.注意:⑴ 1mol NaOH固体溶于水,配制成体积
为1L的溶液。
⑵ 4g NaOH固体溶于水,配制成体积
为1L的溶液。
⑶ 1mol NaOH固体溶于1L水配制的溶液。练习和讨论:1.计算下列溶液的物质的量浓度: 1 mol/L0.1 mol/L必须用溶液的密度求体积2.请计算2210.22001.12 3.从1L1mol/L H2SO4溶液中分别取出100mL、50mL、20mL,所取出溶液的物质的量浓度分别是多少? 所含溶质的物质的量又是多少?都是1mol/L0.1mol 0.05mol 0.02mol 4.下列各溶液中,c(Na+) 最大的是( )
(A)4L 0.5 mol/L NaCl 溶液
(B)1L 0.3 mol/L Na2SO4 溶液
(C)0. 8L 0.4 mol/L NaOH 溶液
(D)2L 0.15 mol/L Na3PO4 溶液
B5. (1) 200mL 0.5 mol·L-1Na2SO4溶液中,
c(SO42-)= c(Na+)=
(2) 100mL 0.2 mol·L-1Ba(OH)2溶液中,
Ba2+和OH-的物质的量浓度的比值为
,500mL溶液中Ba2+和OH-的物质
的量的比值为 0.5mol·L-11mol·L-11:21:2⑴ 下列各溶液中与50mL 3mol/L KCl溶液n(Cl-)相同的是 ⑵ 与50mL 3mol/L KCl溶液c(Cl-)相同的是 A. 50mL 1mol/L KCl溶液
B. 150mL 1mol/L KCl溶液
C. 10mL 3mol/L NaCl溶液
D. 50mL 1mol/L AlCl3溶液(BD)(CD)练习6物质的质量 物质的量 物质含粒子数
(m) (n) (N)÷M×M÷NA (V)
气体体积 (S、T、P)×Vm×NA÷Vm物质的量浓度
(c)×V (aq)÷V(aq)如何配制100mL 1mol/L的NaCl溶液主要仪器:容量瓶容量瓶的使用构造:细颈、平底玻璃瓶,瓶口配有磨口玻璃
塞或塑料塞2. 特点:①容量瓶上标有温度和容积
②容量瓶上有刻线而无刻度3. 用途:用来配制一定体积
一定浓度的溶液4. 注意事项:
①使用前要检查是否漏水②溶解或稀释的操作不能在容量瓶中进行③不能长期存放溶液或进行化学反应配制100mL 1mol/L溶液的步骤: ①计算 ②称量③溶解④转移⑤洗涤⑦定容⑧摇匀⑨装瓶贴好标签托盘天平、药匙、滤纸等烧杯、玻璃棒胶头滴管仪器容量瓶冷却5.9 g⑥摇匀⑴称量时左盘高,右盘低⑵称量时称量物放在右盘,而砝码放在左盘1.称量产生误差2. 溶解、转移、洗涤产生误差⑵未洗涤溶解用的玻璃棒和烧杯⑶洗涤液未转入容量瓶中而倒入废液缸中⑴溶解过程中有少量液体溅出烧杯(仰视定容俯视定容溶液体积增大,
浓度变小溶液体积减小,
浓度变大(⑵定容时俯视刻度⑶定容时液面低于刻度线⑷未等溶液冷却就定容
⑴定容时仰视刻度⑸定容后发现液面高于刻度线后,用滴管吸出少量溶液3.定容误差⑹摇匀后发现液面低于刻度再加水误差分析练习
1.天平的砝码上占有其他物质或已锈蚀( )
2.试剂与砝码的左右位置搞错( )
3.量取液体溶质时,俯视读数( )
4.定容时俯视刻度线( )
5.所配溶液未冷却至室温即转入容量瓶定容( )偏高可能偏低偏高偏高偏低下列操作对溶液浓度造成的误差是6. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转
入容量瓶( ) 溶解、转移、洗涤时有溶液流出容器外,使溶质
减小( )容量瓶在使用前,用蒸馏水洗净,在瓶内有少
量水残留( )
9. 定匀摇匀后,静止时发现液面低于刻度线,再加
水到刻度线( )
定容时加水过量越过刻度线,又取出部分溶液,
使液面降至刻度线( )
偏低偏低偏低偏低无影响练习1 .用18 mol/L浓硫酸配制 100 mL 1.0mol/L 硫酸,选用哪些实验仪器?
(A)100 mL量筒 (B)托盘天平
(C)玻璃棒 (D)50 mL容量瓶
(E) 10 mL量筒 (F)胶头滴管
(G)50 ml 烧杯 (H) 100 mL容量瓶√√√√√简单计算例1:将5.3gNa2CO3配成250mL溶液,求溶液的物质的量浓度。解:n(Na2CO3) = m (Na2CO3) /M (Na2CO3)
= 5.3g/106g?mol-1 = 0.05molc (Na2CO3) = n (Na2CO3) /V[Na2CO3(aq)] = 0.05mol/0.25L= 0.2mol/L
答:溶液的Na2CO3的物质的量浓度为0.2mol/L。例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?解:n(NaCl) = C(NaCl)·V[NaCl(aq)]
= 1.6mol/L×0.25L = 0.4molm(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g答:需要NaCl的质量为23.4g。例3:某浓硝酸中溶质的质量分数为94%,密度为1.5g/cm3。计算该浓硝酸中HNO3的物质的量浓度。 解:设有1000ml硝酸溶液,则m(HNO3) =ρ[HNO3(aq)]·V[HNO3(aq)]·ω(HNO3)
= 1.5g/cm3×1000cm3×94% =1410g
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1
= 22.4mol
C(HNO3) = 22.4mol/L答:该硝酸中HNO3的物质的量浓度为22.4mol/L
