人教版高中化学必修一课件2.3 《氧化还原反应》课件(共44张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件2.3 《氧化还原反应》课件(共44张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 23:04:49 | ||
图片预览











文档简介
课件44张PPT。第1课时 氧化还原反应zxxkw氧化还原反应的实质和规律。1.能够从化合价变化和电子转移的角度认
识氧化还原反应,并会分析判断。
2.理解氧化还原反应与四种基本反应类型
的关系,能够正确识别化合、分解、置换
反应中的氧化还原反应。一 从化合价的变化认识氧化还原反应zxxkw镁元素的化合价由0价升高到+2价,氢元素的化合价由+1价降到0价 氮元素的化合价由+2价升高到+4价,氧元素的化合价由0价降到-2价 氢元素的化合价由0价升高到+1价,铜元素的化合价由+2价降到0价 不存在元素化合价的变化所以不是氧化还原反应。 二 从电子转移的角度认识氧化还原反应 1.从电子得失角度分析学 科网学 科网三 氧化还原反应与四种基本反应类型的关系 完成练习并核对答案。C DDA B123456123456123456123456123456可以是同一种元素既被氧化又被还原,如Cl2+2OH-=== ClO-+Cl-+H2O置换反应都是氧化还原反应,复分解反应都不是氧化还原反应置换反应都是氧化还原反应,化合反应不一定是氧化还原反应,例如:NH3+HCl===NH4Cl。123456 氧化剂和还原剂 zxxkw氧化性或还原性的强弱。1.能够正确表示氧化还原反应中电子转
移的方向和数目。
2.会判断氧化剂和还原剂,会比较物质
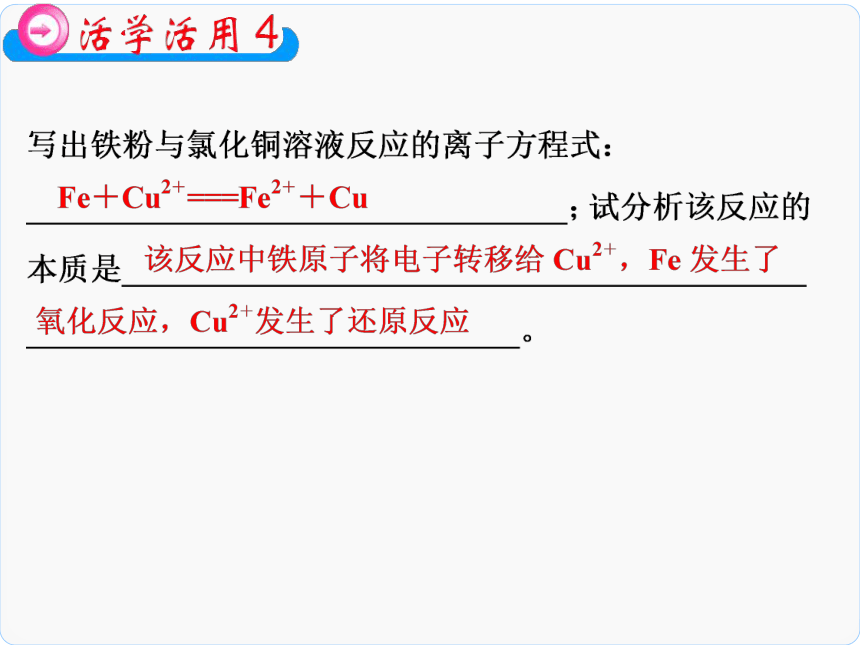
氧化性或还原性的强弱。一 氧化还原反应的表示方法zxxkw二 氧化剂和还原剂1.从电子得失角度分析HCl 因为氢元素的化合价降低,得到电子 Al 因为铝元素的化合价升高,失去电子 6e- SO2中的硫元素Cl2FeFeCl3FeCl3FeCl2KMnO4KMnO4O2 K2MnO4、MnO2KMnO4 KMnO4中的锰元素中的氧元素SO2H2SSSH2S中的硫元素三 物质的氧化性或还原性判断与比较还原氧化 氧化性和还原Fe Cu 还原Fe>Cu Cu2+Fe2+氧化 Cu2+>Fe2+可简记为:两强生两弱 完成练习并核对答案。B CDA C123456元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子 失电子被氧化,得电子被还原得失电子数不相等123456123456123456+5+4+4+61234560+2+20123456
识氧化还原反应,并会分析判断。
2.理解氧化还原反应与四种基本反应类型
的关系,能够正确识别化合、分解、置换
反应中的氧化还原反应。一 从化合价的变化认识氧化还原反应zxxkw镁元素的化合价由0价升高到+2价,氢元素的化合价由+1价降到0价 氮元素的化合价由+2价升高到+4价,氧元素的化合价由0价降到-2价 氢元素的化合价由0价升高到+1价,铜元素的化合价由+2价降到0价 不存在元素化合价的变化所以不是氧化还原反应。 二 从电子转移的角度认识氧化还原反应 1.从电子得失角度分析学 科网学 科网三 氧化还原反应与四种基本反应类型的关系 完成练习并核对答案。C DDA B123456123456123456123456123456可以是同一种元素既被氧化又被还原,如Cl2+2OH-=== ClO-+Cl-+H2O置换反应都是氧化还原反应,复分解反应都不是氧化还原反应置换反应都是氧化还原反应,化合反应不一定是氧化还原反应,例如:NH3+HCl===NH4Cl。123456 氧化剂和还原剂 zxxkw氧化性或还原性的强弱。1.能够正确表示氧化还原反应中电子转
移的方向和数目。
2.会判断氧化剂和还原剂,会比较物质
氧化性或还原性的强弱。一 氧化还原反应的表示方法zxxkw二 氧化剂和还原剂1.从电子得失角度分析HCl 因为氢元素的化合价降低,得到电子 Al 因为铝元素的化合价升高,失去电子 6e- SO2中的硫元素Cl2FeFeCl3FeCl3FeCl2KMnO4KMnO4O2 K2MnO4、MnO2KMnO4 KMnO4中的锰元素中的氧元素SO2H2SSSH2S中的硫元素三 物质的氧化性或还原性判断与比较还原氧化 氧化性和还原Fe Cu 还原Fe>Cu Cu2+Fe2+氧化 Cu2+>Fe2+可简记为:两强生两弱 完成练习并核对答案。B CDA C123456元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子 失电子被氧化,得电子被还原得失电子数不相等123456123456123456+5+4+4+61234560+2+20123456
