江苏省高邮市三垛中学2024-2025学年高一下学期5月月考 化学复习试题(含答案)
文档属性
| 名称 | 江苏省高邮市三垛中学2024-2025学年高一下学期5月月考 化学复习试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 896.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-28 22:10:33 | ||
图片预览


文档简介
高一年级化学5月月考复习试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.化学的发展促进了科技的进步,科技发展离不开材料的不断更新和优化。下列有关说法正确的是( )
A.医用口罩所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
B. “祝融号”火星车用于储能的正十一烷属于不饱和烃
C. “实践十二号”卫星使用的高性能太阳能电池硅芯片中含有单质硅
D. “神舟十九号”航天员的航天服所使用的合成纤维属于无机非金属材料
2. 下列有关化学用语的表示错误的是( )
A. 苯的空间填充模型: B. 乙醛的结构式:
C. 乙炔的结构简式: D. 乙酸的电子式:
3.化合物X具有抗肿瘤等生物活性,其结构简式如下图。下列有关说法不正确的是( )
A. X 分子中含有 2 种含氧官能团 B.能发生加成、酯化和水解反应
C.能使酸性KMnO4溶液褪色 D. 1 mol X 最多能与 2 mol NaOH 反应
4. 在指定条件下,下列选项所示的物质间转化能实现的是( )
A. B. 稀
C. D.
5. 下列有关有机物的说法正确的是( )
A. 石油的分馏、煤的液化和气化都是物理变化 B. 油脂在酸性条件下水解可生产肥皂
C. 邻二甲苯没有同分异构体 D. 糖类、油脂、蛋白质都是天然高分子化合物
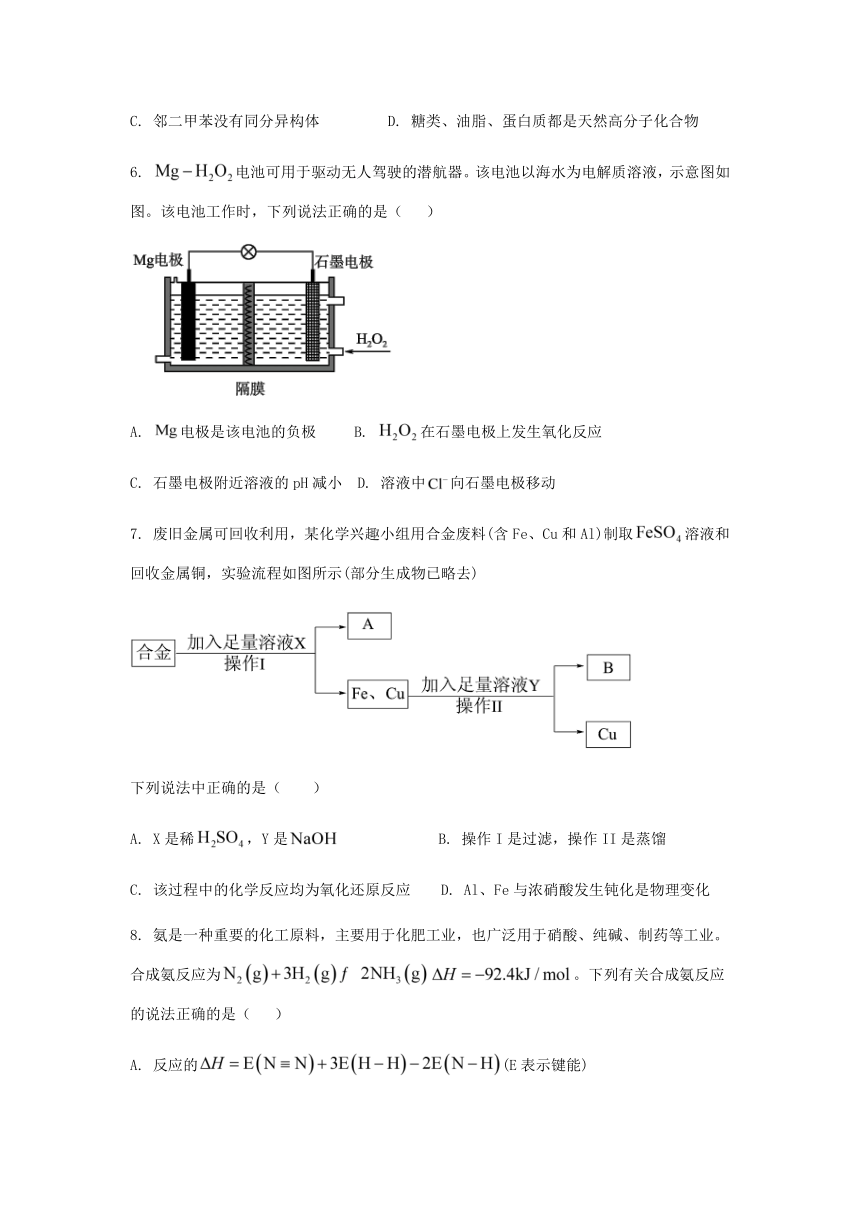
6. 电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
A. 电极是该电池的负极 B. 在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH减小 D. 溶液中向石墨电极移动
7. 废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取溶液和回收金属铜,实验流程如图所示(部分生成物已略去)
下列说法中正确的是( )
A. X是稀,Y是 B. 操作I是过滤,操作II是蒸馏
C. 该过程中的化学反应均为氧化还原反应 D. Al、Fe与浓硝酸发生钝化是物理变化
8. 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。合成氨反应为。下列有关合成氨反应的说法正确的是( )
A. 反应的(E表示键能)
B. 反应中每消耗转移电子的数目约等于
C. 和在一定条件下发生反应放出的热量为92.4kJ
D. 当容器内时反应达到平衡状态
9. 下列说法正确的是( )
A. 红热的C与反应制取水煤气是吸热反应
B. 反应物的总能量低于生成物的总能量时,一定不能发生反应
C. 同温同压下,反应在光照或点燃的条件下的不同
D. 由图可知:
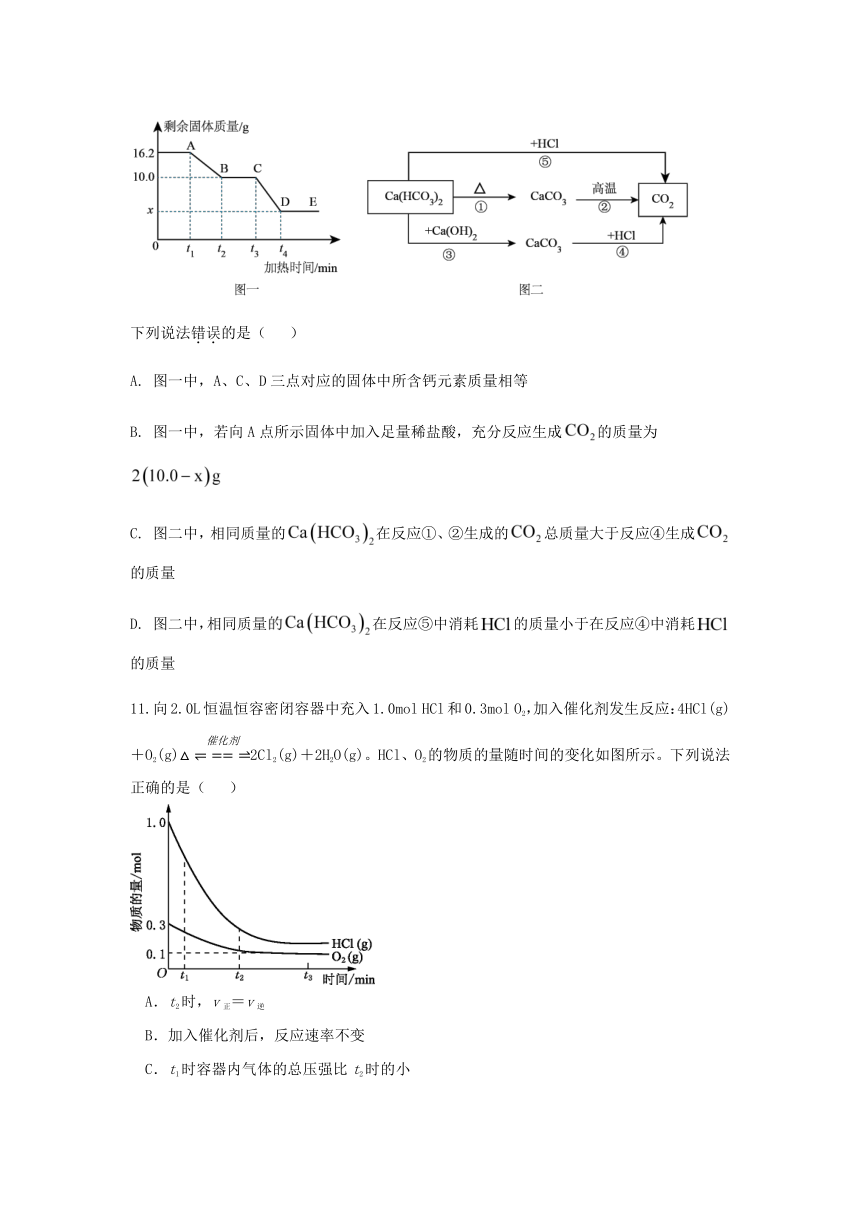
10. 已知碳酸氢钙是一种易溶于水的白色固体,受热易分解。某小组取质量为的碳酸氢钙样品进行加热分解实验,加热过程中剩余固体的质量随加热时间的变化如图一所示。经查阅资料发现,碳酸氢钙能与盐酸反应,也能与石灰水反应。于是,他们构建了由碳酸氢钙转化为二氧化碳的不同路径反应转化关系如图二、
下列说法错误的是( )
A. 图一中,A、C、D三点对应的固体中所含钙元素质量相等
B. 图一中,若向A点所示固体中加入足量稀盐酸,充分反应生成的质量为
C. 图二中,相同质量的在反应①、②生成的总质量大于反应④生成的质量
D. 图二中,相同质量在反应⑤中消耗的质量小于在反应④中消耗的质量
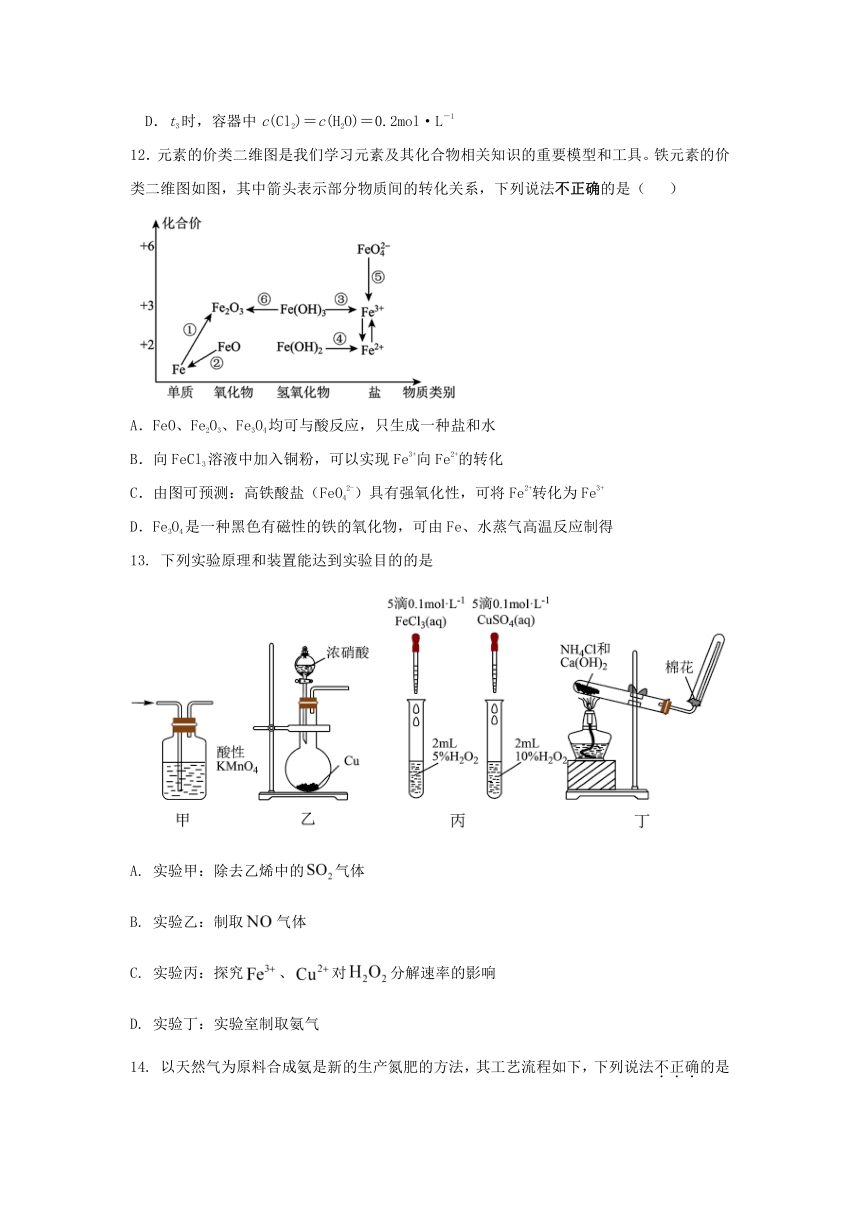
11.向2.0L恒温恒容密闭容器中充入1.0mol HCl和0.3mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。HCl、O2的物质的量随时间的变化如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.加入催化剂后,反应速率不变
C.t1时容器内气体的总压强比t2时的小
D.t3时,容器中c(Cl2)=c(H2O)=0.2mol·L-1
12.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。铁元素的价类二维图如图,其中箭头表示部分物质间的转化关系,下列说法不正确的是( )
A.FeO、Fe2O3、Fe3O4均可与酸反应,只生成一种盐和水
B.向FeCl3溶液中加入铜粉,可以实现Fe3+向Fe2+的转化
C.由图可预测:高铁酸盐(FeO42-)具有强氧化性,可将Fe2+转化为Fe3+
D.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe、水蒸气高温反应制得
13. 下列实验原理和装置能达到实验目的的是
A. 实验甲:除去乙烯中的气体
B. 实验乙:制取气体
C. 实验丙:探究、对分解速率的影响
D. 实验丁:实验室制取氨气
14. 以天然气为原料合成氨是新的生产氮肥的方法,其工艺流程如下,下列说法不正确的是( )
A. 反应①的化学方程式为
B. 反应②是非氧化还原反应
C. 生成至少需要
D. 反应③理论上当时,恰好完全反应
二、非选择题:共4题,共58分。
15.(14分)(1)有机物A的化学式为C4H8O2,A与有机物B、C、D、E有如下关系:
①写出下列有机物的结构简式A: ▲ , C: ▲ 。
②写出B →D的反应方程式: ▲ ;E→A的反应方程式: ▲ 。
(2)苯乙烯是一种重要的有机化工原料。一种生产苯乙烯的流程如下:
已知:CH2==CH—CH3
CH2==CH—CH3CH3CH2CH2Br
①X的结构简式为▲ ,反应①类型为▲ ,反应②的另一种产物为▲ 。
②Y的结构简式为 ▲ 。
16. (16分)研究化学反应原理,对掌握物质的应用有重要的意义。
(1)硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如图所示:
①反应Ⅰ的热化学方程式为____▲_______。
②反应Ⅲ为_____▲______(选填“吸热”或“放热”)反应。
(2)氢氧燃料电池具有清洁高效等优点,简易装置如图所示。
该电池的负极为______▲_____(选填“a”或“b”),电池工作过程中,电子的流向为_______▲____,电池的总反应为____▲_______。
(3)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理:
实验 编号 室温下,试管中所加试剂及其用量/mL 溶液颜色褪至无色所需时间
0.6mol/L 溶液 0.2mol/L 溶液 6mol/L
1 3.0 2.0 3.0 2.0 4.0
2 3.0 3.0 2.0 2.0 5.2
3 3.0 V 1.0 2.0 6.4
①探究实验中,提供6mol/L 的酸是____▲_______(填化学式)。
②实验3中,V=_____▲______。
③根据上表中的实验数据,可以得到的结论是____▲_______。
④利用实验1中数据计算,用的浓度变化表示的平均反应速率:_____▲______。
17. (14分)甲烷既是高效的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)燃烧放出大量的热。
常温下,在中完全燃烧生成和液态水释放出的热量,写出甲烷燃烧的热化学方程式____▲_______。
(2)甲烷—空气质子交换膜燃料电池应用广泛,其结构如图所示。
①a处通入的物质是_____▲______(填化学式),电极的电极反应式为____▲_______。
②若该燃料电池消耗(标准状况下),则理论上电路中转移_____▲______电子。
(3)工业上利用催化重整制。
在恒容密闭容器中发生反应:。
①在不改变物质浓度的条件下,加快该反应速率的措施有_____▲______(答出一点即可)。
②下列叙述中能说明该反应已达平衡状态的有_____▲______(填字母序号)。
A.
B.混合气体的质量不再变化
C.单位时间内生成,同时消耗
D.混合气体的压强不再变化
(4)高温条件下,利用还原的反应过程如图所示。
该反应的催化剂是____▲_______。写出反应ⅱ的化学方程式_____▲______。
17. (14分)含氮化合物(、等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
(1)“纳米零价铁—”体系可将烟气(氮氧化物和)中难溶的氧化为可溶的。在一定温度下,将溶液和溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的氧化。
①催化分解产生、将氧化为的反应机理如图所示,Y的化学式为_____▲______。
②与反应生成的化学方程式为____▲_______。
③纳米零价铁的作用是____▲_______。
④烟气中的也会与反应。一定条件下,将与以体积比2:1置于密闭容器中发生上述反应。
下列能说明反应达到平衡状态的是____▲_______(填正确答案标号)。
A.体系压强保持不变 B.混合气体的颜色保持不变
C.每消耗同时生成 D.和的体积比保持不变
(2)也可以利用电化学手段将其转化为脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是____▲_______。
(3)纳米铁粉可去除水体中的。
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除效率更高,其主要原因是______▲_____。
②控制其他条件不变,用纳米铁粉还原水体中的,测得溶液中含氮物质(、,)浓度随时间变化如图所示。与初始溶液中浓度相比,反应后溶液中所有含氮物质(、,)总浓度减小,原因是____▲_______。
高一年级化学5月月考复习试题参考答案
1 2 3 4 5 6 7
C D D C C A C
8 9 10 11 12 13 14
B A C D A D C
15、(1)①A:CH3COOCH2CH3 C:CH3COONa
②2CH3CH2OH+O22CH3CHO+2H2O
CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
(2)① ,加成反应,HCl ②
16. ①. ②. 吸热 ③. a ④. 由 a 经外电路流向 b ⑤. 2H2 + O2 =2H2O ⑥. H2SO4 ⑦. 4.0 ⑧. KMnO4浓度越大,反应速率越快(或褪色时间越短等合理答案) ⑨. 1.5×10—2 或 0.015
17.(1)
(2) ①. ②. ③. 4
(3) ①. 升高温度或使用催化剂(答出一点即可) ②. CD
(4) ①. ②.
18.(1) ①. FeCl3 ②. 2NO+3H2O2=2HNO3+2H2O ③. 与HCl溶液反应产生Fe2+ ④. BC
(2)
(3) ①. 加少量铜粉时,Fe-Cu-水溶液构成原电池,加速金属铁的反应速率 ②. 可以被Fe还原为N2或者是NO而逸出水体
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意。
1.化学的发展促进了科技的进步,科技发展离不开材料的不断更新和优化。下列有关说法正确的是( )
A.医用口罩所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
B. “祝融号”火星车用于储能的正十一烷属于不饱和烃
C. “实践十二号”卫星使用的高性能太阳能电池硅芯片中含有单质硅
D. “神舟十九号”航天员的航天服所使用的合成纤维属于无机非金属材料
2. 下列有关化学用语的表示错误的是( )
A. 苯的空间填充模型: B. 乙醛的结构式:
C. 乙炔的结构简式: D. 乙酸的电子式:
3.化合物X具有抗肿瘤等生物活性,其结构简式如下图。下列有关说法不正确的是( )
A. X 分子中含有 2 种含氧官能团 B.能发生加成、酯化和水解反应
C.能使酸性KMnO4溶液褪色 D. 1 mol X 最多能与 2 mol NaOH 反应
4. 在指定条件下,下列选项所示的物质间转化能实现的是( )
A. B. 稀
C. D.
5. 下列有关有机物的说法正确的是( )
A. 石油的分馏、煤的液化和气化都是物理变化 B. 油脂在酸性条件下水解可生产肥皂
C. 邻二甲苯没有同分异构体 D. 糖类、油脂、蛋白质都是天然高分子化合物
6. 电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
A. 电极是该电池的负极 B. 在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH减小 D. 溶液中向石墨电极移动
7. 废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取溶液和回收金属铜,实验流程如图所示(部分生成物已略去)
下列说法中正确的是( )
A. X是稀,Y是 B. 操作I是过滤,操作II是蒸馏
C. 该过程中的化学反应均为氧化还原反应 D. Al、Fe与浓硝酸发生钝化是物理变化
8. 氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。合成氨反应为。下列有关合成氨反应的说法正确的是( )
A. 反应的(E表示键能)
B. 反应中每消耗转移电子的数目约等于
C. 和在一定条件下发生反应放出的热量为92.4kJ
D. 当容器内时反应达到平衡状态
9. 下列说法正确的是( )
A. 红热的C与反应制取水煤气是吸热反应
B. 反应物的总能量低于生成物的总能量时,一定不能发生反应
C. 同温同压下,反应在光照或点燃的条件下的不同
D. 由图可知:
10. 已知碳酸氢钙是一种易溶于水的白色固体,受热易分解。某小组取质量为的碳酸氢钙样品进行加热分解实验,加热过程中剩余固体的质量随加热时间的变化如图一所示。经查阅资料发现,碳酸氢钙能与盐酸反应,也能与石灰水反应。于是,他们构建了由碳酸氢钙转化为二氧化碳的不同路径反应转化关系如图二、
下列说法错误的是( )
A. 图一中,A、C、D三点对应的固体中所含钙元素质量相等
B. 图一中,若向A点所示固体中加入足量稀盐酸,充分反应生成的质量为
C. 图二中,相同质量的在反应①、②生成的总质量大于反应④生成的质量
D. 图二中,相同质量在反应⑤中消耗的质量小于在反应④中消耗的质量
11.向2.0L恒温恒容密闭容器中充入1.0mol HCl和0.3mol O2,加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。HCl、O2的物质的量随时间的变化如图所示。下列说法正确的是( )
A.t2时,v正=v逆
B.加入催化剂后,反应速率不变
C.t1时容器内气体的总压强比t2时的小
D.t3时,容器中c(Cl2)=c(H2O)=0.2mol·L-1
12.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。铁元素的价类二维图如图,其中箭头表示部分物质间的转化关系,下列说法不正确的是( )
A.FeO、Fe2O3、Fe3O4均可与酸反应,只生成一种盐和水
B.向FeCl3溶液中加入铜粉,可以实现Fe3+向Fe2+的转化
C.由图可预测:高铁酸盐(FeO42-)具有强氧化性,可将Fe2+转化为Fe3+
D.Fe3O4是一种黑色有磁性的铁的氧化物,可由Fe、水蒸气高温反应制得
13. 下列实验原理和装置能达到实验目的的是
A. 实验甲:除去乙烯中的气体
B. 实验乙:制取气体
C. 实验丙:探究、对分解速率的影响
D. 实验丁:实验室制取氨气
14. 以天然气为原料合成氨是新的生产氮肥的方法,其工艺流程如下,下列说法不正确的是( )
A. 反应①的化学方程式为
B. 反应②是非氧化还原反应
C. 生成至少需要
D. 反应③理论上当时,恰好完全反应
二、非选择题:共4题,共58分。
15.(14分)(1)有机物A的化学式为C4H8O2,A与有机物B、C、D、E有如下关系:
①写出下列有机物的结构简式A: ▲ , C: ▲ 。
②写出B →D的反应方程式: ▲ ;E→A的反应方程式: ▲ 。
(2)苯乙烯是一种重要的有机化工原料。一种生产苯乙烯的流程如下:
已知:CH2==CH—CH3
CH2==CH—CH3CH3CH2CH2Br
①X的结构简式为▲ ,反应①类型为▲ ,反应②的另一种产物为▲ 。
②Y的结构简式为 ▲ 。
16. (16分)研究化学反应原理,对掌握物质的应用有重要的意义。
(1)硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如图所示:
①反应Ⅰ的热化学方程式为____▲_______。
②反应Ⅲ为_____▲______(选填“吸热”或“放热”)反应。
(2)氢氧燃料电池具有清洁高效等优点,简易装置如图所示。
该电池的负极为______▲_____(选填“a”或“b”),电池工作过程中,电子的流向为_______▲____,电池的总反应为____▲_______。
(3)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理:
实验 编号 室温下,试管中所加试剂及其用量/mL 溶液颜色褪至无色所需时间
0.6mol/L 溶液 0.2mol/L 溶液 6mol/L
1 3.0 2.0 3.0 2.0 4.0
2 3.0 3.0 2.0 2.0 5.2
3 3.0 V 1.0 2.0 6.4
①探究实验中,提供6mol/L 的酸是____▲_______(填化学式)。
②实验3中,V=_____▲______。
③根据上表中的实验数据,可以得到的结论是____▲_______。
④利用实验1中数据计算,用的浓度变化表示的平均反应速率:_____▲______。
17. (14分)甲烷既是高效的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)燃烧放出大量的热。
常温下,在中完全燃烧生成和液态水释放出的热量,写出甲烷燃烧的热化学方程式____▲_______。
(2)甲烷—空气质子交换膜燃料电池应用广泛,其结构如图所示。
①a处通入的物质是_____▲______(填化学式),电极的电极反应式为____▲_______。
②若该燃料电池消耗(标准状况下),则理论上电路中转移_____▲______电子。
(3)工业上利用催化重整制。
在恒容密闭容器中发生反应:。
①在不改变物质浓度的条件下,加快该反应速率的措施有_____▲______(答出一点即可)。
②下列叙述中能说明该反应已达平衡状态的有_____▲______(填字母序号)。
A.
B.混合气体的质量不再变化
C.单位时间内生成,同时消耗
D.混合气体的压强不再变化
(4)高温条件下,利用还原的反应过程如图所示。
该反应的催化剂是____▲_______。写出反应ⅱ的化学方程式_____▲______。
17. (14分)含氮化合物(、等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
(1)“纳米零价铁—”体系可将烟气(氮氧化物和)中难溶的氧化为可溶的。在一定温度下,将溶液和溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的氧化。
①催化分解产生、将氧化为的反应机理如图所示,Y的化学式为_____▲______。
②与反应生成的化学方程式为____▲_______。
③纳米零价铁的作用是____▲_______。
④烟气中的也会与反应。一定条件下,将与以体积比2:1置于密闭容器中发生上述反应。
下列能说明反应达到平衡状态的是____▲_______(填正确答案标号)。
A.体系压强保持不变 B.混合气体的颜色保持不变
C.每消耗同时生成 D.和的体积比保持不变
(2)也可以利用电化学手段将其转化为脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是____▲_______。
(3)纳米铁粉可去除水体中的。
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除效率更高,其主要原因是______▲_____。
②控制其他条件不变,用纳米铁粉还原水体中的,测得溶液中含氮物质(、,)浓度随时间变化如图所示。与初始溶液中浓度相比,反应后溶液中所有含氮物质(、,)总浓度减小,原因是____▲_______。
高一年级化学5月月考复习试题参考答案
1 2 3 4 5 6 7
C D D C C A C
8 9 10 11 12 13 14
B A C D A D C
15、(1)①A:CH3COOCH2CH3 C:CH3COONa
②2CH3CH2OH+O22CH3CHO+2H2O
CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
(2)① ,加成反应,HCl ②
16. ①. ②. 吸热 ③. a ④. 由 a 经外电路流向 b ⑤. 2H2 + O2 =2H2O ⑥. H2SO4 ⑦. 4.0 ⑧. KMnO4浓度越大,反应速率越快(或褪色时间越短等合理答案) ⑨. 1.5×10—2 或 0.015
17.(1)
(2) ①. ②. ③. 4
(3) ①. 升高温度或使用催化剂(答出一点即可) ②. CD
(4) ①. ②.
18.(1) ①. FeCl3 ②. 2NO+3H2O2=2HNO3+2H2O ③. 与HCl溶液反应产生Fe2+ ④. BC
(2)
(3) ①. 加少量铜粉时,Fe-Cu-水溶液构成原电池,加速金属铁的反应速率 ②. 可以被Fe还原为N2或者是NO而逸出水体
同课章节目录
