高中化学 4.3《硫和氮的氧化物》课件 新人教版必修1(共29张PPT)
文档属性
| 名称 | 高中化学 4.3《硫和氮的氧化物》课件 新人教版必修1(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 23:16:35 | ||
图片预览





文档简介
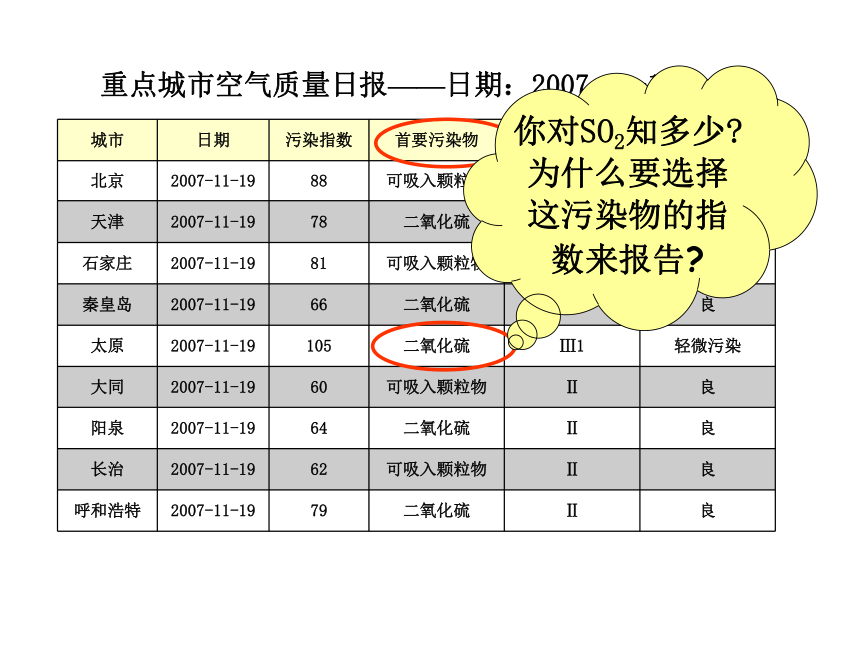
课件29张PPT。化学:4.3《硫和氮的氧化物》课件ppt(人教版必修1)重点城市空气质量日报——日期:2007-11-19
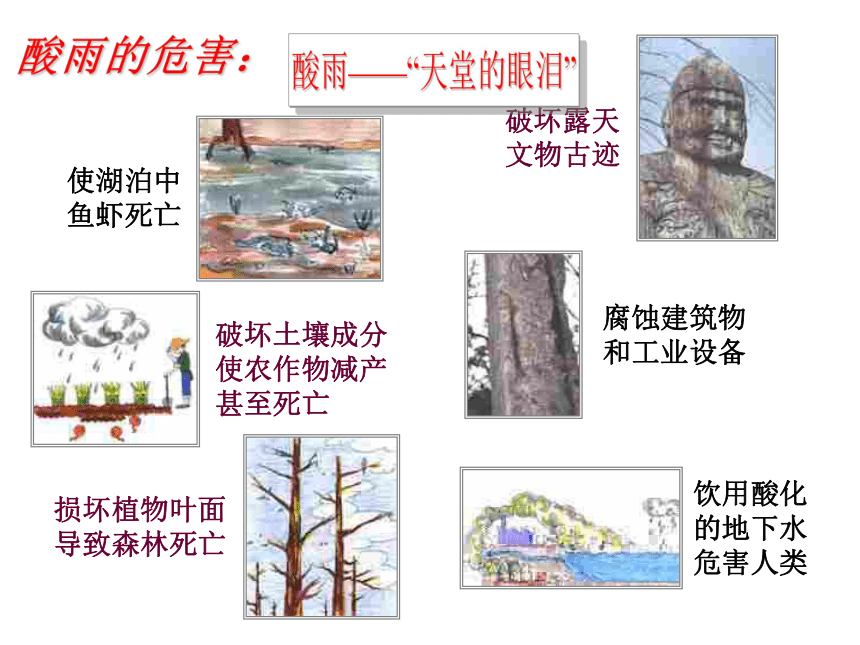
你对SO2知多少? 为什么要选择这污染物的指数来报告? 乐山大佛开凿于唐玄宗开元初年(公元713年),为世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛”是其真实写照,请同学们仔细观察,历经千年时间的流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?破坏土壤成分使农作物减产甚至死亡破坏露天文物古迹使湖泊中鱼虾死亡 酸雨的危害:“黄”银耳是怎样“变”成
“白里透红”的呢? 第三节 硫和氮的氧化物
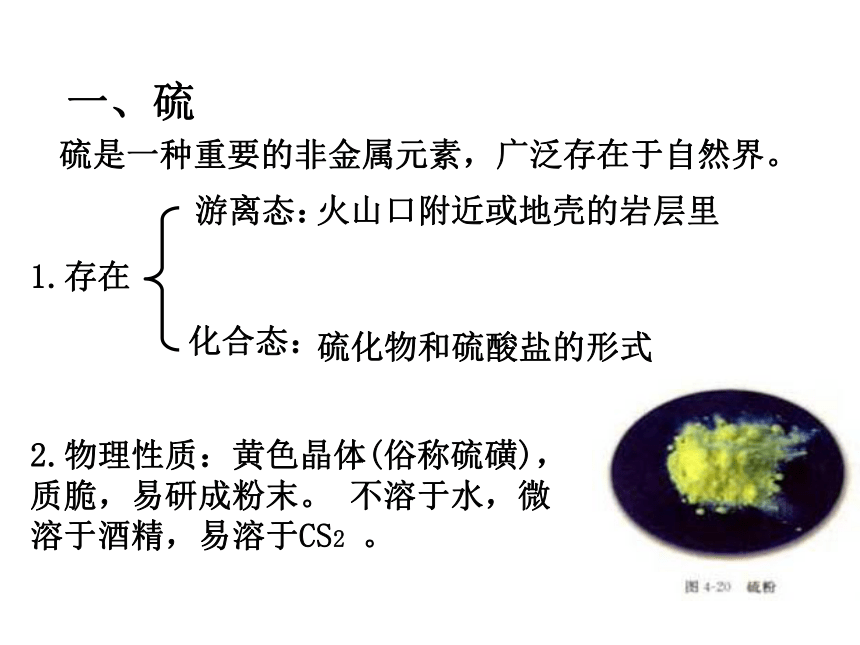
(第1课时)第四章 非金属及其化合物一、硫硫是一种重要的非金属元素,广泛存在于自然界。1.存在游离态:化合态:火山口附近或地壳的岩层里硫化物和硫酸盐的形式2.物理性质:黄色晶体(俗称硫磺),质脆,易研成粉末。 不溶于水,微溶于酒精,易溶于CS2 。3.化学性质:
(1)
S+Fe=FeS 2Cu+S=Cu2S
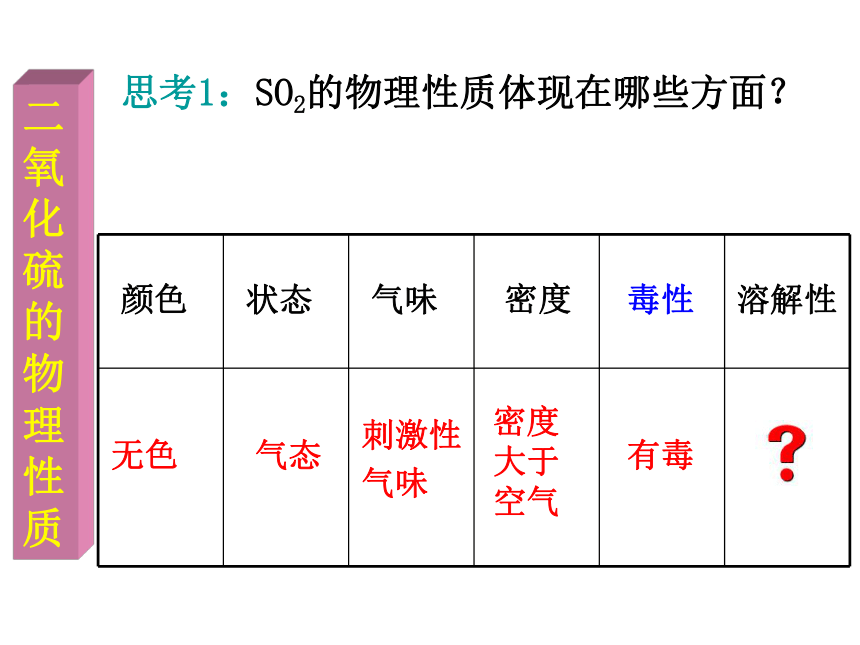
△△既有氧化性又有还原性!(2)还原性实验现象:在氧气中燃烧生成明亮的蓝紫色火焰。氧化性无色气态刺激性
气味密度
大于
空气有毒颜色状态气味密度
毒性溶解性思考1:SO2的物理性质体现在哪些方面?二氧化硫的物理性质探究结论:实验探究1:将集满SO2的试管倒扣在水中,振荡,观察现象并分析。探究现象:试管内液面上升SO2易溶于水二氧化硫的物理性质SO2是一种无色、有刺激性气味、有毒、 比空气重、容易液化、易溶于水的气体。 小结:思考2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?其产物又是什么?能否设计实验验证你的猜测?探究二氧化硫的化学性质探究现象:
溶液呈酸性 PH<7试纸呈红色pH试纸SO2的水溶液实验探究2pH试纸SO2的水溶液二氧化硫的化学性质|酸性氧化物的通性探究结论: SO2溶于水后形成的水溶液显酸性,且体现了酸性氧化物的性质。 SO2具有酸性氧化物通性
——从物质分类的角度SO2与水的反应1
二氧化硫的化学性质|酸性氧化物的通性2NaOH+SO2=Na2SO3 +H2OCaO+SO2=CaSO3Ca(OH)2+SO2=CaSO3 ↓ +H2O(变浑浊)(亚硫酸钙)(亚硫酸钠)【思考3】 SO2与CO2怎样区别?请写出SO2与氧化钙、氢氧化钠、Ca(OH)2溶液反应的化学方程式。? 在相同条件下,既能向正反应进行,同时又能向逆反应方向进行的化学反应。可逆反应:(亚硫酸)*亚硫酸是一种弱酸,不稳定SO2与水的反应判断下列反应哪些不属于可逆反应?√A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
二氧化硫的化学性质|漂白性2、具有漂白性 ——从特性角度品红溶液褪色溶液变回红色SO2有漂白作用被SO2漂白不稳定,容易变回原来的颜色几种具有漂白性物质的性质比较:氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊褪色
二氧化硫溶于水产生的亚硫酸与有色物质直接结合生成不稳定的无色物质
非氧化还原反应(化学变化)暂时性
可漂白某些有色物质,不能使石蕊试液褪色将有色物质的分子吸附在其表面物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子食物可以化妆!不法生产者为了把银耳变白,用硫磺加以薰蒸,满足了消费者银耳越白越好的错误心理,据悉,近日上海市场21种银耳商品进行检查,无一合格。思考4:请同学们标出SO2中S元素的化合价,根据SO2中S元素的化合价推断它应具有怎样的化学性质?还原性氧化性加还原剂如H2S等加氧化剂如O2、Cl2、Br2、KMnO4、HNO3等二氧化硫的化学性质|氧化性还原性探究现象:酸性KMnO4溶液褪色 3、既有氧化性,又有还原性
——从氧化还原角度现象分析:SO2具有还原性,能被酸性KMnO4溶液氧化,而使酸性KMnO4溶液褪色。SO2的水溶液酸性KMnO4溶液实验探究4SO2的水溶液酸性KMnO4溶液现象分析:从SO2中S元素化合价探究可知SO2还应具有 : SO2 + 2H2S =3S↓+ 2H2O二氧化硫的化学性质|氧化性还原性实验探究5:将现制的H2S和SO2气体混合,观察现象。氧化性二氧化硫的化学性质|氧化还原性SO3 + H2O = H2SO4⑵可以漂白纸浆、毛、丝、草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂⑴制造硫酸:二氧化硫的用途△二、三氧化硫的性质1、物理性质:2、化学性质:酸性氧化物的通性
(1)与水的反应
(2)与碱性氧化物反应
(3)与碱反应熔点为16.8℃,沸点为44.8℃,常温下不为气体SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O二氧化硫物理性质无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水化学性质课堂小结1、下列可以用来鉴别SO2 和CO2 的方法是 [ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D2.下列能说明SO2具有漂白作用的是
( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红 B(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
酸漂白还原1
3.SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性D二氧化硫和氯水发生化学反应生成新物质
而HCl 和H2SO4是没有漂白性的,因此漂白性可能消失SO2 + Cl2 + 2H2O = 2HCl + H2SO4课后探究 作业 利用课余时间,考察二氧化硫给地球带来的影响,全面了解二氧化硫的用途和危害。思考我们该如何科学、合理的使用二氧化硫,让这位“空中死神”为人类造福!从生活中来,再回到生活中去。课后书面 作业
报纸谢谢!
你对SO2知多少? 为什么要选择这污染物的指数来报告? 乐山大佛开凿于唐玄宗开元初年(公元713年),为世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛”是其真实写照,请同学们仔细观察,历经千年时间的流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?破坏土壤成分使农作物减产甚至死亡破坏露天文物古迹使湖泊中鱼虾死亡 酸雨的危害:“黄”银耳是怎样“变”成
“白里透红”的呢? 第三节 硫和氮的氧化物
(第1课时)第四章 非金属及其化合物一、硫硫是一种重要的非金属元素,广泛存在于自然界。1.存在游离态:化合态:火山口附近或地壳的岩层里硫化物和硫酸盐的形式2.物理性质:黄色晶体(俗称硫磺),质脆,易研成粉末。 不溶于水,微溶于酒精,易溶于CS2 。3.化学性质:
(1)
S+Fe=FeS 2Cu+S=Cu2S
△△既有氧化性又有还原性!(2)还原性实验现象:在氧气中燃烧生成明亮的蓝紫色火焰。氧化性无色气态刺激性
气味密度
大于
空气有毒颜色状态气味密度
毒性溶解性思考1:SO2的物理性质体现在哪些方面?二氧化硫的物理性质探究结论:实验探究1:将集满SO2的试管倒扣在水中,振荡,观察现象并分析。探究现象:试管内液面上升SO2易溶于水二氧化硫的物理性质SO2是一种无色、有刺激性气味、有毒、 比空气重、容易液化、易溶于水的气体。 小结:思考2:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?其产物又是什么?能否设计实验验证你的猜测?探究二氧化硫的化学性质探究现象:
溶液呈酸性 PH<7试纸呈红色pH试纸SO2的水溶液实验探究2pH试纸SO2的水溶液二氧化硫的化学性质|酸性氧化物的通性探究结论: SO2溶于水后形成的水溶液显酸性,且体现了酸性氧化物的性质。 SO2具有酸性氧化物通性
——从物质分类的角度SO2与水的反应1
二氧化硫的化学性质|酸性氧化物的通性2NaOH+SO2=Na2SO3 +H2OCaO+SO2=CaSO3Ca(OH)2+SO2=CaSO3 ↓ +H2O(变浑浊)(亚硫酸钙)(亚硫酸钠)【思考3】 SO2与CO2怎样区别?请写出SO2与氧化钙、氢氧化钠、Ca(OH)2溶液反应的化学方程式。? 在相同条件下,既能向正反应进行,同时又能向逆反应方向进行的化学反应。可逆反应:(亚硫酸)*亚硫酸是一种弱酸,不稳定SO2与水的反应判断下列反应哪些不属于可逆反应?√A.2NO2 N2O4
B.2H2+O2 2H2O
C.SO2+ H2O H2SO3
D.CO2+ H2O H2CO3
二氧化硫的化学性质|漂白性2、具有漂白性 ——从特性角度品红溶液褪色溶液变回红色SO2有漂白作用被SO2漂白不稳定,容易变回原来的颜色几种具有漂白性物质的性质比较:氯水中的次氯酸将有色物质氧化成无色物质
氧化还原反应
(化学变化)
永久性
可漂白大多数有色物质,能使紫色石蕊褪色
二氧化硫溶于水产生的亚硫酸与有色物质直接结合生成不稳定的无色物质
非氧化还原反应(化学变化)暂时性
可漂白某些有色物质,不能使石蕊试液褪色将有色物质的分子吸附在其表面物理吸附
(物理变化)
暂时性
可吸附某些有色物质的分子食物可以化妆!不法生产者为了把银耳变白,用硫磺加以薰蒸,满足了消费者银耳越白越好的错误心理,据悉,近日上海市场21种银耳商品进行检查,无一合格。思考4:请同学们标出SO2中S元素的化合价,根据SO2中S元素的化合价推断它应具有怎样的化学性质?还原性氧化性加还原剂如H2S等加氧化剂如O2、Cl2、Br2、KMnO4、HNO3等二氧化硫的化学性质|氧化性还原性探究现象:酸性KMnO4溶液褪色 3、既有氧化性,又有还原性
——从氧化还原角度现象分析:SO2具有还原性,能被酸性KMnO4溶液氧化,而使酸性KMnO4溶液褪色。SO2的水溶液酸性KMnO4溶液实验探究4SO2的水溶液酸性KMnO4溶液现象分析:从SO2中S元素化合价探究可知SO2还应具有 : SO2 + 2H2S =3S↓+ 2H2O二氧化硫的化学性质|氧化性还原性实验探究5:将现制的H2S和SO2气体混合,观察现象。氧化性二氧化硫的化学性质|氧化还原性SO3 + H2O = H2SO4⑵可以漂白纸浆、毛、丝、草编制品等
⑶杀灭霉菌和细菌
⑷作食物和干果的防腐剂⑴制造硫酸:二氧化硫的用途△二、三氧化硫的性质1、物理性质:2、化学性质:酸性氧化物的通性
(1)与水的反应
(2)与碱性氧化物反应
(3)与碱反应熔点为16.8℃,沸点为44.8℃,常温下不为气体SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O二氧化硫物理性质无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水化学性质课堂小结1、下列可以用来鉴别SO2 和CO2 的方法是 [ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D2.下列能说明SO2具有漂白作用的是
( )
A.SO2能使酸性高锰酸钾褪色
B.SO2能使品红溶液褪色
C.SO2能溴水褪色
D.SO2难使品红试液变红 B(1)SO2使滴有酚酞的NaOH溶液红色褪去,
SO2体现 性;
(2) SO2使品红褪色,SO2体现 性;
(3) SO2使溴水褪色,SO2体现 性。
酸漂白还原1
3.SO2具有漂白性,氯水有漂白性,如果混在一起,有漂白性吗?A 、和氯气单独通过时相同
B、和二氧化硫单独通过时相同
C、是二者作用效果之和
D、可能失去漂白性D二氧化硫和氯水发生化学反应生成新物质
而HCl 和H2SO4是没有漂白性的,因此漂白性可能消失SO2 + Cl2 + 2H2O = 2HCl + H2SO4课后探究 作业 利用课余时间,考察二氧化硫给地球带来的影响,全面了解二氧化硫的用途和危害。思考我们该如何科学、合理的使用二氧化硫,让这位“空中死神”为人类造福!从生活中来,再回到生活中去。课后书面 作业
报纸谢谢!
