人教版高中化学必修二课件 1.2《元素周期律》课件(共24张PPT)
文档属性
| 名称 | 人教版高中化学必修二课件 1.2《元素周期律》课件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1004.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 23:22:12 | ||
图片预览






文档简介
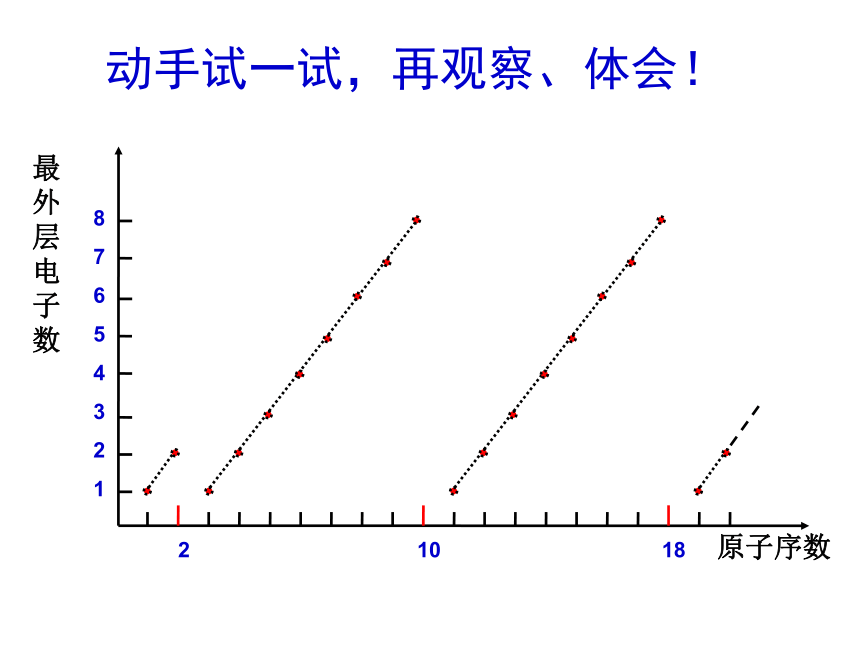
课件24张PPT。第一章 物质结构 元素周期律第二节 元素周期律第2课时 元素周期律写出1-4周期主族元素核外电子排布。动手与思考? 随原子序数递增,核外电子排布有什么变化规律?主族元素核外电子排布过 渡 元 素 2 10 18原子序数最外层电子数8
7
6
5
4
3
2
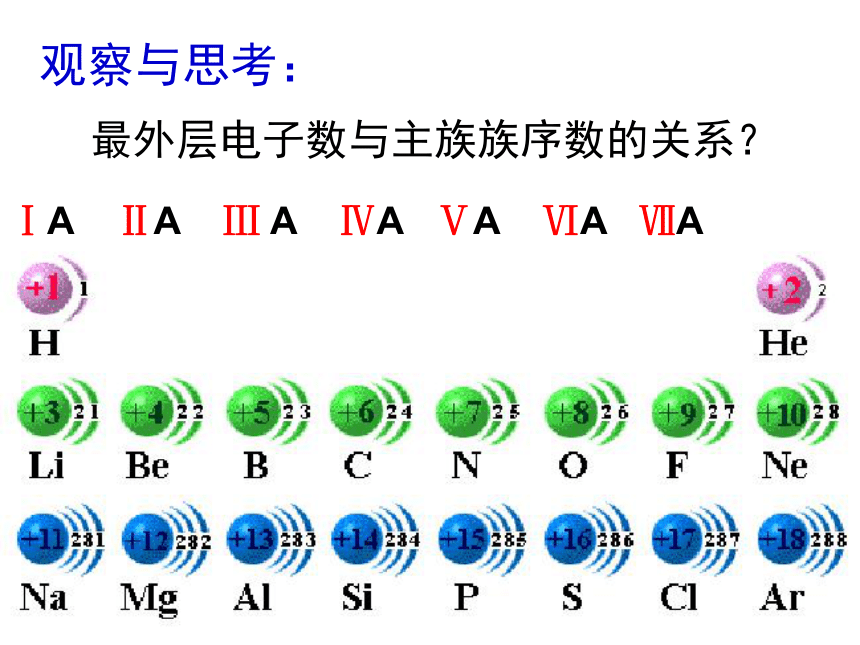
1动手试一试,再观察、体会!ⅠA ⅡA Ⅲ A ⅣA ⅤA ⅥA ⅦA 观察与思考:最外层电子数与主族族序数的关系?学生小结1:随着原子序数的递增,电子层数依次 ,最外层电子数呈 性变化。且最外层电子数等于 。增多周期 族序数 +1 +2 +3 +4 +5 无最高正价 0
-4 -3 -2 -1 +1 +2 +3 +4 +5 +6 +7 0
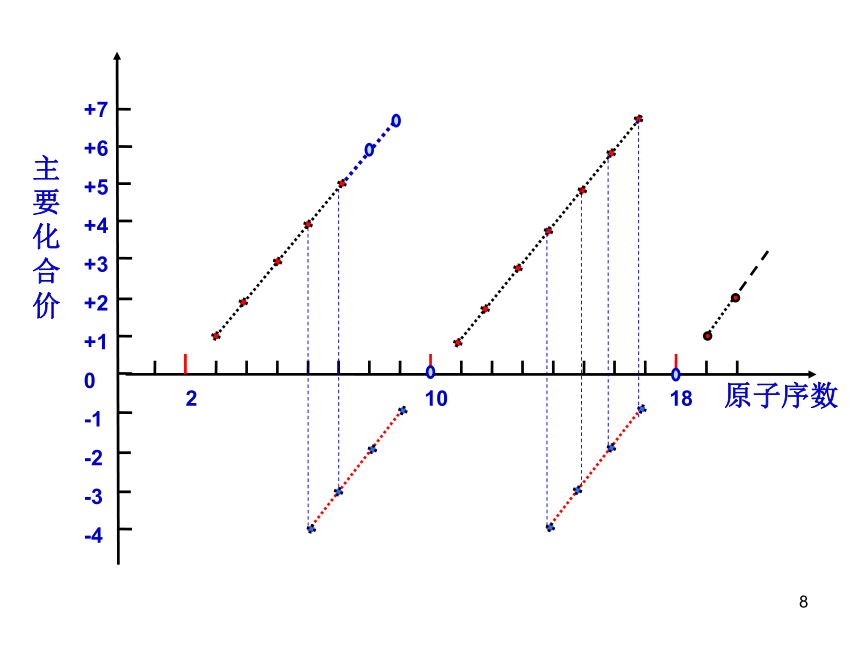
-4 -3 -2 -13~18号元素主要化合价原子序数 3 4 5 6 7 8 9 10 元素名称 锂 铍 硼 碳 氮 氧 氟 氖 原子序数 11 12 13 14 15 16 17 18 元素名称 钠 镁 铝 硅 磷 硫 氯 氩 主要化合价最外层电子数 1 2 3 4 5 6 7 8主要化合价最外层电子数 1 2 3 4 5 6 7 8观察与思考:1 2 10 18原子序数主要化合价+7
+6
+5
+4
+3
+2
+1
0
-1
-2
-3
-41、随着原子序数的递增,最高正价+1~+7(氟、氧无最高正价),最低负价-4~ -1。2、最高正价与最低负价的绝对值之和等于8。3、最高正价=主族序数=最外层电子数 随着原子序数的递增,主族元素的主要化合价呈周期性变化。学生小结2:收获体验: 你能解释氢、氧、氯、硫、钠、镁、铝、等常见元素的化合价吗?思考题:某元素的气态氢化物的符合通式RH4,
且氢的质量分数为25%则R的最高价氧化物
的化学式是 ( )
A. CO B. CO2 C. MgO D. SO2B1主族元素原子半径大小示意图思考:随着原子序数的递增,主族元素的原子半径有什么变化规律?1观察体验:随着原子序数的递增,主族元素的原子半径呈周期性变化。学生小结3:思考、讨论:为什么同周期元素的原子半径随原子序数的增大而减小?电子层数与核电荷数,哪个因素对原子半径的影响更大呢?你能在教材中找到相关的数据证明吗? 电子层数相同时:核电荷数增大,原子核对每一个电子的吸引力增大,电子离核更近,导致原子半径减小。讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl1练习1:比较Na与Na+的半径大小 答案:半径 Na > Na+1决定原子半径的主要因素是电子层数,次要因素是核电荷数,再次才是核外电子数学生小结4:练习1:比较Na与Na+的半径大小Na 答案:半径 Na > Na+11. 比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+练习2:1写出下列微粒的半径由大到小的顺序:
F-、Cl-、Na+、Mg2+练习3:答案:半径: Cl- > F- > Na+ > Mg2+1思考讨论: 元素的金属性和非金属性与元素原子的最外层电子数有关,同时还与原子半径有关。综合上述所学知识,你认为元素的金属性和非金属性随原子序数的递增会有什么变化规律?
最外层电子数越小,原子半径越大,金属性越 。
最外层电子数越大,原子半径越小,金属性越 。学生小结:随着原子序数的递增,元素的金属性与非金属性也呈周期性变化。学生总结:什么是元素周期律?
元素周期律的内容有哪些?
导致元素周期律的本质是什么?结构 性质
量变 质变
7
6
5
4
3
2
1动手试一试,再观察、体会!ⅠA ⅡA Ⅲ A ⅣA ⅤA ⅥA ⅦA 观察与思考:最外层电子数与主族族序数的关系?学生小结1:随着原子序数的递增,电子层数依次 ,最外层电子数呈 性变化。且最外层电子数等于 。增多周期 族序数 +1 +2 +3 +4 +5 无最高正价 0
-4 -3 -2 -1 +1 +2 +3 +4 +5 +6 +7 0
-4 -3 -2 -13~18号元素主要化合价原子序数 3 4 5 6 7 8 9 10 元素名称 锂 铍 硼 碳 氮 氧 氟 氖 原子序数 11 12 13 14 15 16 17 18 元素名称 钠 镁 铝 硅 磷 硫 氯 氩 主要化合价最外层电子数 1 2 3 4 5 6 7 8主要化合价最外层电子数 1 2 3 4 5 6 7 8观察与思考:1 2 10 18原子序数主要化合价+7
+6
+5
+4
+3
+2
+1
0
-1
-2
-3
-41、随着原子序数的递增,最高正价+1~+7(氟、氧无最高正价),最低负价-4~ -1。2、最高正价与最低负价的绝对值之和等于8。3、最高正价=主族序数=最外层电子数 随着原子序数的递增,主族元素的主要化合价呈周期性变化。学生小结2:收获体验: 你能解释氢、氧、氯、硫、钠、镁、铝、等常见元素的化合价吗?思考题:某元素的气态氢化物的符合通式RH4,
且氢的质量分数为25%则R的最高价氧化物
的化学式是 ( )
A. CO B. CO2 C. MgO D. SO2B1主族元素原子半径大小示意图思考:随着原子序数的递增,主族元素的原子半径有什么变化规律?1观察体验:随着原子序数的递增,主族元素的原子半径呈周期性变化。学生小结3:思考、讨论:为什么同周期元素的原子半径随原子序数的增大而减小?电子层数与核电荷数,哪个因素对原子半径的影响更大呢?你能在教材中找到相关的数据证明吗? 电子层数相同时:核电荷数增大,原子核对每一个电子的吸引力增大,电子离核更近,导致原子半径减小。讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl1练习1:比较Na与Na+的半径大小 答案:半径 Na > Na+1决定原子半径的主要因素是电子层数,次要因素是核电荷数,再次才是核外电子数学生小结4:练习1:比较Na与Na+的半径大小Na 答案:半径 Na > Na+11. 比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+练习2:1写出下列微粒的半径由大到小的顺序:
F-、Cl-、Na+、Mg2+练习3:答案:半径: Cl- > F- > Na+ > Mg2+1思考讨论: 元素的金属性和非金属性与元素原子的最外层电子数有关,同时还与原子半径有关。综合上述所学知识,你认为元素的金属性和非金属性随原子序数的递增会有什么变化规律?
最外层电子数越小,原子半径越大,金属性越 。
最外层电子数越大,原子半径越小,金属性越 。学生小结:随着原子序数的递增,元素的金属性与非金属性也呈周期性变化。学生总结:什么是元素周期律?
元素周期律的内容有哪些?
导致元素周期律的本质是什么?结构 性质
量变 质变
