人教版高中化学必修二课件2.2:化学能与电能(第1课时)(共18张PPT)
文档属性
| 名称 | 人教版高中化学必修二课件2.2:化学能与电能(第1课时)(共18张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 816.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-15 00:00:00 | ||
图片预览







文档简介
课件18张PPT。化学能与电能(第一课时)知识结构:化学能转化为电能
发展中的化学电源新课引入: “人体”电池之谜实验仪器:
电流表、铜片、锌片、导线想一想:为什么?实验步骤:
1、分别将锌片和铜片连接到电流表的两个接线柱上。
2、请每组的一名同学伸出双手,哈气,然后两只手分别紧握住锌片和铜片,观察电流表的指针有何变化?
3、两名同学分别伸出一只手,哈气,分别紧握住锌片和铜片,观察电流表的指针有无偏转。新课引入: “人体”电池之谜一、原电池的工作原理实验内容:
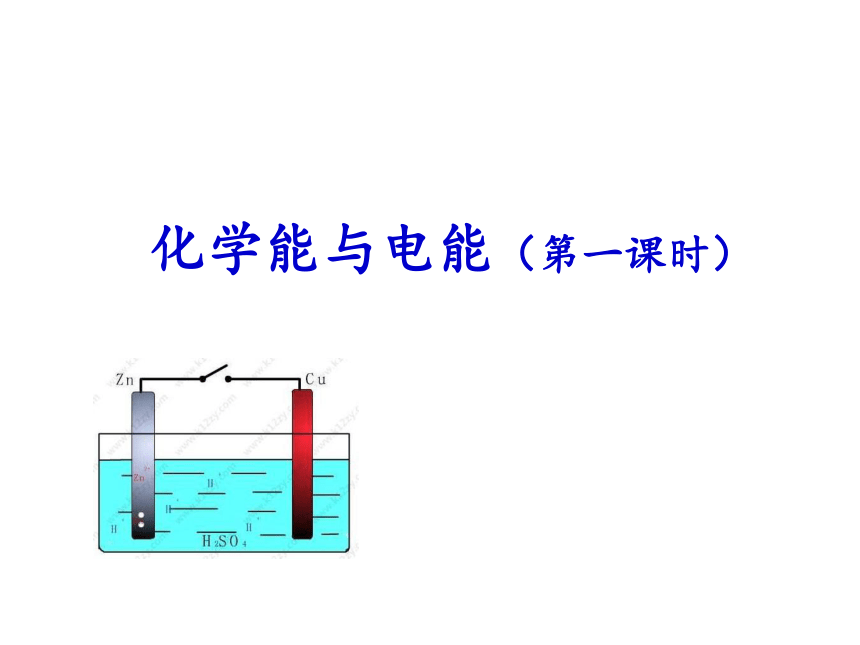
①将Cu片、Zn片平行插入稀硫酸中,不接触;
②将Cu片、Zn片用导线连接起来, 平行插入稀硫酸中;
③在Cu片、Zn片导线之间接入一个电流表,再平行插入稀硫酸中。原电池的工作原理探究一、原电池的工作原理原电池的工作原理探究问题:
(1)在实验①中,发生了什么反应?溶液中的H+在哪块金属上得到电子被还原生成氢气?
(2)在实验②中的铜片上是否有现象?铜的金属活动性在氢后面,为何在铜的表面有氢气放出呢?实验③中电流表的指针有何变化?导线起什么作用?Zn + 2H+ = Zn2+ + H2↑ 讨论:在实验① 和②中发生的化学反应是相同的:实验①中,氢气在锌片上放出;锌片上发生氧化反应: Zn - 2e- = Zn2+
锌片上发生还原反应: 2H+ + 2e- = H2↑实验②中,铜片上有氢气放出。锌片上发生氧化反应: Zn - 2e- = Zn2+
铜片上发生还原反应: 2H+ + 2e- = H2↑现象不同:结论: 实验②中电子由锌片流出,经导线,流入到铜片上,在一定条件下形成电流,构成原电池。原电池反应的本质:原电池是将化学能转化为电能的装置。 正极 负极电流流向电子流向 负极:电子流出的一极
正极:电子流入的一极二、原电池正负极的判断发生氧化反应
发生还原反应负极 正极负极 正极正极 负极 判断下列装置是否构成了原电池,如果是,请指出正负极。思考与练习:三、原电池的构成条件根据原电池的工作原理,总结原电池的构成条件:设想:
① 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。原电池的构成条件探究实验要求:通过对比实验对以上设想加以验证。
操作建议:
①用橘子代替稀硫酸溶液;
②小组分工合作完成;
③设计表格来对比分析实验结果。
表格示例:① 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。设想:原电池的构成条件:
①有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。结论:两极一液一连线问题回顾:“人体”电池揭秘:当一名同学用双手紧握住铜片和锌片时:
手上有少量电解质,哈气形成电解质溶液。锌失去电子发生氧化反应:
2Zn - 4e- = 2Zn2+
铜片上发生还原反应:
O2 + 2H2O + 4e- = 4OH-
人体相当于电解质溶液,起到导电的作用,构成原电池。
当两名同学分别用一只手握住铜片和锌片时:
没有形成闭合的回路,无法构成原电池。 制作水果电池,并实验其能不能使音乐贺卡工作,若不能或效果不理想,分析原因,找出解决方案。拓展实验:作业:书面作业:课后习题 1、2实践作业:①回家收集废干电池,并拆开弄清它的构
造及原理。
②查阅资料,收集常用化学电池的种类、名
称、形状、电极、电解质、电压、能否再
充电、……,整理成文。谢谢大家!
发展中的化学电源新课引入: “人体”电池之谜实验仪器:
电流表、铜片、锌片、导线想一想:为什么?实验步骤:
1、分别将锌片和铜片连接到电流表的两个接线柱上。
2、请每组的一名同学伸出双手,哈气,然后两只手分别紧握住锌片和铜片,观察电流表的指针有何变化?
3、两名同学分别伸出一只手,哈气,分别紧握住锌片和铜片,观察电流表的指针有无偏转。新课引入: “人体”电池之谜一、原电池的工作原理实验内容:
①将Cu片、Zn片平行插入稀硫酸中,不接触;
②将Cu片、Zn片用导线连接起来, 平行插入稀硫酸中;
③在Cu片、Zn片导线之间接入一个电流表,再平行插入稀硫酸中。原电池的工作原理探究一、原电池的工作原理原电池的工作原理探究问题:
(1)在实验①中,发生了什么反应?溶液中的H+在哪块金属上得到电子被还原生成氢气?
(2)在实验②中的铜片上是否有现象?铜的金属活动性在氢后面,为何在铜的表面有氢气放出呢?实验③中电流表的指针有何变化?导线起什么作用?Zn + 2H+ = Zn2+ + H2↑ 讨论:在实验① 和②中发生的化学反应是相同的:实验①中,氢气在锌片上放出;锌片上发生氧化反应: Zn - 2e- = Zn2+
锌片上发生还原反应: 2H+ + 2e- = H2↑实验②中,铜片上有氢气放出。锌片上发生氧化反应: Zn - 2e- = Zn2+
铜片上发生还原反应: 2H+ + 2e- = H2↑现象不同:结论: 实验②中电子由锌片流出,经导线,流入到铜片上,在一定条件下形成电流,构成原电池。原电池反应的本质:原电池是将化学能转化为电能的装置。 正极 负极电流流向电子流向 负极:电子流出的一极
正极:电子流入的一极二、原电池正负极的判断发生氧化反应
发生还原反应负极 正极负极 正极正极 负极 判断下列装置是否构成了原电池,如果是,请指出正负极。思考与练习:三、原电池的构成条件根据原电池的工作原理,总结原电池的构成条件:设想:
① 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。原电池的构成条件探究实验要求:通过对比实验对以上设想加以验证。
操作建议:
①用橘子代替稀硫酸溶液;
②小组分工合作完成;
③设计表格来对比分析实验结果。
表格示例:① 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。设想:原电池的构成条件:
①有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
② 两极材料均插入电解质溶液中。
③ 两极相连形成闭合回路。结论:两极一液一连线问题回顾:“人体”电池揭秘:当一名同学用双手紧握住铜片和锌片时:
手上有少量电解质,哈气形成电解质溶液。锌失去电子发生氧化反应:
2Zn - 4e- = 2Zn2+
铜片上发生还原反应:
O2 + 2H2O + 4e- = 4OH-
人体相当于电解质溶液,起到导电的作用,构成原电池。
当两名同学分别用一只手握住铜片和锌片时:
没有形成闭合的回路,无法构成原电池。 制作水果电池,并实验其能不能使音乐贺卡工作,若不能或效果不理想,分析原因,找出解决方案。拓展实验:作业:书面作业:课后习题 1、2实践作业:①回家收集废干电池,并拆开弄清它的构
造及原理。
②查阅资料,收集常用化学电池的种类、名
称、形状、电极、电解质、电压、能否再
充电、……,整理成文。谢谢大家!
