安徽省蚌埠市A层高中2024-2025学年高一下学期第六次联考(5月期中)化学试卷(含答案)
文档属性
| 名称 | 安徽省蚌埠市A层高中2024-2025学年高一下学期第六次联考(5月期中)化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 355.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-29 11:46:59 | ||
图片预览




文档简介
2024-2025学年第二学期蚌埠市A 层高中第六次联考 高一化学试卷
考试时间:75分钟 满分:100分
注意事项:
1. 答题前填写好自己的姓名、班级、考号等信息
2. 请将答案正确填写在答题卡上
可能用到的相对原子质量: H:1 C:120:16
一 、选择题(本题共14小题,每小题3分,共42分。每小题只有一个正确答 案,请把正确答案涂在答题卡上。)
1.化学与生产、生活、社会密切相关。下列有关说法中正确的是
A. 煤的气化是物理变化,是高效、清洁地利用煤资源的重要途径 B.SO 可用于丝织品漂白,是由于其能氧化丝织品中有色成分
C. 漂白粉与盐酸可混合使用,以提高消毒效果
D. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
2.下列有关化学用语表示不正确的是
A.HClO 的结构式: H-0-Cl
B. 乙烯分子的结构简式为:CH =CH
C. 考古时用于测定文物年代的碳核素:
D. 用电子式表示Na S 的形成过程:
3.设NA 为阿伏伽德罗常数的值。下列说法正确的是
A.0.5 mol 乙酸分子中含C-H 键数目为1.5NA
B.100g 质量分数为46%的乙醇溶液中含氧原子数目为NA
C. 标准状况下,0.5 mol CH Cl 体积为11.2L
D. 标准状况下,22.4 LHCl 气体中H+ 数目为NA
4.下列离子方程式正确的是
A. 用氢氟酸刻蚀玻璃: SiO3+4F+6H+=SiF ↑+3H O
B.NaC1O 溶液中通入少量SO :C1O-+SO +H O=SO +Cl +2H+
C. 粗盐提纯过程中除去Ca +和Mg +的反应:
Ca ++CO -=CaCO ↓; Mg ++2OH=Mg(OH) ↓
D. 用CuSO 溶液除H S气体: Cu ++S -=Cus↓
第 1 页 共 8 页
5.下图为N 分子在催化剂的作用下发生一系列转化示意图,下列叙述错误的是
A. 反应①属于氮的固定;反应②是工业上合成HNO 过程中的某一步
B. 在催化剂a、b 的作用下,化学反应速率和平衡转化率提高了
C. 反应②的总化学方程式可表示为:
D. 反应①和②均有极性共价键形成
6.X、Y、Z、W、R 五种短周期主族元素在元素周期表中的位置如图所示,下列
(
A. 原子半径大小顺序:
Z>W>Y
B.X、Y
的气态氢化物的稳定性: X>Y
C.Z 位于第三周期第
VA
族
D.W、R
氧化物对应水化物的酸性: R>W
)说法中正确的是
X Y
Z W R
7.离子化合物Na O 和CaH 与水的反应分别为①2Na O +2H O=4NaOH+O ↑;
②CaH +2H O=Ca(OH) +2H ↑ 。 下列说法正确的是
A.Na O 、CaH 中均有非极性共价键
B.① 和②中水均发生氧化反应
C.Na O 中阴、阳离子个数比为1:2,CaH 中阴、阳离子个数比为2:1
D. 当反应①和②中转移的电子数相同时,产生的O 和H 的物质的量相同
8.氮是一种非常重要的非金属元素。下列有关说法正确的是
A. 土壤中的硝酸盐被细菌分解转化为N 的过程属于生物固氮
B. “雷雨发庄稼”涉及的物质转化过程为: 硝酸盐
C. 用 稀HNO 处理试管内壁附着的银:3 Ag+4H++NO =3Ag++NO ↑+ 2H O
D. 实验室常用直接加热氯化铵的方法来制取氨气
第 2 页 共 8 页
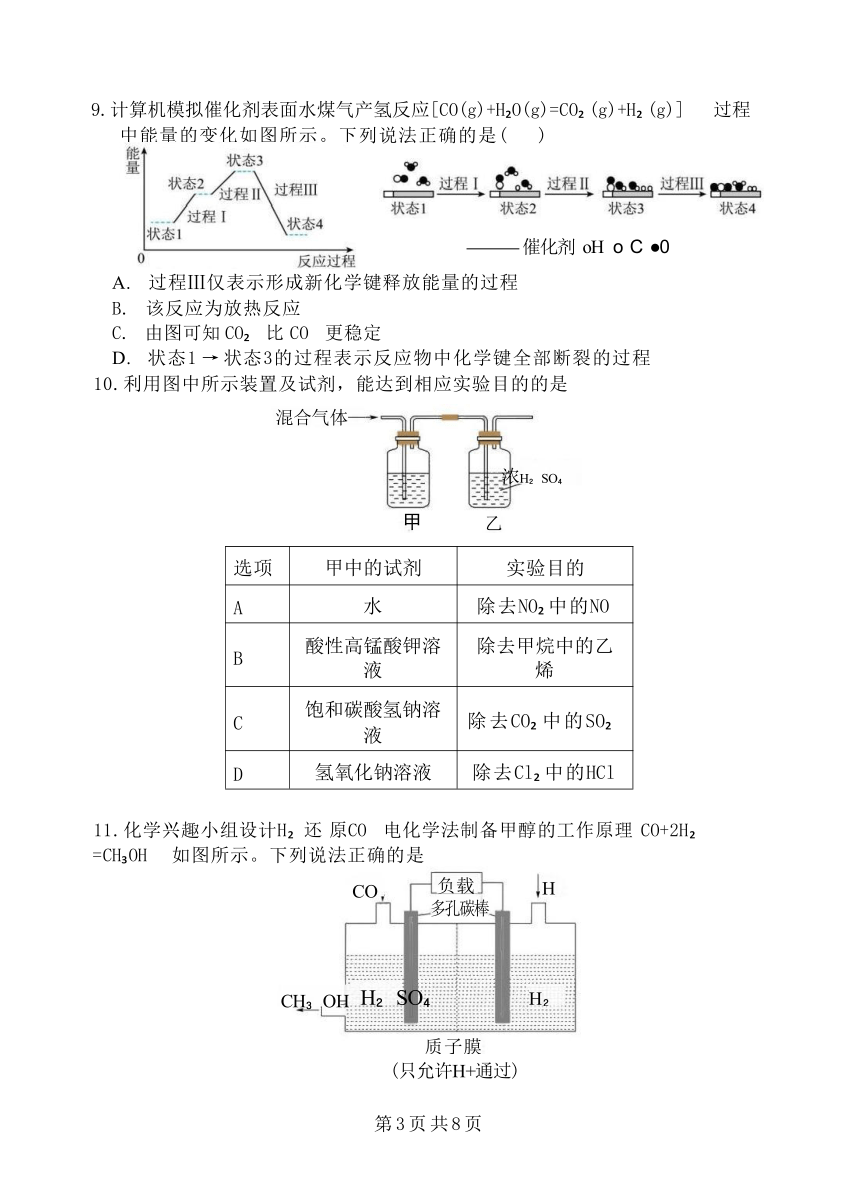
9.计算机模拟催化剂表面水煤气产氢反应[CO(g)+H O(g)=CO (g)+H (g)] 过程 中能量的变化如图所示。下列说法正确的是( )
催化剂 oH o C ●0
A. 过程Ⅲ仅表示形成新化学键释放能量的过程
B. 该反应为放热反应
C. 由图可知 CO 比 CO 更稳定
D. 状态1 → 状态3的过程表示反应物中化学键全部断裂的过程
10.利用图中所示装置及试剂,能达到相应实验目的的是
(
混合气体—
浓
H SO
乙
甲
)
选项 甲中的试剂 实验目的
A 水 除去NO 中的NO
B 酸性高锰酸钾溶 液 除去甲烷中的乙 烯
C 饱和碳酸氢钠溶 液 除去CO 中的SO
D 氢氧化钠溶液 除去Cl 中的HCl
11.化学兴趣小组设计H 还 原CO 电化学法制备甲醇的工作原理 CO+2H =CH OH 如图所示。下列说法正确的是
(
CO
CH OH
H SO
质子膜
负载
多孔碳棒
H O
H
)
(只允许H+通过)
第3页共8页
A. 通 入H 的一端是电池的正极
B. 电池工作过程中H+ 通过质子膜向右移动
C. 通 入CO 的一端发生的电极反应为CO-4e+4H+=CH OH
D. 当电路中通过0.4mol 电子时,理论上生成CH OH 的质量为3.2g
12.下列关于有机物的说法正确的是
A. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B. 羟基的电子式:
C. 乙酸和乙醇可以用碳酸氢钠溶液鉴别
D. 仅用水可鉴别苯、乙酸乙酯、乙醇三种无色液体
13.一定条件下,将3 molA 气 体 和 1mol B气体混合于固定容积为1L 的密闭容 器中,发生反应:3A(g)+B(g) 一 4C(g)+2D(g) 。2min 末该反应达到平衡,生 成 D 的物质的量随时间的变化情况如图所示。下列判断正确的是
(
n/mol
0.8
0
1
2
3
t/min
)
A. 到达平衡时C 的物质的量浓度为1.6 mol ·L-1
B. 反应过程中用A 和 B 表示的反应速率之比为1:1
C. 混合气体的平均相对分子质量随反应进行而增大
D. 从开始到平衡,用D 表示的化学反应速率为0.2 mol ·L- ·min-
14.以某冶金工业产生的废渣(含Cr O 、SiO 、Al O ) 为原料制备K Cr O 的流程 如下图所示。已知水浸后溶液中主要存在的离子是Na+、CrO -、SiO -、
[Al(OH)4]-。
第4页共8页
(
Na CO O
废渣一
煅烧
水
浸
)过量CO
除杂 →Na Cr O
CO AI(OH H SiO
下列说法不正确的是
A. “煅烧”时发生的反应涉及了氧化还原反应
KCl固体
溶液— 反应 K Cr O 固体 溶液
B. 高温“煅烧”时每消耗1mol Cr O 的同时消耗33.6 LO
C. “除杂”时生成氢氧化铝沉淀的离子方程式为:[A1(OH)4]-+CO =HCO + Al(OH) ↓
D. “反应”时发生复分解反应,该反应能发生的原因是该条件下K Cr O 的 溶 解度相对 Na Cr O 和 KCl 较小,导致有K Cr O 沉淀析出
二。非选择题:本题共4小题,共58分。
15. (14分)某化学课题小组利用乙烯利和氢氧化钠反应制备乙烯,并在此基础
上研究乙烯的化学性质,实验装置如下图所示:
相关资料如下:
I.乙烯利的化学式为C H C1O P, 可以和氢氧化钠反应生成乙烯、磷酸钠和氯 化钠
Ⅱ.单质溴易挥发,且和水能发生反应: Br +H O 、 HBr+HBrO ⅢI.溴和溴化氢的沸点及溶解性如下表
名称 Br HBr
常压下沸点 58.8 -86.9
溶解性 水 难溶 易溶
CCl 易溶 难溶
(1)装有碱石灰的仪器名称为 ,碱石灰的作用是 o
(2)实验过程中控制反应快慢的操作为 o
(3)小明同学认为装置B中溶液褪色,可能是因为发生了取代反应,通过验证
(
o
)装置C 中产物即可证明,其检验方法是
(4)小惠同学认为采用图中装置,上述检验方案不合理,你认为原因可能 是 _o
(5)经实验探究证明装置B 中溶液褪色,是因为乙烯和溴发生加成反应所致, 小可同学认为若去掉碱石灰直接将装置A 中产生的气体通入装置B 中,则装 置B 中除生成1,2-二溴乙烷外,可能还有其他有机物生成,其结构简式为 (写出一种即可)
(已知:CH =CH +HBrO→HOCH CH Br)
第5页共8页
(6)乙醇在浓硫酸催化作用下也能制得乙烯,但产生的乙烯中往往混有SO , 若 将混合气体通入溴水中,则不能证明乙烯和溴能发生反应,其原因是 (用 离子方程式说明)。
16. (15分)乱扔废弃电池会造成严重污染。工业上利用废电池中的炭包(包含 碳粉、Fe 、Cu 和 MnO 等物质)进行回收、精制MnO 的大致流程如下图所 示:
(
稀
HNO
空气
H O /
稀
H SO Na CO
溶液
空气
炭包
酸浸 灼烧
粗
MnO →
溶解
沉锰
MnCO →
焙烧
MnO,
产品
废液1
气体X
废液2 气体
Y
)
回答下列问题:
(1)“酸浸”时要先将结块的炭包粉碎,目的 是 。
(2)“酸浸”过程中加入的稀硝酸要过量,目的
是 ;其中Fe 与稀硝酸反应生成NO的离子方 程式为_
(3)“灼烧”的目的是_ _o
(4)“溶解”过程中产生的气体X 是 (填名称), H O 的实际消耗量比理 论值高的可能原因是_ o
(5)沉锰时若溶液pH 过大会产生Mn(OH) 杂质,为提高MnCO 纯度应采 用 (填选项)的方式混合溶液。
A. 将溶解所得溶液缓慢滴入Na CO 溶液中
B.将Na CO 溶液缓慢滴入溶解所得溶液中
(6)“焙烧”过程中发生反应的化学方程式
为
第6页共8页
17. (14分)研究化学反应的原理,对掌握物质的应用有重要的意义。
(
能
量
/
(kJ·mol- )
反应过程
)
甲
I.硅是制作太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如图甲所 示:
(1)反应Ⅲ为 (选填“吸热”或“放热”)反应。
II. 研 究NOx 、SO 、CO 等气体的无害化处理对治理大气污染、建设生态文明 有重要意义。
(2)一定温度下,在恒容的密闭容器中充入1mol CO和2 mol H ,发生反应
CO(g)+2H (g)CH OH(g), 对于该反应,下列说法正确的是 (填选 项)。
A.反应过程中n(CO):n(H ) 不变
B. 升高温度,正反应速率减小
C. 往容器中充入He, 压强增大,反应速率加快
D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡
(3)利用反应2NO(g)+2CO(g) N (g)+2CO (g),可实现汽车尾气的无害化处 理。一定温度下,在容积为2L 的恒容密闭容器中加入等物质的量的NO 和 CO, 测得部分物质的物质的量随时间的变化如图乙所示。
①X 代表的物质是 ;a点正反应速率 逆反应速率(填“>”“<”或 “=”)。
②从反应开始到达平衡时,v(NO)= mol ·L- ·min- ;该条件下,CO 的 平 衡 转 化 率 为 o
第 7 页 共 8 页
第8页共8页
乙
(
SO
M
广
50%H
S
Q
-
—H
O
溶液
质子膜
(只允许
H+
通过)
↓O
N
)
丙
(4)可用电化学原理处理SO 制备硫酸,装置图如图丙所示,电极为多孔材料。写 出M 极的电极反应式: o
18. (15分)药物化学是化学的一个重要领域,回答下列问题:
阿司匹林
I. 药物阿司匹林的结构如上图所示。
(1)阿司匹林的分子式为 o
(2)阿司匹林与乙醇可以发生酯化反应,写出该反应化学方程式: 0
Ⅱ.肉桂酸是制备药物“心痛平”的重要中间体, 一种合成路线如下:
O 丙烯酸 -I 肉桂酸
催化剂,△ CH =CHCOOH 催化剂 CH=CHCOOH
(3)下列物质与A 互为同系物的有 (填序号)。
①苯 ②乙烯 ③戊烷 ④2-丁烯
(4)①B→C 的反应类型为 ;②D 的结构简式为 ;
③A→B 反应的化学方程式为 o
(5)CH =CHCH OH 可以发生的化学反应有 (填选项)。
①氧化反应 ②加成反应 ③取代反应 ④加聚反应 A.①②③ B.①②③④ C.②③④ D.①③④
(6)丙烯酸可通过加聚反应合成水阻垢剂聚丙烯酸,则聚丙烯酸的结构简式为
o
2024-2025学年第二学期A层联考高中第六次联考
高一化学试卷答案
一 .选择题
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D C A C B A C C B C D C A B
二 .非选择题
15. (共14分,每空2分)
(1)(球形)干燥管; 除去乙烯中混有的水蒸气
(2)调节分液漏斗活塞,控制液体的滴加速度
(3)取锥形瓶中少量液体,滴加紫色石蕊试液,观察溶液是否变红,若不变红,说明没 有HBr 生成,没发生取代反应,反之发生取代反应或滴在pH 试纸上观察是否变红。
(其他合理答案也可)
(4)挥发出的Br 和水反应也能生成HBr
(5)HOCH CH Br ( 写CH CH Br 也给分)
(6)Br +SO +2H O=4H++SO -+2Br
16. (共15分,除第(1)问1分,其余每空2分)
(1)增大反应物接触面积,加快反应速率,使反应充分进行(合理即可)
(2)把铁和铜除净; Fe+4H++NO =Fe ++NO↑+2H O;
(3)除去碳粉
( 4 ) 氧 气 MnO 催化H O 分解(合理即可) (5) B
(6) (条件只写高温或焙烧都可以)
17. (共14分,每空2分)
(1)吸热
(2) AD
(3)CO > 0.016 80%
(4)SO -2e+2H O=SO -+4H+
1
18 . (共15分,除(1)问1分外,其余每空2分)
(1)CgH O
(3)②④
(4)①取代反应;
②CH =CHCHO
③CH CH=CH +Cl 2. △→CH =CHCH Cl+HCI
(5) B
(6)
2
考试时间:75分钟 满分:100分
注意事项:
1. 答题前填写好自己的姓名、班级、考号等信息
2. 请将答案正确填写在答题卡上
可能用到的相对原子质量: H:1 C:120:16
一 、选择题(本题共14小题,每小题3分,共42分。每小题只有一个正确答 案,请把正确答案涂在答题卡上。)
1.化学与生产、生活、社会密切相关。下列有关说法中正确的是
A. 煤的气化是物理变化,是高效、清洁地利用煤资源的重要途径 B.SO 可用于丝织品漂白,是由于其能氧化丝织品中有色成分
C. 漂白粉与盐酸可混合使用,以提高消毒效果
D. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
2.下列有关化学用语表示不正确的是
A.HClO 的结构式: H-0-Cl
B. 乙烯分子的结构简式为:CH =CH
C. 考古时用于测定文物年代的碳核素:
D. 用电子式表示Na S 的形成过程:
3.设NA 为阿伏伽德罗常数的值。下列说法正确的是
A.0.5 mol 乙酸分子中含C-H 键数目为1.5NA
B.100g 质量分数为46%的乙醇溶液中含氧原子数目为NA
C. 标准状况下,0.5 mol CH Cl 体积为11.2L
D. 标准状况下,22.4 LHCl 气体中H+ 数目为NA
4.下列离子方程式正确的是
A. 用氢氟酸刻蚀玻璃: SiO3+4F+6H+=SiF ↑+3H O
B.NaC1O 溶液中通入少量SO :C1O-+SO +H O=SO +Cl +2H+
C. 粗盐提纯过程中除去Ca +和Mg +的反应:
Ca ++CO -=CaCO ↓; Mg ++2OH=Mg(OH) ↓
D. 用CuSO 溶液除H S气体: Cu ++S -=Cus↓
第 1 页 共 8 页
5.下图为N 分子在催化剂的作用下发生一系列转化示意图,下列叙述错误的是
A. 反应①属于氮的固定;反应②是工业上合成HNO 过程中的某一步
B. 在催化剂a、b 的作用下,化学反应速率和平衡转化率提高了
C. 反应②的总化学方程式可表示为:
D. 反应①和②均有极性共价键形成
6.X、Y、Z、W、R 五种短周期主族元素在元素周期表中的位置如图所示,下列
(
A. 原子半径大小顺序:
Z>W>Y
B.X、Y
的气态氢化物的稳定性: X>Y
C.Z 位于第三周期第
VA
族
D.W、R
氧化物对应水化物的酸性: R>W
)说法中正确的是
X Y
Z W R
7.离子化合物Na O 和CaH 与水的反应分别为①2Na O +2H O=4NaOH+O ↑;
②CaH +2H O=Ca(OH) +2H ↑ 。 下列说法正确的是
A.Na O 、CaH 中均有非极性共价键
B.① 和②中水均发生氧化反应
C.Na O 中阴、阳离子个数比为1:2,CaH 中阴、阳离子个数比为2:1
D. 当反应①和②中转移的电子数相同时,产生的O 和H 的物质的量相同
8.氮是一种非常重要的非金属元素。下列有关说法正确的是
A. 土壤中的硝酸盐被细菌分解转化为N 的过程属于生物固氮
B. “雷雨发庄稼”涉及的物质转化过程为: 硝酸盐
C. 用 稀HNO 处理试管内壁附着的银:3 Ag+4H++NO =3Ag++NO ↑+ 2H O
D. 实验室常用直接加热氯化铵的方法来制取氨气
第 2 页 共 8 页
9.计算机模拟催化剂表面水煤气产氢反应[CO(g)+H O(g)=CO (g)+H (g)] 过程 中能量的变化如图所示。下列说法正确的是( )
催化剂 oH o C ●0
A. 过程Ⅲ仅表示形成新化学键释放能量的过程
B. 该反应为放热反应
C. 由图可知 CO 比 CO 更稳定
D. 状态1 → 状态3的过程表示反应物中化学键全部断裂的过程
10.利用图中所示装置及试剂,能达到相应实验目的的是
(
混合气体—
浓
H SO
乙
甲
)
选项 甲中的试剂 实验目的
A 水 除去NO 中的NO
B 酸性高锰酸钾溶 液 除去甲烷中的乙 烯
C 饱和碳酸氢钠溶 液 除去CO 中的SO
D 氢氧化钠溶液 除去Cl 中的HCl
11.化学兴趣小组设计H 还 原CO 电化学法制备甲醇的工作原理 CO+2H =CH OH 如图所示。下列说法正确的是
(
CO
CH OH
H SO
质子膜
负载
多孔碳棒
H O
H
)
(只允许H+通过)
第3页共8页
A. 通 入H 的一端是电池的正极
B. 电池工作过程中H+ 通过质子膜向右移动
C. 通 入CO 的一端发生的电极反应为CO-4e+4H+=CH OH
D. 当电路中通过0.4mol 电子时,理论上生成CH OH 的质量为3.2g
12.下列关于有机物的说法正确的是
A. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B. 羟基的电子式:
C. 乙酸和乙醇可以用碳酸氢钠溶液鉴别
D. 仅用水可鉴别苯、乙酸乙酯、乙醇三种无色液体
13.一定条件下,将3 molA 气 体 和 1mol B气体混合于固定容积为1L 的密闭容 器中,发生反应:3A(g)+B(g) 一 4C(g)+2D(g) 。2min 末该反应达到平衡,生 成 D 的物质的量随时间的变化情况如图所示。下列判断正确的是
(
n/mol
0.8
0
1
2
3
t/min
)
A. 到达平衡时C 的物质的量浓度为1.6 mol ·L-1
B. 反应过程中用A 和 B 表示的反应速率之比为1:1
C. 混合气体的平均相对分子质量随反应进行而增大
D. 从开始到平衡,用D 表示的化学反应速率为0.2 mol ·L- ·min-
14.以某冶金工业产生的废渣(含Cr O 、SiO 、Al O ) 为原料制备K Cr O 的流程 如下图所示。已知水浸后溶液中主要存在的离子是Na+、CrO -、SiO -、
[Al(OH)4]-。
第4页共8页
(
Na CO O
废渣一
煅烧
水
浸
)过量CO
除杂 →Na Cr O
CO AI(OH H SiO
下列说法不正确的是
A. “煅烧”时发生的反应涉及了氧化还原反应
KCl固体
溶液— 反应 K Cr O 固体 溶液
B. 高温“煅烧”时每消耗1mol Cr O 的同时消耗33.6 LO
C. “除杂”时生成氢氧化铝沉淀的离子方程式为:[A1(OH)4]-+CO =HCO + Al(OH) ↓
D. “反应”时发生复分解反应,该反应能发生的原因是该条件下K Cr O 的 溶 解度相对 Na Cr O 和 KCl 较小,导致有K Cr O 沉淀析出
二。非选择题:本题共4小题,共58分。
15. (14分)某化学课题小组利用乙烯利和氢氧化钠反应制备乙烯,并在此基础
上研究乙烯的化学性质,实验装置如下图所示:
相关资料如下:
I.乙烯利的化学式为C H C1O P, 可以和氢氧化钠反应生成乙烯、磷酸钠和氯 化钠
Ⅱ.单质溴易挥发,且和水能发生反应: Br +H O 、 HBr+HBrO ⅢI.溴和溴化氢的沸点及溶解性如下表
名称 Br HBr
常压下沸点 58.8 -86.9
溶解性 水 难溶 易溶
CCl 易溶 难溶
(1)装有碱石灰的仪器名称为 ,碱石灰的作用是 o
(2)实验过程中控制反应快慢的操作为 o
(3)小明同学认为装置B中溶液褪色,可能是因为发生了取代反应,通过验证
(
o
)装置C 中产物即可证明,其检验方法是
(4)小惠同学认为采用图中装置,上述检验方案不合理,你认为原因可能 是 _o
(5)经实验探究证明装置B 中溶液褪色,是因为乙烯和溴发生加成反应所致, 小可同学认为若去掉碱石灰直接将装置A 中产生的气体通入装置B 中,则装 置B 中除生成1,2-二溴乙烷外,可能还有其他有机物生成,其结构简式为 (写出一种即可)
(已知:CH =CH +HBrO→HOCH CH Br)
第5页共8页
(6)乙醇在浓硫酸催化作用下也能制得乙烯,但产生的乙烯中往往混有SO , 若 将混合气体通入溴水中,则不能证明乙烯和溴能发生反应,其原因是 (用 离子方程式说明)。
16. (15分)乱扔废弃电池会造成严重污染。工业上利用废电池中的炭包(包含 碳粉、Fe 、Cu 和 MnO 等物质)进行回收、精制MnO 的大致流程如下图所 示:
(
稀
HNO
空气
H O /
稀
H SO Na CO
溶液
空气
炭包
酸浸 灼烧
粗
MnO →
溶解
沉锰
MnCO →
焙烧
MnO,
产品
废液1
气体X
废液2 气体
Y
)
回答下列问题:
(1)“酸浸”时要先将结块的炭包粉碎,目的 是 。
(2)“酸浸”过程中加入的稀硝酸要过量,目的
是 ;其中Fe 与稀硝酸反应生成NO的离子方 程式为_
(3)“灼烧”的目的是_ _o
(4)“溶解”过程中产生的气体X 是 (填名称), H O 的实际消耗量比理 论值高的可能原因是_ o
(5)沉锰时若溶液pH 过大会产生Mn(OH) 杂质,为提高MnCO 纯度应采 用 (填选项)的方式混合溶液。
A. 将溶解所得溶液缓慢滴入Na CO 溶液中
B.将Na CO 溶液缓慢滴入溶解所得溶液中
(6)“焙烧”过程中发生反应的化学方程式
为
第6页共8页
17. (14分)研究化学反应的原理,对掌握物质的应用有重要的意义。
(
能
量
/
(kJ·mol- )
反应过程
)
甲
I.硅是制作太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如图甲所 示:
(1)反应Ⅲ为 (选填“吸热”或“放热”)反应。
II. 研 究NOx 、SO 、CO 等气体的无害化处理对治理大气污染、建设生态文明 有重要意义。
(2)一定温度下,在恒容的密闭容器中充入1mol CO和2 mol H ,发生反应
CO(g)+2H (g)CH OH(g), 对于该反应,下列说法正确的是 (填选 项)。
A.反应过程中n(CO):n(H ) 不变
B. 升高温度,正反应速率减小
C. 往容器中充入He, 压强增大,反应速率加快
D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡
(3)利用反应2NO(g)+2CO(g) N (g)+2CO (g),可实现汽车尾气的无害化处 理。一定温度下,在容积为2L 的恒容密闭容器中加入等物质的量的NO 和 CO, 测得部分物质的物质的量随时间的变化如图乙所示。
①X 代表的物质是 ;a点正反应速率 逆反应速率(填“>”“<”或 “=”)。
②从反应开始到达平衡时,v(NO)= mol ·L- ·min- ;该条件下,CO 的 平 衡 转 化 率 为 o
第 7 页 共 8 页
第8页共8页
乙
(
SO
M
广
50%H
S
Q
-
—H
O
溶液
质子膜
(只允许
H+
通过)
↓O
N
)
丙
(4)可用电化学原理处理SO 制备硫酸,装置图如图丙所示,电极为多孔材料。写 出M 极的电极反应式: o
18. (15分)药物化学是化学的一个重要领域,回答下列问题:
阿司匹林
I. 药物阿司匹林的结构如上图所示。
(1)阿司匹林的分子式为 o
(2)阿司匹林与乙醇可以发生酯化反应,写出该反应化学方程式: 0
Ⅱ.肉桂酸是制备药物“心痛平”的重要中间体, 一种合成路线如下:
O 丙烯酸 -I 肉桂酸
催化剂,△ CH =CHCOOH 催化剂 CH=CHCOOH
(3)下列物质与A 互为同系物的有 (填序号)。
①苯 ②乙烯 ③戊烷 ④2-丁烯
(4)①B→C 的反应类型为 ;②D 的结构简式为 ;
③A→B 反应的化学方程式为 o
(5)CH =CHCH OH 可以发生的化学反应有 (填选项)。
①氧化反应 ②加成反应 ③取代反应 ④加聚反应 A.①②③ B.①②③④ C.②③④ D.①③④
(6)丙烯酸可通过加聚反应合成水阻垢剂聚丙烯酸,则聚丙烯酸的结构简式为
o
2024-2025学年第二学期A层联考高中第六次联考
高一化学试卷答案
一 .选择题
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D C A C B A C C B C D C A B
二 .非选择题
15. (共14分,每空2分)
(1)(球形)干燥管; 除去乙烯中混有的水蒸气
(2)调节分液漏斗活塞,控制液体的滴加速度
(3)取锥形瓶中少量液体,滴加紫色石蕊试液,观察溶液是否变红,若不变红,说明没 有HBr 生成,没发生取代反应,反之发生取代反应或滴在pH 试纸上观察是否变红。
(其他合理答案也可)
(4)挥发出的Br 和水反应也能生成HBr
(5)HOCH CH Br ( 写CH CH Br 也给分)
(6)Br +SO +2H O=4H++SO -+2Br
16. (共15分,除第(1)问1分,其余每空2分)
(1)增大反应物接触面积,加快反应速率,使反应充分进行(合理即可)
(2)把铁和铜除净; Fe+4H++NO =Fe ++NO↑+2H O;
(3)除去碳粉
( 4 ) 氧 气 MnO 催化H O 分解(合理即可) (5) B
(6) (条件只写高温或焙烧都可以)
17. (共14分,每空2分)
(1)吸热
(2) AD
(3)CO > 0.016 80%
(4)SO -2e+2H O=SO -+4H+
1
18 . (共15分,除(1)问1分外,其余每空2分)
(1)CgH O
(3)②④
(4)①取代反应;
②CH =CHCHO
③CH CH=CH +Cl 2. △→CH =CHCH Cl+HCI
(5) B
(6)
2
同课章节目录
