哈尔滨市第九中学校2024-2025学年高二下学期期中化学试卷(图片版,含答案)
文档属性
| 名称 | 哈尔滨市第九中学校2024-2025学年高二下学期期中化学试卷(图片版,含答案) |  | |
| 格式 | |||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-29 17:31:40 | ||
图片预览


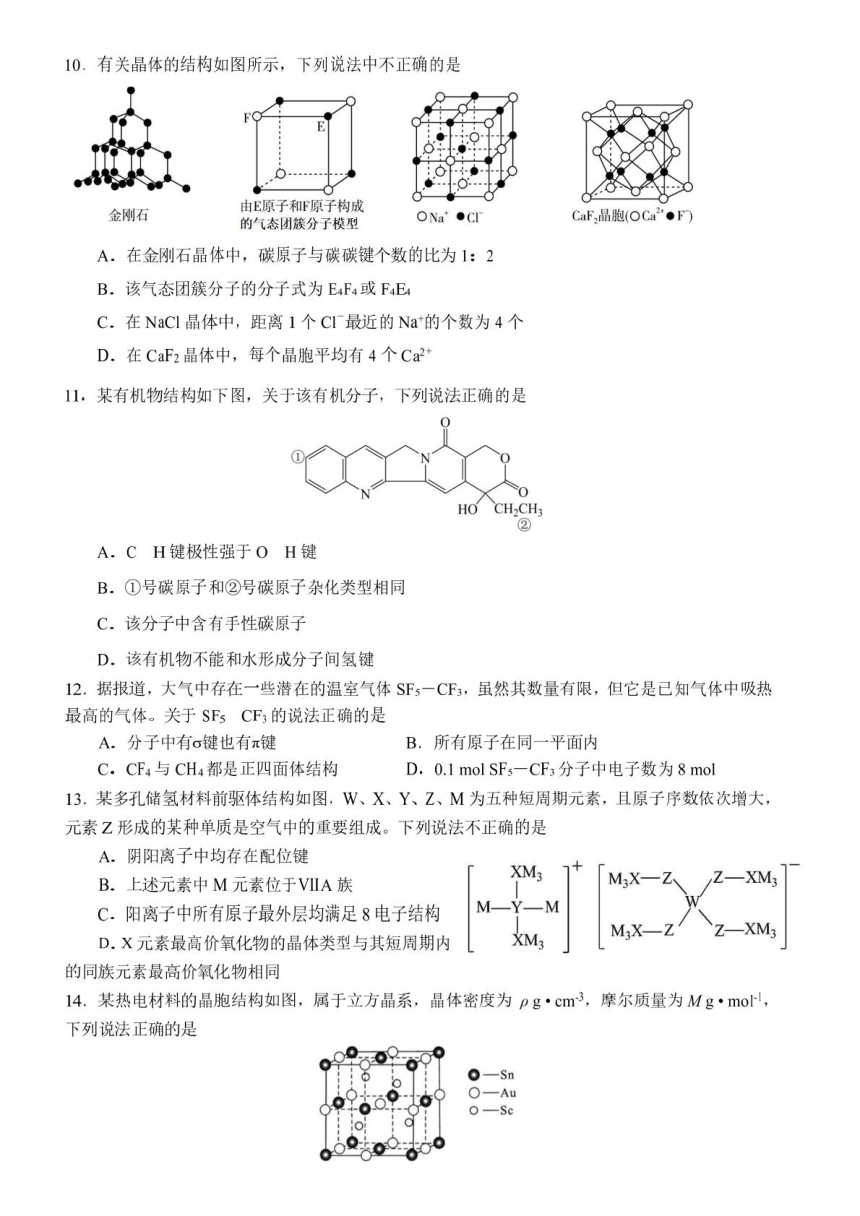
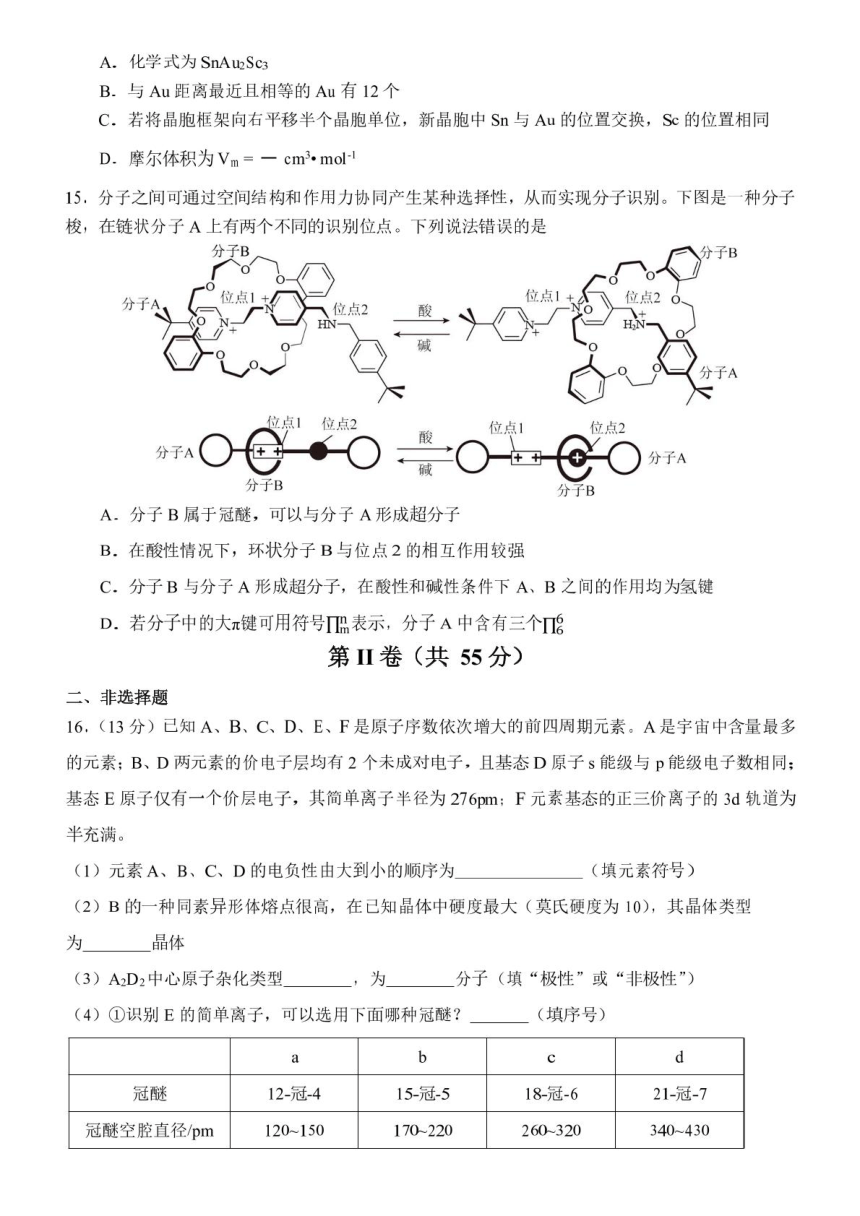

文档简介
哈尔滨市第九中学校2024一2025学年度下学期
期中学业阶段性评价考试高二学年化学学科试卷
(考试时间:75分钟满分:100分)
可能用到的相对原子质量:H-1,C一12,N一14,016,Na一23,P一31,C一35.5
Ti48,Fe-56
第I卷(共45分)
一、选择题:(每小题仅有一个选项符合题意,每小题3分)
1.下列说法正确的是
A.可以利用原子光谱上的特征谱线来鉴定不同的元素
B.元素周期表中金属和非金属分界线附近的元素属于过渡元素
C.金属能导电的原因是由于金属晶体中的金属阳离子在外加电场作用下发生定向移动
D.价电子排布式为5s5p4的元素位于第五周期第IVA族,是s区元素
2.侯氏制碱法中涉及反应之一为NaC1+NH3+CO2+H2O=NaHCO3+NH4CI。下列说法正确的是
A.NaCI晶体属于分子晶体
B.NH是非极性分子
C.1 molCO2中含有2molo键
D.CI的结构示意图为)
3.明矾[KA1(SO4)2·12HO]可用作净水剂。下列说法正确的是
A.半径:r(A13>K)
B.电负性:O)>S)
C.沸点:HS>H2O
D.碱性:AI(OH3>KOH
4.下列表达物质或结构的形成过程错误的是
A.用电子式表示Na0的形成过程:Na今-O个Na一Na[O:P-Na
B.HF的s-po键的形成:
0.00→⊙000
H
H F
HF
Sp2
C.C原子杂化sp轨道形成:
2p
杂化,个
2s
D.π键的形成:
8+8-88-8
5.硅材料在生活中占有重要地位。SiNH2)4(结构如图所示)受热分解可生成Si3N4和NH3。SiN4
是一种优良的耐高温结构陶瓷。下列有关说法错误的是
A.电负性N>Si
B.SiN4属于分子晶体
C.基态Si和N原子的未成对电子数之比为2:3
D.SiNH)4中的Si、N原子轨道的杂化类型相同
高温高压
6.工业合成尿素的反应原理为C0,+2NH
催化剂
O(NH2),+HO。下列说法正确的是
A,基态氧原子(s0)核外电子排布式为1s22s22p4
H
B.NH的电子式为H:H
C.CONH22中N的化合价为+3
D.H2O的VSEPR模型为直线形
7.下列事实对应的解释错误的是
选项
事实
解释
A
沸点:对羟基苯甲醛>邻羟基苯甲醛
邻羟基苯甲醛形成分子内氢键
B
水的热稳定性强于硫化氢
水中O-H的键长比硫化氢中S-H短,键能大
白磷分子的空间构型为正四面体
白磷分子中P-P键间的夹角为109.5
D
煤气能使人中毒
C0通过配位键与血红蛋白中F2+的结合能力强于氧气
8.FTiO,常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是
(1,1,1)
(0.0,0)●
Ti Fe O
己知:晶胞参数为anm,NA为阿伏加德罗常数的值。
A.Fe2+的分数坐标为
111
222
B.氧离子构成正八面体形
C.F 2和Ti之间的最近距离为
D.FeTiO3晶体密度为
.52×1023
-apm
2
Nxag.cm3
9.结构决定性质,性质决定用途。下列事实解释错误的是
选项
事实
解释
缺角的NaCl晶体在饱和NaCI溶液中会慢
A
晶体具有自范性
慢变为完美的立方体块
B
氨水可溶解AgCl沉淀
氨水呈碱性
冰的密度小于干冰
冰晶体中水分子的空间利用率相对较低
D
HCI极易溶于水
HC1和水均为极性分子,两者“相似相溶”
期中学业阶段性评价考试高二学年化学学科试卷
(考试时间:75分钟满分:100分)
可能用到的相对原子质量:H-1,C一12,N一14,016,Na一23,P一31,C一35.5
Ti48,Fe-56
第I卷(共45分)
一、选择题:(每小题仅有一个选项符合题意,每小题3分)
1.下列说法正确的是
A.可以利用原子光谱上的特征谱线来鉴定不同的元素
B.元素周期表中金属和非金属分界线附近的元素属于过渡元素
C.金属能导电的原因是由于金属晶体中的金属阳离子在外加电场作用下发生定向移动
D.价电子排布式为5s5p4的元素位于第五周期第IVA族,是s区元素
2.侯氏制碱法中涉及反应之一为NaC1+NH3+CO2+H2O=NaHCO3+NH4CI。下列说法正确的是
A.NaCI晶体属于分子晶体
B.NH是非极性分子
C.1 molCO2中含有2molo键
D.CI的结构示意图为)
3.明矾[KA1(SO4)2·12HO]可用作净水剂。下列说法正确的是
A.半径:r(A13>K)
B.电负性:O)>S)
C.沸点:HS>H2O
D.碱性:AI(OH3>KOH
4.下列表达物质或结构的形成过程错误的是
A.用电子式表示Na0的形成过程:Na今-O个Na一Na[O:P-Na
B.HF的s-po键的形成:
0.00→⊙000
H
H F
HF
Sp2
C.C原子杂化sp轨道形成:
2p
杂化,个
2s
D.π键的形成:
8+8-88-8
5.硅材料在生活中占有重要地位。SiNH2)4(结构如图所示)受热分解可生成Si3N4和NH3。SiN4
是一种优良的耐高温结构陶瓷。下列有关说法错误的是
A.电负性N>Si
B.SiN4属于分子晶体
C.基态Si和N原子的未成对电子数之比为2:3
D.SiNH)4中的Si、N原子轨道的杂化类型相同
高温高压
6.工业合成尿素的反应原理为C0,+2NH
催化剂
O(NH2),+HO。下列说法正确的是
A,基态氧原子(s0)核外电子排布式为1s22s22p4
H
B.NH的电子式为H:H
C.CONH22中N的化合价为+3
D.H2O的VSEPR模型为直线形
7.下列事实对应的解释错误的是
选项
事实
解释
A
沸点:对羟基苯甲醛>邻羟基苯甲醛
邻羟基苯甲醛形成分子内氢键
B
水的热稳定性强于硫化氢
水中O-H的键长比硫化氢中S-H短,键能大
白磷分子的空间构型为正四面体
白磷分子中P-P键间的夹角为109.5
D
煤气能使人中毒
C0通过配位键与血红蛋白中F2+的结合能力强于氧气
8.FTiO,常用于制备磁芯、磁盘和传感器等,它的晶胞(如图)为等轴晶系。下列叙述错误的是
(1,1,1)
(0.0,0)●
Ti Fe O
己知:晶胞参数为anm,NA为阿伏加德罗常数的值。
A.Fe2+的分数坐标为
111
222
B.氧离子构成正八面体形
C.F 2和Ti之间的最近距离为
D.FeTiO3晶体密度为
.52×1023
-apm
2
Nxag.cm3
9.结构决定性质,性质决定用途。下列事实解释错误的是
选项
事实
解释
缺角的NaCl晶体在饱和NaCI溶液中会慢
A
晶体具有自范性
慢变为完美的立方体块
B
氨水可溶解AgCl沉淀
氨水呈碱性
冰的密度小于干冰
冰晶体中水分子的空间利用率相对较低
D
HCI极易溶于水
HC1和水均为极性分子,两者“相似相溶”
同课章节目录
