2024-2025学年江西省南康中学高二下学期第三次大考化学试题(含答案)
文档属性
| 名称 | 2024-2025学年江西省南康中学高二下学期第三次大考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 972.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-29 20:36:10 | ||
图片预览


文档简介
南康中学2024~2025学年度第二学期高二第三次大考
化 学 试 卷
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Zn:65 Se:79
一、选择题(每小题3分,共42分)
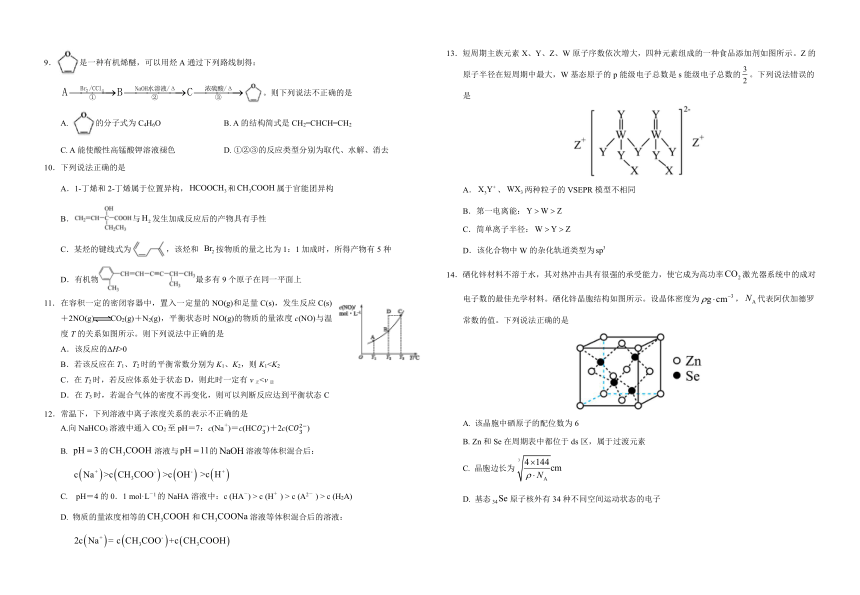
1.化学与生活密切相关,下列叙述错误的是
A. N95型口罩的核心材料是聚丙烯,属于有机高分子材料
B. 福尔马林能防腐,但不能用于食品保鲜
C.苯酚具有消毒防腐作用,可直接用于皮肤表面消毒
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
2.下列化学用语表示正确的是
A.Cl-Cl的p-p 键的电子云图形:
B.反-2-丁烯的结构简式:
C.金属基态原子的核外电子排布式为:
D.光气的空间填充模型:
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.22gCO2中,π键的数目为2NA
B.常温下,1L pH=12的溶液中的数目为0.01NA
C.1L0.1mol·L-1HCl溶液中,H原子的数目为0.1NA
D.3molH2与足量N2充分反应,生成NH3分子的数目为2NA
4.下列物质及其变化与对应的方程式不匹配的是
A. 工业上用处理废水中的
B. 用过量氨水吸收废气中的:
C. 用铝粉和溶液反应制取少量
D. 用溶液检测溶液中的
5.尿素,又称碳酰胺,其合成原理为CO2+2NH3=CO(NH2)2+H2O。下列说法正确的是
A. CO2是含有极性键的极性分子
B. H2O的空间结构为V形
C. NH3分子中氮原子采取sp2杂化
D. CO(NH2)2与氰酸铵(NH4CNO)互为同分异构体,组成晶体中微粒间作用力类型相同
6.某有机物的结构简式如下图,则下列说法错误的是
A.该有机物可与碳酸氢钠溶液反应放出CO2
B.1mol该有机物可以和足量金属钠反应生成1molH2
C.分子式为C12H10O4
D.该有机物可发生氧化、取代、加聚、加成反应
7.下列有关实验装置及原理正确的是
A.用图甲装置分离苯和溴苯的混合物 B.用图乙装置检验溴乙烷的消去产物
C.用图丙装置制取并收集乙酸乙酯 D.用图丁装置验证酸性:碳酸>苯酚
8.实验室提取桂花精油的流程如下。下列说法错误的是
A.“操作①”所需的玻璃仪器有烧杯、漏斗、玻璃棒
B.“操作②”为过滤,所得的石油醚可循环利用
C.“乙醇洗涤”可提高桂花精油的收率
D.“减压蒸馏”可防止桂花精油在较高温度下变质
9.是一种有机烯醚,可以用烃A通过下列路线制得:
。则下列说法不正确的是
A. 的分子式为C4H6O B. A的结构简式是CH2=CHCH=CH2
C. A能使酸性高锰酸钾溶液褪色 D. ①②③的反应类型分别为取代、水解、消去
10.下列说法正确的是
A.1-丁烯和2-丁烯属于位置异构,和属于官能团异构
B.与发生加成反应后的产物具有手性
C.某烃的键线式为,该烃和 按物质的量之比为1:1加成时,所得产物有5种
D.有机物最多有9个原子在同一平面上
11.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
A.该反应的ΔH>0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1C.在T2时,若反应体系处于状态D,则此时一定有v正D.在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
12.常温下,下列溶液中离子浓度关系的表示不正确的是
A.向NaHCO3溶液中通入CO2至pH=7:c(Na+)=c(HC)+2c(C)
B. 的溶液与的溶液等体积混合后:
C. pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (A2- ) > c (H2A)
D. 物质的量浓度相等的和溶液等体积混合后的溶液:
13.短周期主族元素X、Y、Z、W原子序数依次增大,四种元素组成的一种食品添加剂如图所示。Z的原子半径在短周期中最大,W基态原子的p能级电子总数是s能级电子总数的。下列说法错误的是
A.、两种粒子的VSEPR模型不相同
B.第一电离能:
C.简单离子半径:
D.该化合物中W的杂化轨道类型为
14.硒化锌材料不溶于水,其对热冲击具有很强的承受能力,使它成为高功率激光器系统中的成对电子数的最佳光学材料。硒化锌晶胞结构如图所示。设晶体密度为,代表阿伏加德罗常数的值。下列说法正确的是
A. 该晶胞中硒原子的配位数为6
B. Zn和Se在周期表中都位于ds区,属于过渡元素
C. 晶胞边长为
D. 基态原子核外有34种不同空间运动状态的电子
二、非选择题(共58分)
15.(12分)(1)某烷烃X的结构简式为。
①该烷烃用系统命名法命名的名称是 。
②若X是由烯烃Y加氢得到的,Y存在多种同分异构体,上述烯烃Y中,存在顺反异构的结构简式为 。
(2)分子式为C9H12的芳香烃,苯环上的一溴取代物只有一种,该芳香烃的结构简式为 。
(3)书写下列化学方程式:
①甲苯与氯气在光照条件下发生一元取代反应
②苯酚钠溶液中通入少量二氧化碳:_______。
③与新制的Cu(OH)2反应的化学方程式:___________________
16.(16分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的气味。实验室制备乙酸异戊酯装置示意图和有关数据如下:
密度/(g·cm-3) 沸点/℃ 水中的溶解度
异戊醇 0.8123 131 微溶
乙酸 1.0492 118 溶
乙酸异戊酯 0.8670 142 难容
已知异戊醇的结构简式:
(1)制取乙酸异戊酯反应的化学方程式是 。
(2)异戊醇、乙酸、浓硫酸加入反应容器中的顺序是 。
(3)为了实验的安全,还需在反应器中加入 。
(4)加入药品结束后,开始缓慢加热A,回流50min,待反应液冷却至室温后倒入分液漏斗中,分别用 和 (填序号)洗涤混合液,以除去其中的杂质。
a. 水 b. 饱和NaHCO3溶液 c. NaOH溶液
(5)经上述除杂操作后,加入少量无水MgSO4干燥,过滤后再对所得产品进行蒸馏的提纯操作。
①下列在蒸馏装置中,仪器选择及安装都正确的是 (填序号)
②若从130℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是 。
(6)为提高异戊醇的转化率可采取的措施是 。
17.(16分)四钼酸铵是钼深加工的重要中间产品。一种以钼精矿(主要含),还有Cu、Fe的化合物及等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
回答下列问题:
(1)铁元素的价电子排布图为_______。
(2)焙烧渣中的在“碱浸”时转化为,反应的离子方程式为_______。
(3)“净化”时加入溶液,是为了除去残留的和。研究表明,该溶液中和pH的关系为:,若控制溶液的pH=3.9,此时溶液中的浓度为_______(已知FeS的)。
(4)“沉淀”时生成的离子方程式为_______。
(5)从溶液到晶体的“一系列操作”为_______、_______、过滤、洗涤、干燥。
(6)该流程中产生的工业废气和可以回收利用,实验原理如图。装置a中溶液的作用是_______,装置b电解过程的阴极反应式为_______。
18.(14分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RCHO+CH3COOR′RCH=CHCOOR′
请回答:
(1)X中官能团的名称是 。
(2)D→E的化学方程式 ,反应类型为 。
(3)对于化合物D,下列说法正确的是___________。
A.能发生水解反应 B.能和钠反应
C.能使Br2/CCl4溶液褪色 D.能发生氧化反应
(4)F的结构简式 。
(5)满足下列条件的F同分异构体数目为 (①苯环上有三个取代基②能与碳酸氢钠反应),写出其中等效氢数目最少的一种同分异构体结构简式为 。
南康中学2024~2025学年度第二学期高二第三次大考
化学参考答案
1. C 2.A
3.B【解析】A.一分子CO2含有2个π键,22g二氧化碳的物质的量为0.5mol,π键的数目为NA,C错误;C.溶液中含有H2O,而H2O中含有H原子的数目远大于0.1NA,C项错误;D.合成氨为可逆反应,反应物不可能完全转化为生成物,故3molH2与足量N2充分反应,生成NH3分子的数目小于2NA,D项错误。
4.A
5.B【解析】A.分子中正负电荷中心重合,为非极性分子,A错误;B.中O的杂化方式为,有2个孤电子对,其VSEPR模型为四面体形,其空间结构为V形,B正确;C.中N原子的价层电子对数为3+1=4,因此N原子采取杂化,C错误;D.中含有铵根,因此为离子晶体,D错误;
6.C【详解】A.该有机物中含有羧基,羧基可以与NaHCO3反应产生CO2,A正确;B.该有机物中羟基、羧基能与Na反应产生H2,1 mol该有机物中含有1 mol 羧基和1 mol羟基,根据反应比例:2—COOH~H2、2—OH~H2,知产生H2为1 mol,B正确;C.该有机物中,不饱和度为7,碳原子个数为12,则氢原子个数为,分子式为:,C错误;D.该有机物可以发生氧化反应,如燃烧、碳碳双键(醛基、羟基)与KMnO4反应;可以发生取代反应,如酯化反应;可以发生加成反应,如苯环、碳碳双键、醛基与H2加成(也可看成还原反应);含碳碳双键,可以发生加聚反应,D正确;故答案C。
7.B 8.B
9.D【详解】A.的分子式为C4H6O,故A正确;B.由上述分析可知,A为CH2=CHCH=CH2,故B正确;C.A中有碳碳双键,能使高锰酸钾酸性溶液褪色,故C正确;D.由上述分析可知,①、②、③的反应类型分别为加成、水解、取代,故D错误;故选:D。
10.A【解析】1-丁烯和2-丁烯,双键位置不一样,属于位置异构,和官能团不一样,属于官能团异构,故A正确;与氢气加成后的产物为,该分子不具有手性,故B错误;和 按物质的量之比为1:1加成时,可以发生1,2-加成,产物为:、、,也可以发生1,4-加成,产物为:,共有4种,故C错误;有机物中,苯环和碳碳双键(三键)都可以在同一个平面上,中可以有3个原子共面(包含R中一个原子),故最多有21个原子共面,如图所示,故B错误;故选D。
11.D
12.B
13.A【解析】PH3中P原子价层电子对数为,杂化类型为sp3杂化;H3O+中O原子价层电子对数为,杂化类型为sp3杂化,VSEPR模型相同,A错误;同周期主族元素从左到右第一电离能呈增大趋势,同主族元素由上而下第一电离能递减,第一电离能:,B正确; 电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子半径:,C正确; 该化合物中P形成3个单键、1个双键,杂化轨道类型为,D正确;故选 A。
14.C【详解】A.与Se原子距离最近的Zn原子有4个,该晶胞中硒原子的配位数为4,A错误;B.Zn位于周期表中第IIB族,属于ds区,Se位于周期表中第VIA族,属于p区,B错误;C.设晶胞的边长为acm,则有,C正确;D.基态原子的核外电子排布式为:,共占据了18个轨道,则基态原子核外有18种不同空间运动状态的电子,D错误;故答案为:C。
15.(12分,每空2分) (1)①2,3-二甲基戊烷 ②
(2)
(3)①
②+H2O+CO2→+NaHCO3
③+2Cu(OH)2+NaOH+Cu2O↓+3H2O。
16.(16分,除标注外,其余每空2分)
(1)CH3COOH++H2O
(2)异戊醇、浓硫酸、乙酸 (3) 碎瓷片(1分) (4) a b
(5)① b ②高(1分) 产品中会收集到异戊醇
(6)加入过量的乙酸或及时分离出反应产物
【详解】(2)由密度可知,先加异戊醇,再加浓硫酸,浓硫酸溶于异戊醇放热,最后加乙酸减少乙酸挥发;
(3)蒸馏法分离混合物要防止暴沸,故还需在反应器中加入碎瓷片;
(4)待反应液冷却至室温后倒入分液漏斗中,先用水洗,洗掉大部分硫酸和乙酸,再用饱和NaHCO3溶液洗涤除去残余的酸;
(5)①结合蒸馏原理可知,a中温度计位置错误,c中冷凝水进水方向错误,b正确,故选b;
②若从130℃便开始收集馏分,会混有一部分异戊醇,使产品的产率偏高;
(6)该反应为可逆反应,为提高异戊醇的转化率,可以采取的措施有:加入过量的乙酸或及时分离出产物(如用分水器分水),任选一个作答。
17.(16分,每空2分)
(1) (2)
(3)mol/L
(4)
(5) 蒸发浓缩 冷却结晶
(6)吸收废气中的,将其转化为
【详解】(1)基态Fe原子核外有26个电子,其核外电子排布式为[Ar]3d64s2,按照洪特规则,3d轨道上6个电子优先占据5个不同轨道,故价层电子的电子排布图为。
(2)焙烧渣中的MoO3在“碱浸“时转化为,转化为CO2,故反应的离子方程式为。
(3),,时,此溶液中Fe2+的浓度为。
(4)据分析,向含滤液中加NH4NO3、HNO3“沉淀”时生成(NH4)2Mo4O13·2H2O的离子方程式为。
(5)从FeSO4溶液到FeSO4·7H2O晶体的“一系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(6)NaHCO3溶液能和SO2反应,而不与CO2反应,故装置a中溶液的作用是吸收废气中的SO2,并且转化为Na2SO3进入电解池,装置b电解过程的阴极的CO2得到电子生成HCOOH,电极反应式为。
18.(14分,每空2分)(1)碳碳双键、酯基
(2)2 +O22 +2H2O 氧化反应
(3)BD
(4)
(5) 6 或
【分析】乙烯与水加成得到A:乙醇,乙醇氧化得到B:乙酸,甲苯发生烷基上的氯代得到C:,C发生取代反应得到D:,D催化氧化得到E:,B与D发生酯化反应得到F:,根据已知信息,E与F反应得到X:。
【详解】(1)根据分析,X为,官能团的名称是:碳碳双键、酯基;(4)化合物D为苯甲醇含有羟基能和钠反应,能发生氧化反应,选BD;
(6)①F同分异构体含有一个苯环,能与碳酸氢钠反应说明含有羧基,苯环上有三个取代基2个甲基和1个羧基共有6种。
化 学 试 卷
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Zn:65 Se:79
一、选择题(每小题3分,共42分)
1.化学与生活密切相关,下列叙述错误的是
A. N95型口罩的核心材料是聚丙烯,属于有机高分子材料
B. 福尔马林能防腐,但不能用于食品保鲜
C.苯酚具有消毒防腐作用,可直接用于皮肤表面消毒
D.“复方氯乙烷气雾剂”可用于运动中急性损伤的镇痛
2.下列化学用语表示正确的是
A.Cl-Cl的p-p 键的电子云图形:
B.反-2-丁烯的结构简式:
C.金属基态原子的核外电子排布式为:
D.光气的空间填充模型:
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.22gCO2中,π键的数目为2NA
B.常温下,1L pH=12的溶液中的数目为0.01NA
C.1L0.1mol·L-1HCl溶液中,H原子的数目为0.1NA
D.3molH2与足量N2充分反应,生成NH3分子的数目为2NA
4.下列物质及其变化与对应的方程式不匹配的是
A. 工业上用处理废水中的
B. 用过量氨水吸收废气中的:
C. 用铝粉和溶液反应制取少量
D. 用溶液检测溶液中的
5.尿素,又称碳酰胺,其合成原理为CO2+2NH3=CO(NH2)2+H2O。下列说法正确的是
A. CO2是含有极性键的极性分子
B. H2O的空间结构为V形
C. NH3分子中氮原子采取sp2杂化
D. CO(NH2)2与氰酸铵(NH4CNO)互为同分异构体,组成晶体中微粒间作用力类型相同
6.某有机物的结构简式如下图,则下列说法错误的是
A.该有机物可与碳酸氢钠溶液反应放出CO2
B.1mol该有机物可以和足量金属钠反应生成1molH2
C.分子式为C12H10O4
D.该有机物可发生氧化、取代、加聚、加成反应
7.下列有关实验装置及原理正确的是
A.用图甲装置分离苯和溴苯的混合物 B.用图乙装置检验溴乙烷的消去产物
C.用图丙装置制取并收集乙酸乙酯 D.用图丁装置验证酸性:碳酸>苯酚
8.实验室提取桂花精油的流程如下。下列说法错误的是
A.“操作①”所需的玻璃仪器有烧杯、漏斗、玻璃棒
B.“操作②”为过滤,所得的石油醚可循环利用
C.“乙醇洗涤”可提高桂花精油的收率
D.“减压蒸馏”可防止桂花精油在较高温度下变质
9.是一种有机烯醚,可以用烃A通过下列路线制得:
。则下列说法不正确的是
A. 的分子式为C4H6O B. A的结构简式是CH2=CHCH=CH2
C. A能使酸性高锰酸钾溶液褪色 D. ①②③的反应类型分别为取代、水解、消去
10.下列说法正确的是
A.1-丁烯和2-丁烯属于位置异构,和属于官能团异构
B.与发生加成反应后的产物具有手性
C.某烃的键线式为,该烃和 按物质的量之比为1:1加成时,所得产物有5种
D.有机物最多有9个原子在同一平面上
11.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法中正确的是
A.该反应的ΔH>0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1
12.常温下,下列溶液中离子浓度关系的表示不正确的是
A.向NaHCO3溶液中通入CO2至pH=7:c(Na+)=c(HC)+2c(C)
B. 的溶液与的溶液等体积混合后:
C. pH=4的0.1 mol·L-1的NaHA溶液中:c (HA-) > c (H+ ) > c (A2- ) > c (H2A)
D. 物质的量浓度相等的和溶液等体积混合后的溶液:
13.短周期主族元素X、Y、Z、W原子序数依次增大,四种元素组成的一种食品添加剂如图所示。Z的原子半径在短周期中最大,W基态原子的p能级电子总数是s能级电子总数的。下列说法错误的是
A.、两种粒子的VSEPR模型不相同
B.第一电离能:
C.简单离子半径:
D.该化合物中W的杂化轨道类型为
14.硒化锌材料不溶于水,其对热冲击具有很强的承受能力,使它成为高功率激光器系统中的成对电子数的最佳光学材料。硒化锌晶胞结构如图所示。设晶体密度为,代表阿伏加德罗常数的值。下列说法正确的是
A. 该晶胞中硒原子的配位数为6
B. Zn和Se在周期表中都位于ds区,属于过渡元素
C. 晶胞边长为
D. 基态原子核外有34种不同空间运动状态的电子
二、非选择题(共58分)
15.(12分)(1)某烷烃X的结构简式为。
①该烷烃用系统命名法命名的名称是 。
②若X是由烯烃Y加氢得到的,Y存在多种同分异构体,上述烯烃Y中,存在顺反异构的结构简式为 。
(2)分子式为C9H12的芳香烃,苯环上的一溴取代物只有一种,该芳香烃的结构简式为 。
(3)书写下列化学方程式:
①甲苯与氯气在光照条件下发生一元取代反应
②苯酚钠溶液中通入少量二氧化碳:_______。
③与新制的Cu(OH)2反应的化学方程式:___________________
16.(16分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的气味。实验室制备乙酸异戊酯装置示意图和有关数据如下:
密度/(g·cm-3) 沸点/℃ 水中的溶解度
异戊醇 0.8123 131 微溶
乙酸 1.0492 118 溶
乙酸异戊酯 0.8670 142 难容
已知异戊醇的结构简式:
(1)制取乙酸异戊酯反应的化学方程式是 。
(2)异戊醇、乙酸、浓硫酸加入反应容器中的顺序是 。
(3)为了实验的安全,还需在反应器中加入 。
(4)加入药品结束后,开始缓慢加热A,回流50min,待反应液冷却至室温后倒入分液漏斗中,分别用 和 (填序号)洗涤混合液,以除去其中的杂质。
a. 水 b. 饱和NaHCO3溶液 c. NaOH溶液
(5)经上述除杂操作后,加入少量无水MgSO4干燥,过滤后再对所得产品进行蒸馏的提纯操作。
①下列在蒸馏装置中,仪器选择及安装都正确的是 (填序号)
②若从130℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”),其原因是 。
(6)为提高异戊醇的转化率可采取的措施是 。
17.(16分)四钼酸铵是钼深加工的重要中间产品。一种以钼精矿(主要含),还有Cu、Fe的化合物及等)为原料制备四钼酸铵同时得到副产品绿矾的流程如下:
回答下列问题:
(1)铁元素的价电子排布图为_______。
(2)焙烧渣中的在“碱浸”时转化为,反应的离子方程式为_______。
(3)“净化”时加入溶液,是为了除去残留的和。研究表明,该溶液中和pH的关系为:,若控制溶液的pH=3.9,此时溶液中的浓度为_______(已知FeS的)。
(4)“沉淀”时生成的离子方程式为_______。
(5)从溶液到晶体的“一系列操作”为_______、_______、过滤、洗涤、干燥。
(6)该流程中产生的工业废气和可以回收利用,实验原理如图。装置a中溶液的作用是_______,装置b电解过程的阴极反应式为_______。
18.(14分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
已知:RCHO+CH3COOR′RCH=CHCOOR′
请回答:
(1)X中官能团的名称是 。
(2)D→E的化学方程式 ,反应类型为 。
(3)对于化合物D,下列说法正确的是___________。
A.能发生水解反应 B.能和钠反应
C.能使Br2/CCl4溶液褪色 D.能发生氧化反应
(4)F的结构简式 。
(5)满足下列条件的F同分异构体数目为 (①苯环上有三个取代基②能与碳酸氢钠反应),写出其中等效氢数目最少的一种同分异构体结构简式为 。
南康中学2024~2025学年度第二学期高二第三次大考
化学参考答案
1. C 2.A
3.B【解析】A.一分子CO2含有2个π键,22g二氧化碳的物质的量为0.5mol,π键的数目为NA,C错误;C.溶液中含有H2O,而H2O中含有H原子的数目远大于0.1NA,C项错误;D.合成氨为可逆反应,反应物不可能完全转化为生成物,故3molH2与足量N2充分反应,生成NH3分子的数目小于2NA,D项错误。
4.A
5.B【解析】A.分子中正负电荷中心重合,为非极性分子,A错误;B.中O的杂化方式为,有2个孤电子对,其VSEPR模型为四面体形,其空间结构为V形,B正确;C.中N原子的价层电子对数为3+1=4,因此N原子采取杂化,C错误;D.中含有铵根,因此为离子晶体,D错误;
6.C【详解】A.该有机物中含有羧基,羧基可以与NaHCO3反应产生CO2,A正确;B.该有机物中羟基、羧基能与Na反应产生H2,1 mol该有机物中含有1 mol 羧基和1 mol羟基,根据反应比例:2—COOH~H2、2—OH~H2,知产生H2为1 mol,B正确;C.该有机物中,不饱和度为7,碳原子个数为12,则氢原子个数为,分子式为:,C错误;D.该有机物可以发生氧化反应,如燃烧、碳碳双键(醛基、羟基)与KMnO4反应;可以发生取代反应,如酯化反应;可以发生加成反应,如苯环、碳碳双键、醛基与H2加成(也可看成还原反应);含碳碳双键,可以发生加聚反应,D正确;故答案C。
7.B 8.B
9.D【详解】A.的分子式为C4H6O,故A正确;B.由上述分析可知,A为CH2=CHCH=CH2,故B正确;C.A中有碳碳双键,能使高锰酸钾酸性溶液褪色,故C正确;D.由上述分析可知,①、②、③的反应类型分别为加成、水解、取代,故D错误;故选:D。
10.A【解析】1-丁烯和2-丁烯,双键位置不一样,属于位置异构,和官能团不一样,属于官能团异构,故A正确;与氢气加成后的产物为,该分子不具有手性,故B错误;和 按物质的量之比为1:1加成时,可以发生1,2-加成,产物为:、、,也可以发生1,4-加成,产物为:,共有4种,故C错误;有机物中,苯环和碳碳双键(三键)都可以在同一个平面上,中可以有3个原子共面(包含R中一个原子),故最多有21个原子共面,如图所示,故B错误;故选D。
11.D
12.B
13.A【解析】PH3中P原子价层电子对数为,杂化类型为sp3杂化;H3O+中O原子价层电子对数为,杂化类型为sp3杂化,VSEPR模型相同,A错误;同周期主族元素从左到右第一电离能呈增大趋势,同主族元素由上而下第一电离能递减,第一电离能:,B正确; 电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,简单离子半径:,C正确; 该化合物中P形成3个单键、1个双键,杂化轨道类型为,D正确;故选 A。
14.C【详解】A.与Se原子距离最近的Zn原子有4个,该晶胞中硒原子的配位数为4,A错误;B.Zn位于周期表中第IIB族,属于ds区,Se位于周期表中第VIA族,属于p区,B错误;C.设晶胞的边长为acm,则有,C正确;D.基态原子的核外电子排布式为:,共占据了18个轨道,则基态原子核外有18种不同空间运动状态的电子,D错误;故答案为:C。
15.(12分,每空2分) (1)①2,3-二甲基戊烷 ②
(2)
(3)①
②+H2O+CO2→+NaHCO3
③+2Cu(OH)2+NaOH+Cu2O↓+3H2O。
16.(16分,除标注外,其余每空2分)
(1)CH3COOH++H2O
(2)异戊醇、浓硫酸、乙酸 (3) 碎瓷片(1分) (4) a b
(5)① b ②高(1分) 产品中会收集到异戊醇
(6)加入过量的乙酸或及时分离出反应产物
【详解】(2)由密度可知,先加异戊醇,再加浓硫酸,浓硫酸溶于异戊醇放热,最后加乙酸减少乙酸挥发;
(3)蒸馏法分离混合物要防止暴沸,故还需在反应器中加入碎瓷片;
(4)待反应液冷却至室温后倒入分液漏斗中,先用水洗,洗掉大部分硫酸和乙酸,再用饱和NaHCO3溶液洗涤除去残余的酸;
(5)①结合蒸馏原理可知,a中温度计位置错误,c中冷凝水进水方向错误,b正确,故选b;
②若从130℃便开始收集馏分,会混有一部分异戊醇,使产品的产率偏高;
(6)该反应为可逆反应,为提高异戊醇的转化率,可以采取的措施有:加入过量的乙酸或及时分离出产物(如用分水器分水),任选一个作答。
17.(16分,每空2分)
(1) (2)
(3)mol/L
(4)
(5) 蒸发浓缩 冷却结晶
(6)吸收废气中的,将其转化为
【详解】(1)基态Fe原子核外有26个电子,其核外电子排布式为[Ar]3d64s2,按照洪特规则,3d轨道上6个电子优先占据5个不同轨道,故价层电子的电子排布图为。
(2)焙烧渣中的MoO3在“碱浸“时转化为,转化为CO2,故反应的离子方程式为。
(3),,时,此溶液中Fe2+的浓度为。
(4)据分析,向含滤液中加NH4NO3、HNO3“沉淀”时生成(NH4)2Mo4O13·2H2O的离子方程式为。
(5)从FeSO4溶液到FeSO4·7H2O晶体的“一系列操作”为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(6)NaHCO3溶液能和SO2反应,而不与CO2反应,故装置a中溶液的作用是吸收废气中的SO2,并且转化为Na2SO3进入电解池,装置b电解过程的阴极的CO2得到电子生成HCOOH,电极反应式为。
18.(14分,每空2分)(1)碳碳双键、酯基
(2)2 +O22 +2H2O 氧化反应
(3)BD
(4)
(5) 6 或
【分析】乙烯与水加成得到A:乙醇,乙醇氧化得到B:乙酸,甲苯发生烷基上的氯代得到C:,C发生取代反应得到D:,D催化氧化得到E:,B与D发生酯化反应得到F:,根据已知信息,E与F反应得到X:。
【详解】(1)根据分析,X为,官能团的名称是:碳碳双键、酯基;(4)化合物D为苯甲醇含有羟基能和钠反应,能发生氧化反应,选BD;
(6)①F同分异构体含有一个苯环,能与碳酸氢钠反应说明含有羧基,苯环上有三个取代基2个甲基和1个羧基共有6种。
同课章节目录
