1.1.3 物质的转化 教学课件 (共25张PPT)—高中化学人教版(2019)必修一
文档属性
| 名称 | 1.1.3 物质的转化 教学课件 (共25张PPT)—高中化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 23:48:27 | ||
图片预览







文档简介
(共25张PPT)
1.1.3 物质的转化
一、宏观辨识与微观探析
能从宏观上辨识酸、碱、盐等物质的性质及转化现象,从微观角度理解不同酸溶液含 H 、碱溶液含 OH 、碳酸盐溶液含碳酸根离子导致性质相似的本质,建立宏观与微观之间的联系。
二、变化观念与平衡思想
认识物质的性质和转化规律,理解元素在化学变化中不变的观念,能依据物质组成和性质分析物质间转化的可能性。
三、科学态度与社会责任
体会化学知识在工业生产制取物质中的应用,了解化学科研工作者的责任与贡献,培养严谨的科学态度,增强对化学服务社会的责任感。
核心素养目标
重点:
1. 酸、碱、盐的主要化学性质
2. 物质之间的转化关系及规律
3. 单质到盐的转化途径
难点:
1. 理解物质性质相似的微观本质
2. 根据物质组成和性质确定物质转化的方法
3. 工业制取物质时多因素综合考虑的应用
学习重难点
01 酸、碱、盐及氧化物的主要化学性质
酸的主要化学性质
酸的主要化学性质 现象或方程式 基本反应类型
与指示剂作用
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
H2SO4+Zn = ZnSO4+ H2↑
2HCl+CaO = CaCl2+H2O
H2SO4+2NaOH = Na2SO4+2H2O
H2SO4+BaCl2 = BaSO4↓+2HCl
紫色石蕊溶液遇酸显红色
置换反应
复分解反应
复分解反应
复分解反应
——
酸的主要化学性质
(1)酸和酸碱指示剂反应:使紫色
石蕊溶液变红,使无色酚酞溶
液不变色
(2)酸 + 金属氧化物 → 盐 + 水
(3)酸 + 活泼金属 → 盐 + 氢气
(4)酸 + 碱 → 盐 + 水
(5)酸 + 盐 → 新盐 + 新酸
酸具有相似化学性质的原因:
在不同的酸溶液中都含有H+
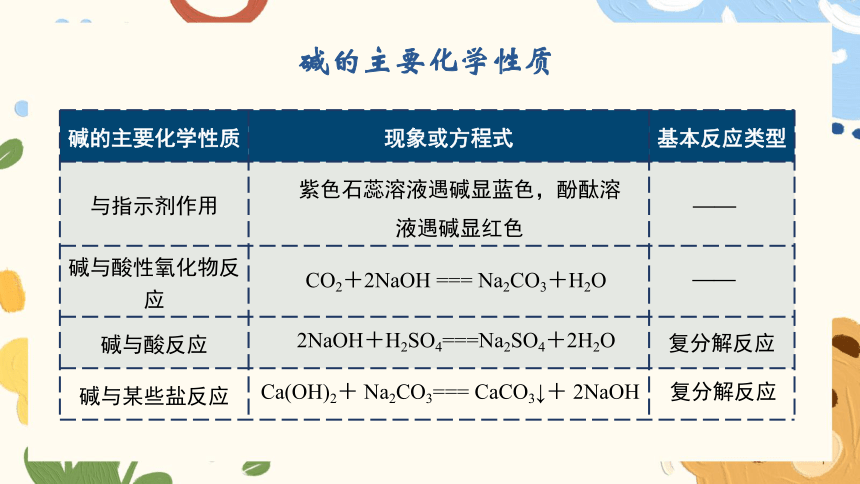
碱的主要化学性质
碱的主要化学性质 现象或方程式 基本反应类型
与指示剂作用
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
CO2+2NaOH === Na2CO3+H2O
2NaOH+H2SO4===Na2SO4+2H2O
紫色石蕊溶液遇碱显蓝色,酚酞溶液遇碱显红色
Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH
——
复分解反应
复分解反应
——
碱的主要化学性质
(1)和酸碱指示剂反应:使紫色
石蕊溶液变蓝,使无色酚酞
溶液变红
(2)碱 + 非金属氧化物 → 盐 + 水
(3)酸 + 碱 → 盐 + 水
(4)碱+ 盐 → 新盐 + 新碱
碱具有相似化学性质的原因:
在不同的碱溶液中都含有OH-
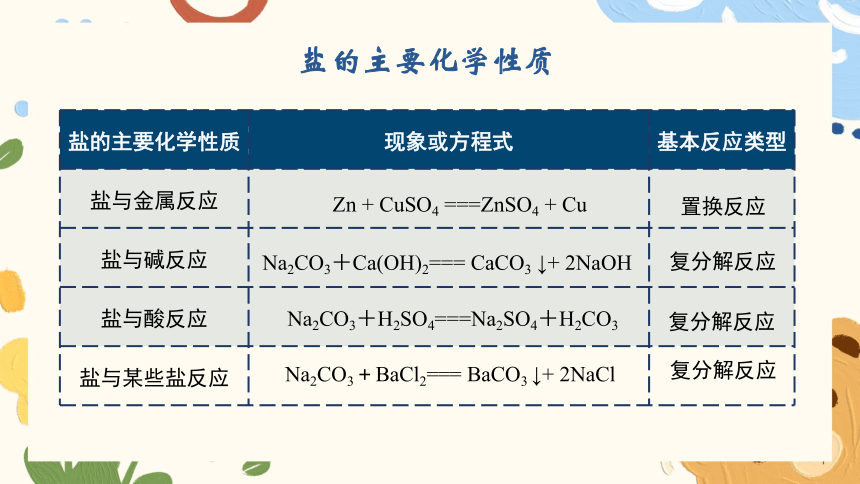
盐的主要化学性质
盐的主要化学性质 现象或方程式 基本反应类型
盐与金属反应
盐与碱反应
盐与酸反应
盐与某些盐反应
Na2CO3+Ca(OH)2=== CaCO3 ↓+ 2NaOH
Na2CO3+H2SO4===Na2SO4+H2CO3
Zn + CuSO4 ===ZnSO4 + Cu
Na2CO3+BaCl2=== BaCO3 ↓+ 2NaCl
复分解反应
复分解反应
复分解反应
置换反应
盐的主要化学性质
(1)盐 + 金属 → 新盐 + 新金属
(2)盐 + 碱 → 新盐 + 新碱
(3)盐 + 酸 → 新盐 + 新酸
(4)盐1 + 盐2 → 盐3 + 盐4
盐的组成中都含有金属阳离子(或铵根离子)和酸根离子;含有相同阳离子或阴离子的盐具有相似的化学性质
氧化物的主要化学性质
主要化学性质 现象或方程式 基本反应类型
酸性氧化物 多数能与水反应
与碱反应
与碱性氧化物反应
碱性氧化物 部分能与水反应
与酸反应
与酸性氧化物反应
CO2(少量) + Ca(OH)2 = CaCO3↓ + H2O
SO2 + CaO = CaSO3
CaO + H2O = Ca(OH)2
CuO + 2HCl = CuCl2 + H2O
SO3 + H2O = H2SO4
——
化合反应
化合反应
复分解反应
化合反应
Na2O + CO2 = Na2CO3
化合反应
四大基本反应类型
基本反应类型 反应物种类 生成物种类 反应表达式 特征 化合价变化
化合反应 两种或两种以上 一种 A+B+ →X 多变一 可变可不变
分解反应 一种 两种或两种以上 X→A+B+ 一变多 置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC 单换单 一定改变
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB 双交换价不变 一定不变
02 物质的转化
思考讨论
(1)写出下列物质之间转化的化学方程式,体会由金属单质到盐的转化关系。
① Ca → CaO → Ca(OH)2 → CaSO4
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2SO4===CaSO4↓+2NaOH
思考讨论
(1)写出下列物质之间转化的化学方程式,体会由非金属单质到盐的转化关系。
② C → CO2 → H2CO3 → CaCO3
CO2+H2O===H2CO3
Ca(OH)2+H2CO3===CaCO3↓+2H2O
C+O2===CO2
点燃
单质到盐的一般转化关系
能与水反应生成可溶性碱的常见金属氧化物只有4种:
CaO、Na2O、K2O、BaO
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
物质转化的途径
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。化学变化遵循质量守恒定律(即反应前后元素种类和原子个数不变),这是考虑如何实现物质之间的转化时最基本的依据。
物质转化需考虑的因素
考虑因素
反应进行的可能性
原料来源
成本高低
设备要求
绿色化学
化学科研工作者
化学科研工作者是指从事与化学有关的基础研究和应用研究的专业技术人员。其主要工作是:在原子、分子水平上研究物质的组成、 结构、性质及相互关系;研究物质转化的规律 和控制手段;在此基础上,研究如何实现物质的人工转化,以及如何对生活、生产和生命中的化学过程实现按需调控;等等。例如,具有特定功能(如催化作用)的新分子的合成、安全高效和节能环保物质转化工艺的研发等。这些工作不仅与经济发展、社会进步关系密切,而且是材料、生命、环境、能源和信息等现代科学技术发展的重要基础。
化学科研工作者
对科研工作具有浓厚的兴趣,具备扎实的化学专业知识和技能,掌握系统的科学研究方法,善于思考,敢于质疑,具有创新精神等是成为化学科研工作者的必要条件。化学科研工作者的就业单位很多,如高等院校、研究机构和相关企业等。化学科研工作者在推动人类社会可持续发展中必将发挥越来越重要的作用!
随堂练习
1. 类推是化学学习中常用的思维方法。下列类推正确的是( )
A. 某些金属与酸反应有气体产生,则与酸反应产生气体的物质一定是金属
B. 酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C. 单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D. 碱性溶液能使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定是碱性溶液
D
随堂练习
2. 已知:物质X与Ca(OH)2在水溶液中能发生反应,反应的化学方程式如下:X+Ca(OH)2=Y+Cu(OH)2↓。下列分析错误的是( )
A. X肯定不可能是酸
B. X和Y的相对分子质量之差为24
C. X可能是单质,也可能是化合物
D. 可以是CaCl2或Ca(NO3)2
C
随堂练习
3. 构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )
A. CuO、Ba(OH)2、CuSO4 B. NaOH、HNO3、K2CO3
C. KOH、FeCl3、Na2CO3 D. NaOH、Ba(NO3)2、H2SO4
B
随堂练习
4. KOH在我国古代纺织业中常用作漂洗的洗涤剂。古代制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是 ( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
C
感谢您的观看
“THANK YOU”
1.1.3 物质的转化
一、宏观辨识与微观探析
能从宏观上辨识酸、碱、盐等物质的性质及转化现象,从微观角度理解不同酸溶液含 H 、碱溶液含 OH 、碳酸盐溶液含碳酸根离子导致性质相似的本质,建立宏观与微观之间的联系。
二、变化观念与平衡思想
认识物质的性质和转化规律,理解元素在化学变化中不变的观念,能依据物质组成和性质分析物质间转化的可能性。
三、科学态度与社会责任
体会化学知识在工业生产制取物质中的应用,了解化学科研工作者的责任与贡献,培养严谨的科学态度,增强对化学服务社会的责任感。
核心素养目标
重点:
1. 酸、碱、盐的主要化学性质
2. 物质之间的转化关系及规律
3. 单质到盐的转化途径
难点:
1. 理解物质性质相似的微观本质
2. 根据物质组成和性质确定物质转化的方法
3. 工业制取物质时多因素综合考虑的应用
学习重难点
01 酸、碱、盐及氧化物的主要化学性质
酸的主要化学性质
酸的主要化学性质 现象或方程式 基本反应类型
与指示剂作用
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
H2SO4+Zn = ZnSO4+ H2↑
2HCl+CaO = CaCl2+H2O
H2SO4+2NaOH = Na2SO4+2H2O
H2SO4+BaCl2 = BaSO4↓+2HCl
紫色石蕊溶液遇酸显红色
置换反应
复分解反应
复分解反应
复分解反应
——
酸的主要化学性质
(1)酸和酸碱指示剂反应:使紫色
石蕊溶液变红,使无色酚酞溶
液不变色
(2)酸 + 金属氧化物 → 盐 + 水
(3)酸 + 活泼金属 → 盐 + 氢气
(4)酸 + 碱 → 盐 + 水
(5)酸 + 盐 → 新盐 + 新酸
酸具有相似化学性质的原因:
在不同的酸溶液中都含有H+
碱的主要化学性质
碱的主要化学性质 现象或方程式 基本反应类型
与指示剂作用
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
CO2+2NaOH === Na2CO3+H2O
2NaOH+H2SO4===Na2SO4+2H2O
紫色石蕊溶液遇碱显蓝色,酚酞溶液遇碱显红色
Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH
——
复分解反应
复分解反应
——
碱的主要化学性质
(1)和酸碱指示剂反应:使紫色
石蕊溶液变蓝,使无色酚酞
溶液变红
(2)碱 + 非金属氧化物 → 盐 + 水
(3)酸 + 碱 → 盐 + 水
(4)碱+ 盐 → 新盐 + 新碱
碱具有相似化学性质的原因:
在不同的碱溶液中都含有OH-
盐的主要化学性质
盐的主要化学性质 现象或方程式 基本反应类型
盐与金属反应
盐与碱反应
盐与酸反应
盐与某些盐反应
Na2CO3+Ca(OH)2=== CaCO3 ↓+ 2NaOH
Na2CO3+H2SO4===Na2SO4+H2CO3
Zn + CuSO4 ===ZnSO4 + Cu
Na2CO3+BaCl2=== BaCO3 ↓+ 2NaCl
复分解反应
复分解反应
复分解反应
置换反应
盐的主要化学性质
(1)盐 + 金属 → 新盐 + 新金属
(2)盐 + 碱 → 新盐 + 新碱
(3)盐 + 酸 → 新盐 + 新酸
(4)盐1 + 盐2 → 盐3 + 盐4
盐的组成中都含有金属阳离子(或铵根离子)和酸根离子;含有相同阳离子或阴离子的盐具有相似的化学性质
氧化物的主要化学性质
主要化学性质 现象或方程式 基本反应类型
酸性氧化物 多数能与水反应
与碱反应
与碱性氧化物反应
碱性氧化物 部分能与水反应
与酸反应
与酸性氧化物反应
CO2(少量) + Ca(OH)2 = CaCO3↓ + H2O
SO2 + CaO = CaSO3
CaO + H2O = Ca(OH)2
CuO + 2HCl = CuCl2 + H2O
SO3 + H2O = H2SO4
——
化合反应
化合反应
复分解反应
化合反应
Na2O + CO2 = Na2CO3
化合反应
四大基本反应类型
基本反应类型 反应物种类 生成物种类 反应表达式 特征 化合价变化
化合反应 两种或两种以上 一种 A+B+ →X 多变一 可变可不变
分解反应 一种 两种或两种以上 X→A+B+ 一变多 置换反应 一种单质、一种化合物 一种单质、一种化合物 A+BC→B+AC 单换单 一定改变
复分解反应 两种化合物 两种化合物 AB+CD→AD+CB 双交换价不变 一定不变
02 物质的转化
思考讨论
(1)写出下列物质之间转化的化学方程式,体会由金属单质到盐的转化关系。
① Ca → CaO → Ca(OH)2 → CaSO4
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+Na2SO4===CaSO4↓+2NaOH
思考讨论
(1)写出下列物质之间转化的化学方程式,体会由非金属单质到盐的转化关系。
② C → CO2 → H2CO3 → CaCO3
CO2+H2O===H2CO3
Ca(OH)2+H2CO3===CaCO3↓+2H2O
C+O2===CO2
点燃
单质到盐的一般转化关系
能与水反应生成可溶性碱的常见金属氧化物只有4种:
CaO、Na2O、K2O、BaO
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
物质转化的途径
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。化学变化遵循质量守恒定律(即反应前后元素种类和原子个数不变),这是考虑如何实现物质之间的转化时最基本的依据。
物质转化需考虑的因素
考虑因素
反应进行的可能性
原料来源
成本高低
设备要求
绿色化学
化学科研工作者
化学科研工作者是指从事与化学有关的基础研究和应用研究的专业技术人员。其主要工作是:在原子、分子水平上研究物质的组成、 结构、性质及相互关系;研究物质转化的规律 和控制手段;在此基础上,研究如何实现物质的人工转化,以及如何对生活、生产和生命中的化学过程实现按需调控;等等。例如,具有特定功能(如催化作用)的新分子的合成、安全高效和节能环保物质转化工艺的研发等。这些工作不仅与经济发展、社会进步关系密切,而且是材料、生命、环境、能源和信息等现代科学技术发展的重要基础。
化学科研工作者
对科研工作具有浓厚的兴趣,具备扎实的化学专业知识和技能,掌握系统的科学研究方法,善于思考,敢于质疑,具有创新精神等是成为化学科研工作者的必要条件。化学科研工作者的就业单位很多,如高等院校、研究机构和相关企业等。化学科研工作者在推动人类社会可持续发展中必将发挥越来越重要的作用!
随堂练习
1. 类推是化学学习中常用的思维方法。下列类推正确的是( )
A. 某些金属与酸反应有气体产生,则与酸反应产生气体的物质一定是金属
B. 酸与碱发生中和反应生成盐和水,则生成盐和水的反应一定是中和反应
C. 单质一定是由同种元素组成的物质,则由同种元素组成的物质一定是单质
D. 碱性溶液能使酚酞溶液变成红色,则能使酚酞溶液变成红色的溶液一定是碱性溶液
D
随堂练习
2. 已知:物质X与Ca(OH)2在水溶液中能发生反应,反应的化学方程式如下:X+Ca(OH)2=Y+Cu(OH)2↓。下列分析错误的是( )
A. X肯定不可能是酸
B. X和Y的相对分子质量之差为24
C. X可能是单质,也可能是化合物
D. 可以是CaCl2或Ca(NO3)2
C
随堂练习
3. 构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )
A. CuO、Ba(OH)2、CuSO4 B. NaOH、HNO3、K2CO3
C. KOH、FeCl3、Na2CO3 D. NaOH、Ba(NO3)2、H2SO4
B
随堂练习
4. KOH在我国古代纺织业中常用作漂洗的洗涤剂。古代制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是 ( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
C
感谢您的观看
“THANK YOU”
