黑龙江省大庆实验中学2024-2025学年高三下学期得分训练(六)化学试题(PDF版、含答案)
文档属性
| 名称 | 黑龙江省大庆实验中学2024-2025学年高三下学期得分训练(六)化学试题(PDF版、含答案) |  | |
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 10:32:44 | ||
图片预览




文档简介
大庆实验中学实验二部 2022 级高三得分训练(六)
化学试题
可能用到的相对原子质量:Mn-55 B-11 As-75
一、选择题(本题共 15 小题,每小题 3 分,共 45 分,在每小题给出的四个选项中,只有一项符合题目要求)
1.下列利用非物质文化遗产技艺生产的工艺品中,所含主要成分与其它选项不同的是
A.黑龙江佳木斯赫哲族鱼皮镂刻粘贴画 B.吉林长白山满族剪纸
C.辽宁锦州满族刺绣布衣 D.内蒙古根河鄂伦春族桦树皮画
2.下列化学用语说法正确的是
A 12.用于考古断代的核素: 6 C
B.用电子式表示KCl的形成过程:
C.H2O2 分子类型:非极性分子
D.防冻液中添加的醇的系统命名:丙二醇
3.下列实验操作或方法错误的是
A.用KSCN溶液检验FeSO4 是否变质 B.用盐酸清洗焰色试验的铂丝
C.用石灰水鉴别Na2CO3与NaHCO3 D.细碎钠屑投入乙醇中处理
4.实践出真知,下列实践项目对应的解释正确的是
选项 实践项目 化学知识
家务劳动:用洗洁精洗涤餐
A 表面活性剂在水中会形成亲水基团向内,疏水基团向外的胶束
具
B 2-消防演练:泡沫灭火器灭火 Al3+ 和CO3 相互促进水解
社区服务:用 84 消毒液进行
C 含氯消毒剂具有碱性
消毒
社会实践:用乙酸乙酯洗涤 乙酸乙酯与油漆中的成分极性都较小,根据相似相溶原理,油
D
油漆 漆易溶于乙酸乙酯
试卷第 1 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
5.下列说法错误的是
A.用溴水可以鉴别苯酚溶液、2,4-己二烯和甲苯
B.室温下,在水中的溶解度:甘油>苯酚>溴乙烷
C.核磁共振氢谱不能区分CH3CH2OH和CH3OCH3
D.两种二肽互为同分异构体,二者的水解产物可能相同
6.科学家成功分离并表征了一种含有碳-碳单电子 σ 键的化合物。这一重要突破源于对六苯基乙烷(HPE)衍
生物的巧妙处理。HPE 的结构如下:
下列说法错误的是
A.HPE 中碳原子的杂化方式为 sp2、 sp3 B.HPE 中所有原子在同一平面上
C.HPE 的一硝基取代物有三种 D.HPE 的分子式为C38H30
7.W、X、Y、Z 为原子序数依次增大的短周期元素,Y 和 Z 同主族。化学式为 XW4 Z Y2 2 8的盐有强氧化
性,其阴离子的结构如图所示。下列说法正确的是
A.简单离子半径:W < X < Y < Z
B.第一电离能由大到小排序:X>Y>Z
C.最简单氢化物的沸点:X > Y
D. XW4 Z2 2Y8具有强氧化性是因为 Z 元素呈+7价
8.沉淀的转化在科研和生产中具有重要的应用价值。例如,锅炉水垢既会降低燃料的利用率,造成能源浪
费,又会影响锅炉的使用寿命,并形成安全隐患,因此要定期除去水垢,下列说法不正确的是
A.相同温度下,在水中溶解度:CaCO3 < CaSO4
B 2- 2-.沉淀转化离子反应为:CaSO4 s + CO3 aq CaCO3 s + SO4 aq
试卷第 2 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
C.转化生成的CaCO3可以进一步加盐酸除去
D.过程中涉及化学物质Na2CO3是强电解质,而CaSO4、CaCO3是弱电解质
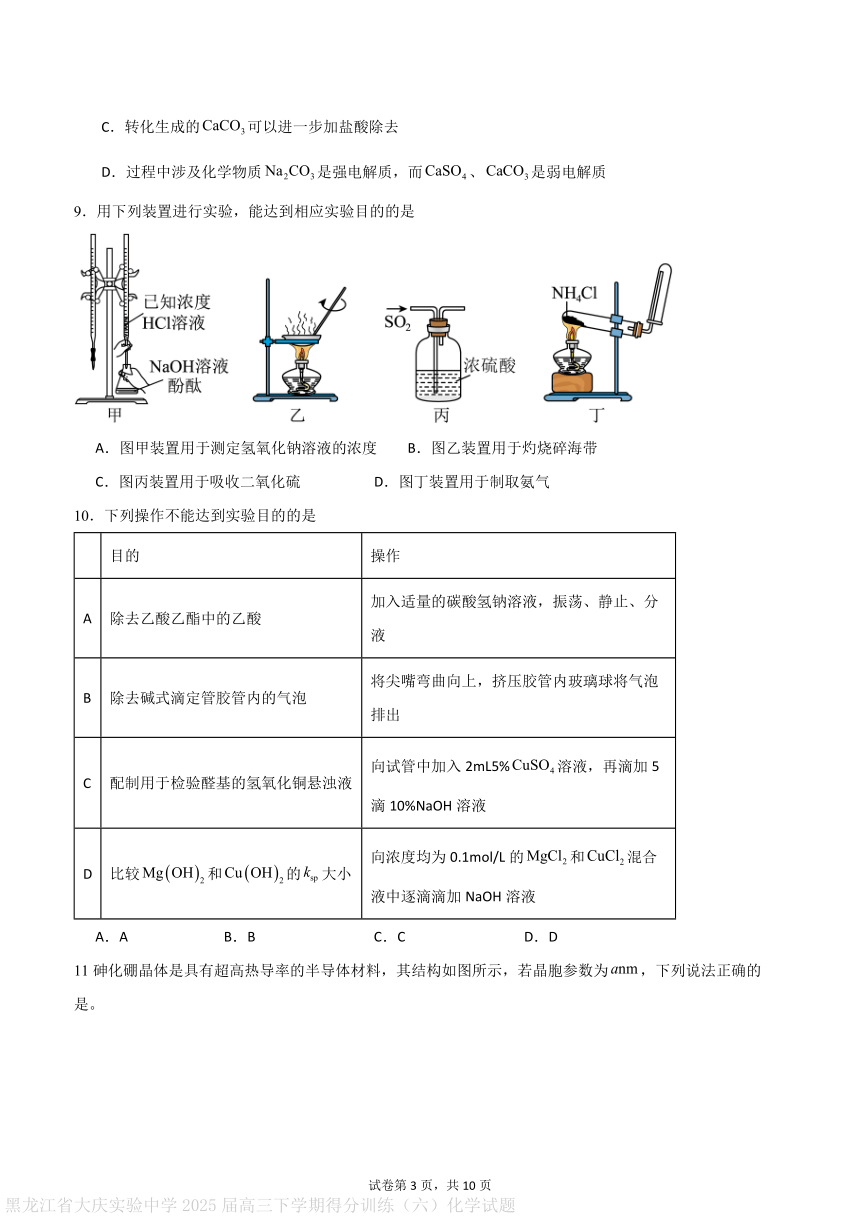
9.用下列装置进行实验,能达到相应实验目的的是
A.图甲装置用于测定氢氧化钠溶液的浓度 B.图乙装置用于灼烧碎海带
C.图丙装置用于吸收二氧化硫 D.图丁装置用于制取氨气
10.下列操作不能达到实验目的的是
目的 操作
加入适量的碳酸氢钠溶液,振荡、静止、分
A 除去乙酸乙酯中的乙酸
液
将尖嘴弯曲向上,挤压胶管内玻璃球将气泡
B 除去碱式滴定管胶管内的气泡
排出
向试管中加入 2mL5% CuSO4 溶液,再滴加 5
C 配制用于检验醛基的氢氧化铜悬浊液
滴 10%NaOH 溶液
向浓度均为 0.1mol/L 的MgCl2 和CuCl2 混合
D 比较Mg OH 和Cu OH2 2的 ksp 大小
液中逐滴滴加 NaOH 溶液
A.A B.B C.C D.D
11 砷化硼晶体是具有超高热导率的半导体材料,其结构如图所示,若晶胞参数为 anm,下列说法正确的
是。
试卷第 3 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
A.砷化硼的化学式为B7As4
B.与顶点 B 原子距离最近且等距的 B 原子有 6 个
C.B、As 3原子之间的最短距离为 anm
4
344
D -3.该晶体的密度为 g cmN a3A
12.以废旧铅酸电池中的含铅废料(含 Pb、PbO、PbO2、PbSO4 及炭黑等)和 H2SO4 为原料制备高纯 PbO 的工
艺流程如图所示:
下列说法中错误的是
A.预处理时可以将含铅废料进行粉碎,有利于加快反应速率
B.滤液 1 的主要成分为 Na2SO4
Δ
C II 2+ -.过程 的主反应离子方程式为 Pb + 2OH PbO +H2O
D.上述过程中可用FeO代替FeSO4
13.下列陈述 I 与陈述 II 不存在因果关系的是
选项 陈述 I 陈述 II
A 稳定性:H2O > H2S 键能:H-O>H-S
B 沸点:乙醇>乙醛 相对分子质量:乙醇>乙醛
C 酸性:CF3COOH > CCl3COOH 电负性:F>Cl
D 碱性:NaOH > Mg OH 2 金属性:Na>Mg
试卷第 4 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
A.A B.B C.C D.D
14.我国科学家设计了一种水系S - MnO2 可充电电池,其工作原理如图所示。
下列说法正确的是
A.充电时,电子由电极 b 经导线流回电源的正极
B.充电时,阳极附近溶液的 pH 增大
C - 2+.放电时,负极的电极反应:Cu2S - 4e = S + 2Cu
D.放电时,溶液中Cu 2+ 向电极 b 方向迁移
15.在 25℃时,向两份10mL0.2mol L-1的CH3COONH4溶液 pH = 7 中分别滴加浓度均为0.2mol L-1的盐酸和
NaOH 溶液。部分离子浓度随加入溶液体积的变化如图所示。下列说法不正确的是
A.相同条件下,醋酸和一水合氨的电离平衡常数相等
B - -. b 点: c CH3COOH + c CH3COO = 2c Cl
C.水的电离程度: a > c = d
D. b 点 c Cl- 和d 点 c Na+ - +存在的关系是 2c Cl = c Na
二、非选择题(本题共 4 小题,共 55 分)
16.(14 分)以辉铋矿(主要成分为 Bi2S3,含有 CuS、FeS2、SiO2 杂质)和软锰矿(主要成分为 MnO2)为原料联合
制备 BiOCl 和 MnSO4 H2O 的工艺流程如图:
试卷第 5 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
离子 开始沉淀 pH 完全沉淀 pH
Fe2+ 6.3 8.3
Fe3+ 1.6 3.1
已知:①金属活动性:Fe>Bi>Cu。
②Bi3+易水解为 BiOCl 沉淀;常温下,BiOCl 存在的 pH 范围约为 2.0~11.0。
③常温下,该工艺中有关金属离子开始沉淀和完全沉淀的 pH 见表。
(1)“联合焙烧”时 Bi2S3、FeS2、CuS 分别转化为 Bi2O3、Fe2O3、CuO,写出生成 MnSO4 和 Bi2O3 的化学方程
式: 。
(2)“浸出”时需及时补充浓盐酸调节浸取液的 pH≈l.4,其目的是 。
(3)“滤渣 1”的主要成分为 (填化学式)。
(4)“转化”时加入足量金属 Bi 的目的是 (用离子方程式表示)。
(5)为保证 BiOCl 产品的纯度,理论上“沉铋”时应控制溶液的 pH 范围为 。
(6)将 100kg 辉铋矿进行“联合焙烧”,“转化”时消耗 2.0kg 金属 Bi,假设其余各步损失不计,干燥后称量 BiOCl
产品质量为 47.5kg,滴定测得产品中 Bi 的质量分数为 80.0%。辉铋矿中 Bi 元素的质量分数为 %(保留
3 位有效数字)。
(7)已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图所示。则从“滤液 2”中获得较高纯度
MnSO4 H2O 的“操作 I”为控制温度在 80~90℃、 、 、用 80~90℃蒸馏水洗涤 2~3 次、真空干燥。
试卷第 6 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
17.(13 分)电解原理具有广泛的应用。某实验小组按照课本内容进行电解CuCl2溶液实验。
I.溶液配制:
(1)若要配制 1000mL 2mol/L 的CuCl2溶液,为使配制过程中不出现浑浊现象,至少需要滴加 0.2mol/L 的盐酸
滴。(已知:K S[Cu(OH)2] =2.0 × 10 ,每滴溶液的体积约 0.05mL,加入盐酸后溶液体积变化忽略不计)
(2)配制过程中下图所示操作的先后顺序为 (填编号)
(3)氯化铜溶液中存在:[Cu(H2O)4]
2+(蓝色) +4Cl [CuCl ]24 (黄色) +4H2O ΔH >0,加热盛有CuCl2溶液的
试管,试管中溶液颜色变为 。
II.电解CuCl2溶液
(4)按下图装置进行电解饱和CuCl2溶液实验:阳极口放置湿润的淀粉 KI试纸可观察
到 。(填实验现象)
(5)按上图电解饱和CuCl2溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大
量白色固体。
探究异常现象:
试卷第 7 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
已知:ⅰ.相关物质颜色:铜(红色)、Cu2O(砖红色)、CuCl(白色)、CuOH(黄色,不稳定,易分解)。
ⅱ.CuCl易溶于浓盐酸,CuCl(s) + Cl (aq) [CuCl2]
(aq)
ⅲ.Cu+在水中不稳定,易发生歧化反应。
经检验:红色固体中无Cu2O。
提出假设:红色固体是铜,白色固体是CuCl。
验证假设:设计下表实验。
序号 实验操作 实验现象
石墨棒上红色和白色物质都消失;无色溶
将有固体析出的石墨棒一端插入盛
液变蓝色,并有无色气体产生,在接近试
A 2mL 稀硝酸试管中,反应完后取出,
管口处变红色;加入AgNO3溶液产生白色
再向试管中滴加几滴AgNO3溶液
沉淀。
将有固体析出的石墨棒一端插入盛
石墨棒上红色固体不溶,白色固体消失,
B 2mLI 的试管中,反应完后取出,再向
溶液无色;加水后出现白色沉淀。
试管中加入一定量的水
①实验 A 石墨棒上红色物质消失的离子方程式为 。
②上表中空格处应填写的内容是:Ⅰ 。
③实验 B 加水后出现白色沉淀的原因是 。
结论:猜想正确。
(6)阴极生成CuCl的电极反应式为 。
18.(14 分)乙酸(CH3COOH)是重要的化工原料,Cativa 法是生产乙酸常用的方法,在催化剂作用下,
乙酸产率高,恒压下,向某装有催化剂的密闭容器中充入一定量的CH3OH g 和 CO(g),发生如下反应:
主反应:CH3OH g + CO g = CH3COOH g DH1
副反应:CH3OH g + CH3COOH g = CH3COOCH3 g + H2O g DH2
回答下列问题:
(1) 从热力学角度分析,主反应的 H1 0(填“<”或“>”)。已知该反应的正、逆反应的活化能分别为
E kJ mol-1正 和E逆 kJ mol
-1
,且生成物的总能量为 e kJ mol-1,则反应物的总能量为
kJ mol-1(用含E e正、E逆和 的代数式表示)。
试卷第 8 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
(2)若在密闭容器中按照物质的量之比 1:2 通入 CH3OH 和 CO 只进行主反应(起始投料量相同),调控外界条
件,进行 a、b 两组实验,实验 b 在容积为 VL 的恒容容器中进行,反应体系总压强随时间变化如图所示。
图中实验 b 反应从开始到平衡时的反应速率 v(CH3OH) kPa min -1 ;根据实验 b,列出 Kp=
(以分数形式表示);与实验 b 相比,实验 a 改变的条件是 。
(3)体系中同时发生两个反应,在不同温度下,达到平衡时,测得两种含碳产物的分布分数
é
n CH COOH
ù
δ êδ CH3COOH
= 3
ê n CH3COOH + n CH3COOCH
ú 随投料比 x(物质的量之比)的变化关系如图所示。
3 ú
①下列说法正确的是______________(单选)
n CH3OH a.投料比 x 代表 n CO
b.L、M 两点的甲醇的平衡转化率:α(M)>α(L)
c.曲线 c 代表乙酸的分布分数
②请根据图中曲线,判断副反应的DH2 0(填“<”或“>”),理由
19.(14 分)1.化合物 I 是药物合成的中间体,其合成路线如图所示。
试卷第 9 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
回答下列问题:
(1)G 中含氧官能团的名称为 。
(2)B→C 的反应类型为 。
(3)F 的结构简式为 。
(4)G 与足量的氢氧化钠溶液在加热条件下反应的化学方程式为 。
(5)关于化合物 I,下列说法正确的是 (填字母)。
a.I 可以发生银镜反应,也可以与盐酸发生反应
b.1 个 I 分子中含有 2 个手性碳原子
c.1mol I 分子含有 sp3 杂化的原子个数为8NA
d.I 分子间只存在氢键,不存在范德华力
(6)符合下列条件的 A 的同分异构体有 种。
①分子中含有苯环
②分子中含有-NO2,且-NO2与苯环直接相连
③可以与新制氢氧化铜悬浊液在加热的条件下产生砖红色沉淀
(7)由 合成 的路线如下(反应条件略
去),其中 J 和 K 的结构简式分别为 和 。
试卷第 10 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
化学得分训练(六)答案
一、单选题(每题 3分,共 45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 A B C D C B B D A C C C B C D
二、非选择题(共 55分)
16.(13 分)
焙烧
(1)2Bi2S3+6MnO2+9O2 2Bi2O3+6MnSO4
(2)增大H+浓度,使Bi3+充分浸出,同时抑制Bi3+(Fe3+、Cu2+)水解
(3)SiO2
(4)Bi+3Fe3+=Bi3++3Fe2+、2Bi+3Cu2+=3Cu+2Bi3+
(5)2≤pH<6.3 (6)36.0 (7) 蒸发结晶 趁热过滤
17. (14 分)
(1)10(2分) (2)④⑥③⑤②①(2分) (3)黄绿色(1分)(答黄色不得分) (4)试纸变蓝(1分)
(5)①3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O(2分)②浓盐酸(2分)
③稀释后Cl-浓度减小,与CuCl配位能力减弱,产生白色沉淀(2分)Cu2++e-+Cl-=CuCl(2分)
18.(14 分)
(1) < (e+E逆-E正) (2) 3/8或0.375 1/315 加压并降温
(3)b ΔH2 0 T1 δ CH3COOCH3 T2 δ CH COOCH 当同一投料比时,观察可知 时 大于 时 3 3 ,由T2>T1可知,
δ CH3COOCH温度越高则 3 ΔH 0越小,说明温度升高副反应的平衡逆向移动, 2
19.(14 分)
(1)酯基、酰胺基 (2)加成(还原)反应
(3)
(4)
(5)ab
(6)13
(7)
{#{QQABaYQUoggAAhBAARhCAQ0oCEKQkAEACYoGwAAYIAAAwQNABAA=}#}
化学试题
可能用到的相对原子质量:Mn-55 B-11 As-75
一、选择题(本题共 15 小题,每小题 3 分,共 45 分,在每小题给出的四个选项中,只有一项符合题目要求)
1.下列利用非物质文化遗产技艺生产的工艺品中,所含主要成分与其它选项不同的是
A.黑龙江佳木斯赫哲族鱼皮镂刻粘贴画 B.吉林长白山满族剪纸
C.辽宁锦州满族刺绣布衣 D.内蒙古根河鄂伦春族桦树皮画
2.下列化学用语说法正确的是
A 12.用于考古断代的核素: 6 C
B.用电子式表示KCl的形成过程:
C.H2O2 分子类型:非极性分子
D.防冻液中添加的醇的系统命名:丙二醇
3.下列实验操作或方法错误的是
A.用KSCN溶液检验FeSO4 是否变质 B.用盐酸清洗焰色试验的铂丝
C.用石灰水鉴别Na2CO3与NaHCO3 D.细碎钠屑投入乙醇中处理
4.实践出真知,下列实践项目对应的解释正确的是
选项 实践项目 化学知识
家务劳动:用洗洁精洗涤餐
A 表面活性剂在水中会形成亲水基团向内,疏水基团向外的胶束
具
B 2-消防演练:泡沫灭火器灭火 Al3+ 和CO3 相互促进水解
社区服务:用 84 消毒液进行
C 含氯消毒剂具有碱性
消毒
社会实践:用乙酸乙酯洗涤 乙酸乙酯与油漆中的成分极性都较小,根据相似相溶原理,油
D
油漆 漆易溶于乙酸乙酯
试卷第 1 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
5.下列说法错误的是
A.用溴水可以鉴别苯酚溶液、2,4-己二烯和甲苯
B.室温下,在水中的溶解度:甘油>苯酚>溴乙烷
C.核磁共振氢谱不能区分CH3CH2OH和CH3OCH3
D.两种二肽互为同分异构体,二者的水解产物可能相同
6.科学家成功分离并表征了一种含有碳-碳单电子 σ 键的化合物。这一重要突破源于对六苯基乙烷(HPE)衍
生物的巧妙处理。HPE 的结构如下:
下列说法错误的是
A.HPE 中碳原子的杂化方式为 sp2、 sp3 B.HPE 中所有原子在同一平面上
C.HPE 的一硝基取代物有三种 D.HPE 的分子式为C38H30
7.W、X、Y、Z 为原子序数依次增大的短周期元素,Y 和 Z 同主族。化学式为 XW4 Z Y2 2 8的盐有强氧化
性,其阴离子的结构如图所示。下列说法正确的是
A.简单离子半径:W < X < Y < Z
B.第一电离能由大到小排序:X>Y>Z
C.最简单氢化物的沸点:X > Y
D. XW4 Z2 2Y8具有强氧化性是因为 Z 元素呈+7价
8.沉淀的转化在科研和生产中具有重要的应用价值。例如,锅炉水垢既会降低燃料的利用率,造成能源浪
费,又会影响锅炉的使用寿命,并形成安全隐患,因此要定期除去水垢,下列说法不正确的是
A.相同温度下,在水中溶解度:CaCO3 < CaSO4
B 2- 2-.沉淀转化离子反应为:CaSO4 s + CO3 aq CaCO3 s + SO4 aq
试卷第 2 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
C.转化生成的CaCO3可以进一步加盐酸除去
D.过程中涉及化学物质Na2CO3是强电解质,而CaSO4、CaCO3是弱电解质
9.用下列装置进行实验,能达到相应实验目的的是
A.图甲装置用于测定氢氧化钠溶液的浓度 B.图乙装置用于灼烧碎海带
C.图丙装置用于吸收二氧化硫 D.图丁装置用于制取氨气
10.下列操作不能达到实验目的的是
目的 操作
加入适量的碳酸氢钠溶液,振荡、静止、分
A 除去乙酸乙酯中的乙酸
液
将尖嘴弯曲向上,挤压胶管内玻璃球将气泡
B 除去碱式滴定管胶管内的气泡
排出
向试管中加入 2mL5% CuSO4 溶液,再滴加 5
C 配制用于检验醛基的氢氧化铜悬浊液
滴 10%NaOH 溶液
向浓度均为 0.1mol/L 的MgCl2 和CuCl2 混合
D 比较Mg OH 和Cu OH2 2的 ksp 大小
液中逐滴滴加 NaOH 溶液
A.A B.B C.C D.D
11 砷化硼晶体是具有超高热导率的半导体材料,其结构如图所示,若晶胞参数为 anm,下列说法正确的
是。
试卷第 3 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
A.砷化硼的化学式为B7As4
B.与顶点 B 原子距离最近且等距的 B 原子有 6 个
C.B、As 3原子之间的最短距离为 anm
4
344
D -3.该晶体的密度为 g cmN a3A
12.以废旧铅酸电池中的含铅废料(含 Pb、PbO、PbO2、PbSO4 及炭黑等)和 H2SO4 为原料制备高纯 PbO 的工
艺流程如图所示:
下列说法中错误的是
A.预处理时可以将含铅废料进行粉碎,有利于加快反应速率
B.滤液 1 的主要成分为 Na2SO4
Δ
C II 2+ -.过程 的主反应离子方程式为 Pb + 2OH PbO +H2O
D.上述过程中可用FeO代替FeSO4
13.下列陈述 I 与陈述 II 不存在因果关系的是
选项 陈述 I 陈述 II
A 稳定性:H2O > H2S 键能:H-O>H-S
B 沸点:乙醇>乙醛 相对分子质量:乙醇>乙醛
C 酸性:CF3COOH > CCl3COOH 电负性:F>Cl
D 碱性:NaOH > Mg OH 2 金属性:Na>Mg
试卷第 4 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
A.A B.B C.C D.D
14.我国科学家设计了一种水系S - MnO2 可充电电池,其工作原理如图所示。
下列说法正确的是
A.充电时,电子由电极 b 经导线流回电源的正极
B.充电时,阳极附近溶液的 pH 增大
C - 2+.放电时,负极的电极反应:Cu2S - 4e = S + 2Cu
D.放电时,溶液中Cu 2+ 向电极 b 方向迁移
15.在 25℃时,向两份10mL0.2mol L-1的CH3COONH4溶液 pH = 7 中分别滴加浓度均为0.2mol L-1的盐酸和
NaOH 溶液。部分离子浓度随加入溶液体积的变化如图所示。下列说法不正确的是
A.相同条件下,醋酸和一水合氨的电离平衡常数相等
B - -. b 点: c CH3COOH + c CH3COO = 2c Cl
C.水的电离程度: a > c = d
D. b 点 c Cl- 和d 点 c Na+ - +存在的关系是 2c Cl = c Na
二、非选择题(本题共 4 小题,共 55 分)
16.(14 分)以辉铋矿(主要成分为 Bi2S3,含有 CuS、FeS2、SiO2 杂质)和软锰矿(主要成分为 MnO2)为原料联合
制备 BiOCl 和 MnSO4 H2O 的工艺流程如图:
试卷第 5 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
离子 开始沉淀 pH 完全沉淀 pH
Fe2+ 6.3 8.3
Fe3+ 1.6 3.1
已知:①金属活动性:Fe>Bi>Cu。
②Bi3+易水解为 BiOCl 沉淀;常温下,BiOCl 存在的 pH 范围约为 2.0~11.0。
③常温下,该工艺中有关金属离子开始沉淀和完全沉淀的 pH 见表。
(1)“联合焙烧”时 Bi2S3、FeS2、CuS 分别转化为 Bi2O3、Fe2O3、CuO,写出生成 MnSO4 和 Bi2O3 的化学方程
式: 。
(2)“浸出”时需及时补充浓盐酸调节浸取液的 pH≈l.4,其目的是 。
(3)“滤渣 1”的主要成分为 (填化学式)。
(4)“转化”时加入足量金属 Bi 的目的是 (用离子方程式表示)。
(5)为保证 BiOCl 产品的纯度,理论上“沉铋”时应控制溶液的 pH 范围为 。
(6)将 100kg 辉铋矿进行“联合焙烧”,“转化”时消耗 2.0kg 金属 Bi,假设其余各步损失不计,干燥后称量 BiOCl
产品质量为 47.5kg,滴定测得产品中 Bi 的质量分数为 80.0%。辉铋矿中 Bi 元素的质量分数为 %(保留
3 位有效数字)。
(7)已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图所示。则从“滤液 2”中获得较高纯度
MnSO4 H2O 的“操作 I”为控制温度在 80~90℃、 、 、用 80~90℃蒸馏水洗涤 2~3 次、真空干燥。
试卷第 6 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
17.(13 分)电解原理具有广泛的应用。某实验小组按照课本内容进行电解CuCl2溶液实验。
I.溶液配制:
(1)若要配制 1000mL 2mol/L 的CuCl2溶液,为使配制过程中不出现浑浊现象,至少需要滴加 0.2mol/L 的盐酸
滴。(已知:K S[Cu(OH)2] =2.0 × 10 ,每滴溶液的体积约 0.05mL,加入盐酸后溶液体积变化忽略不计)
(2)配制过程中下图所示操作的先后顺序为 (填编号)
(3)氯化铜溶液中存在:[Cu(H2O)4]
2+(蓝色) +4Cl [CuCl ]24 (黄色) +4H2O ΔH >0,加热盛有CuCl2溶液的
试管,试管中溶液颜色变为 。
II.电解CuCl2溶液
(4)按下图装置进行电解饱和CuCl2溶液实验:阳极口放置湿润的淀粉 KI试纸可观察
到 。(填实验现象)
(5)按上图电解饱和CuCl2溶液一段时间后,阴极石墨棒上有异常现象:石墨棒上除有红色固体外还附着有大
量白色固体。
探究异常现象:
试卷第 7 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
已知:ⅰ.相关物质颜色:铜(红色)、Cu2O(砖红色)、CuCl(白色)、CuOH(黄色,不稳定,易分解)。
ⅱ.CuCl易溶于浓盐酸,CuCl(s) + Cl (aq) [CuCl2]
(aq)
ⅲ.Cu+在水中不稳定,易发生歧化反应。
经检验:红色固体中无Cu2O。
提出假设:红色固体是铜,白色固体是CuCl。
验证假设:设计下表实验。
序号 实验操作 实验现象
石墨棒上红色和白色物质都消失;无色溶
将有固体析出的石墨棒一端插入盛
液变蓝色,并有无色气体产生,在接近试
A 2mL 稀硝酸试管中,反应完后取出,
管口处变红色;加入AgNO3溶液产生白色
再向试管中滴加几滴AgNO3溶液
沉淀。
将有固体析出的石墨棒一端插入盛
石墨棒上红色固体不溶,白色固体消失,
B 2mLI 的试管中,反应完后取出,再向
溶液无色;加水后出现白色沉淀。
试管中加入一定量的水
①实验 A 石墨棒上红色物质消失的离子方程式为 。
②上表中空格处应填写的内容是:Ⅰ 。
③实验 B 加水后出现白色沉淀的原因是 。
结论:猜想正确。
(6)阴极生成CuCl的电极反应式为 。
18.(14 分)乙酸(CH3COOH)是重要的化工原料,Cativa 法是生产乙酸常用的方法,在催化剂作用下,
乙酸产率高,恒压下,向某装有催化剂的密闭容器中充入一定量的CH3OH g 和 CO(g),发生如下反应:
主反应:CH3OH g + CO g = CH3COOH g DH1
副反应:CH3OH g + CH3COOH g = CH3COOCH3 g + H2O g DH2
回答下列问题:
(1) 从热力学角度分析,主反应的 H1 0(填“<”或“>”)。已知该反应的正、逆反应的活化能分别为
E kJ mol-1正 和E逆 kJ mol
-1
,且生成物的总能量为 e kJ mol-1,则反应物的总能量为
kJ mol-1(用含E e正、E逆和 的代数式表示)。
试卷第 8 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
(2)若在密闭容器中按照物质的量之比 1:2 通入 CH3OH 和 CO 只进行主反应(起始投料量相同),调控外界条
件,进行 a、b 两组实验,实验 b 在容积为 VL 的恒容容器中进行,反应体系总压强随时间变化如图所示。
图中实验 b 反应从开始到平衡时的反应速率 v(CH3OH) kPa min -1 ;根据实验 b,列出 Kp=
(以分数形式表示);与实验 b 相比,实验 a 改变的条件是 。
(3)体系中同时发生两个反应,在不同温度下,达到平衡时,测得两种含碳产物的分布分数
é
n CH COOH
ù
δ êδ CH3COOH
= 3
ê n CH3COOH + n CH3COOCH
ú 随投料比 x(物质的量之比)的变化关系如图所示。
3 ú
①下列说法正确的是______________(单选)
n CH3OH a.投料比 x 代表 n CO
b.L、M 两点的甲醇的平衡转化率:α(M)>α(L)
c.曲线 c 代表乙酸的分布分数
②请根据图中曲线,判断副反应的DH2 0(填“<”或“>”),理由
19.(14 分)1.化合物 I 是药物合成的中间体,其合成路线如图所示。
试卷第 9 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
回答下列问题:
(1)G 中含氧官能团的名称为 。
(2)B→C 的反应类型为 。
(3)F 的结构简式为 。
(4)G 与足量的氢氧化钠溶液在加热条件下反应的化学方程式为 。
(5)关于化合物 I,下列说法正确的是 (填字母)。
a.I 可以发生银镜反应,也可以与盐酸发生反应
b.1 个 I 分子中含有 2 个手性碳原子
c.1mol I 分子含有 sp3 杂化的原子个数为8NA
d.I 分子间只存在氢键,不存在范德华力
(6)符合下列条件的 A 的同分异构体有 种。
①分子中含有苯环
②分子中含有-NO2,且-NO2与苯环直接相连
③可以与新制氢氧化铜悬浊液在加热的条件下产生砖红色沉淀
(7)由 合成 的路线如下(反应条件略
去),其中 J 和 K 的结构简式分别为 和 。
试卷第 10 页,共 10 页
黑龙江省大庆实验中学 2025届高三下学期得分训练(六)化学试题
化学得分训练(六)答案
一、单选题(每题 3分,共 45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 A B C D C B B D A C C C B C D
二、非选择题(共 55分)
16.(13 分)
焙烧
(1)2Bi2S3+6MnO2+9O2 2Bi2O3+6MnSO4
(2)增大H+浓度,使Bi3+充分浸出,同时抑制Bi3+(Fe3+、Cu2+)水解
(3)SiO2
(4)Bi+3Fe3+=Bi3++3Fe2+、2Bi+3Cu2+=3Cu+2Bi3+
(5)2≤pH<6.3 (6)36.0 (7) 蒸发结晶 趁热过滤
17. (14 分)
(1)10(2分) (2)④⑥③⑤②①(2分) (3)黄绿色(1分)(答黄色不得分) (4)试纸变蓝(1分)
(5)①3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O(2分)②浓盐酸(2分)
③稀释后Cl-浓度减小,与CuCl配位能力减弱,产生白色沉淀(2分)Cu2++e-+Cl-=CuCl(2分)
18.(14 分)
(1) < (e+E逆-E正) (2) 3/8或0.375 1/315 加压并降温
(3)b ΔH2 0 T1 δ CH3COOCH3 T2 δ CH COOCH 当同一投料比时,观察可知 时 大于 时 3 3 ,由T2>T1可知,
δ CH3COOCH温度越高则 3 ΔH 0越小,说明温度升高副反应的平衡逆向移动, 2
19.(14 分)
(1)酯基、酰胺基 (2)加成(还原)反应
(3)
(4)
(5)ab
(6)13
(7)
{#{QQABaYQUoggAAhBAARhCAQ0oCEKQkAEACYoGwAAYIAAAwQNABAA=}#}
同课章节目录
