2025年中考化学三轮冲刺热点训练 微型实验(含答案)
文档属性
| 名称 | 2025年中考化学三轮冲刺热点训练 微型实验(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 605.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 10:40:51 | ||
图片预览

文档简介
微型实验
1.如图,将注射器中的溶液缓缓推入V形管,并用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧。下列说法不正确的是
A.此实验可以说明燃烧需要可燃物与充足的氧气接触
B.实验过程中观察到白磷燃烧产生大量白烟
C.将注射器撤掉,向V形管中通入CO2,白磷很快停止燃烧,其灭火原理是隔绝氧气
D.该微型实验的优点是装置简单、节约药品、减少污染
2.依据如图进行实验(加持仪器略去),实验过程:①通入N2,点燃酒精灯,一段时间后,a、b中无明显现象②改通O2后片刻,熄灭酒精灯,b中红磷燃烧。下列说法错误的是
A.实验过程①要先通入N2一段时间,再点燃酒精灯
B.实验过程②的a中无明显现象
C.对比①②两个实验过程b中的实验现象,可知燃烧物燃烧需要氧气
D.红磷燃烧,产生大量白色烟雾
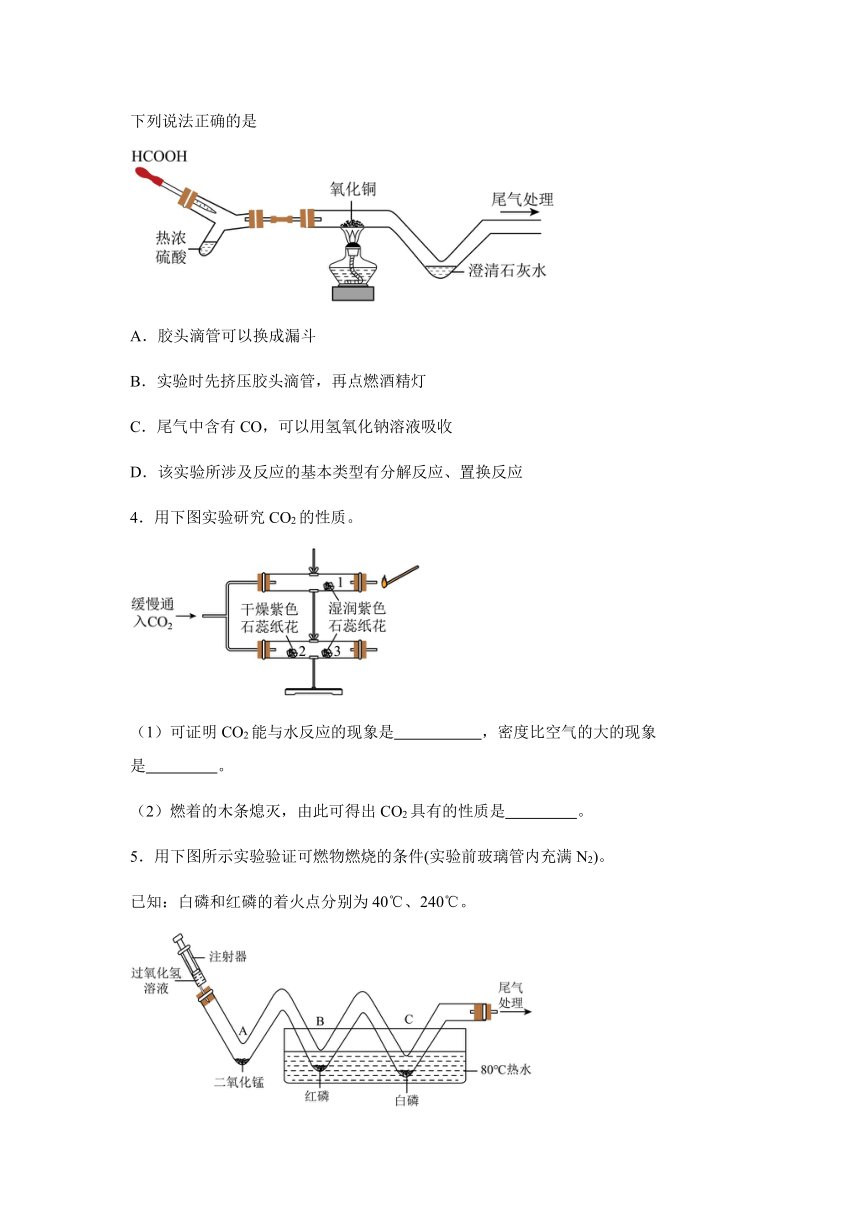
3.如图是CO还原氧化铜的实验装置(夹持仪器等略)。已知:HCOOH H2O+CO↑,下列说法正确的是
A.胶头滴管可以换成漏斗
B.实验时先挤压胶头滴管,再点燃酒精灯
C.尾气中含有CO,可以用氢氧化钠溶液吸收
D.该实验所涉及反应的基本类型有分解反应、置换反应
4.用下图实验研究CO2的性质。
(1)可证明CO2能与水反应的现象是 ,密度比空气的大的现象是 。
(2)燃着的木条熄灭,由此可得出CO2具有的性质是 。
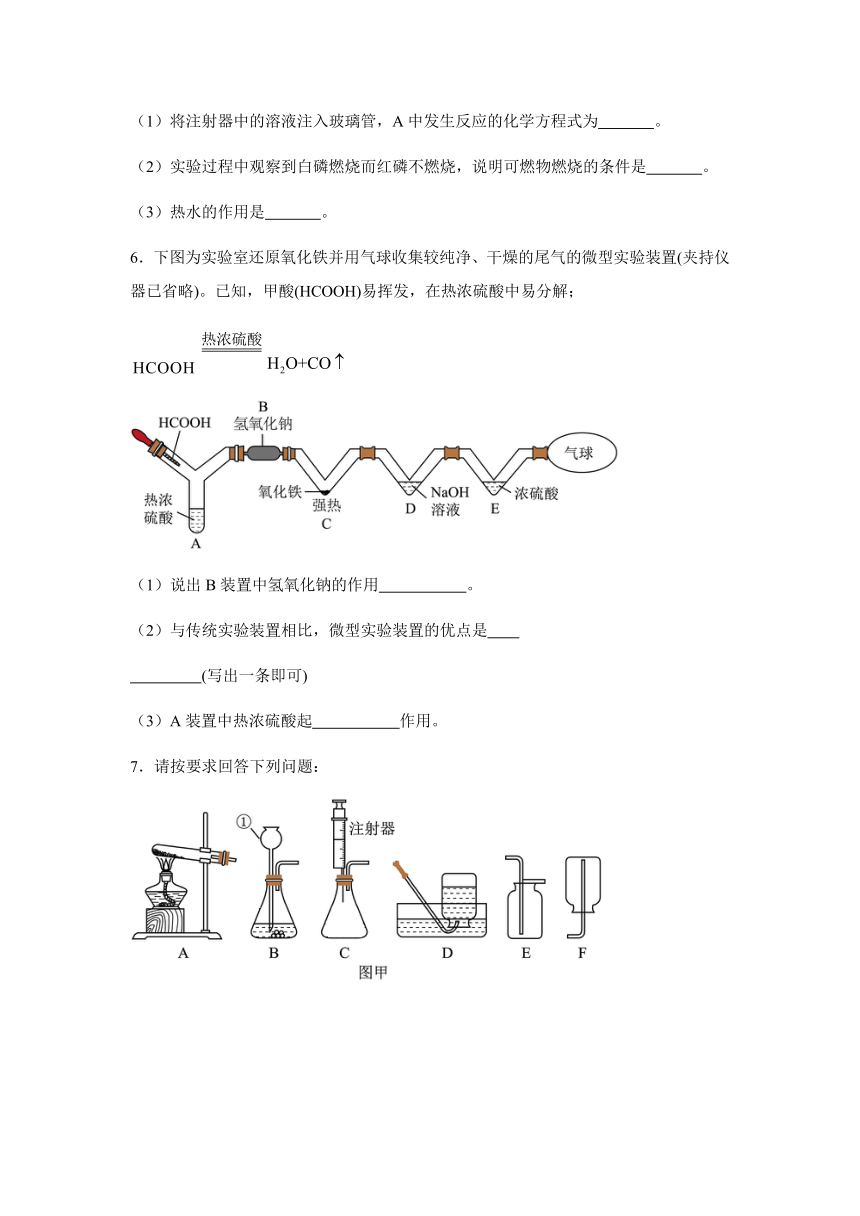
5.用下图所示实验验证可燃物燃烧的条件(实验前玻璃管内充满N2)。
已知:白磷和红磷的着火点分别为40℃、240℃。
(1)将注射器中的溶液注入玻璃管,A中发生反应的化学方程式为 。
(2)实验过程中观察到白磷燃烧而红磷不燃烧,说明可燃物燃烧的条件是 。
(3)热水的作用是 。
6.下图为实验室还原氧化铁并用气球收集较纯净、干燥的尾气的微型实验装置(夹持仪器已省略)。已知,甲酸(HCOOH)易挥发,在热浓硫酸中易分解;
(1)说出B装置中氢氧化钠的作用 。
(2)与传统实验装置相比,微型实验装置的优点是
(写出一条即可)
(3)A装置中热浓硫酸起 作用。
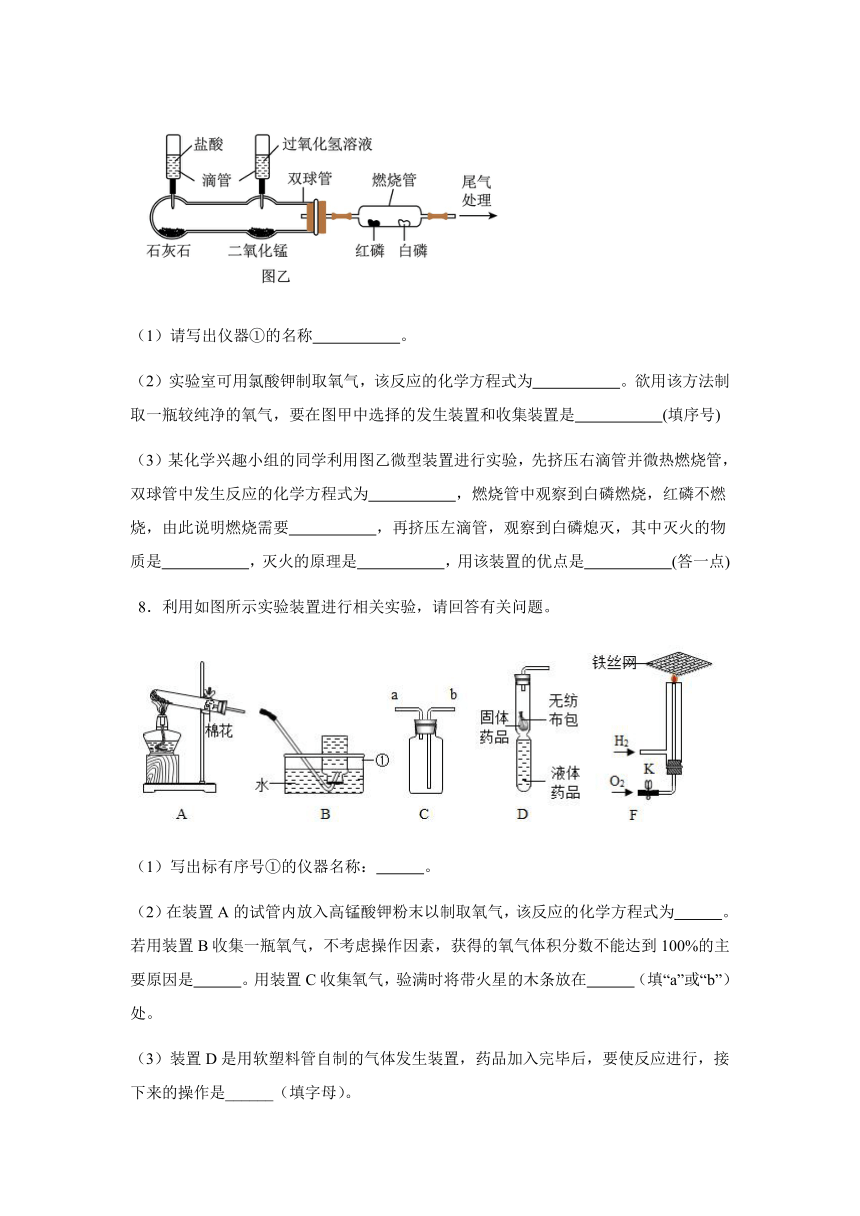
7.请按要求回答下列问题:
(1)请写出仪器①的名称 。
(2)实验室可用氯酸钾制取氧气,该反应的化学方程式为 。欲用该方法制取一瓶较纯净的氧气,要在图甲中选择的发生装置和收集装置是 (填序号)
(3)某化学兴趣小组的同学利用图乙微型装置进行实验,先挤压右滴管并微热燃烧管,双球管中发生反应的化学方程式为 ,燃烧管中观察到白磷燃烧,红磷不燃烧,由此说明燃烧需要 ,再挤压左滴管,观察到白磷熄灭,其中灭火的物质是 ,灭火的原理是 ,用该装置的优点是 (答一点)
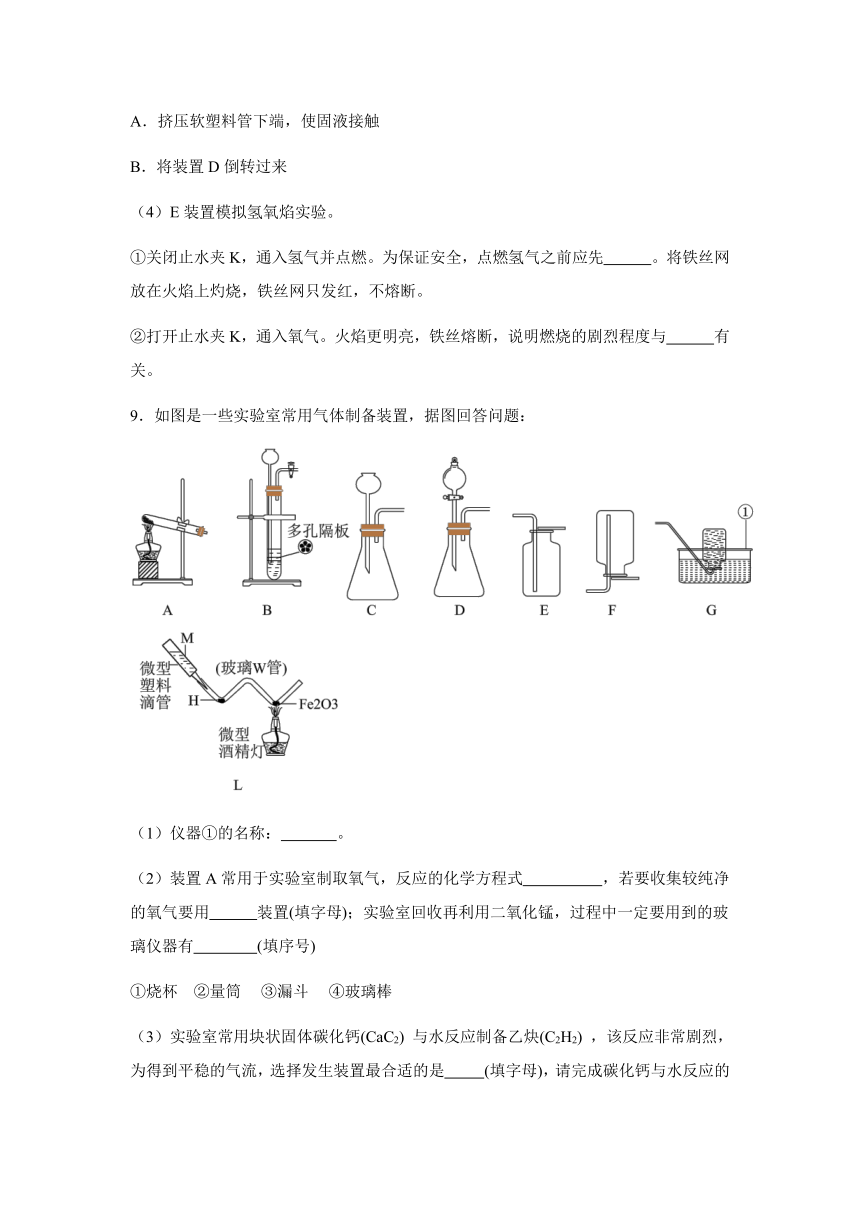
8.利用如图所示实验装置进行相关实验,请回答有关问题。
(1)写出标有序号①的仪器名称: 。
(2)在装置A的试管内放入高锰酸钾粉末以制取氧气,该反应的化学方程式为 。若用装置B收集一瓶氧气,不考虑操作因素,获得的氧气体积分数不能达到100%的主要原因是 。用装置C收集氧气,验满时将带火星的木条放在 (填“a”或“b”)处。
(3)装置D是用软塑料管自制的气体发生装置,药品加入完毕后,要使反应进行,接下来的操作是______(填字母)。
A.挤压软塑料管下端,使固液接触
B.将装置D倒转过来
(4)E装置模拟氢氧焰实验。
①关闭止水夹K,通入氢气并点燃。为保证安全,点燃氢气之前应先 。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开止水夹K,通入氧气。火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与 有关。
9.如图是一些实验室常用气体制备装置,据图回答问题:
(1)仪器①的名称: 。
(2)装置A常用于实验室制取氧气,反应的化学方程式 ,若要收集较纯净的氧气要用 装置(填字母);实验室回收再利用二氧化锰,过程中一定要用到的玻璃仪器有 (填序号)
①烧杯 ②量筒 ③漏斗 ④玻璃棒
(3)实验室常用块状固体碳化钙(CaC2) 与水反应制备乙炔(C2H2) ,该反应非常剧烈,为得到平稳的气流,选择发生装置最合适的是 (填字母),请完成碳化钙与水反应的化学方程式: CaC2+ H2O= ( )+ C2H2↑(横线上填化学计量数, “1”不写; 括号内填化学式) 。
(4)图L为某种“微型”实验装置。如果M处装稀盐酸,H处放少量铁屑,则反应进行时加热处发生反应的化学方程式为 ,使用“微型”装置进行实验的优点是 。
10.实验探究能促进思维发展,引领我们探索创新。
实验1.探究微粒性质
(1)观察到滴有无色酚酞试液的纱布条 ,说明构成物质的微粒 。
(2)a比c处先变色,说明氨气的密度 (填“>”或“<”)空气。
实验2.探究物质组成
(3)火焰上方罩一只干冷烧杯,观察到内壁有水珠产生,证明水是由 组成的。
(4)写出氢气在空气中燃烧的化学方程式 。
实验3.探究燃烧条件
(5)该实验说明燃烧条件之一是可燃物与 接触。
(6)在烛芯的棉线中加入细镁条可制成“吹不灭的蜡烛”。蜡烛正常燃烧时,焰心的镁条不燃烧(焰心温度高于镁条的着火点),原因是 。
实验4.探究反应发生
(7)如图所示是用pH传感器探究盐酸和氢氧化钠发生反应前后的pH变化情况,证明该化学反应发生的依据是溶液的pH 。
11.创新实验可以使现象更明显,操作更简单,减少环境污染等。下面是某课外小组对教材实验进行的创新设计,请回答相关问题。
(1)实验A:从胶头滴管中挤入少量浓氨水,观察到石蕊、酚酞都变色,说明分子 ;
(2)实验B:向试管中加入氢氧化钠固体后,观察到U型管中的液面a b (填“高于”或“低于”)。一段时间后可观察到饱和澄清石灰水变浑浊,原因是 。
(3)实验C:试管中观察到白磷燃烧的现象是产生白烟。反应完全后,待冷却到室温,可观察到注射器中蒸馏水慢慢流入试管中,试管内液面最终上升至刻度 处。
12.化学兴趣小组对化学实验装置进行改进,装置图如下:
(1)实验Ⅰ,滴入水后立即打开止水夹,整个实验过程中可观察到注射器的活塞运动情况为 。
(2)实验Ⅱ,打开分液漏斗活塞,通入干燥氧气约十秒钟,引燃铁丝下端的火柴,伸入塑料瓶内,并对准玻璃管上方,可观察到铁丝剧烈燃烧,实验装置改进后的优点是 (填序号);①实验随时可做,不用提前制备气体更方便②塑料瓶代替集气瓶,可以不用放水防止其炸裂③集氧气的制取、干燥、性质验证于一体,实验更优化;
(3)实验Ⅲ,能证明金属活动性Fe>Cu>Ag的现象是 ,发生反应的化学方程式为 。
(4)实验Ⅳ,同时取下U形管两端胶塞。 (填“左”或“右”)边玻璃管液面上升速度更快。
答案
1.A
2.D
3.B
4.(1) 2处干燥紫色石蕊纸花不变色,1、3处湿润紫色石蕊纸花变红色;3处湿润紫色石蕊纸花比1处湿润紫色石蕊纸花先变红色
(2)不能燃烧且不支持燃烧
5.(1)2H2O2 2H2O+O2↑
(2)温度达到可燃物的着火点
(3)提供热量
6.(1)干燥气体、吸收甲酸
(2)节约药品、减少污染 (3)催化
7.(1)长颈漏斗
(2)2KCIO3 2KCI+3O2↑;AD
(3)2H2O2 2H2O+O2↑;氧气和达到燃烧所需的最低温度;二氧化碳;隔绝氧气;节约药品(合理即可)
8.(1)水槽
(2)2KMnO4 K2MnO4+MnO2+O2↑;氧气中混入了水蒸气;a
(3)A
(4)①验纯 ②氧气的浓度
9.(1)水槽
(2)2KClO3 2KCl+3O2↑;G;①③④
(3)D;1 2 1 Ca(OH)2 1
(4)Fe2O3+3H2 2Fe+3H2O ;节约药品、减少污染(合理即可)
10.(1)变红;总是在不断运动着
(2)<
(3)氢元素、氧元素
(4)2H2+O2 2H2O
(5)空气(氧气)
(6)镁条没有与空气(氧气)接触
(7)逐渐变小,最终小于7
11.(1)不断运动
(2)低于;氢氧化钠溶于水放热,氢氧化钙的溶解度随温度升高而减小,有固体析出,故变浑浊
(3)1
12.(1)先向右后向左
(2)①②③
(3)铁丝表面有红色固体析出,银丝表面无变化(只写铁丝表面有红色固体析出没写银丝表面无变化不给分);Fe+CuSO4 = FeSO4+Cu
(4)左
1.如图,将注射器中的溶液缓缓推入V形管,并用80℃的热水加热盛有红磷和白磷的W形管时,发现白磷燃烧而红磷不燃烧。下列说法不正确的是
A.此实验可以说明燃烧需要可燃物与充足的氧气接触
B.实验过程中观察到白磷燃烧产生大量白烟
C.将注射器撤掉,向V形管中通入CO2,白磷很快停止燃烧,其灭火原理是隔绝氧气
D.该微型实验的优点是装置简单、节约药品、减少污染
2.依据如图进行实验(加持仪器略去),实验过程:①通入N2,点燃酒精灯,一段时间后,a、b中无明显现象②改通O2后片刻,熄灭酒精灯,b中红磷燃烧。下列说法错误的是
A.实验过程①要先通入N2一段时间,再点燃酒精灯
B.实验过程②的a中无明显现象
C.对比①②两个实验过程b中的实验现象,可知燃烧物燃烧需要氧气
D.红磷燃烧,产生大量白色烟雾
3.如图是CO还原氧化铜的实验装置(夹持仪器等略)。已知:HCOOH H2O+CO↑,下列说法正确的是
A.胶头滴管可以换成漏斗
B.实验时先挤压胶头滴管,再点燃酒精灯
C.尾气中含有CO,可以用氢氧化钠溶液吸收
D.该实验所涉及反应的基本类型有分解反应、置换反应
4.用下图实验研究CO2的性质。
(1)可证明CO2能与水反应的现象是 ,密度比空气的大的现象是 。
(2)燃着的木条熄灭,由此可得出CO2具有的性质是 。
5.用下图所示实验验证可燃物燃烧的条件(实验前玻璃管内充满N2)。
已知:白磷和红磷的着火点分别为40℃、240℃。
(1)将注射器中的溶液注入玻璃管,A中发生反应的化学方程式为 。
(2)实验过程中观察到白磷燃烧而红磷不燃烧,说明可燃物燃烧的条件是 。
(3)热水的作用是 。
6.下图为实验室还原氧化铁并用气球收集较纯净、干燥的尾气的微型实验装置(夹持仪器已省略)。已知,甲酸(HCOOH)易挥发,在热浓硫酸中易分解;
(1)说出B装置中氢氧化钠的作用 。
(2)与传统实验装置相比,微型实验装置的优点是
(写出一条即可)
(3)A装置中热浓硫酸起 作用。
7.请按要求回答下列问题:
(1)请写出仪器①的名称 。
(2)实验室可用氯酸钾制取氧气,该反应的化学方程式为 。欲用该方法制取一瓶较纯净的氧气,要在图甲中选择的发生装置和收集装置是 (填序号)
(3)某化学兴趣小组的同学利用图乙微型装置进行实验,先挤压右滴管并微热燃烧管,双球管中发生反应的化学方程式为 ,燃烧管中观察到白磷燃烧,红磷不燃烧,由此说明燃烧需要 ,再挤压左滴管,观察到白磷熄灭,其中灭火的物质是 ,灭火的原理是 ,用该装置的优点是 (答一点)
8.利用如图所示实验装置进行相关实验,请回答有关问题。
(1)写出标有序号①的仪器名称: 。
(2)在装置A的试管内放入高锰酸钾粉末以制取氧气,该反应的化学方程式为 。若用装置B收集一瓶氧气,不考虑操作因素,获得的氧气体积分数不能达到100%的主要原因是 。用装置C收集氧气,验满时将带火星的木条放在 (填“a”或“b”)处。
(3)装置D是用软塑料管自制的气体发生装置,药品加入完毕后,要使反应进行,接下来的操作是______(填字母)。
A.挤压软塑料管下端,使固液接触
B.将装置D倒转过来
(4)E装置模拟氢氧焰实验。
①关闭止水夹K,通入氢气并点燃。为保证安全,点燃氢气之前应先 。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开止水夹K,通入氧气。火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与 有关。
9.如图是一些实验室常用气体制备装置,据图回答问题:
(1)仪器①的名称: 。
(2)装置A常用于实验室制取氧气,反应的化学方程式 ,若要收集较纯净的氧气要用 装置(填字母);实验室回收再利用二氧化锰,过程中一定要用到的玻璃仪器有 (填序号)
①烧杯 ②量筒 ③漏斗 ④玻璃棒
(3)实验室常用块状固体碳化钙(CaC2) 与水反应制备乙炔(C2H2) ,该反应非常剧烈,为得到平稳的气流,选择发生装置最合适的是 (填字母),请完成碳化钙与水反应的化学方程式: CaC2+ H2O= ( )+ C2H2↑(横线上填化学计量数, “1”不写; 括号内填化学式) 。
(4)图L为某种“微型”实验装置。如果M处装稀盐酸,H处放少量铁屑,则反应进行时加热处发生反应的化学方程式为 ,使用“微型”装置进行实验的优点是 。
10.实验探究能促进思维发展,引领我们探索创新。
实验1.探究微粒性质
(1)观察到滴有无色酚酞试液的纱布条 ,说明构成物质的微粒 。
(2)a比c处先变色,说明氨气的密度 (填“>”或“<”)空气。
实验2.探究物质组成
(3)火焰上方罩一只干冷烧杯,观察到内壁有水珠产生,证明水是由 组成的。
(4)写出氢气在空气中燃烧的化学方程式 。
实验3.探究燃烧条件
(5)该实验说明燃烧条件之一是可燃物与 接触。
(6)在烛芯的棉线中加入细镁条可制成“吹不灭的蜡烛”。蜡烛正常燃烧时,焰心的镁条不燃烧(焰心温度高于镁条的着火点),原因是 。
实验4.探究反应发生
(7)如图所示是用pH传感器探究盐酸和氢氧化钠发生反应前后的pH变化情况,证明该化学反应发生的依据是溶液的pH 。
11.创新实验可以使现象更明显,操作更简单,减少环境污染等。下面是某课外小组对教材实验进行的创新设计,请回答相关问题。
(1)实验A:从胶头滴管中挤入少量浓氨水,观察到石蕊、酚酞都变色,说明分子 ;
(2)实验B:向试管中加入氢氧化钠固体后,观察到U型管中的液面a b (填“高于”或“低于”)。一段时间后可观察到饱和澄清石灰水变浑浊,原因是 。
(3)实验C:试管中观察到白磷燃烧的现象是产生白烟。反应完全后,待冷却到室温,可观察到注射器中蒸馏水慢慢流入试管中,试管内液面最终上升至刻度 处。
12.化学兴趣小组对化学实验装置进行改进,装置图如下:
(1)实验Ⅰ,滴入水后立即打开止水夹,整个实验过程中可观察到注射器的活塞运动情况为 。
(2)实验Ⅱ,打开分液漏斗活塞,通入干燥氧气约十秒钟,引燃铁丝下端的火柴,伸入塑料瓶内,并对准玻璃管上方,可观察到铁丝剧烈燃烧,实验装置改进后的优点是 (填序号);①实验随时可做,不用提前制备气体更方便②塑料瓶代替集气瓶,可以不用放水防止其炸裂③集氧气的制取、干燥、性质验证于一体,实验更优化;
(3)实验Ⅲ,能证明金属活动性Fe>Cu>Ag的现象是 ,发生反应的化学方程式为 。
(4)实验Ⅳ,同时取下U形管两端胶塞。 (填“左”或“右”)边玻璃管液面上升速度更快。
答案
1.A
2.D
3.B
4.(1) 2处干燥紫色石蕊纸花不变色,1、3处湿润紫色石蕊纸花变红色;3处湿润紫色石蕊纸花比1处湿润紫色石蕊纸花先变红色
(2)不能燃烧且不支持燃烧
5.(1)2H2O2 2H2O+O2↑
(2)温度达到可燃物的着火点
(3)提供热量
6.(1)干燥气体、吸收甲酸
(2)节约药品、减少污染 (3)催化
7.(1)长颈漏斗
(2)2KCIO3 2KCI+3O2↑;AD
(3)2H2O2 2H2O+O2↑;氧气和达到燃烧所需的最低温度;二氧化碳;隔绝氧气;节约药品(合理即可)
8.(1)水槽
(2)2KMnO4 K2MnO4+MnO2+O2↑;氧气中混入了水蒸气;a
(3)A
(4)①验纯 ②氧气的浓度
9.(1)水槽
(2)2KClO3 2KCl+3O2↑;G;①③④
(3)D;1 2 1 Ca(OH)2 1
(4)Fe2O3+3H2 2Fe+3H2O ;节约药品、减少污染(合理即可)
10.(1)变红;总是在不断运动着
(2)<
(3)氢元素、氧元素
(4)2H2+O2 2H2O
(5)空气(氧气)
(6)镁条没有与空气(氧气)接触
(7)逐渐变小,最终小于7
11.(1)不断运动
(2)低于;氢氧化钠溶于水放热,氢氧化钙的溶解度随温度升高而减小,有固体析出,故变浑浊
(3)1
12.(1)先向右后向左
(2)①②③
(3)铁丝表面有红色固体析出,银丝表面无变化(只写铁丝表面有红色固体析出没写银丝表面无变化不给分);Fe+CuSO4 = FeSO4+Cu
(4)左
同课章节目录
