江苏省扬州中学2024-2025学年高二下学期5月月考化学试题(含答案)
文档属性
| 名称 | 江苏省扬州中学2024-2025学年高二下学期5月月考化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 936.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 14:59:27 | ||
图片预览




文档简介
江苏省扬州中学2024-2025学年第二学期5月考试试题
高二化学
试卷满分:100分,考试时间:75分钟
注意事项:
1.作答第Ⅰ卷前请考生务必将自己的姓名,考试证号等写在答题卡上,并贴上条形码。
2.将选择题答案填写在答题卡的指定位置上(使用机读卡的用2B铅笔在机读卡上填涂),非选择题一律在答题卡上作答,在试卷上答题无效。
3.考试结束后,请将机读卡和答题卡交监考人员。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 K-39 Mn-55 Fe-56 Se-79
选择题(共39分)
单项选择题:本题包括13小题,每题3分,共39分。每小题只有一个选项最符合题意。
1.科技是国家强盛之基,创新是民族进步之魂。下列说法正确的是
A.航展上国产大型客机C919进行飞行表演,其机身使用的碳纤维属于有机高分子材料
B.C919飞机上使用了芳纶纤维,芳纶属于天然纤维
C.聚氨酯泳衣能有效提升游泳速度,其成分属于天然高分子
D.“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷,其属于新型无机非金属材料
2.下列说法正确的是
A.有机物与甲烷是同系物
B.CH3COOCH2CH3和 CH3CH2COOCH3是同一种物质
C.与是同分异构体
D.CH3CH2OH 和具有相同的官能团,互为同系物
3.下列化学用语表示正确的是
A.质量数为78、中子数为44的Se原子Se B.氨基的电子式:
C.基态O原子的电子排布式为:2s22p4 D.水分子的空间填充模型:
4.丁二酮肟与Ni2+反应生成鲜红色的二丁二酮肟合镍沉淀,其结构如图所示。该反应可鉴定Ni2+的存在。下列说法不正确的是
A.沸点高低:CH4<NH3<H2O
B.第一电离能大小:I1(C)<I1(N)<I1(O)
C.半径大小:r(O)<r(N)<r(C)
D.Ni2+提供空轨道,N原子提供孤电子对
阅读下列材料,完成5~7题:
元素周期表中ⅥA族元素及其化合物用途广泛。O3具有杀菌、消毒、漂白等作用;H2S是一种易燃的有毒气体(燃烧热为562.2kJ·mol-1),常用于沉淀重金属离子;硫酰氯(SO2Cl2)是重要的化工试剂,在催化剂作用下合成反应为 SO2(g)+Cl2(g)SO2Cl2(g) H=a kJ·mol-1
(a<0);硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,H2Se具有较强的还原性,工业上通过电解强碱性Na2TeO3溶液制备Te。
5.下列说法正确的是( )
A.H2S是在空气中完全燃烧时能生成SO3
B.SO2也有漂白性,O3和SO2的漂白原理相同
C.温度升高,由SO2制SO2Cl2的平衡转化率降低
D.使用催化剂能增大合成SO2Cl2反应的平衡常数
6.下列化学反应表示正确的是( )
A.H2S燃烧的热化学方程式:H2S(g)+2O2(g)=SO2(g)+H2O(g) H =-562.2 kJ·mol-1
B.用H2S气体沉淀溶液中Pb2+的离子方程式:Pb2++=PbS↓
C.电解强碱性Na2TeO3溶液的阴极反应:Te+4+3H2O=Te+6O
D.SO2Cl2遇水强烈水解生成两种酸:SO2Cl2+2H2O=H2SO3+2HCl
7.下列说法不正确的是( )
A.H2O比H2Se稳定是因为水分子间能形成氢键
B.H3O+和H2O的的中心原子杂化轨道类型均为sp3
C.硫可形成S2、S4、S6等不同单质,它们互为同素异形体
D.CS2分子中σ键与π键的个数之比为1:1
8.Mg/LiFePO4电池的电池反应为:xMg2++2LiFePO4xMg+2Li1-xFePO4+2xLi+,装置如下图所示。下列说法正确的是( )
A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有24g Mg2+迁移至正极区
C.充电时,化学能主要转变为电能
D.充电时,阳极发生的电极反应为
LiFePO4-x =Li1-xFePO4+xLi+
9.制备重要的有机合成中间体丙的反应如下。下列说法正确的是( )
A.1mol甲最多可以与3mol H2反应 B.甲→乙的反应类型为加成反应
C.丙能与盐酸和金属钠发生反应 D.丙分子中所有碳原子共平面
10.室温下,下列实验探究方案不能达到探究目的的是
选项 探究方案 探究目的
A. 向蔗糖溶液中加入稀H2SO4并加热,冷却后再加入新制Cu(OH)2悬浊液,加热 蔗糖是否发生水解
B. 用强光照射氯水,同时利用pH传感器、氯离子传感器和氧气传感器采集数据 HClO光照分解产物
C. 向碳酸钠溶液滴加足量的H2SO4溶液,观察现象 非金属性S>C
D. 向电石滴加饱和食盐水,将产生的气体先通入足量硫酸铜溶液,再通入高锰酸钾溶液,观察高锰酸钾溶液是否褪色 乙炔具有还原性
11.黄鸣龙是第一位名字写进有机化学课本的中国人,Wolff-Kishner-黄鸣龙还原反应机理如下(R、R’均代表烃基),下列有关说法不正确的是
A.肼的沸点高于氨气,原因是分子间氢键数目更多,且相对分子质量更大
B.过程①发生加成反应,过程②发生消去反应
C.过程④的反应历程可表示为:+O+N2↑+H2O
D.通过黄鸣龙还原反应,将丙酮转化为烷烃,该烷烃的二氯代物有2种
12.室温下:Ka1(H2C2O4)=10-1.26、Ka2(H2C2O4)=10-4.27、Ksp(CaC2O4)=10-8.64,实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如下:
实验1:测定某浓度NaHC2O4溶液的pH=4.3
实验2:配制pH相等的(NH4)2SO4、NH4Cl、NH4HSO4三种溶液
实验3:向0.10mol·L-1Na2C2O4溶液中滴加等浓度盐酸后,混合溶液的pH=7
实验4:向0.10mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4mol·L-1
下列所得结论正确的是
A.实验1中c(H2C2O4) = 103.07c(C2)
B.实验2中溶液浓度的大小关系为:c(NH4Cl)C.实验3混合溶液中有:c(Na+)=c(C2)+c(HC2)+c(C)
D.实验4所得上层清液中的c(HC2)=10-4.37mol·L-1
13.在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= 41.2 kJ·mol-1
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g) ΔH= -247.1 kJ·mol-1
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法不正确的是
A.反应Ⅰ的平衡常数可表示为K=
B.图中曲线B表示CO的物质的量随温度的变化
C.提高 CO2转化为CH4的转化率,需要研发在低温区高效的催化剂
D.升高温度,反应CH4(g)+H2O(g)CO(g)+3H2(g)的平衡正向移动
第Ⅱ卷(非选择题 共61分)
14.布洛芬(Ⅳ)是一种非甾体抗炎药,具有镇痛、解热和抗炎的作用。以金属氢化物(如LiAlH4)为还原剂代替锌汞齐作催化剂可实现绿色合成布洛芬,其合成工艺路线如图所示。
化合物I中碳原子的杂化方式为 ▲ 。化合物III中官能团的名称为 ▲ ,
化合物I→化合物II的反应类型为 ▲ 反应。
化合物II的某种同分异构体含有苯环,能与FeCl3溶液发生显色反应,且核磁共振氢谱图上只有4组峰,写出其中一种化合物的结构简式: ▲ 。
(4)关于上述示意图中的相关物质及转化,下列说法正确的有_ ▲ __。
A.化合物I可以和NaOH反应
B.由化合物I到Ⅱ的转化中,有非极性共价键的断裂与形成
C.化合物Ⅲ属于卤代烃
D.化合物Ⅳ中存在手性碳原子
(5) 请设计以丙酮为原料设计合成 的路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
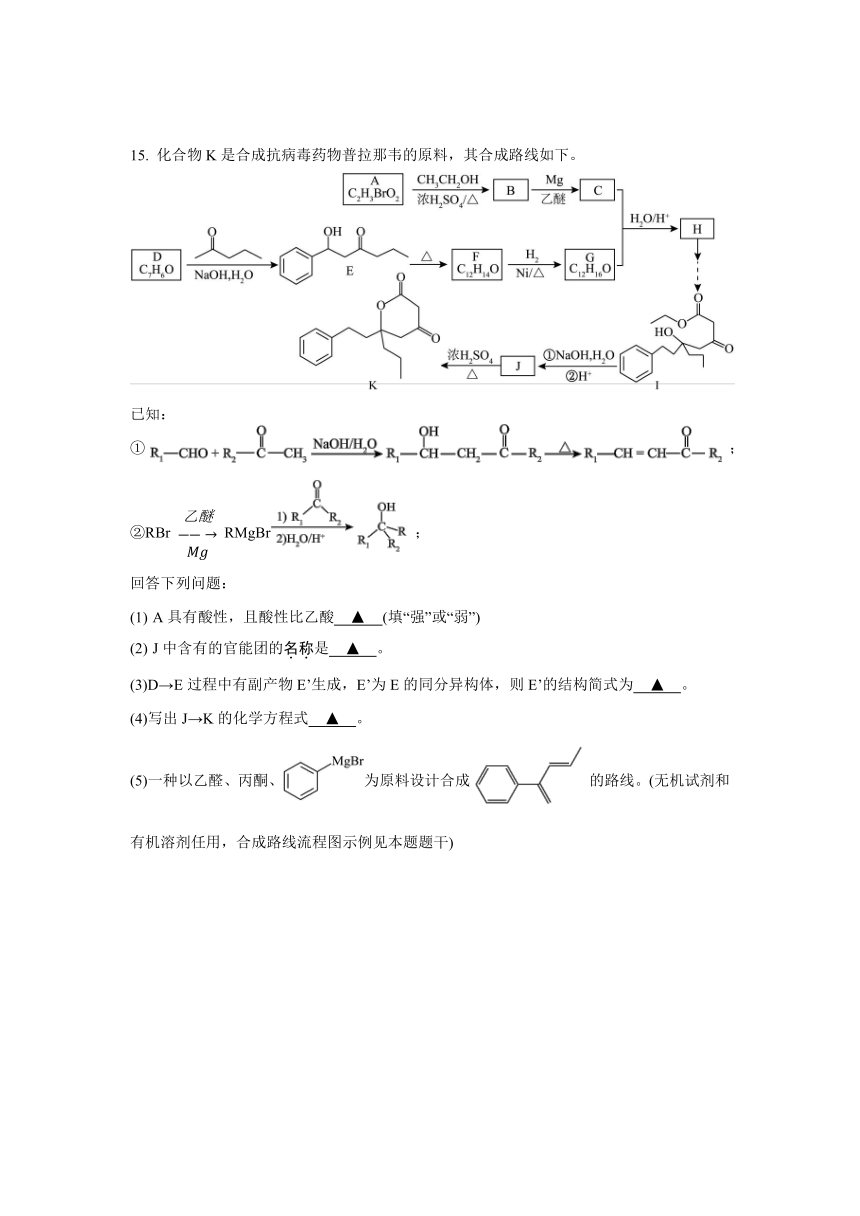
15. 化合物K是合成抗病毒药物普拉那韦的原料,其合成路线如下。
已知:
① ;
②RBr RMgBr ;
回答下列问题:
A具有酸性,且酸性比乙酸 ▲ (填“强”或“弱”)
J中含有的官能团的名称是 ▲ 。
(3)D→E过程中有副产物E’生成,E’为E的同分异构体,则E’的结构简式为 ▲ 。
(4)写出J→K的化学方程式 ▲ 。
(5)一种以乙醛、丙酮、为原料设计合成的路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
16. 量子点是一种纳米级别的半导体,其直径一般在1nm~10nm之间。当紫外光作用在量子点上时会发出明亮的荧光,量子点的直径不同,荧光颜色对应不同。在生命科学、光电子器件、显示技术等方面都具有广泛的应用。一种在实验室制备CdSe量子点的流程图如下:
回答下列问题:
(1)元素Se的价电子排布式为 ▲ 。CdSe量子点分散至水中可形成 ▲ (填分散系名称)。
(2)题16图2中仪器a的名称为 ▲ 。
(3)制备CdSe时,可用紫外光照射以监测反应进程,当观察到 ▲ (填现象)时,说明CdSe量子点生长基本停止,制备完成。
(4)配位剂L是一种组成人体内蛋白质的氨基酸,
其质谱图如题16图3所示,分子中含硫质量分数为
26.45%且巯基(-SH)与β-碳原子直接相连,
则配位剂L的结构简式为 ▲ 。
实验室中,还可以用 ▲ (填现代仪器分析法名称)获得其化学键或官能团的信息。
(5)设计实验方案验证CdSe纳米颗粒已洗涤干净 ▲ 。
(6)实验室常用氧化还原滴定法测定CdSe样品中Se的质量分数,步骤如下:
Ⅰ.取2.000g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
Ⅱ.准确量取25.00mL待测液于锥形瓶中,加入0.0200mol L 1KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL 0.06mol L 1FeSO4溶液,加入磷酸后再用0.0200mol L 1KMnO4标准溶液滴定,消耗KMnO4标准溶液10.00mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒(M=79g mol 1)的质量分数 ▲
二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气(和)。
已知下列热化学方程式:
CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206 kJ mol 1
CO2(g)+4H2(g)CH4(g)+2H2O(g) △H2=—165 kJ mol 1
则反应CH4(g)+CO2(g)2CO(g)+2H2(g) 的△H= ▲
(2)Ni催化CO2加H2形成CH4,其历程如题17图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如题17图2所示。
①260℃时生成主要产物所发生反应的化学方程式为 。
②温度高于320℃,CO2的转化率下降的原因是 。
①260℃时生成主要产物所发生反应的化学方程式为 ▲ 。
②温度高于320℃,CO2的转化率下降的原因是 ▲ 。
(3)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
VCB的结构简式为 ▲ 。
(4)利用电解转化法从烟气中分离CO2的原理如题17图3所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式: ▲ 。
江苏省扬州中学2024-2025学年第二学期5月考试题答案
1 2 3 4 5 6 7 8 9 10 11 12 13
D A B B C C A D C A D D B
(16分)
(1) sp2 sp3 (2分) 碳溴键(2分) (2)还原(2分)
(3) (或) (3分)
(4) CD (2分)
(5) (5分)15.(15分)
(1) 强 (2分) (2) 羰基、羟基、羧基 (3分)
(3) (3分)
(4)+H2O(2分)
(5)(5分)
16.(17分)
(1) 4s24p4(2分) 胶体 (1分)
(2)(球形)冷凝管(2分)
(3)荧光颜色不再变化(2分)
(4) (2分) 红外光谱法(2分)
(5)取最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无明显现象说明洗涤干净 (2分)
(6)39.5% (4分)
H2SeO3溶液与KMnO4反应,再用Fe2+消耗过量KMnO4,最后用KMnO4滴定过量Fe2+,
通过得失电子守恒,可以得到关系 KMnO4 ~ 5Fe2+
通过得失电子守恒,可以得到关系 5 H2SeO3 ~ 2KMnO4
可知 最后过量的n(Fe2+)=5n(KMnO4)=0.02mol·L-1×0.01L×5=1×10-3mol,
则消耗 起初过量KMnO4的n(Fe2+)=0.06mol·L-1×0.025L-1×10-3mol—1×10-3mol=5×10-4mol,
起初过量n(KMnO4)=n(Fe2+)=1×10-4mol,
则与H2SeO3反应的n(KMnO4)= 0.02mol·L-1×0.025L-1×10-3mol—1×10-5mol =4×10-4mol,
则n(H2SeO3)=n(KMnO4)=1×10-3mol,则硒的质量分数为
17.(13分)
(1) 247 (2分)
(2) ①CO2+4H2CH4+2H2O (3分)
②温度升高催化剂活性降低(或温度升高CO2难吸附在催化剂表面),反应速率减慢(2分)
(3分)
-2e-+HCO+2CO2↑+2H2O (3分)
高二化学
试卷满分:100分,考试时间:75分钟
注意事项:
1.作答第Ⅰ卷前请考生务必将自己的姓名,考试证号等写在答题卡上,并贴上条形码。
2.将选择题答案填写在答题卡的指定位置上(使用机读卡的用2B铅笔在机读卡上填涂),非选择题一律在答题卡上作答,在试卷上答题无效。
3.考试结束后,请将机读卡和答题卡交监考人员。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 K-39 Mn-55 Fe-56 Se-79
选择题(共39分)
单项选择题:本题包括13小题,每题3分,共39分。每小题只有一个选项最符合题意。
1.科技是国家强盛之基,创新是民族进步之魂。下列说法正确的是
A.航展上国产大型客机C919进行飞行表演,其机身使用的碳纤维属于有机高分子材料
B.C919飞机上使用了芳纶纤维,芳纶属于天然纤维
C.聚氨酯泳衣能有效提升游泳速度,其成分属于天然高分子
D.“天和核心舱”电推进系统中的腔体采用氮化硼陶瓷,其属于新型无机非金属材料
2.下列说法正确的是
A.有机物与甲烷是同系物
B.CH3COOCH2CH3和 CH3CH2COOCH3是同一种物质
C.与是同分异构体
D.CH3CH2OH 和具有相同的官能团,互为同系物
3.下列化学用语表示正确的是
A.质量数为78、中子数为44的Se原子Se B.氨基的电子式:
C.基态O原子的电子排布式为:2s22p4 D.水分子的空间填充模型:
4.丁二酮肟与Ni2+反应生成鲜红色的二丁二酮肟合镍沉淀,其结构如图所示。该反应可鉴定Ni2+的存在。下列说法不正确的是
A.沸点高低:CH4<NH3<H2O
B.第一电离能大小:I1(C)<I1(N)<I1(O)
C.半径大小:r(O)<r(N)<r(C)
D.Ni2+提供空轨道,N原子提供孤电子对
阅读下列材料,完成5~7题:
元素周期表中ⅥA族元素及其化合物用途广泛。O3具有杀菌、消毒、漂白等作用;H2S是一种易燃的有毒气体(燃烧热为562.2kJ·mol-1),常用于沉淀重金属离子;硫酰氯(SO2Cl2)是重要的化工试剂,在催化剂作用下合成反应为 SO2(g)+Cl2(g)SO2Cl2(g) H=a kJ·mol-1
(a<0);硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,H2Se具有较强的还原性,工业上通过电解强碱性Na2TeO3溶液制备Te。
5.下列说法正确的是( )
A.H2S是在空气中完全燃烧时能生成SO3
B.SO2也有漂白性,O3和SO2的漂白原理相同
C.温度升高,由SO2制SO2Cl2的平衡转化率降低
D.使用催化剂能增大合成SO2Cl2反应的平衡常数
6.下列化学反应表示正确的是( )
A.H2S燃烧的热化学方程式:H2S(g)+2O2(g)=SO2(g)+H2O(g) H =-562.2 kJ·mol-1
B.用H2S气体沉淀溶液中Pb2+的离子方程式:Pb2++=PbS↓
C.电解强碱性Na2TeO3溶液的阴极反应:Te+4+3H2O=Te+6O
D.SO2Cl2遇水强烈水解生成两种酸:SO2Cl2+2H2O=H2SO3+2HCl
7.下列说法不正确的是( )
A.H2O比H2Se稳定是因为水分子间能形成氢键
B.H3O+和H2O的的中心原子杂化轨道类型均为sp3
C.硫可形成S2、S4、S6等不同单质,它们互为同素异形体
D.CS2分子中σ键与π键的个数之比为1:1
8.Mg/LiFePO4电池的电池反应为:xMg2++2LiFePO4xMg+2Li1-xFePO4+2xLi+,装置如下图所示。下列说法正确的是( )
A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有24g Mg2+迁移至正极区
C.充电时,化学能主要转变为电能
D.充电时,阳极发生的电极反应为
LiFePO4-x =Li1-xFePO4+xLi+
9.制备重要的有机合成中间体丙的反应如下。下列说法正确的是( )
A.1mol甲最多可以与3mol H2反应 B.甲→乙的反应类型为加成反应
C.丙能与盐酸和金属钠发生反应 D.丙分子中所有碳原子共平面
10.室温下,下列实验探究方案不能达到探究目的的是
选项 探究方案 探究目的
A. 向蔗糖溶液中加入稀H2SO4并加热,冷却后再加入新制Cu(OH)2悬浊液,加热 蔗糖是否发生水解
B. 用强光照射氯水,同时利用pH传感器、氯离子传感器和氧气传感器采集数据 HClO光照分解产物
C. 向碳酸钠溶液滴加足量的H2SO4溶液,观察现象 非金属性S>C
D. 向电石滴加饱和食盐水,将产生的气体先通入足量硫酸铜溶液,再通入高锰酸钾溶液,观察高锰酸钾溶液是否褪色 乙炔具有还原性
11.黄鸣龙是第一位名字写进有机化学课本的中国人,Wolff-Kishner-黄鸣龙还原反应机理如下(R、R’均代表烃基),下列有关说法不正确的是
A.肼的沸点高于氨气,原因是分子间氢键数目更多,且相对分子质量更大
B.过程①发生加成反应,过程②发生消去反应
C.过程④的反应历程可表示为:+O+N2↑+H2O
D.通过黄鸣龙还原反应,将丙酮转化为烷烃,该烷烃的二氯代物有2种
12.室温下:Ka1(H2C2O4)=10-1.26、Ka2(H2C2O4)=10-4.27、Ksp(CaC2O4)=10-8.64,实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如下:
实验1:测定某浓度NaHC2O4溶液的pH=4.3
实验2:配制pH相等的(NH4)2SO4、NH4Cl、NH4HSO4三种溶液
实验3:向0.10mol·L-1Na2C2O4溶液中滴加等浓度盐酸后,混合溶液的pH=7
实验4:向0.10mol·L-1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10-4mol·L-1
下列所得结论正确的是
A.实验1中c(H2C2O4) = 103.07c(C2)
B.实验2中溶液浓度的大小关系为:c(NH4Cl)
D.实验4所得上层清液中的c(HC2)=10-4.37mol·L-1
13.在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH= 41.2 kJ·mol-1
反应Ⅲ:2CO(g)+2H2(g)=CO2(g)+CH4(g) ΔH= -247.1 kJ·mol-1
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示。下列说法不正确的是
A.反应Ⅰ的平衡常数可表示为K=
B.图中曲线B表示CO的物质的量随温度的变化
C.提高 CO2转化为CH4的转化率,需要研发在低温区高效的催化剂
D.升高温度,反应CH4(g)+H2O(g)CO(g)+3H2(g)的平衡正向移动
第Ⅱ卷(非选择题 共61分)
14.布洛芬(Ⅳ)是一种非甾体抗炎药,具有镇痛、解热和抗炎的作用。以金属氢化物(如LiAlH4)为还原剂代替锌汞齐作催化剂可实现绿色合成布洛芬,其合成工艺路线如图所示。
化合物I中碳原子的杂化方式为 ▲ 。化合物III中官能团的名称为 ▲ ,
化合物I→化合物II的反应类型为 ▲ 反应。
化合物II的某种同分异构体含有苯环,能与FeCl3溶液发生显色反应,且核磁共振氢谱图上只有4组峰,写出其中一种化合物的结构简式: ▲ 。
(4)关于上述示意图中的相关物质及转化,下列说法正确的有_ ▲ __。
A.化合物I可以和NaOH反应
B.由化合物I到Ⅱ的转化中,有非极性共价键的断裂与形成
C.化合物Ⅲ属于卤代烃
D.化合物Ⅳ中存在手性碳原子
(5) 请设计以丙酮为原料设计合成 的路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
15. 化合物K是合成抗病毒药物普拉那韦的原料,其合成路线如下。
已知:
① ;
②RBr RMgBr ;
回答下列问题:
A具有酸性,且酸性比乙酸 ▲ (填“强”或“弱”)
J中含有的官能团的名称是 ▲ 。
(3)D→E过程中有副产物E’生成,E’为E的同分异构体,则E’的结构简式为 ▲ 。
(4)写出J→K的化学方程式 ▲ 。
(5)一种以乙醛、丙酮、为原料设计合成的路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
16. 量子点是一种纳米级别的半导体,其直径一般在1nm~10nm之间。当紫外光作用在量子点上时会发出明亮的荧光,量子点的直径不同,荧光颜色对应不同。在生命科学、光电子器件、显示技术等方面都具有广泛的应用。一种在实验室制备CdSe量子点的流程图如下:
回答下列问题:
(1)元素Se的价电子排布式为 ▲ 。CdSe量子点分散至水中可形成 ▲ (填分散系名称)。
(2)题16图2中仪器a的名称为 ▲ 。
(3)制备CdSe时,可用紫外光照射以监测反应进程,当观察到 ▲ (填现象)时,说明CdSe量子点生长基本停止,制备完成。
(4)配位剂L是一种组成人体内蛋白质的氨基酸,
其质谱图如题16图3所示,分子中含硫质量分数为
26.45%且巯基(-SH)与β-碳原子直接相连,
则配位剂L的结构简式为 ▲ 。
实验室中,还可以用 ▲ (填现代仪器分析法名称)获得其化学键或官能团的信息。
(5)设计实验方案验证CdSe纳米颗粒已洗涤干净 ▲ 。
(6)实验室常用氧化还原滴定法测定CdSe样品中Se的质量分数,步骤如下:
Ⅰ.取2.000g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
Ⅱ.准确量取25.00mL待测液于锥形瓶中,加入0.0200mol L 1KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL 0.06mol L 1FeSO4溶液,加入磷酸后再用0.0200mol L 1KMnO4标准溶液滴定,消耗KMnO4标准溶液10.00mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒(M=79g mol 1)的质量分数 ▲
二氧化碳资源化利用是目前研究的热点之一。
(1)二氧化碳可用于重整天然气制合成气(和)。
已知下列热化学方程式:
CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206 kJ mol 1
CO2(g)+4H2(g)CH4(g)+2H2O(g) △H2=—165 kJ mol 1
则反应CH4(g)+CO2(g)2CO(g)+2H2(g) 的△H= ▲
(2)Ni催化CO2加H2形成CH4,其历程如题17图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如题17图2所示。
①260℃时生成主要产物所发生反应的化学方程式为 。
②温度高于320℃,CO2的转化率下降的原因是 。
①260℃时生成主要产物所发生反应的化学方程式为 ▲ 。
②温度高于320℃,CO2的转化率下降的原因是 ▲ 。
(3)由二氧化碳合成VCB(锂电池电解质的添加剂)的实验流程如下,已知EC、VCB核磁共振氢谱均只有一组峰,均含五元环状结构,EC能水解生成乙二醇。
VCB的结构简式为 ▲ 。
(4)利用电解转化法从烟气中分离CO2的原理如题17图3所示。已知气体可选择性通过膜电极,溶液不能通过。写出电解时膜电极b上所发生的电极反应式: ▲ 。
江苏省扬州中学2024-2025学年第二学期5月考试题答案
1 2 3 4 5 6 7 8 9 10 11 12 13
D A B B C C A D C A D D B
(16分)
(1) sp2 sp3 (2分) 碳溴键(2分) (2)还原(2分)
(3) (或) (3分)
(4) CD (2分)
(5) (5分)15.(15分)
(1) 强 (2分) (2) 羰基、羟基、羧基 (3分)
(3) (3分)
(4)+H2O(2分)
(5)(5分)
16.(17分)
(1) 4s24p4(2分) 胶体 (1分)
(2)(球形)冷凝管(2分)
(3)荧光颜色不再变化(2分)
(4) (2分) 红外光谱法(2分)
(5)取最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无明显现象说明洗涤干净 (2分)
(6)39.5% (4分)
H2SeO3溶液与KMnO4反应,再用Fe2+消耗过量KMnO4,最后用KMnO4滴定过量Fe2+,
通过得失电子守恒,可以得到关系 KMnO4 ~ 5Fe2+
通过得失电子守恒,可以得到关系 5 H2SeO3 ~ 2KMnO4
可知 最后过量的n(Fe2+)=5n(KMnO4)=0.02mol·L-1×0.01L×5=1×10-3mol,
则消耗 起初过量KMnO4的n(Fe2+)=0.06mol·L-1×0.025L-1×10-3mol—1×10-3mol=5×10-4mol,
起初过量n(KMnO4)=n(Fe2+)=1×10-4mol,
则与H2SeO3反应的n(KMnO4)= 0.02mol·L-1×0.025L-1×10-3mol—1×10-5mol =4×10-4mol,
则n(H2SeO3)=n(KMnO4)=1×10-3mol,则硒的质量分数为
17.(13分)
(1) 247 (2分)
(2) ①CO2+4H2CH4+2H2O (3分)
②温度升高催化剂活性降低(或温度升高CO2难吸附在催化剂表面),反应速率减慢(2分)
(3分)
-2e-+HCO+2CO2↑+2H2O (3分)
同课章节目录
