北京市首都师范大学附属苹果园中学2024-2025学年高二下学期期中考试化学试题(含答案)
文档属性
| 名称 | 北京市首都师范大学附属苹果园中学2024-2025学年高二下学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 15:13:27 | ||
图片预览



文档简介
首都师范大学附属苹果园中学2024-2025学年第二学期期中考试
高二化学试卷
考生须知 1.本试卷为闭卷考试,满分为100分,考试时间为90分钟。 2.本试卷共7页,各题答案均答在本题规定的位置。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分 单项选择题 共42分
本题包括14道小题,每小题3分
1. 下列化学用语或图示表达不正确的是
A. 甲酸的结构式:
B. 乙烯的电子式:
C. 丙炔的键线式:
D. 聚丙烯的结构简式:
2. 下列物质属于酮的是
A. B.
C. D.
3. 下列有机物命名正确的是
A. 3,3-二甲基丁烷 B. 3-甲基-3-乙基戊烷
C. 2-乙基丁烷 D. 2,3,3-三甲基丁烷
4. 下列物质中,与1-丁烯互为同系物的是
A B.
C. D.
5. 下列各组液体混合物,可以利用分液操作分离,且有机物从分液漏斗下口放出的是
A. 苯和溴苯 B. 己烷和水 C. 硝基苯和水 D. 乙醇和水
6. 下列各组物质既能用溴水鉴别,也能用酸性高锰酸钾溶液鉴别的是
A. 苯和甲苯 B. 己烷和己烯 C. 己烯和己炔 D. 己烯和甲苯
7. 下列有机化合物分子中的所有碳原子不可能处于同一平面的是
A. B. CH3CH(CH3)CH3
C. CHC-CH3 D. CH2=C(CH3)2
8. 下列事实不能说明基团间存在相互影响的是
A. 氯乙酸的酸性强于乙酸的酸性
B. 苯酚能与溶液反应而乙醇不能
C. 甲苯能使酸性溶液褪色而甲烷不能
D. 乙烯能使酸性溶液褪色而乙烷不能
9. 硒()在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法不正确的是
A. Se原子在周期表中位于p区
B. 乙烷硒啉分子中,C原子的杂化类型有、
C. 乙烷硒啉分子中有5种不同化学环境的氢原子
D. 键角大小:气态
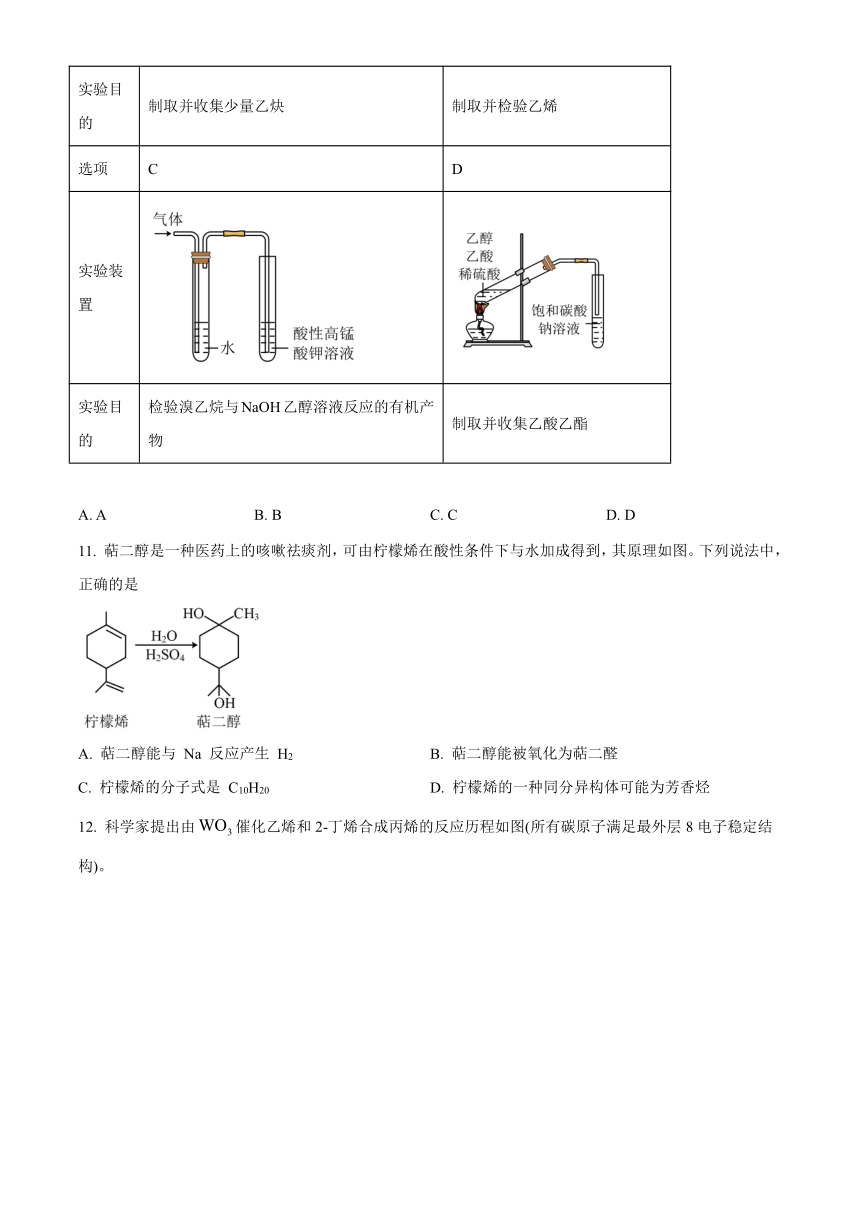
10. 用下列实验装置完成对应的实验,能达到实验目的的是
选项 A B
实验装置
实验目的 制取并收集少量乙炔 制取并检验乙烯
选项 C D
实验装置
实验目的 检验溴乙烷与NaOH乙醇溶液反应的有机产物 制取并收集乙酸乙酯
A. A B. B C. C D. D
11. 萜二醇是一种医药上的咳嗽祛痰剂,可由柠檬烯在酸性条件下与水加成得到,其原理如图。下列说法中,正确的是
A. 萜二醇能与 Na 反应产生 H2 B. 萜二醇能被氧化为萜二醛
C. 柠檬烯的分子式是 C10H20 D. 柠檬烯的一种同分异构体可能为芳香烃
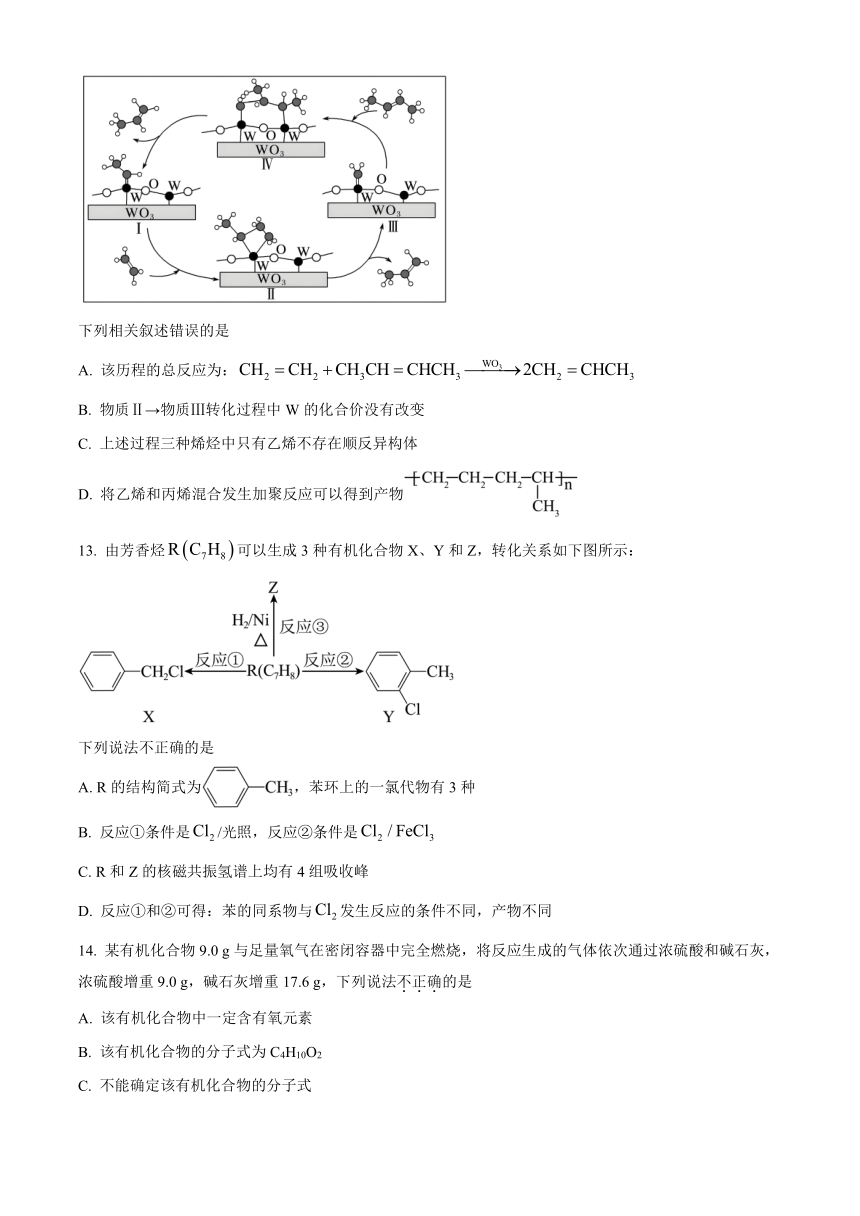
12. 科学家提出由催化乙烯和2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层8电子稳定结构)。
下列相关叙述错误的是
A. 该历程的总反应为:
B. 物质Ⅱ→物质Ⅲ转化过程中W的化合价没有改变
C. 上述过程三种烯烃中只有乙烯不存在顺反异构体
D. 将乙烯和丙烯混合发生加聚反应可以得到产物
13. 由芳香烃可以生成3种有机化合物X、Y和Z,转化关系如下图所示:
下列说法不正确的是
A. R的结构简式为,苯环上的一氯代物有3种
B. 反应①条件是/光照,反应②条件是
C. R和Z的核磁共振氢谱上均有4组吸收峰
D. 反应①和②可得:苯的同系物与发生反应的条件不同,产物不同
14. 某有机化合物9.0 g与足量氧气在密闭容器中完全燃烧,将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重9.0 g,碱石灰增重17.6 g,下列说法不正确的是
A. 该有机化合物中一定含有氧元素
B. 该有机化合物的分子式为C4H10O2
C. 不能确定该有机化合物的分子式
D. 该有机化合物分子中碳原子数和氢原子数之比一定是2∶5
第二部分 非选择题 (共58分)
15. 写出下列反应化学方程式
(1)实验室制乙炔:___________。
(2)实验室制乙烯:___________。
(3)甲苯生成三硝基甲苯:___________。
(4)2-氯丁烷生成2-丁醇:___________。
(5)2-甲基-1,3-丁二烯的1,4-加聚(产物可使酸性KMnO4溶液褪色):___________。
16. 甲醇是重要的工业生产原料。
Ⅰ.甲醇空气氧化法是生产工业甲醛的常用方法。发生的反应为:
2CH3OH+O22+2H2O
(1)HCHO的空间结构为___________,它是一个___________(填“极性”或“非极性”)分子。
(2)甲醇氧化生成HCHO时,会产生CO、CO2等副产物。相同条件下,CO2的沸点比CO的高,主要原因为___________。
Ⅱ.以甲醇为原料生产碳酸二甲酯()的反应过程如下。
i.
ii.
(3)碳酸二甲酯分子中羰基碳原子的杂化类型是___________。
(4)CuCl中,基态的价电子排布式为___________,CuCl在生产碳酸二甲酯的反应过程中所起的作用是___________。
(5)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的易被氧化为难溶的CuO。
iii.加入4-甲基咪唑()可与形成配合物,可提高甲醇的转化率。
4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
请结合信息回答以下问题
①4-甲基咪唑中,1~4号原子___________(填“在”或“不在”)同一平面上,___________(填“1”或“3”)号N原子更容易与形成配位键。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是___________(填序号)。
a.配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的CuO
c.形成的配合物能增大反应的限度
(6)配位原子提供孤电子对的能力是影响配体与之间配位键强度的一个重要因素。若用某结构相似的含O配体与配位,所得配合物的稳定性比含N配体低,可能的原因是___________。
17. 探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:
(1)实验i中淡黄色沉淀是___________(写化学式)。
(2)对比i、ii的实验现象,可得出卤代烃水解的实验结论是___________。
(3)实验iii的化学方程式是___________。
(4)检测ii中___________、iii中___________的生成可判断分别发生水解和消去反应。
(5)为深入研究1-溴丁烷与NaOH溶液是否能发生消去反应,小组设计如下装置探究(加热和夹持装置略去):
加热圆底烧瓶一段时间后,B中酸性高锰酸钾溶液褪色
①甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是___________。
②乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是___________。
18. 聚乙烯醇滴眼液可治疗眼部干涩等,主要成分是,某同学设计其合成路线如下:
(1)①的化学方程式是___________。
(2)试剂a是___________。
(3)HOCH2CH2OH和B反应的化学方程式是___________。
(4)②的反应类型是___________。
(5)③过程除了生成聚乙烯醇,另一个产物的结构简式为___________。
(6)乙酸乙烯酯有多种同分异构体,其中能与NaHCO3溶液反应放出气体的有:、___________、___________、___________(不考虑立体异构,存在顺反异构的,顺式、反式均要写出)。
19. 有机化合物A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用,研究有机化合物A的分子结构、性质如下:
(1)确定A的分子式
经元素分析得到化合物A的实验式为CH2O,通过___________法(填仪器分析方法)可以测得A的相对分子质量为90,则A的分子式为___________。
(2)确定A的分子结构
使用现代分析仪器对A的分子结构进行测定,结果如下:
谱图 数据分析结果
红外光谱 含有-COOH、-OH
核磁共振氢谱 峰面积比为1︰1︰1︰3
A的结构简式为___________。
(3)研究A的结构和性质的关系
①A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同的光学性质,两种分子的关系为___________(填字母)。
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构
②写出A发生消去反应的化学方程式___________。
③写出2 mol A酯化反应生成1 mol水的化学方程式___________。
④已知:电离常数Ka(A)=1.3810-4,Ka(丙酸)=1.3410-5,分析数据可知A的酸性强于丙酸,请从共价键极性的角度解释原因___________。
20. 以石油裂解产物烯烃为原料合成一些新物质的路线如下。
已知:Diels-Alder反应:
(1)生成X的反应类型是___________。
(2)A→B的化学方程式是___________。
(3)E的结构简式是___________。
(4)Y的结构简式是___________。
(5)甲物质名称是___________;Z→W的化学方程式是___________。
首都师范大学附属苹果园中学2024-2025学年第二学期期中考试
高二化学试卷
考生须知 1.本试卷为闭卷考试,满分为100分,考试时间为90分钟。 2.本试卷共7页,各题答案均答在本题规定的位置。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分 单项选择题 共42分
本题包括14道小题,每小题3分
【1题答案】
【答案】D
【2题答案】
【答案】C
【3题答案】
【答案】B
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】B
【7题答案】
【答案】B
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
【答案】C
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】C
【14题答案】
【答案】C
第二部分 非选择题 (共58分)
【15题答案】
【答案】(1)
(2)
(3) (4)
(5)
【16题答案】
【答案】(1) ①. 平面三角形 ②. 极性
(2)CO2的相对分子质量比CO大,分子间作用力也大,则沸点高
(3)
(4) ①. ②. 催化作用
(5) ①. 在 ②. 3 ③. ab
(6)电负性,O对孤电子对的吸引力更强,故O作配体时,提供孤电子对与形成配位键的能力弱
【17题答案】
【答案】(1)AgBr
(2)1-溴丁烷在碱性溶液中水解速率更快
(3)BrCH2CH2CH2CH3+NaOHCH2=CHCH2CH3+NaBr+H2O
(4) ①. 1-丁醇 ②. 1-丁烯
(5) ①. A装置发生水解反应生成的1-丁醇,也可以使B中酸性高锰酸钾溶液褪色 ②. 将B中溶液换成溴的四氯化碳溶液(或溴水),若褪色,则证明可发生消去反应,反之,则没有发生
【18题答案】
【答案】(1)CH2=CH2+Br2→BrCH2CH2Br
(2)NaOH水溶液 (3)
(4)加聚反应 (5)
(6) ①. ②. ③.
【19题答案】
【答案】(1) ①. 质谱 ②. C3H6O3
(2) (3) ①. d ②. ③. ④. O—C的极性大于H—C的极性,A羧基中的羟基的极性增强,更易电离出氢离子
【20题答案】
【答案】(1)取代反应
(2)+2NaOH+2NaCl+2H2O
(3) (4) (5) ①. 2-甲基-1,3-丁二烯 ②. +
高二化学试卷
考生须知 1.本试卷为闭卷考试,满分为100分,考试时间为90分钟。 2.本试卷共7页,各题答案均答在本题规定的位置。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分 单项选择题 共42分
本题包括14道小题,每小题3分
1. 下列化学用语或图示表达不正确的是
A. 甲酸的结构式:
B. 乙烯的电子式:
C. 丙炔的键线式:
D. 聚丙烯的结构简式:
2. 下列物质属于酮的是
A. B.
C. D.
3. 下列有机物命名正确的是
A. 3,3-二甲基丁烷 B. 3-甲基-3-乙基戊烷
C. 2-乙基丁烷 D. 2,3,3-三甲基丁烷
4. 下列物质中,与1-丁烯互为同系物的是
A B.
C. D.
5. 下列各组液体混合物,可以利用分液操作分离,且有机物从分液漏斗下口放出的是
A. 苯和溴苯 B. 己烷和水 C. 硝基苯和水 D. 乙醇和水
6. 下列各组物质既能用溴水鉴别,也能用酸性高锰酸钾溶液鉴别的是
A. 苯和甲苯 B. 己烷和己烯 C. 己烯和己炔 D. 己烯和甲苯
7. 下列有机化合物分子中的所有碳原子不可能处于同一平面的是
A. B. CH3CH(CH3)CH3
C. CHC-CH3 D. CH2=C(CH3)2
8. 下列事实不能说明基团间存在相互影响的是
A. 氯乙酸的酸性强于乙酸的酸性
B. 苯酚能与溶液反应而乙醇不能
C. 甲苯能使酸性溶液褪色而甲烷不能
D. 乙烯能使酸性溶液褪色而乙烷不能
9. 硒()在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法不正确的是
A. Se原子在周期表中位于p区
B. 乙烷硒啉分子中,C原子的杂化类型有、
C. 乙烷硒啉分子中有5种不同化学环境的氢原子
D. 键角大小:气态
10. 用下列实验装置完成对应的实验,能达到实验目的的是
选项 A B
实验装置
实验目的 制取并收集少量乙炔 制取并检验乙烯
选项 C D
实验装置
实验目的 检验溴乙烷与NaOH乙醇溶液反应的有机产物 制取并收集乙酸乙酯
A. A B. B C. C D. D
11. 萜二醇是一种医药上的咳嗽祛痰剂,可由柠檬烯在酸性条件下与水加成得到,其原理如图。下列说法中,正确的是
A. 萜二醇能与 Na 反应产生 H2 B. 萜二醇能被氧化为萜二醛
C. 柠檬烯的分子式是 C10H20 D. 柠檬烯的一种同分异构体可能为芳香烃
12. 科学家提出由催化乙烯和2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层8电子稳定结构)。
下列相关叙述错误的是
A. 该历程的总反应为:
B. 物质Ⅱ→物质Ⅲ转化过程中W的化合价没有改变
C. 上述过程三种烯烃中只有乙烯不存在顺反异构体
D. 将乙烯和丙烯混合发生加聚反应可以得到产物
13. 由芳香烃可以生成3种有机化合物X、Y和Z,转化关系如下图所示:
下列说法不正确的是
A. R的结构简式为,苯环上的一氯代物有3种
B. 反应①条件是/光照,反应②条件是
C. R和Z的核磁共振氢谱上均有4组吸收峰
D. 反应①和②可得:苯的同系物与发生反应的条件不同,产物不同
14. 某有机化合物9.0 g与足量氧气在密闭容器中完全燃烧,将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重9.0 g,碱石灰增重17.6 g,下列说法不正确的是
A. 该有机化合物中一定含有氧元素
B. 该有机化合物的分子式为C4H10O2
C. 不能确定该有机化合物的分子式
D. 该有机化合物分子中碳原子数和氢原子数之比一定是2∶5
第二部分 非选择题 (共58分)
15. 写出下列反应化学方程式
(1)实验室制乙炔:___________。
(2)实验室制乙烯:___________。
(3)甲苯生成三硝基甲苯:___________。
(4)2-氯丁烷生成2-丁醇:___________。
(5)2-甲基-1,3-丁二烯的1,4-加聚(产物可使酸性KMnO4溶液褪色):___________。
16. 甲醇是重要的工业生产原料。
Ⅰ.甲醇空气氧化法是生产工业甲醛的常用方法。发生的反应为:
2CH3OH+O22+2H2O
(1)HCHO的空间结构为___________,它是一个___________(填“极性”或“非极性”)分子。
(2)甲醇氧化生成HCHO时,会产生CO、CO2等副产物。相同条件下,CO2的沸点比CO的高,主要原因为___________。
Ⅱ.以甲醇为原料生产碳酸二甲酯()的反应过程如下。
i.
ii.
(3)碳酸二甲酯分子中羰基碳原子的杂化类型是___________。
(4)CuCl中,基态的价电子排布式为___________,CuCl在生产碳酸二甲酯的反应过程中所起的作用是___________。
(5)上述方法中,甲醇单位时间内的转化率较低。为分析原因,查阅如下资料。
i.甲醇单位时间内的转化率主要受(+1价铜元素)浓度的影响。
ii.CuCl在甲醇中溶解度较小,且其中的易被氧化为难溶的CuO。
iii.加入4-甲基咪唑()可与形成配合物,可提高甲醇的转化率。
4-甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
请结合信息回答以下问题
①4-甲基咪唑中,1~4号原子___________(填“在”或“不在”)同一平面上,___________(填“1”或“3”)号N原子更容易与形成配位键。
②加入4-甲基咪唑后,甲醇转化率提高,可能的原因是___________(填序号)。
a.配合物中的-NH结构可增大其在甲醇中的溶解度
b.通过形成配合物,避免被氧化为难溶的CuO
c.形成的配合物能增大反应的限度
(6)配位原子提供孤电子对的能力是影响配体与之间配位键强度的一个重要因素。若用某结构相似的含O配体与配位,所得配合物的稳定性比含N配体低,可能的原因是___________。
17. 探究小组为研究1-溴丁烷的水解反应和消去反应,设计如下探究实验:
(1)实验i中淡黄色沉淀是___________(写化学式)。
(2)对比i、ii的实验现象,可得出卤代烃水解的实验结论是___________。
(3)实验iii的化学方程式是___________。
(4)检测ii中___________、iii中___________的生成可判断分别发生水解和消去反应。
(5)为深入研究1-溴丁烷与NaOH溶液是否能发生消去反应,小组设计如下装置探究(加热和夹持装置略去):
加热圆底烧瓶一段时间后,B中酸性高锰酸钾溶液褪色
①甲同学认为不能依据酸性高锰酸钾溶液褪色,判断A中发生消去反应,理由是___________。
②乙同学对实验进行了改进,依据实验现象可判断是否发生消去反应,改进的方案是___________。
18. 聚乙烯醇滴眼液可治疗眼部干涩等,主要成分是,某同学设计其合成路线如下:
(1)①的化学方程式是___________。
(2)试剂a是___________。
(3)HOCH2CH2OH和B反应的化学方程式是___________。
(4)②的反应类型是___________。
(5)③过程除了生成聚乙烯醇,另一个产物的结构简式为___________。
(6)乙酸乙烯酯有多种同分异构体,其中能与NaHCO3溶液反应放出气体的有:、___________、___________、___________(不考虑立体异构,存在顺反异构的,顺式、反式均要写出)。
19. 有机化合物A可由葡萄糖发酵得到,在医药和食品领域中有广泛应用,研究有机化合物A的分子结构、性质如下:
(1)确定A的分子式
经元素分析得到化合物A的实验式为CH2O,通过___________法(填仪器分析方法)可以测得A的相对分子质量为90,则A的分子式为___________。
(2)确定A的分子结构
使用现代分析仪器对A的分子结构进行测定,结果如下:
谱图 数据分析结果
红外光谱 含有-COOH、-OH
核磁共振氢谱 峰面积比为1︰1︰1︰3
A的结构简式为___________。
(3)研究A的结构和性质的关系
①A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同的光学性质,两种分子的关系为___________(填字母)。
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构
②写出A发生消去反应的化学方程式___________。
③写出2 mol A酯化反应生成1 mol水的化学方程式___________。
④已知:电离常数Ka(A)=1.3810-4,Ka(丙酸)=1.3410-5,分析数据可知A的酸性强于丙酸,请从共价键极性的角度解释原因___________。
20. 以石油裂解产物烯烃为原料合成一些新物质的路线如下。
已知:Diels-Alder反应:
(1)生成X的反应类型是___________。
(2)A→B的化学方程式是___________。
(3)E的结构简式是___________。
(4)Y的结构简式是___________。
(5)甲物质名称是___________;Z→W的化学方程式是___________。
首都师范大学附属苹果园中学2024-2025学年第二学期期中考试
高二化学试卷
考生须知 1.本试卷为闭卷考试,满分为100分,考试时间为90分钟。 2.本试卷共7页,各题答案均答在本题规定的位置。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分 单项选择题 共42分
本题包括14道小题,每小题3分
【1题答案】
【答案】D
【2题答案】
【答案】C
【3题答案】
【答案】B
【4题答案】
【答案】B
【5题答案】
【答案】C
【6题答案】
【答案】B
【7题答案】
【答案】B
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
【答案】C
【11题答案】
【答案】A
【12题答案】
【答案】C
【13题答案】
【答案】C
【14题答案】
【答案】C
第二部分 非选择题 (共58分)
【15题答案】
【答案】(1)
(2)
(3) (4)
(5)
【16题答案】
【答案】(1) ①. 平面三角形 ②. 极性
(2)CO2的相对分子质量比CO大,分子间作用力也大,则沸点高
(3)
(4) ①. ②. 催化作用
(5) ①. 在 ②. 3 ③. ab
(6)电负性,O对孤电子对的吸引力更强,故O作配体时,提供孤电子对与形成配位键的能力弱
【17题答案】
【答案】(1)AgBr
(2)1-溴丁烷在碱性溶液中水解速率更快
(3)BrCH2CH2CH2CH3+NaOHCH2=CHCH2CH3+NaBr+H2O
(4) ①. 1-丁醇 ②. 1-丁烯
(5) ①. A装置发生水解反应生成的1-丁醇,也可以使B中酸性高锰酸钾溶液褪色 ②. 将B中溶液换成溴的四氯化碳溶液(或溴水),若褪色,则证明可发生消去反应,反之,则没有发生
【18题答案】
【答案】(1)CH2=CH2+Br2→BrCH2CH2Br
(2)NaOH水溶液 (3)
(4)加聚反应 (5)
(6) ①. ②. ③.
【19题答案】
【答案】(1) ①. 质谱 ②. C3H6O3
(2) (3) ①. d ②. ③. ④. O—C的极性大于H—C的极性,A羧基中的羟基的极性增强,更易电离出氢离子
【20题答案】
【答案】(1)取代反应
(2)+2NaOH+2NaCl+2H2O
(3) (4) (5) ①. 2-甲基-1,3-丁二烯 ②. +
同课章节目录
