湖北省沙市中学2024-2025学年高三下学期模拟预测化学试卷(含答案)
文档属性
| 名称 | 湖北省沙市中学2024-2025学年高三下学期模拟预测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 14:43:33 | ||
图片预览




文档简介
2025年普通高中学业水平选择性考试(模拟)
化 学 试 卷
本试题卷共8页,19题。全卷满分100分。考试用时75分钟。
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:C 12 O 16 Zn 65 Mo 96 Cd 112
一、单选题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2025年巴黎AI峰会上,DeepSeek创始人梁文峰通过量子全息投影技术远程参会。全息投影的实现依赖于材料科学与光学技术的结合。下列相关说法错误的是
A.全息投影膜是一种薄而柔的聚酯膜(),该聚酯膜是通过缩聚反应形成的
B.全息投影技术常用卤化银作光敏材料,利用了光照时卤化银可分解产生Ag原子的特点
C.空气显示影像时通过电激发氧气发光,该过程属于化学变化
D.全息投影技术的光电器件所用材料氮化镓为新型无机非金属材料
2.电影《哪吒之魔童闹海》中有许多有趣的情境与化学知识密切相关,下列叙述错误的是
A.结界兽的设计灵感来源于商周青铜器,青铜是一种铜、锡、铅合金
B.石矶娘娘头戴的红色玛瑙簪子是一种硅酸盐
C.敖丙制造的冰晶具有规则的几何外形,是因为晶体具有自范性
D.海底炼狱中困住妖兽的铁链有可能会发生吸氧腐蚀而断裂
3.化学与生活息息相关、密不可分。下列说法正确的是
选项 生活情境 涉及化学知识
A LED灯装饰的建筑夜景 原子吸收光谱
B 阳台铁栏杆上刷油漆 主要是防止铁发生化学腐蚀
C 使用含氟牙膏可以坚固牙齿 牙齿表面釉质层的主要成分可以转为更难溶的氟磷灰石
D 用盐水浸泡菠萝后再食用 盐水能使菠萝中的蛋白酶变性
A.A B.B C.C D.D
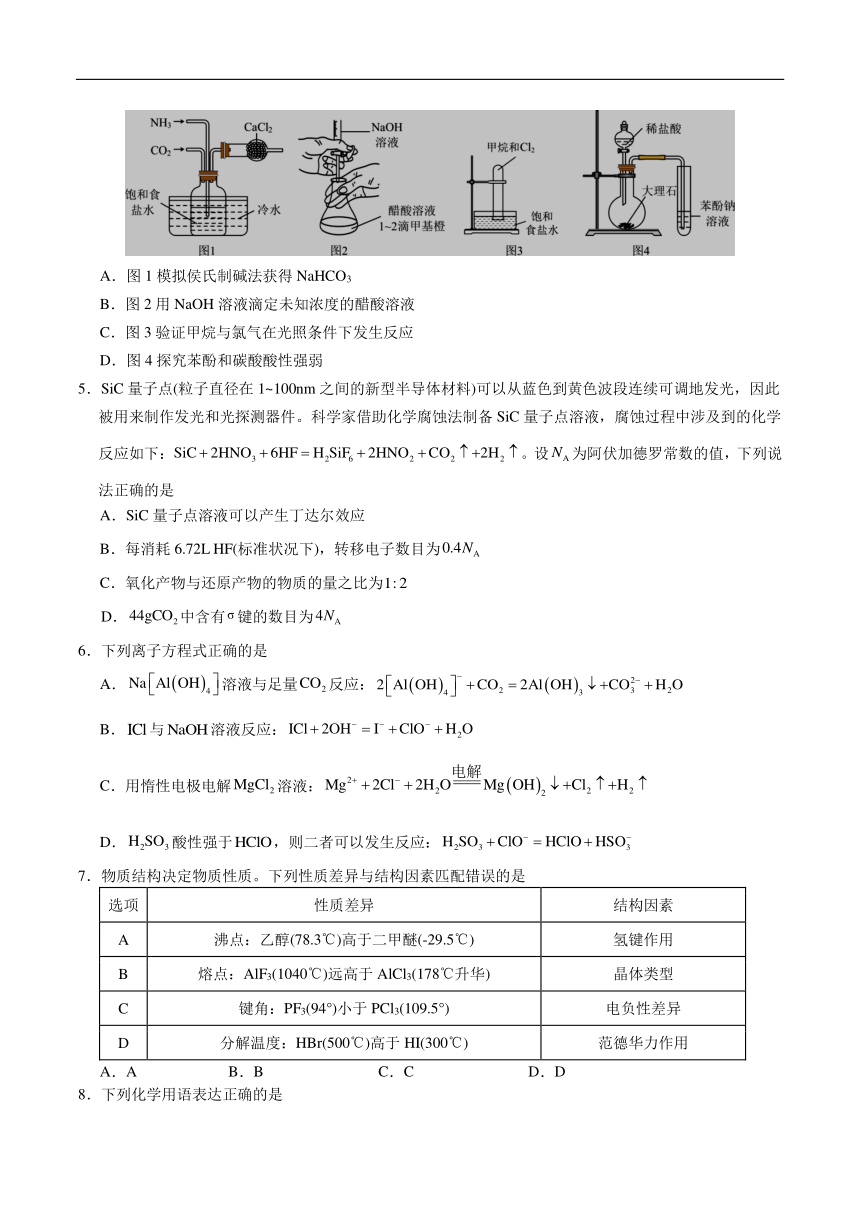
4.下列实验操作正确且能达到实验目的的是
A.图1模拟侯氏制碱法获得NaHCO3
B.图2用NaOH溶液滴定未知浓度的醋酸溶液
C.图3验证甲烷与氯气在光照条件下发生反应
D.图4探究苯酚和碳酸酸性强弱
5.SiC量子点(粒子直径在1~100nm之间的新型半导体材料)可以从蓝色到黄色波段连续可调地发光,因此被用来制作发光和光探测器件。科学家借助化学腐蚀法制备SiC量子点溶液,腐蚀过程中涉及到的化学反应如下:。设为阿伏加德罗常数的值,下列说法正确的是
A.SiC量子点溶液可以产生丁达尔效应
B.每消耗6.72L HF(标准状况下),转移电子数目为
C.氧化产物与还原产物的物质的量之比为
D.中含有键的数目为
6.下列离子方程式正确的是
A.溶液与足量反应:
B.与溶液反应:
C.用惰性电极电解溶液:
D.酸性强于,则二者可以发生反应:
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:乙醇(78.3℃)高于二甲醚(-29.5℃) 氢键作用
B 熔点:AlF3(1040℃)远高于AlCl3(178℃升华) 晶体类型
C 键角:PF3(94°)小于PCl3(109.5°) 电负性差异
D 分解温度:HBr(500℃)高于HI(300℃) 范德华力作用
A.A B.B C.C D.D
8.下列化学用语表达正确的是
A.中的大π键可表示为
B.的名称为2,3,5,5-四甲基-4-乙基己烷
C.酚醛树脂()经加成聚合反应制备
D.和反应的中和热,则稀溶液中和反应的焓变
9.纤维素可以多条单链的形式存在,在低温下溶于溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,可使纤维素绿色再生利用。下列说法错误的是
A.纤维素难溶于水的主要原因是其链间有多个氢键
B.提供破坏纤维素链之间的氢键,引发溶胀
C.加入尿素形成动态“包覆层”,防止链间重新结合
D.低温时纤维素分子链间的相互作用力增强,更易被溶解
10.某同学探究和与的配合能力强弱,已知,鲁米诺在
碱性环境中,可被分解产生的活性氧氧化并释放蓝色荧光,其反应快慢决定发光强度与持续时间。进行如下实验:
序号 0.75% 鲁米诺溶液(含和氨水)/mL 、、溶液/mL 溶液/mL 蒸馏水/mL 发光时间/s 荧光强度
1 50 50 50 0 0.5 25 强
2 50 50 50 0.5 0 120 弱
3 0 50 50 0.5 x 无 无
下列说法错误的是
A.作为缓冲溶液,维持溶液碱性环境
B.
C.实验1和实验2中,发光时间越长,说明溶液中发挥催化作用的浓度越高
D.与配位能力:
11.Pd在航空航天、化工医药等领域有重要的用途,一种从废汽车尾气催化剂(含有Pd、Al2O3、SiO2、P t、炭等)中回收Pd的工艺如下:
下列说法错误的是
A.滤渣的主要成分为、C
B.“酸浸”时主反应为:
C.-18-冠-6超分子具有识别功能,可以分离和
D.“沉钯”时被还原为并形成沉淀
12.嫦娥六号挖回的月背土壤成分确认了的含量,X、Y、Z、W是短周期主族元素,原子序数依次增大。短周期中,Y原子半径最大,基态X原子价层电子排布式为,W的最高正化合价和最低负化合价代数和等于0。下列叙述正确的是
A.简单离子半径: B.和的阴、阳离子数目比不同
C.分子是非极性分子 D.单质熔点:
13.生物电芬顿系统是将生物(电活性微生物,弱酸、中性条件下活性高)电化学系统与芬顿氧化工艺耦合的新兴水处理技术,产生的活性中间体在废水处理领域具有良好的应用前景。现用生物电芬顿系统处理含废水,工作原理如图,下列叙述错误的是
A.离子交换膜为质子交换膜
B.电解过程中a极区pH增大
C.b极电极反应式为,还伴随反应:
D.若处理,不考虑其他副反应,理论上电路中通过
14.金属钼()的一种晶胞为体心立方堆积(图1),晶胞参数为。以晶胞参数为单位长度建立如图所示坐标系(图2),该晶胞沿其体对角线方向上的投影如图3所示。下列说法错误的是
A.图3中原子3和原子4的连线长度为
B.金属钼的密度为
C.若图1中原子1的分数坐标为,则原子2的分数坐标为
D.钼原子的空间利用率为
15.工业上用氨气调节pH去除酸性废水中的铅。常温时,原溶液中含铅微粒的总物质的量浓度为0.01mol/L,各含铅微粒的物质的量分数与pH的关系如图所示(已知:NH3·H2O的Kb=1.74×10-5,Pb(OH)2难溶于水,10-0.2≈0.63,忽略溶液体积的变化)。下列说法正确的是
A.pH越大,除铅效果越好
B.pH=8时,溶液中的氨主要以NH3·H2O的形式存在
C.
D.的平衡常数为10-6.1
二、填空题:本题共4小题,共55分。
16.(12分)过氧乙酸(CH3COOOH)在卫生医疗、食品消毒及漂白剂领域等有广“泛应用。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在难溶固体酸的催化下制备过氧乙酸(CH3COOOH)。实验装置如图所示,请回答下列问题:
已知:①过氧乙酸为无色有刺激性气味液体,易挥发,见光或受热易分解,其纯品极为敏感,易发生爆炸性反应;氧化性与高锰酸钾相当。
②相关物质性质
相关物质 CH3COOH CH3COOOH 乙酸丁酯 乙酸丁酯与水共沸物
沸点(°C) 118 105 126 90.7
实验步骤:
①向油水分离器中加入适量蒸馏水液面低于分离器支管口;
②仪器2中加入固体酸催化剂、适量乙酸丁酯和液体A,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为60°C;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入液体B;
④当油水分离器中水层液面升高到支管口时,进行操作X;
⑤关闭仪器7处放空阀,继续反应,重复步骤④。待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。
回答下列问题:
(1)下列有关实验说法正确的是________。
A.液体A为浓度为30%的双氧水
B.为了达到更好的冷凝效果,冷凝水方向宜与气流方向形成逆流,因此仪器6中冷凝水b进a出
C.反应时采用抽气泵减压可降低共沸物的沸点,防止温度过高导致过氧乙酸分解
D.反应结束后,先关闭抽气泵,再打开仪器7处的放空阀
(2)操作X为 。
(3)乙酸丁酯的主要作用除了形成共沸物,利于水蒸出,防止温度过高之外,还有 ,可通过 (填实验现象)判断反应已完成。
(4)粗产品中过氧乙酸(CH3COOOH)含量的测定:
滴定1:用______量取一定体积的样品VmL置于______,用胶头滴管取过量 KI溶液与过氧化物作用,从_______中取出并加入指示剂,以0.10mol·L-1的硫代硫酸钠溶液用________滴定( I2+2=2I-+),消耗量为V1mL;
滴定2:另量取一定体积的样品 VmL,用0.02mol·L-1的酸性高锰酸钾溶液滴定,消耗量为V2mL,只发生反应为5H2O2+2+6H+=2Mn2+ +5O2 +8H2O
①为完成滴定1实验,请在横线上按顺序填上相应仪器或试剂瓶 (填字母)。
A.量筒 B.烧杯 C.碱式滴定管
D.容量瓶 E.移液管 F.淀粉溶液滴瓶
G.酚酞溶液滴瓶 H.锥形瓶 I.托盘天平
②计算粗产品中过氧乙酸的浓度为 mol·L-1。
17.(14分)镉(Cd)广泛用于金属电镀、制作合金、制作颜料等。以炼锌工艺中烧结电尘(主要成分为CdO、CdSO4,含CdS、Pb、Zn等杂质)为原料,氨法浸出提镉的流程如图1所示。
已知:①CdS既不溶于水也不溶于氨溶液;氨浸出工序中,CdSO4浸出的离子方程式为;净化工序中,含Cd微粒未发生变化。
②室温下,,,。
回答下列问题:
(1)Cd与Zn同族且相邻,基态Cd原子的价电子轨道表示式为 。浸出渣的主要成分是 (填化学式)。
(2)氨浸出工序中,CdO浸出的离子方程式为 。浸出的总氨浓度(与的总浓度)和最佳总氨浓度下氨铵比分别与浸出率的关系曲线如图2、3所示,则最佳条件下溶液中 。
(3)沉镉工序中,消耗0.65g锌粉时,溶液质量减轻 g。
(4)沉锌工序中,室温下向溶液中通入至饱和,且控制溶液的,则此时溶液中 。沉锌余液可返回 工序,实现闭环循环,使元素充分利用。
18.(14分)制氢技术研究具有重要意义。
(1)肼硼烷水解制氢。
①肼硼烷水解:,生成的可进一步转化为或。若要增大氢气的产率,需提高生成 的选择性(填“”或“”)。请画出的VSEPR模型: 。
②石墨烯可用作肼硼烷水解的催化剂载体。在石墨烯上引入氨基,有利于催化剂均匀分散于水中,原因是
。
(2)电催化乙二醇制氢,同时得到乙醇酸,电解原理如下图-1所示。一定条件下,测得乙二醇与乙醇酸的总物质的量及乙醇酸的法拉第效率随时间变化如下图-2所示。[法拉第效率]
①阳极的电极反应式为 。
②乙醇酸的法拉第效率小于100%的原因是 。
(3)甲醇和水蒸气重整制氢。在340℃时,将一定量的和在催化剂作用下发生反应,其可能的机理如下图-3所示。
①水蒸气在催化剂表面生成活性。随着水蒸气浓度的增大,的转化率先增大后减小的原因是 。
②过程中会分解生成CO,导致催化剂中毒。适当增大水蒸气的浓度,能降低CO的含量,原因是 。
19.(15分)奥卡西平是一种可用于治疗神经系统疾病的药物。奥卡西平的一种合成路线如下:
(1)奥卡西平中含有的官能团有_______。
A.酯基 B.酮羰基 C.醛基 D.酰胺基
(2)化合物H中有 个手性碳原子。
(3)反应①所需的试剂与条件是 ;B的名称为 。
(4)合成路线中属于还原反应的是_______。
A.反应② B.反应③ C.反应④ D.反应⑤
(5)写出符合下列要求的D的一种同分异构体的结构简式 。
ⅰ)含有联苯()结构,且除苯环外不含其他环状结构
ⅱ)核磁共振氢谱显示苯环上的氢原子有四种不同的化学环境,且个数比为1:1:1:1
(6)已知:+ +HCl。反应④进行时,①若过量,有利于反应
正向进行,原因是 。②若不足,F的转化率未发生明显降低,但G的产率却显著下降,原因是 。
(7)合成路线中B→C的转化过程是构建碳骨架的常见方法之一。已知:+(、为烃基或H)结合相关信息,写出B→C的转化路线。(无机试剂任选)。(可表示为:目标产物
化 学 参 考 答 案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B C C A C D A D D C D B A D
16、(1)C (2)打开放空阀,打开活塞,逐滴放出过量水
(3)降低过氧乙酸浓度,提高其稳定性,防止反应时发生爆炸 当油水分离器中水层不再增加(4)① EHFC ②
17、(1) CdS
(2) 5
(3) 0.47 (4) 氨浸出
18、(1)①
② 氨基与水分子之间形成氢键,增大了催化剂的水溶性
(2)① ② 生成其他含碳副产物(如等)或
(3)① 水蒸气浓度增大,生成更多,有利于转化;水蒸气浓度过大,占据较多氧空位,不利于甲醇吸附 ② CO被氧化(或)
19、(1)BD(1分) (2)2(1分)
(3)浓硫酸、浓硝酸、加热(1分) 邻硝基甲苯或2-硝基甲苯(1分) (4)AB
(5)、、
(任写一种)
(6)NH3与氯化氢反应生成氯化铵,使平衡正向移动
生成的G继续与F反应,生成副产物或1分子氨气与2分子F发生反应,生成副产物
(7)(3分)
化 学 试 卷
本试题卷共8页,19题。全卷满分100分。考试用时75分钟。
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:C 12 O 16 Zn 65 Mo 96 Cd 112
一、单选题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2025年巴黎AI峰会上,DeepSeek创始人梁文峰通过量子全息投影技术远程参会。全息投影的实现依赖于材料科学与光学技术的结合。下列相关说法错误的是
A.全息投影膜是一种薄而柔的聚酯膜(),该聚酯膜是通过缩聚反应形成的
B.全息投影技术常用卤化银作光敏材料,利用了光照时卤化银可分解产生Ag原子的特点
C.空气显示影像时通过电激发氧气发光,该过程属于化学变化
D.全息投影技术的光电器件所用材料氮化镓为新型无机非金属材料
2.电影《哪吒之魔童闹海》中有许多有趣的情境与化学知识密切相关,下列叙述错误的是
A.结界兽的设计灵感来源于商周青铜器,青铜是一种铜、锡、铅合金
B.石矶娘娘头戴的红色玛瑙簪子是一种硅酸盐
C.敖丙制造的冰晶具有规则的几何外形,是因为晶体具有自范性
D.海底炼狱中困住妖兽的铁链有可能会发生吸氧腐蚀而断裂
3.化学与生活息息相关、密不可分。下列说法正确的是
选项 生活情境 涉及化学知识
A LED灯装饰的建筑夜景 原子吸收光谱
B 阳台铁栏杆上刷油漆 主要是防止铁发生化学腐蚀
C 使用含氟牙膏可以坚固牙齿 牙齿表面釉质层的主要成分可以转为更难溶的氟磷灰石
D 用盐水浸泡菠萝后再食用 盐水能使菠萝中的蛋白酶变性
A.A B.B C.C D.D
4.下列实验操作正确且能达到实验目的的是
A.图1模拟侯氏制碱法获得NaHCO3
B.图2用NaOH溶液滴定未知浓度的醋酸溶液
C.图3验证甲烷与氯气在光照条件下发生反应
D.图4探究苯酚和碳酸酸性强弱
5.SiC量子点(粒子直径在1~100nm之间的新型半导体材料)可以从蓝色到黄色波段连续可调地发光,因此被用来制作发光和光探测器件。科学家借助化学腐蚀法制备SiC量子点溶液,腐蚀过程中涉及到的化学反应如下:。设为阿伏加德罗常数的值,下列说法正确的是
A.SiC量子点溶液可以产生丁达尔效应
B.每消耗6.72L HF(标准状况下),转移电子数目为
C.氧化产物与还原产物的物质的量之比为
D.中含有键的数目为
6.下列离子方程式正确的是
A.溶液与足量反应:
B.与溶液反应:
C.用惰性电极电解溶液:
D.酸性强于,则二者可以发生反应:
7.物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 沸点:乙醇(78.3℃)高于二甲醚(-29.5℃) 氢键作用
B 熔点:AlF3(1040℃)远高于AlCl3(178℃升华) 晶体类型
C 键角:PF3(94°)小于PCl3(109.5°) 电负性差异
D 分解温度:HBr(500℃)高于HI(300℃) 范德华力作用
A.A B.B C.C D.D
8.下列化学用语表达正确的是
A.中的大π键可表示为
B.的名称为2,3,5,5-四甲基-4-乙基己烷
C.酚醛树脂()经加成聚合反应制备
D.和反应的中和热,则稀溶液中和反应的焓变
9.纤维素可以多条单链的形式存在,在低温下溶于溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,可使纤维素绿色再生利用。下列说法错误的是
A.纤维素难溶于水的主要原因是其链间有多个氢键
B.提供破坏纤维素链之间的氢键,引发溶胀
C.加入尿素形成动态“包覆层”,防止链间重新结合
D.低温时纤维素分子链间的相互作用力增强,更易被溶解
10.某同学探究和与的配合能力强弱,已知,鲁米诺在
碱性环境中,可被分解产生的活性氧氧化并释放蓝色荧光,其反应快慢决定发光强度与持续时间。进行如下实验:
序号 0.75% 鲁米诺溶液(含和氨水)/mL 、、溶液/mL 溶液/mL 蒸馏水/mL 发光时间/s 荧光强度
1 50 50 50 0 0.5 25 强
2 50 50 50 0.5 0 120 弱
3 0 50 50 0.5 x 无 无
下列说法错误的是
A.作为缓冲溶液,维持溶液碱性环境
B.
C.实验1和实验2中,发光时间越长,说明溶液中发挥催化作用的浓度越高
D.与配位能力:
11.Pd在航空航天、化工医药等领域有重要的用途,一种从废汽车尾气催化剂(含有Pd、Al2O3、SiO2、P t、炭等)中回收Pd的工艺如下:
下列说法错误的是
A.滤渣的主要成分为、C
B.“酸浸”时主反应为:
C.-18-冠-6超分子具有识别功能,可以分离和
D.“沉钯”时被还原为并形成沉淀
12.嫦娥六号挖回的月背土壤成分确认了的含量,X、Y、Z、W是短周期主族元素,原子序数依次增大。短周期中,Y原子半径最大,基态X原子价层电子排布式为,W的最高正化合价和最低负化合价代数和等于0。下列叙述正确的是
A.简单离子半径: B.和的阴、阳离子数目比不同
C.分子是非极性分子 D.单质熔点:
13.生物电芬顿系统是将生物(电活性微生物,弱酸、中性条件下活性高)电化学系统与芬顿氧化工艺耦合的新兴水处理技术,产生的活性中间体在废水处理领域具有良好的应用前景。现用生物电芬顿系统处理含废水,工作原理如图,下列叙述错误的是
A.离子交换膜为质子交换膜
B.电解过程中a极区pH增大
C.b极电极反应式为,还伴随反应:
D.若处理,不考虑其他副反应,理论上电路中通过
14.金属钼()的一种晶胞为体心立方堆积(图1),晶胞参数为。以晶胞参数为单位长度建立如图所示坐标系(图2),该晶胞沿其体对角线方向上的投影如图3所示。下列说法错误的是
A.图3中原子3和原子4的连线长度为
B.金属钼的密度为
C.若图1中原子1的分数坐标为,则原子2的分数坐标为
D.钼原子的空间利用率为
15.工业上用氨气调节pH去除酸性废水中的铅。常温时,原溶液中含铅微粒的总物质的量浓度为0.01mol/L,各含铅微粒的物质的量分数与pH的关系如图所示(已知:NH3·H2O的Kb=1.74×10-5,Pb(OH)2难溶于水,10-0.2≈0.63,忽略溶液体积的变化)。下列说法正确的是
A.pH越大,除铅效果越好
B.pH=8时,溶液中的氨主要以NH3·H2O的形式存在
C.
D.的平衡常数为10-6.1
二、填空题:本题共4小题,共55分。
16.(12分)过氧乙酸(CH3COOOH)在卫生医疗、食品消毒及漂白剂领域等有广“泛应用。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在难溶固体酸的催化下制备过氧乙酸(CH3COOOH)。实验装置如图所示,请回答下列问题:
已知:①过氧乙酸为无色有刺激性气味液体,易挥发,见光或受热易分解,其纯品极为敏感,易发生爆炸性反应;氧化性与高锰酸钾相当。
②相关物质性质
相关物质 CH3COOH CH3COOOH 乙酸丁酯 乙酸丁酯与水共沸物
沸点(°C) 118 105 126 90.7
实验步骤:
①向油水分离器中加入适量蒸馏水液面低于分离器支管口;
②仪器2中加入固体酸催化剂、适量乙酸丁酯和液体A,仪器6中通冷却水,开通仪器1和8,缓慢关闭仪器7处放空阀,温度维持为60°C;
③待真空度达到反应要求时,打开仪器3的活塞,缓慢逐滴滴入液体B;
④当油水分离器中水层液面升高到支管口时,进行操作X;
⑤关闭仪器7处放空阀,继续反应,重复步骤④。待反应结束,冷却后放出油水分离器中下层水,将上层液体从油水分离器上口倒入仪器2,分离仪器2中的混合物,初步得到粗产品。
回答下列问题:
(1)下列有关实验说法正确的是________。
A.液体A为浓度为30%的双氧水
B.为了达到更好的冷凝效果,冷凝水方向宜与气流方向形成逆流,因此仪器6中冷凝水b进a出
C.反应时采用抽气泵减压可降低共沸物的沸点,防止温度过高导致过氧乙酸分解
D.反应结束后,先关闭抽气泵,再打开仪器7处的放空阀
(2)操作X为 。
(3)乙酸丁酯的主要作用除了形成共沸物,利于水蒸出,防止温度过高之外,还有 ,可通过 (填实验现象)判断反应已完成。
(4)粗产品中过氧乙酸(CH3COOOH)含量的测定:
滴定1:用______量取一定体积的样品VmL置于______,用胶头滴管取过量 KI溶液与过氧化物作用,从_______中取出并加入指示剂,以0.10mol·L-1的硫代硫酸钠溶液用________滴定( I2+2=2I-+),消耗量为V1mL;
滴定2:另量取一定体积的样品 VmL,用0.02mol·L-1的酸性高锰酸钾溶液滴定,消耗量为V2mL,只发生反应为5H2O2+2+6H+=2Mn2+ +5O2 +8H2O
①为完成滴定1实验,请在横线上按顺序填上相应仪器或试剂瓶 (填字母)。
A.量筒 B.烧杯 C.碱式滴定管
D.容量瓶 E.移液管 F.淀粉溶液滴瓶
G.酚酞溶液滴瓶 H.锥形瓶 I.托盘天平
②计算粗产品中过氧乙酸的浓度为 mol·L-1。
17.(14分)镉(Cd)广泛用于金属电镀、制作合金、制作颜料等。以炼锌工艺中烧结电尘(主要成分为CdO、CdSO4,含CdS、Pb、Zn等杂质)为原料,氨法浸出提镉的流程如图1所示。
已知:①CdS既不溶于水也不溶于氨溶液;氨浸出工序中,CdSO4浸出的离子方程式为;净化工序中,含Cd微粒未发生变化。
②室温下,,,。
回答下列问题:
(1)Cd与Zn同族且相邻,基态Cd原子的价电子轨道表示式为 。浸出渣的主要成分是 (填化学式)。
(2)氨浸出工序中,CdO浸出的离子方程式为 。浸出的总氨浓度(与的总浓度)和最佳总氨浓度下氨铵比分别与浸出率的关系曲线如图2、3所示,则最佳条件下溶液中 。
(3)沉镉工序中,消耗0.65g锌粉时,溶液质量减轻 g。
(4)沉锌工序中,室温下向溶液中通入至饱和,且控制溶液的,则此时溶液中 。沉锌余液可返回 工序,实现闭环循环,使元素充分利用。
18.(14分)制氢技术研究具有重要意义。
(1)肼硼烷水解制氢。
①肼硼烷水解:,生成的可进一步转化为或。若要增大氢气的产率,需提高生成 的选择性(填“”或“”)。请画出的VSEPR模型: 。
②石墨烯可用作肼硼烷水解的催化剂载体。在石墨烯上引入氨基,有利于催化剂均匀分散于水中,原因是
。
(2)电催化乙二醇制氢,同时得到乙醇酸,电解原理如下图-1所示。一定条件下,测得乙二醇与乙醇酸的总物质的量及乙醇酸的法拉第效率随时间变化如下图-2所示。[法拉第效率]
①阳极的电极反应式为 。
②乙醇酸的法拉第效率小于100%的原因是 。
(3)甲醇和水蒸气重整制氢。在340℃时,将一定量的和在催化剂作用下发生反应,其可能的机理如下图-3所示。
①水蒸气在催化剂表面生成活性。随着水蒸气浓度的增大,的转化率先增大后减小的原因是 。
②过程中会分解生成CO,导致催化剂中毒。适当增大水蒸气的浓度,能降低CO的含量,原因是 。
19.(15分)奥卡西平是一种可用于治疗神经系统疾病的药物。奥卡西平的一种合成路线如下:
(1)奥卡西平中含有的官能团有_______。
A.酯基 B.酮羰基 C.醛基 D.酰胺基
(2)化合物H中有 个手性碳原子。
(3)反应①所需的试剂与条件是 ;B的名称为 。
(4)合成路线中属于还原反应的是_______。
A.反应② B.反应③ C.反应④ D.反应⑤
(5)写出符合下列要求的D的一种同分异构体的结构简式 。
ⅰ)含有联苯()结构,且除苯环外不含其他环状结构
ⅱ)核磁共振氢谱显示苯环上的氢原子有四种不同的化学环境,且个数比为1:1:1:1
(6)已知:+ +HCl。反应④进行时,①若过量,有利于反应
正向进行,原因是 。②若不足,F的转化率未发生明显降低,但G的产率却显著下降,原因是 。
(7)合成路线中B→C的转化过程是构建碳骨架的常见方法之一。已知:+(、为烃基或H)结合相关信息,写出B→C的转化路线。(无机试剂任选)。(可表示为:目标产物
化 学 参 考 答 案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C B C C A C D A D D C D B A D
16、(1)C (2)打开放空阀,打开活塞,逐滴放出过量水
(3)降低过氧乙酸浓度,提高其稳定性,防止反应时发生爆炸 当油水分离器中水层不再增加(4)① EHFC ②
17、(1) CdS
(2) 5
(3) 0.47 (4) 氨浸出
18、(1)①
② 氨基与水分子之间形成氢键,增大了催化剂的水溶性
(2)① ② 生成其他含碳副产物(如等)或
(3)① 水蒸气浓度增大,生成更多,有利于转化;水蒸气浓度过大,占据较多氧空位,不利于甲醇吸附 ② CO被氧化(或)
19、(1)BD(1分) (2)2(1分)
(3)浓硫酸、浓硝酸、加热(1分) 邻硝基甲苯或2-硝基甲苯(1分) (4)AB
(5)、、
(任写一种)
(6)NH3与氯化氢反应生成氯化铵,使平衡正向移动
生成的G继续与F反应,生成副产物或1分子氨气与2分子F发生反应,生成副产物
(7)(3分)
同课章节目录
