人教版高中化学必修二课件 4.1开发利用金属矿物和海水资源 (共42张PPT)
文档属性
| 名称 | 人教版高中化学必修二课件 4.1开发利用金属矿物和海水资源 (共42张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-16 00:05:16 | ||
图片预览










文档简介
课件42张PPT。第四章 化学与自然资源的开发利用
第一节 开发利用金属矿物和海水资源
第1课时 金属矿物的开发利用1.了解金属在自然界中的存在形式。
2.掌握金属的冶炼方法。
3.掌握铝热反应原理及实验步骤。
4.了解金属回收和资源保护的意义。
5.认识和体会化学在自然资源开发和利用中的意义和作用。一、金属在自然界中的存在形态游离化合二、金属的冶炼
1.冶炼原理:将金属从化合物中还原出来。
2.冶炼方法①:
金属冶炼的常用方法有:
(1)热分解法,如①汞、②银;
(2)电解法,如③钠、④镁、⑤铝;
(3)热还原法,如⑥高炉炼铁、⑦铝热法炼铁;
(4)其他方法,如⑧湿法炼铜、⑨火法炼铜。写出①~⑨的化学方程式:
①_________________,②__________________,
③_________________________,
④________________________,
⑤_____________________________,
⑥_______________________,
⑦_______________________,
⑧____________________,
⑨____________________。Fe+CuSO4====FeSO4+Cu三、金属资源的合理开发利用
1.合理开发利用金属资源的意义:金属矿物资源是_____再生资
源且贮量有限,冶炼过程中会消耗大量能量,也易造成环境污
染。故应合理开发利用金属资源。
2.有效利用金属资源②的途径:
(1)提高金属矿物的_______;
(2)减少金属的使用量;
(3)加强金属资源的_____________;
(4)使用_________代替金属材料。不可利用率回收和再利用其他材料【思考辨析】
1.判断正误:
(1)黄金的冶炼需要热分解法。( )
分析:金在自然界中以游离态存在,无需进行冶炼。
(2)金属阳离子被还原,一定得到金属单质。( )
分析:变价金属元素的最高价阳离子被还原时,可能得到中间价
态的离子,而不一定得到金属单质,如Fe3+可被还原成Fe2+。
(3)金属冶炼的实质是把金属从化合态还原为游离态。( )
分析:金属冶炼的实质是利用氧化还原反应将金属从化合物中
还原出来。××√2.问题思考:
(1)利用CO冶炼铁的反应是置换反应吗?
分析:不是。CO冶炼铁的反应是3CO+Fe2O3 2Fe+3CO2,该反
应不是置换反应。
(2)化学反应4H2+Fe3O4====3Fe+4H2O和3Fe+4H2O====Fe3O4+4H2
在一定条件下都能进行,说明氢气和铁的还原性是不确定的,对
吗?
分析:不对,两个反应的条件是不同的。【知识链接】
①金属冶炼方法与人类使用金属的关系
金属的冶炼方法与金属的活泼性有关,金属越不活泼,越容易冶炼,人类发现和使用得越早,金属越活泼,金属越难冶炼,人类使用得越晚。如约6 000年前人类使用铜,而约200年前才使用铝。
②金属资源利用中的三个问题
a.地球上的金属资源是有限的,不可再生的。
b.金属冶炼技术的提升和创新以及冶炼过程中产生的废水、废气、废渣的处理是合理利用金属资源的重要方面。
c.金属的腐蚀和金属资源的短缺是对人类严峻的挑战。一、金属的活泼性与冶炼方法
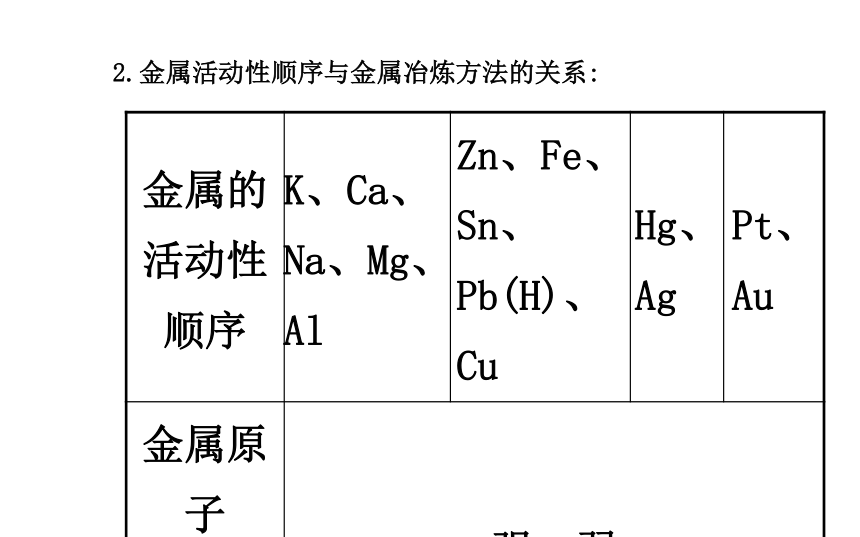
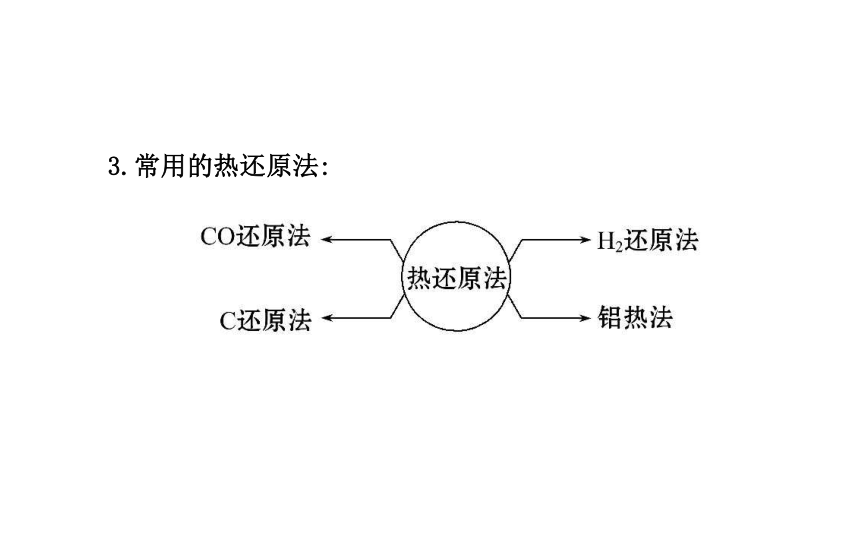
1.金属的冶炼原理:金属冶炼的实质是使金属化合物中的金属阳离子得到电子被还原为金属单质的过程,即:Mn++ne-====M。2.金属活动性顺序与金属冶炼方法的关系:3.常用的热还原法:【知识备选】金属冶炼的三个步骤及目的【学而后思】
(1)为什么越活泼的金属,被人类利用得越晚?
提示:因为金属越活泼,其离子的氧化性越弱,就越难被还原,故制取和应用的时间越晚。
(2)选择金属冶炼方法的依据是什么?
提示:选择何种方法冶炼金属,应依据金属在自然界中的存在形态和金属的活动性。
金属冶炼时,金属元素由化合态变为游离态,金属活动性不同,其阳离子得电子能力不同,得电子能力强的,易被还原,可选用加热法或热还原法,得电子能力弱的较难被还原,可用电解法。二、铝热反应
1.铝热反应:
(1)概念:铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
(2)原理:Al作还原剂,另一种氧化物作氧化剂,用铝将氧化物中的金属置换出来。
(3)铝热剂:铝粉和某些金属氧化物(Fe3O4、Cr2O3、V2O5等)组成的混合物。
(4)反应特点:
①在高温下进行;②反应迅速并放出大量的热;③新生成的金属单质呈熔融态且易与Al2O3分离。2.铝热反应实验:3.铝热反应实验注意事项:
(1)要保证纸漏斗重叠时四周均为四层,且内层纸漏斗一定要用水润湿,以防高温物质从纸漏斗四周溅出;
(2)要用盛有细沙的蒸发皿接收熔融物,既要防止蒸发皿炸裂,又要防止熔融的液体溅出伤人。【知识备选】类似“铝热法”的金属冶炼方法
其他的金属单质与金属氧化物混合之后点燃,也会发生强烈的氧化还原反应,效果类似于“铝热反应”。其中的金属单质可以是铝、镁、钙、钛,或者是非金属硼、硅,而金属氧化物可以是三氧化二铬、二氧化锰、氧化亚铁、三氧化二铁、四氧化三铁、氧化铜和四氧化三铅或者是非金属氧化物二氧化硅、三氧化二硼等。有时这些反应也根据反应中的还原剂而被称为“镁热法”“硅热法”“钙热法”“碳热法”等。【学而后思】
(1)能否用铝热反应冶炼金属镁?
提示:不能,铝热反应的实质是置换反应,利用铝的活泼性置换出较不活泼的金属,镁比铝活泼,只能利用电解法冶炼。
(2)铝热反应中镁带和氯酸钾的作用分别是什么?
提示:镁带燃烧放出大量的热,使氯酸钾分解产生氧气,促使镁带更加剧烈燃烧,产生更多热量,从而使铝热剂在高温下发生反应。类型 一 金属的冶炼?
【典例】(2013·山东高考改编)由下列物质冶炼相应金属时采用电解法的是( )
A.Fe2O3 B.NaCl C.Cu2S D.AlCl3【解题指南】解答本题要注意以下两点:
(1)金属的活泼性决定了其冶炼方法;
(2)活泼金属应用电解法冶炼。【解析】选B。排在铝(包含铝)之前的活泼金属应用电解法冶
炼,B正确;由Fe2O3冶炼铁应用热还原法,由Cu2S冶炼铜属火法炼
铜,反应为Cu2S+O2 2Cu+SO2,冶炼铝应电解Al2O3。【变式训练】下列化学方程式,能用于工业上冶炼金属镁的是
( )
A.2Na+MgCl2====2NaCl+Mg
B.MgCl2(熔融) Mg+Cl2↑
C.2MgO 2Mg+O2
D.MgCO3 MgO+CO2↑
【解析】选B。镁是比铝活泼性强的金属,应利用电解法冶炼。【变式备选】从金属被利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近几百年的事。下列跟这个先后顺序有关的是( )
①地壳中金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤ C.③⑤ D.②④【解析】选D。金属活动性顺序表中,金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属离子还原,人们开发、利用的时间也就越早;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来使金属离子还原,人们开发利用的时间就越晚。类型 二 铝热反应及其应用?
【典例】如图所示进行铝热反应,回答下列问题:
(1)写出该反应的化学方程式: ,反应
中 是氧化剂, 是还原剂,该反
应属于 反应(填四种基本反应类型)。(2)选出该实验的实验现象(填写序号): 。
①镁带剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四
射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内
的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:
内层纸漏斗底部剪一小孔: ;
蒸发皿盛沙: ;
镁带:_ ;
氯酸钾: 。【解题指南】解答本题要注意以下3点:
(1)铝热反应为置换反应,铝置换比其活泼性差的难熔金属。
(2)铝热反应放出大量的热量使难熔金属熔化。
(3)铝热反应中镁使氯酸钾分解,引发铝热反应。【解析】(1)铝热反应为2Al+Fe2O3 2Fe+Al2O3,该反应中
Fe2O3作氧化剂,Al作还原剂。(2)①②③④全为该铝热反应的
现象。(3)铝热反应实验中:①为使熔融物易落下通常在内层纸
漏斗底部剪一小孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙
子;③反应中镁带引起氯酸钾分解;④氯酸钾引发铝热反应。
答案:(1)Fe2O3+2Al Al2O3+2Fe
Fe2O3 Al 置换 (2)①②③④
(3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾
分解 引发铝热反应【名师点评】讲解本题时应重点强调以下3点:
(1)铝热反应利用了铝的较强的还原性;
(2)铝热反应的现象要围绕反应放出大量的热展开;
(3)了解铝热反应中镁带和氯酸钾的作用。【方法规律】铝热反应试题的分析
在无机框图推断中常出现反应模式: ,且A、C为单
质,B、D是化合物。分析该反应的特点:该反应是置换反应且条
件是高温,可初步确定是铝热反应,且A是铝。再结合其他的条
件确定其他物质。【变式训练】在反应Al+XaOb Al2O3+X中,X不可能的物质
是( )
A.Fe B.Mg C.Cr D.Mn
【解析】选B。该反应的模式是铝热反应,可利用铝热反应冶炼
金属Fe、Cr、Mn等难熔金属,不能冶炼比铝更活泼的金属。【变式备选】用铝热法从下列金属氧化物中制取相应的金属各1 mol,消耗铝的质量最多的是( )
A.Fe2O3 B.V2O5 C.MnO2 D.Cr2O3
【解析】选B。金属冶炼的本质是Mn++ne-====M。消耗铝的质量最多的是生成1 mol该金属得到电子数最多的,可见金属在氧化物中化合价越高,需电子数越多,消耗铝的质量越多。1.(2013·武汉高一检测)不同的金属,其冶炼方法也可能不同,主要原因是( )
A.金属的活动性不同
B.金属在自然界中的分布不同
C.金属在自然界中的存在形式不同
D.金属在自然界中的含量不同
【解析】选A。根据金属的活动性不同,对不同的金属采取不同的冶炼方法,A正确。2.铝热剂中铝的作用是( )
A.催化剂 B.氧化剂 C.还原剂 D.填充剂
【解析】选C。铝热反应的实质就是铝将金属氧化物中的金属还原出来,所以铝热剂中的铝是作还原剂。3.(2013·沈阳高一检测)下列方法中不能从溶有黄金的王水中提取出金的方法是( )
A.萃取 B.用Zn置换 C.用Fe置换 D.电解
【解析】选A。Au不活泼,其提取方法有多种可能。用铁或锌置换或电解的方法都能得到金。4.(双选)下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融) 2Na+Cl2↑
B.MgO+H2 Mg+H2O
C.Fe3O4 3Fe+2O2↑
D.2HgO 2Hg+O2↑
【解析】选B、C。Na、Mg很活泼,应用电解法冶炼,A正确,B错
误;铁属较活泼金属,可用热还原法,C错误;较不活泼金属汞可
用热分解法,D正确。5.以铝土矿(主要成分氧化铝)、盐酸、氨水为主要原料制备金
属铝,反应原理如下:
Al2O3+6HCl====2AlCl3+3H2O,AlCl3+3NH3·H2O====Al(OH)3↓+
3NH4Cl,2Al(OH)3 Al2O3+3H2O,_____________(完成该反
应),并指出该反应中生成标准状况下6.72 L氧气,冶炼出铝的
物质的量是 mol,利用冶炼出的铝在高温下与氧化铁
反应,写出该反应的化学方程式 。【解析】据给出的反应可知最后一步是电解熔融的氧化铝制取
金属铝,化学方程式是2Al2O3(熔融) 4Al+3O2↑,该反应
中生成标准状况下6.72 L氧气,即氧气是6.72 L÷22.4 L·mol-1
=0.3 mol,故冶炼出铝的物质的量是0.3 mol×4÷3=0.4 mol,冶
炼出的铝在高温下与氧化铁反应的化学方程式是2Al+Fe2O3
2Fe+Al2O3。
答案:2Al2O3(熔融) 4Al+3O2↑ 0.4
2Al+Fe2O3 2Fe+Al2O3 铝热反应产物的实验探究
如图是铝热反应的实验装置图,该反应的化学方程式为
2Al+Fe2O3 2Fe+Al2O3。
关于“铝热反应”的现象有这样的描述:
“反应放出大量的热,并发出耀眼的光芒”
“纸漏斗的下部被烧穿,有熔融物落入沙
中”。(1)已知,Al、Fe2O3、Al2O3、Fe的熔点、沸点数据如下:
据此有同学推测,铝热反应所得到的熔融物应是铁铝合金,该同
学的推测是否合理?请说明理由。
提示:合理。因为Fe的熔点比Al的熔点高,但比Al的沸点低,即
铁熔化时,Al已熔化但并没有气化,因此Fe、Al熔合在一起形成
铁铝合金。(2)实验室欲在常温下溶解此熔融物,能否选用稀硫酸?能否选用浓硫酸或NaOH溶液?请说明理由。
提示:能选择稀硫酸,因为稀硫酸能完全溶解此熔融物,并且不会造成环境污染;不能选择浓硫酸或NaOH溶液,因为浓硫酸会使Fe、Al钝化,NaOH溶液不能溶解单质铁。
(3)请设计一个简单的实验方案,证明所得的块状熔融物中是否含有金属铝。
提示:取适量样品置于试管中,加入NaOH溶液,若有气泡产生,证明熔融物中存在金属铝;若不产生气泡,则证明熔融物中不存在金属铝。
第一节 开发利用金属矿物和海水资源
第1课时 金属矿物的开发利用1.了解金属在自然界中的存在形式。
2.掌握金属的冶炼方法。
3.掌握铝热反应原理及实验步骤。
4.了解金属回收和资源保护的意义。
5.认识和体会化学在自然资源开发和利用中的意义和作用。一、金属在自然界中的存在形态游离化合二、金属的冶炼
1.冶炼原理:将金属从化合物中还原出来。
2.冶炼方法①:
金属冶炼的常用方法有:
(1)热分解法,如①汞、②银;
(2)电解法,如③钠、④镁、⑤铝;
(3)热还原法,如⑥高炉炼铁、⑦铝热法炼铁;
(4)其他方法,如⑧湿法炼铜、⑨火法炼铜。写出①~⑨的化学方程式:
①_________________,②__________________,
③_________________________,
④________________________,
⑤_____________________________,
⑥_______________________,
⑦_______________________,
⑧____________________,
⑨____________________。Fe+CuSO4====FeSO4+Cu三、金属资源的合理开发利用
1.合理开发利用金属资源的意义:金属矿物资源是_____再生资
源且贮量有限,冶炼过程中会消耗大量能量,也易造成环境污
染。故应合理开发利用金属资源。
2.有效利用金属资源②的途径:
(1)提高金属矿物的_______;
(2)减少金属的使用量;
(3)加强金属资源的_____________;
(4)使用_________代替金属材料。不可利用率回收和再利用其他材料【思考辨析】
1.判断正误:
(1)黄金的冶炼需要热分解法。( )
分析:金在自然界中以游离态存在,无需进行冶炼。
(2)金属阳离子被还原,一定得到金属单质。( )
分析:变价金属元素的最高价阳离子被还原时,可能得到中间价
态的离子,而不一定得到金属单质,如Fe3+可被还原成Fe2+。
(3)金属冶炼的实质是把金属从化合态还原为游离态。( )
分析:金属冶炼的实质是利用氧化还原反应将金属从化合物中
还原出来。××√2.问题思考:
(1)利用CO冶炼铁的反应是置换反应吗?
分析:不是。CO冶炼铁的反应是3CO+Fe2O3 2Fe+3CO2,该反
应不是置换反应。
(2)化学反应4H2+Fe3O4====3Fe+4H2O和3Fe+4H2O====Fe3O4+4H2
在一定条件下都能进行,说明氢气和铁的还原性是不确定的,对
吗?
分析:不对,两个反应的条件是不同的。【知识链接】
①金属冶炼方法与人类使用金属的关系
金属的冶炼方法与金属的活泼性有关,金属越不活泼,越容易冶炼,人类发现和使用得越早,金属越活泼,金属越难冶炼,人类使用得越晚。如约6 000年前人类使用铜,而约200年前才使用铝。
②金属资源利用中的三个问题
a.地球上的金属资源是有限的,不可再生的。
b.金属冶炼技术的提升和创新以及冶炼过程中产生的废水、废气、废渣的处理是合理利用金属资源的重要方面。
c.金属的腐蚀和金属资源的短缺是对人类严峻的挑战。一、金属的活泼性与冶炼方法
1.金属的冶炼原理:金属冶炼的实质是使金属化合物中的金属阳离子得到电子被还原为金属单质的过程,即:Mn++ne-====M。2.金属活动性顺序与金属冶炼方法的关系:3.常用的热还原法:【知识备选】金属冶炼的三个步骤及目的【学而后思】
(1)为什么越活泼的金属,被人类利用得越晚?
提示:因为金属越活泼,其离子的氧化性越弱,就越难被还原,故制取和应用的时间越晚。
(2)选择金属冶炼方法的依据是什么?
提示:选择何种方法冶炼金属,应依据金属在自然界中的存在形态和金属的活动性。
金属冶炼时,金属元素由化合态变为游离态,金属活动性不同,其阳离子得电子能力不同,得电子能力强的,易被还原,可选用加热法或热还原法,得电子能力弱的较难被还原,可用电解法。二、铝热反应
1.铝热反应:
(1)概念:铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应。
(2)原理:Al作还原剂,另一种氧化物作氧化剂,用铝将氧化物中的金属置换出来。
(3)铝热剂:铝粉和某些金属氧化物(Fe3O4、Cr2O3、V2O5等)组成的混合物。
(4)反应特点:
①在高温下进行;②反应迅速并放出大量的热;③新生成的金属单质呈熔融态且易与Al2O3分离。2.铝热反应实验:3.铝热反应实验注意事项:
(1)要保证纸漏斗重叠时四周均为四层,且内层纸漏斗一定要用水润湿,以防高温物质从纸漏斗四周溅出;
(2)要用盛有细沙的蒸发皿接收熔融物,既要防止蒸发皿炸裂,又要防止熔融的液体溅出伤人。【知识备选】类似“铝热法”的金属冶炼方法
其他的金属单质与金属氧化物混合之后点燃,也会发生强烈的氧化还原反应,效果类似于“铝热反应”。其中的金属单质可以是铝、镁、钙、钛,或者是非金属硼、硅,而金属氧化物可以是三氧化二铬、二氧化锰、氧化亚铁、三氧化二铁、四氧化三铁、氧化铜和四氧化三铅或者是非金属氧化物二氧化硅、三氧化二硼等。有时这些反应也根据反应中的还原剂而被称为“镁热法”“硅热法”“钙热法”“碳热法”等。【学而后思】
(1)能否用铝热反应冶炼金属镁?
提示:不能,铝热反应的实质是置换反应,利用铝的活泼性置换出较不活泼的金属,镁比铝活泼,只能利用电解法冶炼。
(2)铝热反应中镁带和氯酸钾的作用分别是什么?
提示:镁带燃烧放出大量的热,使氯酸钾分解产生氧气,促使镁带更加剧烈燃烧,产生更多热量,从而使铝热剂在高温下发生反应。类型 一 金属的冶炼?
【典例】(2013·山东高考改编)由下列物质冶炼相应金属时采用电解法的是( )
A.Fe2O3 B.NaCl C.Cu2S D.AlCl3【解题指南】解答本题要注意以下两点:
(1)金属的活泼性决定了其冶炼方法;
(2)活泼金属应用电解法冶炼。【解析】选B。排在铝(包含铝)之前的活泼金属应用电解法冶
炼,B正确;由Fe2O3冶炼铁应用热还原法,由Cu2S冶炼铜属火法炼
铜,反应为Cu2S+O2 2Cu+SO2,冶炼铝应电解Al2O3。【变式训练】下列化学方程式,能用于工业上冶炼金属镁的是
( )
A.2Na+MgCl2====2NaCl+Mg
B.MgCl2(熔融) Mg+Cl2↑
C.2MgO 2Mg+O2
D.MgCO3 MgO+CO2↑
【解析】选B。镁是比铝活泼性强的金属,应利用电解法冶炼。【变式备选】从金属被利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近几百年的事。下列跟这个先后顺序有关的是( )
①地壳中金属元素的含量 ②金属活动性顺序 ③金属的导电性 ④金属冶炼的难易程度 ⑤金属的延展性
A.①③ B.②⑤ C.③⑤ D.②④【解析】选D。金属活动性顺序表中,金属的位置越靠后,越容易被还原,用一般的还原方法就能使金属离子还原,人们开发、利用的时间也就越早;金属的位置越靠前,越难被还原,最活泼的金属只能用最强的还原手段(电解)来使金属离子还原,人们开发利用的时间就越晚。类型 二 铝热反应及其应用?
【典例】如图所示进行铝热反应,回答下列问题:
(1)写出该反应的化学方程式: ,反应
中 是氧化剂, 是还原剂,该反
应属于 反应(填四种基本反应类型)。(2)选出该实验的实验现象(填写序号): 。
①镁带剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四
射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内
的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:
内层纸漏斗底部剪一小孔: ;
蒸发皿盛沙: ;
镁带:_ ;
氯酸钾: 。【解题指南】解答本题要注意以下3点:
(1)铝热反应为置换反应,铝置换比其活泼性差的难熔金属。
(2)铝热反应放出大量的热量使难熔金属熔化。
(3)铝热反应中镁使氯酸钾分解,引发铝热反应。【解析】(1)铝热反应为2Al+Fe2O3 2Fe+Al2O3,该反应中
Fe2O3作氧化剂,Al作还原剂。(2)①②③④全为该铝热反应的
现象。(3)铝热反应实验中:①为使熔融物易落下通常在内层纸
漏斗底部剪一小孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙
子;③反应中镁带引起氯酸钾分解;④氯酸钾引发铝热反应。
答案:(1)Fe2O3+2Al Al2O3+2Fe
Fe2O3 Al 置换 (2)①②③④
(3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾
分解 引发铝热反应【名师点评】讲解本题时应重点强调以下3点:
(1)铝热反应利用了铝的较强的还原性;
(2)铝热反应的现象要围绕反应放出大量的热展开;
(3)了解铝热反应中镁带和氯酸钾的作用。【方法规律】铝热反应试题的分析
在无机框图推断中常出现反应模式: ,且A、C为单
质,B、D是化合物。分析该反应的特点:该反应是置换反应且条
件是高温,可初步确定是铝热反应,且A是铝。再结合其他的条
件确定其他物质。【变式训练】在反应Al+XaOb Al2O3+X中,X不可能的物质
是( )
A.Fe B.Mg C.Cr D.Mn
【解析】选B。该反应的模式是铝热反应,可利用铝热反应冶炼
金属Fe、Cr、Mn等难熔金属,不能冶炼比铝更活泼的金属。【变式备选】用铝热法从下列金属氧化物中制取相应的金属各1 mol,消耗铝的质量最多的是( )
A.Fe2O3 B.V2O5 C.MnO2 D.Cr2O3
【解析】选B。金属冶炼的本质是Mn++ne-====M。消耗铝的质量最多的是生成1 mol该金属得到电子数最多的,可见金属在氧化物中化合价越高,需电子数越多,消耗铝的质量越多。1.(2013·武汉高一检测)不同的金属,其冶炼方法也可能不同,主要原因是( )
A.金属的活动性不同
B.金属在自然界中的分布不同
C.金属在自然界中的存在形式不同
D.金属在自然界中的含量不同
【解析】选A。根据金属的活动性不同,对不同的金属采取不同的冶炼方法,A正确。2.铝热剂中铝的作用是( )
A.催化剂 B.氧化剂 C.还原剂 D.填充剂
【解析】选C。铝热反应的实质就是铝将金属氧化物中的金属还原出来,所以铝热剂中的铝是作还原剂。3.(2013·沈阳高一检测)下列方法中不能从溶有黄金的王水中提取出金的方法是( )
A.萃取 B.用Zn置换 C.用Fe置换 D.电解
【解析】选A。Au不活泼,其提取方法有多种可能。用铁或锌置换或电解的方法都能得到金。4.(双选)下列金属冶炼的反应原理,错误的是( )
A.2NaCl(熔融) 2Na+Cl2↑
B.MgO+H2 Mg+H2O
C.Fe3O4 3Fe+2O2↑
D.2HgO 2Hg+O2↑
【解析】选B、C。Na、Mg很活泼,应用电解法冶炼,A正确,B错
误;铁属较活泼金属,可用热还原法,C错误;较不活泼金属汞可
用热分解法,D正确。5.以铝土矿(主要成分氧化铝)、盐酸、氨水为主要原料制备金
属铝,反应原理如下:
Al2O3+6HCl====2AlCl3+3H2O,AlCl3+3NH3·H2O====Al(OH)3↓+
3NH4Cl,2Al(OH)3 Al2O3+3H2O,_____________(完成该反
应),并指出该反应中生成标准状况下6.72 L氧气,冶炼出铝的
物质的量是 mol,利用冶炼出的铝在高温下与氧化铁
反应,写出该反应的化学方程式 。【解析】据给出的反应可知最后一步是电解熔融的氧化铝制取
金属铝,化学方程式是2Al2O3(熔融) 4Al+3O2↑,该反应
中生成标准状况下6.72 L氧气,即氧气是6.72 L÷22.4 L·mol-1
=0.3 mol,故冶炼出铝的物质的量是0.3 mol×4÷3=0.4 mol,冶
炼出的铝在高温下与氧化铁反应的化学方程式是2Al+Fe2O3
2Fe+Al2O3。
答案:2Al2O3(熔融) 4Al+3O2↑ 0.4
2Al+Fe2O3 2Fe+Al2O3 铝热反应产物的实验探究
如图是铝热反应的实验装置图,该反应的化学方程式为
2Al+Fe2O3 2Fe+Al2O3。
关于“铝热反应”的现象有这样的描述:
“反应放出大量的热,并发出耀眼的光芒”
“纸漏斗的下部被烧穿,有熔融物落入沙
中”。(1)已知,Al、Fe2O3、Al2O3、Fe的熔点、沸点数据如下:
据此有同学推测,铝热反应所得到的熔融物应是铁铝合金,该同
学的推测是否合理?请说明理由。
提示:合理。因为Fe的熔点比Al的熔点高,但比Al的沸点低,即
铁熔化时,Al已熔化但并没有气化,因此Fe、Al熔合在一起形成
铁铝合金。(2)实验室欲在常温下溶解此熔融物,能否选用稀硫酸?能否选用浓硫酸或NaOH溶液?请说明理由。
提示:能选择稀硫酸,因为稀硫酸能完全溶解此熔融物,并且不会造成环境污染;不能选择浓硫酸或NaOH溶液,因为浓硫酸会使Fe、Al钝化,NaOH溶液不能溶解单质铁。
(3)请设计一个简单的实验方案,证明所得的块状熔融物中是否含有金属铝。
提示:取适量样品置于试管中,加入NaOH溶液,若有气泡产生,证明熔融物中存在金属铝;若不产生气泡,则证明熔融物中不存在金属铝。
