云南省保山市腾冲市第五中学2024-2025学年高三下学期模拟预测化学试卷(含答案)
文档属性
| 名称 | 云南省保山市腾冲市第五中学2024-2025学年高三下学期模拟预测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-05-30 16:42:50 | ||
图片预览


文档简介
腾冲市第五中学2025届高三模拟预测
化学试卷
考生注意:
1.答卷前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并认真核准条形码上的准考证号、姓名、考场号、座位号及科目,在规定的位置贴好条形码。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—1 2N—14 O—16 S—32 Cr—52 Fe—56
第Ⅰ卷(选择题 共42分)
单项选择题(本大题共14小题,每小题3分,共42分。在每小题所给的四个选项中,只有一项是符合题目要求的。)
1.诗词是中华优秀传统文化的一部分。从化学视角分析,下列说法错误的是
A.“何以解忧,唯有杜康”中的杜康酒的主要成分有烃的含氧衍生物
B.“日照澄洲江雾开,淘金女伴满江隈”中包含丁达尔效应
C.“落汤螃蟹着红袍”发生的是化学变化
D.“九秋风露越窑开,夺得千峰翠色来”,“翠色”来自氧化亚铜
2.下列化学用语或图示表达正确的是
A.3,3-二甲基戊烷的键线式:
B.乙烯分子中σ键的电子云图:
C.空间填充模型,可表示CH4分子,也可表示CCl4分子
D.用电子式表示HCl的形成过程:
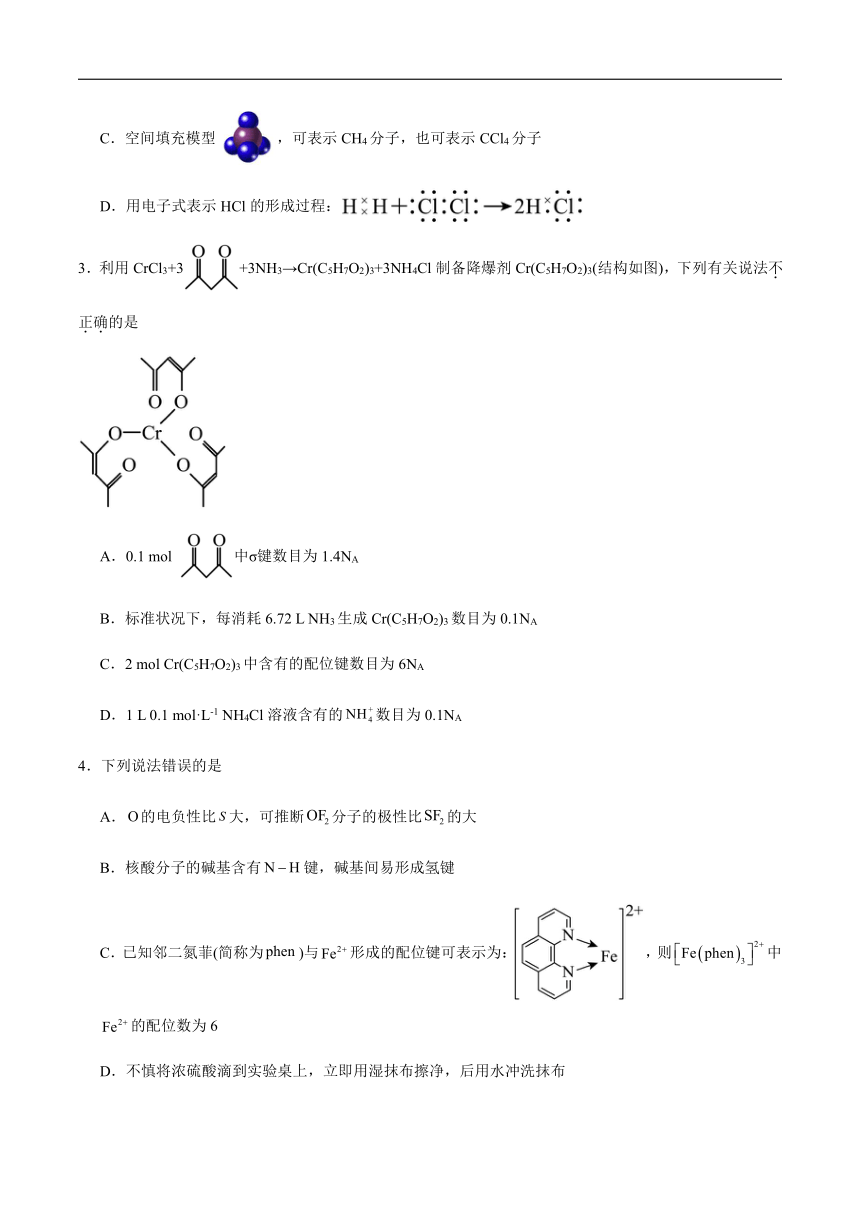
3.利用CrCl3+3+3NH3→Cr(C5H7O2)3+3NH4Cl制备降爆剂Cr(C5H7O2)3(结构如图),下列有关说法不正确的是
A.0.1 mol 中σ键数目为1.4NA
B.标准状况下,每消耗6.72 L NH3生成Cr(C5H7O2)3数目为0.1NA
C.2 mol Cr(C5H7O2)3中含有的配位键数目为6NA
D.1 L 0.1 mol·L-1 NH4Cl溶液含有的数目为0.1NA
4.下列说法错误的是
A.的电负性比大,可推断分子的极性比的大
B.核酸分子的碱基含有键,碱基间易形成氢键
C.已知邻二氮菲(简称为)与形成的配位键可表示为:,则中的配位数为6
D.不慎将浓硫酸滴到实验桌上,立即用湿抹布擦净,后用水冲洗抹布
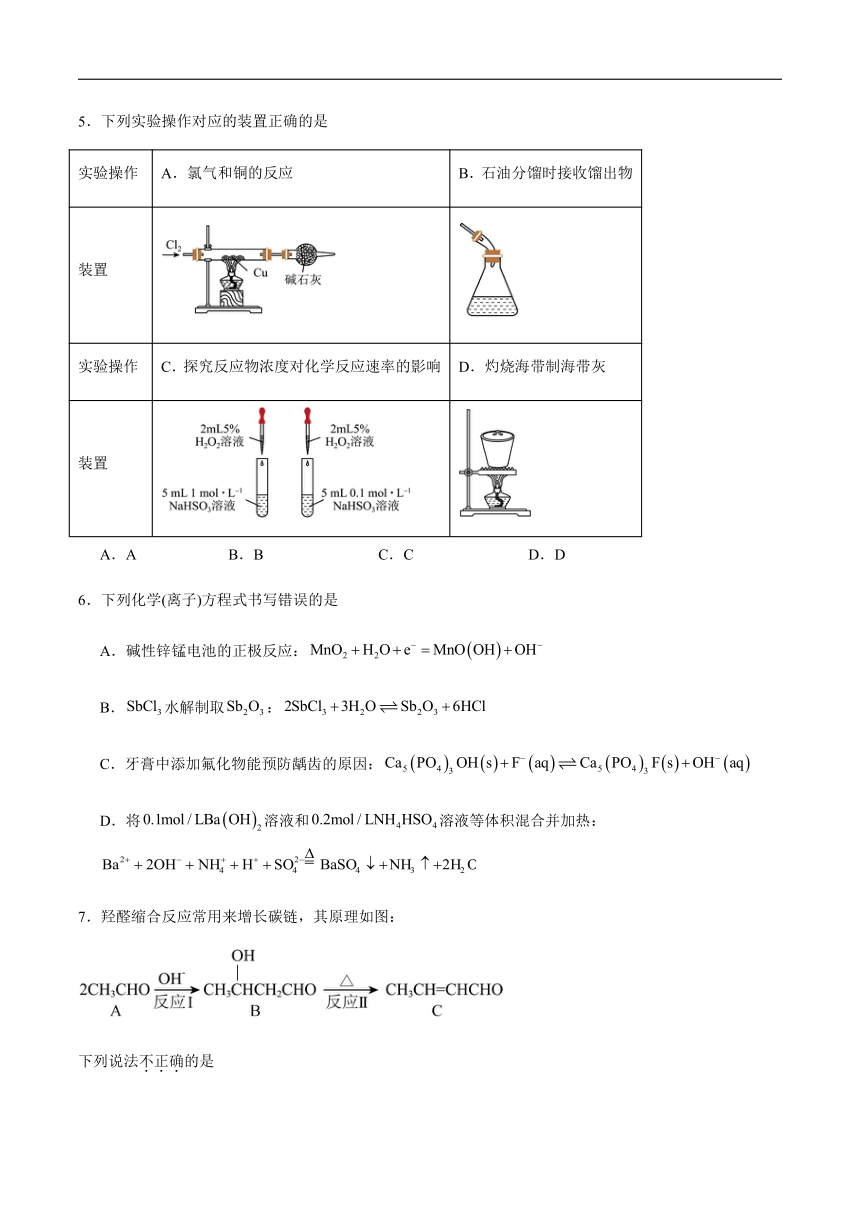
5.下列实验操作对应的装置正确的是
实验操作 A.氯气和铜的反应 B.石油分馏时接收馏出物
装置
实验操作 C.探究反应物浓度对化学反应速率的影响 D.灼烧海带制海带灰
装置
A.A B.B C.C D.D
6.下列化学(离子)方程式书写错误的是
A.碱性锌锰电池的正极反应:
B.水解制取:
C.牙膏中添加氟化物能预防龋齿的原因:
D.将溶液和溶液等体积混合并加热:
7.羟醛缩合反应常用来增长碳链,其原理如图:
下列说法不正确的是
A.反应I、Ⅱ分别为加成、消去反应
B.A的同分异构体含键数目最多为
C.反应I、Ⅱ均体现了醛基相邻碳原子的碳氢键极性强,易断裂
D.将乙醛和丙醛在溶液中充分混合共热,最多生成3种烯醛
8.组成和结构决定性质和变化,关于下列事实的解释中错误的是
选项 事实 解释
A Be的第一电离能大于B 电子的能量:Be失去的是2s能级上的电子,B失去的是2p能级上的电子,该能级上的电子的能量比2s能级上的电子的能量低
B P能形成和,N只能形成 原子轨道:P有3d轨道,N没有
C 相同温度下,电离平衡常数()() 氢键:中形成分子内氢键,使其更难电离出
D 溶液中滴加溶液,红色褪去 稳定性:与生成配合物的稳定性较强
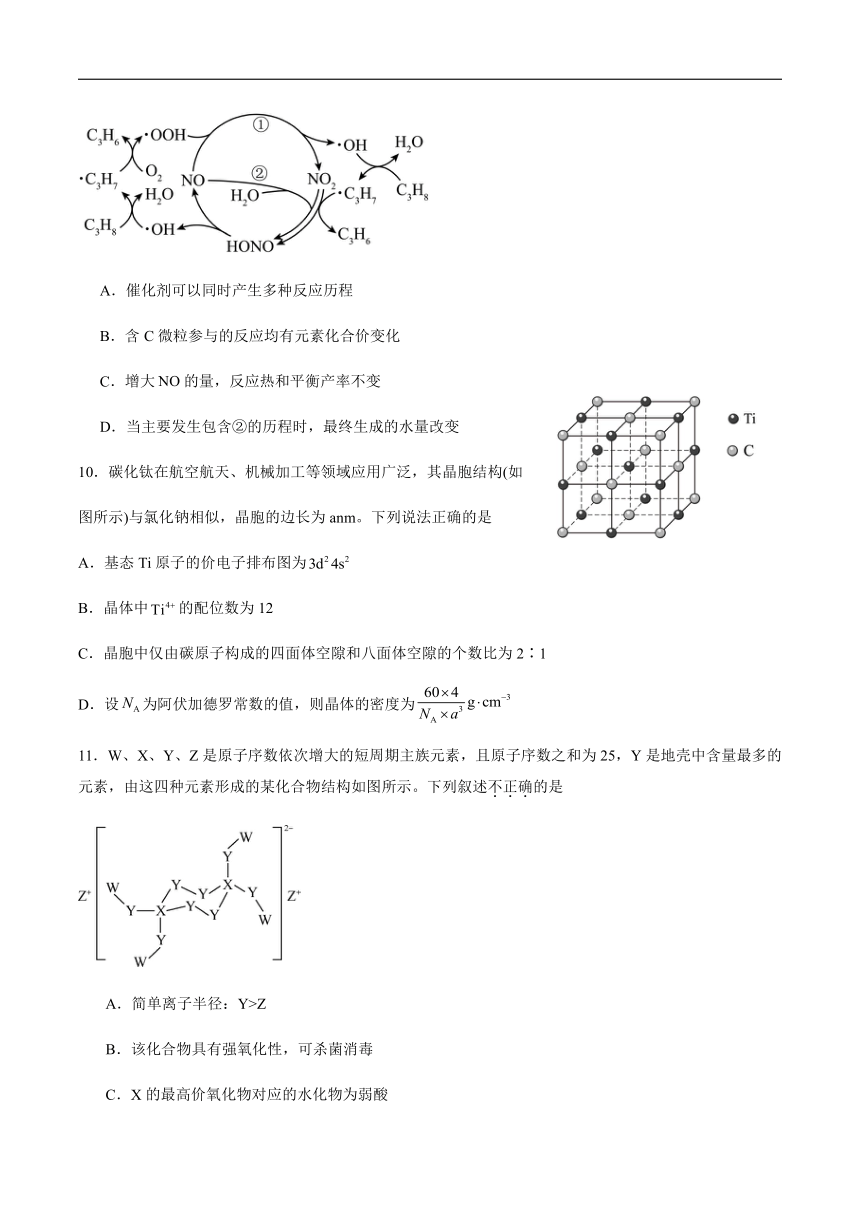
9.在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列叙述错误的是
A.催化剂可以同时产生多种反应历程
B.含C微粒参与的反应均有元素化合价变化
C.增大的量,反应热和平衡产率不变
D.当主要发生包含②的历程时,最终生成的水量改变
10.碳化钛在航空航天、机械加工等领域应用广泛,其晶胞结构(如
图所示)与氯化钠相似,晶胞的边长为anm。下列说法正确的是
A.基态Ti原子的价电子排布图为
B.晶体中的配位数为12
C.晶胞中仅由碳原子构成的四面体空隙和八面体空隙的个数比为2∶1
D.设为阿伏加德罗常数的值,则晶体的密度为
11.W、X、Y、Z是原子序数依次增大的短周期主族元素,且原子序数之和为25,Y是地壳中含量最多的元素,由这四种元素形成的某化合物结构如图所示。下列叙述不正确的是
A.简单离子半径:Y>Z
B.该化合物具有强氧化性,可杀菌消毒
C.X的最高价氧化物对应的水化物为弱酸
D.该化合物的阴离子中各原子最外层均达到8电子稳定结构
12.探究钠及其化合物的性质,下列方案设计、现象及结论都正确的是
方案设计 现象 结论
A 向露置在空气中的固体中加入稀盐酸 溶液中产生气泡 固体已经变质
B 将一小块金属钠在燃烧匙中点燃,伸入盛有的集气瓶中 产生黑、白两种固体 钠的还原性强,与二氧化碳发生了置换反应
C 向2mL 2 溶液中滴加2滴4稀盐酸 溶液中产生气泡 该溶液中混有杂质
D 向插有温度计的10mL 0.1 溶液中加入一定量NaOH固体 有刺激性气味产生,温度计示数增大 反应为放热反应
13.利用下图所示装置可合成己二腈。充电时生成己二腈,放电时生成O2,其中a、b是互为反置的双极膜,双极膜中的H2O会解离出H+和OH-向两极移动。下列说法正确的是
A.放电时,N极的电势高于M极的电势 B.放电时,双极膜中H+向N极移动
C.充电时,N极的电极反应式为
D.若充电时制得,则放电时需生成1molO2才能使左室溶液恢复至初始状态
14.常温下Ag(Ⅰ)-水溶液体系中存在反应:,平衡常数为K。已知初始浓度,所有含碳物种的摩尔分数与pH的变化关系如图所示(忽略溶液体积变化)。下列说法错误的是
A.曲线Ⅱ、Ⅲ分别表示、的摩尔分数与pH的变化关系
B.常温下的电离常数
C.pH=n时,
D.pH=8时,
第Ⅱ卷(非选择题 共58分)
二、填空题(本大题共4小题,共58分)
15.1869年门捷列夫发现元素周期律,他预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2,其中Ge化合价为+4)制取高纯度锗,其工艺流程如图所示。请回答:
(1)粉碎精硫锗矿的目的 。800℃,使精硫锗矿在N2氛围中升华的原因 。
(2)写出825 ℃,NH3还原GeS2的化学反应方程式 。
(3)酸浸时温度不能过高的原因 ;酸浸后得到粗GeO2的操作为 。
(4)GeCl4易水解生成GeO2·nH2O,化学方程式为 。
(5)GeO2是锗酸(H2GeO3)的酸酐,请判断25 ℃时0.1 mol·L-1NaHGeO3溶液pH (填“>”、“=”或“<”)7,(已知25 ℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。GeO2与碱反应可生成锗酸盐,其中CaGeO3是一种难溶电解质,一定温度下,CaGeO3在水中的沉淀溶解平衡曲线如图所示,下列说法不正确的是 (填序号)。
A.通过蒸发可以使溶液由q点变到p
B.q点无CaGeO3沉淀生成
C.n点与p点对应的Ksp相等点
D.加入Na2GeO3可以使溶液由n点变到m点
16.对乙酰氨基酚(,)具有解热镇痛的效果,其解热作用缓慢而持久,刺激性小,极少有过敏反应。某科学小组设计如下转化流程在实验室制备对乙酰氨基酚(部分产物已略去):
(1)苯酚 (填“能”或“不能”)与金属钠反应。步骤Ⅰ反应温度须控制在0~5℃,采用的控温方法为 。
(2)步骤Ⅱ的反应原理为 ,反应装置如图甲所示。该科学小组通过实验测定了不同温度下对氨基苯酚钠的产率,数据如表:
温度/℃ 25 45 55 65
产率/% 52.6 64.7 62.5 58.8
①盛装溶液的仪器名称是 。
②通过实验数据,可知最佳反应温度为 ℃。
(3)步骤Ⅲ中硫酸的作用是析出对氨基苯酚,若加入硫酸过多或过快,可能导致发生的副反应的离子方程式为 。
(4)步骤Ⅳ的实验装置如图乙所示。其中,冷凝管的作用是 ;反应结束后,得到的晶体需用冰水洗涤,其目的是 。
(5)该科学小组用0.4mol苯酚进行实验,该实验中对乙酰氨基酚的总产率为55%,实际得到对乙酰氨基酚 g。
17.常用作脱硝催化剂,采用共沉淀法等比掺入金属后,催化剂的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为,主反应如下:
反应I:;
反应II:
(1)已知:。则 。
(2)某条件下对于反应I,,,k正、k逆为速率常数。升高温度时,k正增大m倍,k逆增大n倍,则m n(填“>”“<”或“=”)。
(3)将模拟烟气按一定流速通到催化剂表面,不同温度下气体出口处测定相关物质浓度,得出NO的转化率、的选择性、的生成量随温度变化关系如下图。
①选择时,温度高于260℃时NO转化率下降的原因为 。
②综合分析,该脱硝过程应选择的最佳催化剂中M为 。
③选用合适的催化剂还能抑制催化剂表面出现NH4HSO4结晶现象,结晶会导致 。
(4)273℃,P0kPa下,向恒温恒压密闭的容器中(假设仅发生反应I、II)通入4molNH3、4molNO、2molO2。
①下列选项不能说明反应I、Ⅱ均达到化学平衡状态的是 。
A.混合气体的平均摩尔质量保持不变 B.n(NH3)∶n(NO)保持不变
C.有1molN-H键断裂的同时,有键断裂 D.NO的分压保持不变
②达到平衡后测定O2转化率为30%,体系中NH3为1.2mol。则NO的转化率为 ,反应I的Kp= (写出计算式即可)(分压=总压×物质的量分数)。
18.根据肾上腺素(F)的两条合成路线回答下列问题:
路线一:
(1)A的化学名称为 ;检验物质A和B的试剂为 (写化学式)。
(2)的化学方程式为 。
(3)的合成路线设计为:,不能选用高锰酸钾的原因是 。
路线二:
(4)路线二中属于取代反应的是 (填序号);G的结构简式 。
(5)H的2种芳香族同分异构体含硝基和3种不同化学环境的氢原子(个数比为),写其中一种的结构简式 。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A D A A D D A D C
题号 11 12 13 14
答案 D B C C
15.(1) 增大固体表面积,加快GeS2的升华速率 避免GeS2被氧化,得到较为纯净的GeS2
(2)3GeS2+2NH33GeS+N2+3H2S
(3) 浓硝酸受热易分解、易挥发 过滤
(4)GeCl4+(n+2)H2O=GeO2·nH2O↓+4HCl
(5) > A D
16.(1) 能 冰水浴
(2) 三颈烧瓶 45℃
(3)
(4) 冷凝回流 洗去杂质并降低对乙酰氨基酚的损失
(5)33.22
17.(1)-1838
(2)<
(3) 催化剂活性下降(或副反应增多) W0.15MnCeTiOx 结晶覆盖活性位点,降低催化剂活性或催化剂中毒
(4) C 75%
18.(1) 邻苯二酚或1,2-苯二酚 或
(2)
(3)高锰酸钾氧化性强,可以将I结构中的酚羟基氧化,且能将I中-CH2OH氧化为羧基
(4) ①②
(5)、
化学试卷
考生注意:
1.答卷前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号填写在答题卡上,并认真核准条形码上的准考证号、姓名、考场号、座位号及科目,在规定的位置贴好条形码。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—1 2N—14 O—16 S—32 Cr—52 Fe—56
第Ⅰ卷(选择题 共42分)
单项选择题(本大题共14小题,每小题3分,共42分。在每小题所给的四个选项中,只有一项是符合题目要求的。)
1.诗词是中华优秀传统文化的一部分。从化学视角分析,下列说法错误的是
A.“何以解忧,唯有杜康”中的杜康酒的主要成分有烃的含氧衍生物
B.“日照澄洲江雾开,淘金女伴满江隈”中包含丁达尔效应
C.“落汤螃蟹着红袍”发生的是化学变化
D.“九秋风露越窑开,夺得千峰翠色来”,“翠色”来自氧化亚铜
2.下列化学用语或图示表达正确的是
A.3,3-二甲基戊烷的键线式:
B.乙烯分子中σ键的电子云图:
C.空间填充模型,可表示CH4分子,也可表示CCl4分子
D.用电子式表示HCl的形成过程:
3.利用CrCl3+3+3NH3→Cr(C5H7O2)3+3NH4Cl制备降爆剂Cr(C5H7O2)3(结构如图),下列有关说法不正确的是
A.0.1 mol 中σ键数目为1.4NA
B.标准状况下,每消耗6.72 L NH3生成Cr(C5H7O2)3数目为0.1NA
C.2 mol Cr(C5H7O2)3中含有的配位键数目为6NA
D.1 L 0.1 mol·L-1 NH4Cl溶液含有的数目为0.1NA
4.下列说法错误的是
A.的电负性比大,可推断分子的极性比的大
B.核酸分子的碱基含有键,碱基间易形成氢键
C.已知邻二氮菲(简称为)与形成的配位键可表示为:,则中的配位数为6
D.不慎将浓硫酸滴到实验桌上,立即用湿抹布擦净,后用水冲洗抹布
5.下列实验操作对应的装置正确的是
实验操作 A.氯气和铜的反应 B.石油分馏时接收馏出物
装置
实验操作 C.探究反应物浓度对化学反应速率的影响 D.灼烧海带制海带灰
装置
A.A B.B C.C D.D
6.下列化学(离子)方程式书写错误的是
A.碱性锌锰电池的正极反应:
B.水解制取:
C.牙膏中添加氟化物能预防龋齿的原因:
D.将溶液和溶液等体积混合并加热:
7.羟醛缩合反应常用来增长碳链,其原理如图:
下列说法不正确的是
A.反应I、Ⅱ分别为加成、消去反应
B.A的同分异构体含键数目最多为
C.反应I、Ⅱ均体现了醛基相邻碳原子的碳氢键极性强,易断裂
D.将乙醛和丙醛在溶液中充分混合共热,最多生成3种烯醛
8.组成和结构决定性质和变化,关于下列事实的解释中错误的是
选项 事实 解释
A Be的第一电离能大于B 电子的能量:Be失去的是2s能级上的电子,B失去的是2p能级上的电子,该能级上的电子的能量比2s能级上的电子的能量低
B P能形成和,N只能形成 原子轨道:P有3d轨道,N没有
C 相同温度下,电离平衡常数()() 氢键:中形成分子内氢键,使其更难电离出
D 溶液中滴加溶液,红色褪去 稳定性:与生成配合物的稳定性较强
9.在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列叙述错误的是
A.催化剂可以同时产生多种反应历程
B.含C微粒参与的反应均有元素化合价变化
C.增大的量,反应热和平衡产率不变
D.当主要发生包含②的历程时,最终生成的水量改变
10.碳化钛在航空航天、机械加工等领域应用广泛,其晶胞结构(如
图所示)与氯化钠相似,晶胞的边长为anm。下列说法正确的是
A.基态Ti原子的价电子排布图为
B.晶体中的配位数为12
C.晶胞中仅由碳原子构成的四面体空隙和八面体空隙的个数比为2∶1
D.设为阿伏加德罗常数的值,则晶体的密度为
11.W、X、Y、Z是原子序数依次增大的短周期主族元素,且原子序数之和为25,Y是地壳中含量最多的元素,由这四种元素形成的某化合物结构如图所示。下列叙述不正确的是
A.简单离子半径:Y>Z
B.该化合物具有强氧化性,可杀菌消毒
C.X的最高价氧化物对应的水化物为弱酸
D.该化合物的阴离子中各原子最外层均达到8电子稳定结构
12.探究钠及其化合物的性质,下列方案设计、现象及结论都正确的是
方案设计 现象 结论
A 向露置在空气中的固体中加入稀盐酸 溶液中产生气泡 固体已经变质
B 将一小块金属钠在燃烧匙中点燃,伸入盛有的集气瓶中 产生黑、白两种固体 钠的还原性强,与二氧化碳发生了置换反应
C 向2mL 2 溶液中滴加2滴4稀盐酸 溶液中产生气泡 该溶液中混有杂质
D 向插有温度计的10mL 0.1 溶液中加入一定量NaOH固体 有刺激性气味产生,温度计示数增大 反应为放热反应
13.利用下图所示装置可合成己二腈。充电时生成己二腈,放电时生成O2,其中a、b是互为反置的双极膜,双极膜中的H2O会解离出H+和OH-向两极移动。下列说法正确的是
A.放电时,N极的电势高于M极的电势 B.放电时,双极膜中H+向N极移动
C.充电时,N极的电极反应式为
D.若充电时制得,则放电时需生成1molO2才能使左室溶液恢复至初始状态
14.常温下Ag(Ⅰ)-水溶液体系中存在反应:,平衡常数为K。已知初始浓度,所有含碳物种的摩尔分数与pH的变化关系如图所示(忽略溶液体积变化)。下列说法错误的是
A.曲线Ⅱ、Ⅲ分别表示、的摩尔分数与pH的变化关系
B.常温下的电离常数
C.pH=n时,
D.pH=8时,
第Ⅱ卷(非选择题 共58分)
二、填空题(本大题共4小题,共58分)
15.1869年门捷列夫发现元素周期律,他预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2,其中Ge化合价为+4)制取高纯度锗,其工艺流程如图所示。请回答:
(1)粉碎精硫锗矿的目的 。800℃,使精硫锗矿在N2氛围中升华的原因 。
(2)写出825 ℃,NH3还原GeS2的化学反应方程式 。
(3)酸浸时温度不能过高的原因 ;酸浸后得到粗GeO2的操作为 。
(4)GeCl4易水解生成GeO2·nH2O,化学方程式为 。
(5)GeO2是锗酸(H2GeO3)的酸酐,请判断25 ℃时0.1 mol·L-1NaHGeO3溶液pH (填“>”、“=”或“<”)7,(已知25 ℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。GeO2与碱反应可生成锗酸盐,其中CaGeO3是一种难溶电解质,一定温度下,CaGeO3在水中的沉淀溶解平衡曲线如图所示,下列说法不正确的是 (填序号)。
A.通过蒸发可以使溶液由q点变到p
B.q点无CaGeO3沉淀生成
C.n点与p点对应的Ksp相等点
D.加入Na2GeO3可以使溶液由n点变到m点
16.对乙酰氨基酚(,)具有解热镇痛的效果,其解热作用缓慢而持久,刺激性小,极少有过敏反应。某科学小组设计如下转化流程在实验室制备对乙酰氨基酚(部分产物已略去):
(1)苯酚 (填“能”或“不能”)与金属钠反应。步骤Ⅰ反应温度须控制在0~5℃,采用的控温方法为 。
(2)步骤Ⅱ的反应原理为 ,反应装置如图甲所示。该科学小组通过实验测定了不同温度下对氨基苯酚钠的产率,数据如表:
温度/℃ 25 45 55 65
产率/% 52.6 64.7 62.5 58.8
①盛装溶液的仪器名称是 。
②通过实验数据,可知最佳反应温度为 ℃。
(3)步骤Ⅲ中硫酸的作用是析出对氨基苯酚,若加入硫酸过多或过快,可能导致发生的副反应的离子方程式为 。
(4)步骤Ⅳ的实验装置如图乙所示。其中,冷凝管的作用是 ;反应结束后,得到的晶体需用冰水洗涤,其目的是 。
(5)该科学小组用0.4mol苯酚进行实验,该实验中对乙酰氨基酚的总产率为55%,实际得到对乙酰氨基酚 g。
17.常用作脱硝催化剂,采用共沉淀法等比掺入金属后,催化剂的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为,主反应如下:
反应I:;
反应II:
(1)已知:。则 。
(2)某条件下对于反应I,,,k正、k逆为速率常数。升高温度时,k正增大m倍,k逆增大n倍,则m n(填“>”“<”或“=”)。
(3)将模拟烟气按一定流速通到催化剂表面,不同温度下气体出口处测定相关物质浓度,得出NO的转化率、的选择性、的生成量随温度变化关系如下图。
①选择时,温度高于260℃时NO转化率下降的原因为 。
②综合分析,该脱硝过程应选择的最佳催化剂中M为 。
③选用合适的催化剂还能抑制催化剂表面出现NH4HSO4结晶现象,结晶会导致 。
(4)273℃,P0kPa下,向恒温恒压密闭的容器中(假设仅发生反应I、II)通入4molNH3、4molNO、2molO2。
①下列选项不能说明反应I、Ⅱ均达到化学平衡状态的是 。
A.混合气体的平均摩尔质量保持不变 B.n(NH3)∶n(NO)保持不变
C.有1molN-H键断裂的同时,有键断裂 D.NO的分压保持不变
②达到平衡后测定O2转化率为30%,体系中NH3为1.2mol。则NO的转化率为 ,反应I的Kp= (写出计算式即可)(分压=总压×物质的量分数)。
18.根据肾上腺素(F)的两条合成路线回答下列问题:
路线一:
(1)A的化学名称为 ;检验物质A和B的试剂为 (写化学式)。
(2)的化学方程式为 。
(3)的合成路线设计为:,不能选用高锰酸钾的原因是 。
路线二:
(4)路线二中属于取代反应的是 (填序号);G的结构简式 。
(5)H的2种芳香族同分异构体含硝基和3种不同化学环境的氢原子(个数比为),写其中一种的结构简式 。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A D A A D D A D C
题号 11 12 13 14
答案 D B C C
15.(1) 增大固体表面积,加快GeS2的升华速率 避免GeS2被氧化,得到较为纯净的GeS2
(2)3GeS2+2NH33GeS+N2+3H2S
(3) 浓硝酸受热易分解、易挥发 过滤
(4)GeCl4+(n+2)H2O=GeO2·nH2O↓+4HCl
(5) > A D
16.(1) 能 冰水浴
(2) 三颈烧瓶 45℃
(3)
(4) 冷凝回流 洗去杂质并降低对乙酰氨基酚的损失
(5)33.22
17.(1)-1838
(2)<
(3) 催化剂活性下降(或副反应增多) W0.15MnCeTiOx 结晶覆盖活性位点,降低催化剂活性或催化剂中毒
(4) C 75%
18.(1) 邻苯二酚或1,2-苯二酚 或
(2)
(3)高锰酸钾氧化性强,可以将I结构中的酚羟基氧化,且能将I中-CH2OH氧化为羧基
(4) ①②
(5)、
同课章节目录
