2025中考九年级化学微观粒子与物质的结构和性质专题复习学案(含解析)
文档属性
| 名称 | 2025中考九年级化学微观粒子与物质的结构和性质专题复习学案(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-02 15:05:04 | ||
图片预览




文档简介
微观粒子与物质的结构和性质专题复习
考点一 物质的组成与构成
真题训练
考法01微粒的观点解释现象
1.(2024·广东广州·中考真题)对下列宏观事实的微观解释合理的是
A.酒香不怕巷子深:分子在不断运动
B.气体的热胀冷缩:气体分子的大小发生改变
C.硫酸铜溶液显蓝色:溶液中含有硫酸根离子
D.金刚石和石墨的物理性质差异较大:原子种类不同
2.(2024·山东东营·中考真题)小东同学将少量医用酒精涂在手背上,先感到手背凉凉的,后闻到了酒精的气味,会儿发现酒精不见了,气味也变淡了。下列说法错误的是
A.手背凉凉的——分子获得能量运动速率加快 B.闻到了酒精的气味——分子在不断地运动
C.酒精不见了——分子之间的间隔变大 D.气味变淡了——分子的总数减少
3.(2024·上海·中考真题)以下说法正确的是
A.蔗糖溶于水,分子变小 B.酒精燃烧生成新分子
C.氧气液化,分子间距变大 D.冰融化成水,分子数变多
考法02 构成物质的微粒
4.(2024·江苏苏州·中考真题)下列物质由分子构成的是
A.铜 B.氯化钠 C.水 D.金刚石
5.(2024·山东青岛·中考真题)物质都是由微观粒子构成的。下列物质由原子构成的是
A.氢气 B.一氧化碳
C.金刚石 D.氯化钠
6.(2024·河南·中考真题)分子、原子、离子都是构成物质的微观粒子。下列物质由离子构成的是
A.H2O B.CuSO4 C.C60 D.CH4
考法03 原子的结构
7.(2024·山东青岛·中考真题)科学家运用了模型建构的方法探索原子的结构。下列对原子结构模型演变过程的认识,不正确的是
A.道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
B.汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C.卢瑟福等人通过粒子散射实验修正了汤姆孙葡萄干布丁模型
D.卢瑟福核式模型是最完善的原子结构模型,不会被替代
8.(2024·山东烟台·中考真题)元素观、微粒观是重要的化学观念。下列有关说法错误的是
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核的体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
9.(2024·北京·中考真题)为实现高效光催化分解水制氢,科研人员开展纳米复合光催化材料的研究。铌(Nb)在元素周期表中的原子序数是41,下列关于Nb的说法不正确的是
A.质子数是41 B.核电荷数是41 C.原子质量是41 D.核外电子数是41
考法04 原子结构示意图
10.(2024·广西·中考真题)氯原子的结构示意图如图所示。氯原子的核电荷数为
A.2 B.7 C.8 D.17
11.(2024·江苏宿迁·中考真题)氯原子、碘原子结构示意图如图所示。下列说法正确的是
A.氯元素和碘元素的化学性质相似 B.符号“2Cl”可表示2个氯元素
C.图中“”表示两种原子带正电荷 D.碘原子在化学反应中易失去电子
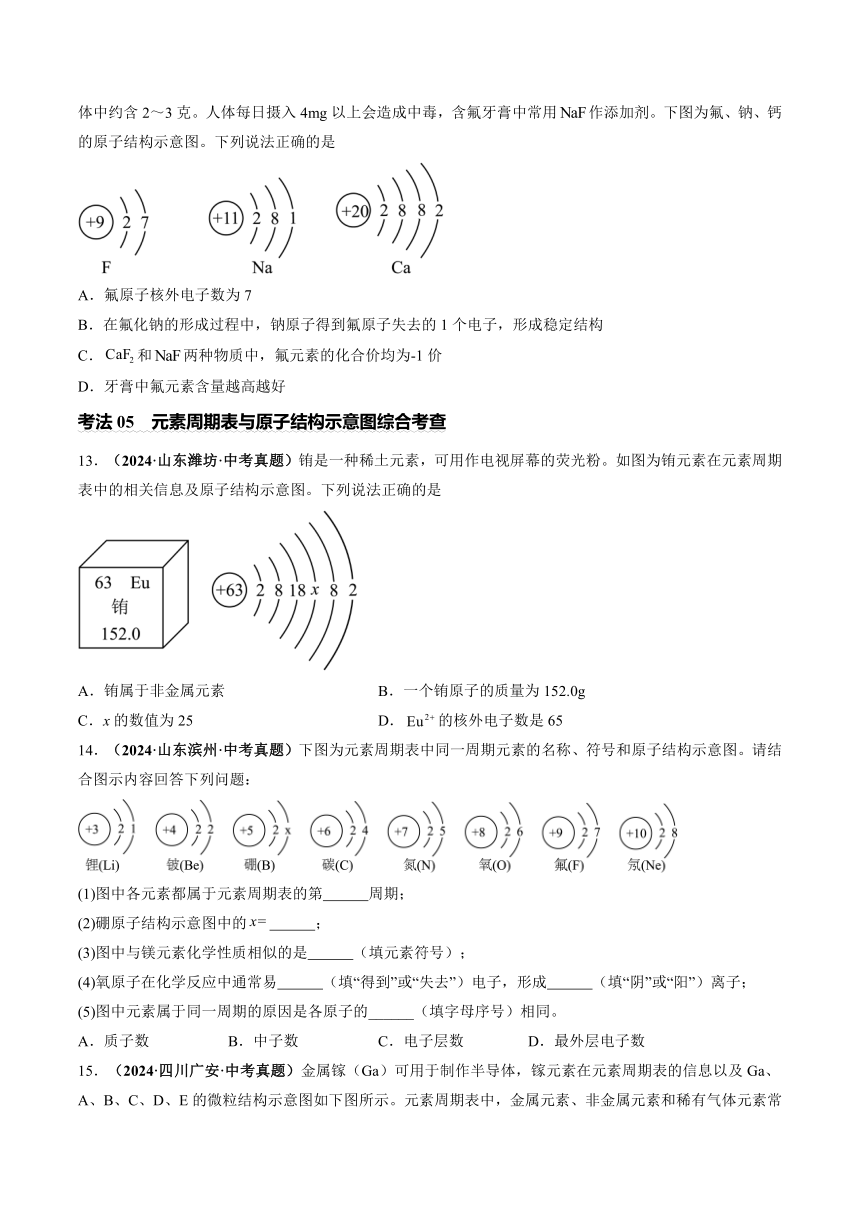
12.(2024·山东菏泽·中考真题)氟元素在自然界中主要存在于萤石(主要成分)等矿物中,正常成年人体中约含2~3克。人体每日摄入4mg以上会造成中毒,含氟牙膏中常用作添加剂。下图为氟、钠、钙的原子结构示意图。下列说法正确的是
A.氟原子核外电子数为7
B.在氟化钠的形成过程中,钠原子得到氟原子失去的1个电子,形成稳定结构
C.和两种物质中,氟元素的化合价均为-1价
D.牙膏中氟元素含量越高越好
考法05 元素周期表与原子结构示意图综合考查
13.(2024·山东潍坊·中考真题)铕是一种稀土元素,可用作电视屏幕的荧光粉。如图为铕元素在元素周期表中的相关信息及原子结构示意图。下列说法正确的是
A.铕属于非金属元素 B.一个铕原子的质量为152.0g
C.x的数值为25 D.的核外电子数是65
14.(2024·山东滨州·中考真题)下图为元素周期表中同一周期元素的名称、符号和原子结构示意图。请结合图示内容回答下列问题:
(1)图中各元素都属于元素周期表的第 周期;
(2)硼原子结构示意图中的 ;
(3)图中与镁元素化学性质相似的是 (填元素符号);
(4)氧原子在化学反应中通常易 (填“得到”或“失去”)电子,形成 (填“阴”或“阳”)离子;
(5)图中元素属于同一周期的原因是各原子的______(填字母序号)相同。
A.质子数 B.中子数 C.电子层数 D.最外层电子数
15.(2024·四川广安·中考真题)金属镓(Ga)可用于制作半导体,镓元素在元素周期表的信息以及Ga、A、B、C、D、E的微粒结构示意图如下图所示。元素周期表中,金属元素、非金属元素和稀有气体元素常用不同颜色区分。
回答下列问题:
(1)镓元素位于元素周期表第 周期。
(2)在元素周期表中,镓元素与A元素所占方格颜色 (填“相同”或“不同”)。
(3)上图中,一共涉及 种元素。
(4)E失去3个电子,形成阳离子,该离子符号为 。
核心知识
知识点一 构成物质的微观粒子
1.构成物质的粒子有分子、原子、离子,它们都可以直接构成物质。
2.微观粒子的基本性质:体积小、质量小;不断运动;粒子之间都有间隔;同种粒子化学性质相同,不同种粒子化学性质不相同;
3.物质的化学性质由构成它的粒子来保持。如保持水化学性质的粒子是水分子;保持铁化学性质的粒子是铁原子;保持氯化钠化学性质的是钠离子和氯离子。
4.分子、原子、离子构成的常见物质
(1)常见的由分子构成的物质:
①一些非金属单质,如:氢气、氧气、氮气、C60
②两种非金属组成的化合物,如:水、过氧化氢、一氧化碳、二氧化碳等;
③大部分有机物,如:甲烷、酒精、葡萄糖等。
(2)常见的由原子构成的物质:
①金属单质,例如:金、铁;
②非金属固体单质,例如:金刚石、硅
③稀有气体单质,例如:氦气、氖气、氩气
(3)常见的由离子构成的物质:大多数碱和盐,如氯化钠、硫酸铜、氢氧化钠等。
5.微观粒子的概念
(1)分子:分子是保持物质化学性质的最小粒子。
(2)原子:原子是化学变化中的最小粒子。
(3)离子:离子是带电的原子或原子团。
知识点二 原子的结构
1.原子的结构
原子核(带正电) 质子(带正电)
原子(不显电性) 中子(不带电)
核外电子(带负电)
2.注意点:
(1)不同种类的原子质子数不同;
(2)在原子中,核电荷数=质子数=核外电子数;
(3)质子数不一定等于中子数;
(4)不是所有原子的原子核中都有中子。
(5)原子质量几乎全部集中在原子核上。
3.原子核外电子排布规律
(1)原子核外电子是分层排布的。
(2)离核近的电子能量低,离核远的电子能量高。
(3)第一层最多2个电子;第二层最多8个电子;最外层最多8个电子。
4.原子分类(最外层电子数决定化学性质)
种类 最外层电子数 化学性质 形成离子
金属原子 1-3 易失去电子 阳离子
非金属原子 4-7 易得到电子 阴离子
稀有气体原子 8(He是2个) 化学性质稳定,不易得失电子
5.在结构示意图中,原子、阴离子、阳离子的判断依据:
在原子中:质子数等于电子数;在阳离子中:质子数大于电子数; 在阴离子中:质子数小于电子数。
6.相对原子质量
(1)概念:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得到的值。
(2)表达式:
(3)相对原子质量与原子核内微粒的关系:相对原子质量≈质子数+中子数
7.元素周期表:
(1)结构:每个横行叫周期,共7个横行,即7个周期; 每个纵行叫族,共18个纵行,16个族(8、9、10三个纵行合成为1个族);
(2)每格的信息(5个):
A是原子序数、 B是元素符号、
C是元素名称、 D是相对原子质量;
根据元素名称的偏旁部首可判断元素是否为金属元素
(3)原子序数=质子数=核外电子数=核电荷数
(4)元素周期表排列规律:
①周期数等于原子核外电子层数;
②横行:电子层数相同,最外层电子数从左到右依次增多;
③纵行:最外层电子数相同(即化学性质相似);从上到下电子层数递增。
命题预测
1.【新考法】精典古籍再认识——古籍中的化学(2024·海南·中考真题)宋代李重元在《忆王孙 ·夏词》中写到“过雨荷花满院香”。从微观角度分析,花香飘 满院的合理解释是
A.分子可以再分 B.分子的体积变大 C.分子间有间隔 D.分子在不断运动
2.【原创题】下列物质中既有分子又有离子的是
A.C60 B.汞 C.氨 D.氢氧化钠溶液
3.【新考法】 探月工程——月壤中的元素(2024·四川巴中·中考真题)我国探月工程嫦娥五号返回器曾携带1731g月壤样品返回地球。月壤中含量丰富的氦-3可作为核聚变燃料,其原子核是由2个质子和1个中子构成的,氦-3的原子结构示意图为
A. B. C. D.
4.【新考法】 结合生产生活(2024·黑龙江牡丹江·中考真题)新版《生活饮用水卫生标准》中的水质检测修订了镉、铅等的限量。这里的镉、铅指的是
A.原子 B.元素 C.分子 D.单质
5.(2024·陕西西安·模拟预测)下列有关微粒的说法不正确的是
A.原子是化学变化中的最小微粒
B.质子数相同的原子属于同种元素
C.镁原子和氦原子最外层电子数相同,化学性质相似
D.构成一氧化碳的微粒是一氧化碳分子
6.(2024·甘肃金昌·三模)下列对分子、原子、离子的认识,不正确的是
A.铜是由铜分子构成的 B.如图,原子核中有两个中子
C.构成硫酸的阴离子是 D.化学变化中的最小粒子是原子
7.【新情境】科技前沿——6G技术(2024·四川遂宁·中考真题)2024年以“创新预见6G未来”为主题的全球6G技术大会在南京召开。氮化镓是制造芯片的材料之一。镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是
A.镓元素为非金属元素 B.镓原子的中子数是31
C.图中X的数值是8 D.镓的相对原子质量是69.72g
8.(2024·江西九江·二模)据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下将CH4、转化为甲醇(CH3OH)、甲醛(CH2O)等,主要原理如图所示。下列说法错误的是
A.反应前后元素种类不变
B.表示水分子
C.该过程可看出化学反应经历了原子重新组合
D.这一系列的催化反应中(不考虑催化剂),没有发生变化的粒子是原子
9.(2024·山东菏泽·一模)如图是五种微粒的结构示意图,下列说法不正确的是
A.上述五种微粒只涉及四种元素
B.①②④属于原子,③属于阴离子
C.②③⑤表示的微粒性质较稳定
D.①④对应元素组成化合物的化学式为NaF
10.(2024·山东枣庄·中考真题)世界是物质的。从宏观角度看,物质是由元素组成的;从微观角度看,物质又是由分子、原子和离子等微观粒子构成的。
根据图示信息,回答下列问题:
(1)图1中铍原子的质子数为 ,铍属于 (填“金属”或“非金属”)元素。
(2)图2中最外层达到相对稳定结构的微观粒子是 (填字母序号),与C属于同种元素的是 (填字母序号)。
(3)图2中B单质是由 (填“分子”或“原子”)构成的。
(4)图2中A和B两种元素组成化合物的化学式为 ,其中A元素的化合价为 。
11.(2024·甘肃临夏·中考真题)我国科学家公布了对嫦娥五号带回月球土壤样品的研究成果,准确测定了月球土壤样品中40多种元素的含量,以下为钛、锂、钠、氦-3的有关信息。
(1)钛属于 (选填“金属”或“非金属”)元素,钛原子结构示意图中n的值是 。
(2)锂、钠两种元素化学性质相似的原因是 。锂离子电池为手机等内部常用的电池,碳酸锂是生产锂离子电池的常用原料,已知Li的化合价为,碳酸锂的化学式为 。
(3)已知氦-3原子是一种含2个质子和1个中子的原子,下列模型能表示氦-3原子的是 (填序号)。
12.(2024·山东泰安·中考真题)在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)物质的组成及构成关系如图所示,图中①处表示的是 ,②处表示的是 。
(2)根据下图钠、镁、氯、钾四种原子的结构示意图,回答问题。
①氯原子的结构示意图中x的数值为 。
②钠原子和钾原子具有相似的化学性质,在化学反应中均容易 (填“得到”或“失去”)电子。
③钠和镁属于不同种元素,是因为它们原子中 不同。
(3)我国某研究团队通过构筑原子级分散的钌催化剂实现高效氮气电还原合成氨,反应前后分子变化的微观示意图如图:
该反应的化学反应方程式为 。
真题训练
1.【答案】A
【详解】A、酒香不怕巷子深,是因为酒精中含有的分子是在不断地运动,向四周扩散,使人们闻到酒香,故选项解释合理;
B、升高温度分子运动速度加快,分子之间间隔增大,降低温度分子运动速度减慢,分子之间间隔减小,所以气体的热胀冷缩主要是因为气体分子间的间隔随温度的变化而改变,而分子的大小不变,故选项解释不合理;
C、硫酸铜溶液显蓝色,是因为溶液中含有铜离子,故选项解释不合理;
D、金刚石和石墨都是由碳原子构成的单质,二者的物理性质差异很大是因为碳原子排列方式不同,故选项解释不合理;
故选:A。
2.【答案】D
【详解】A、酒精挥发从手上吸热,酒精分子获得能量运动速率加快,故说法正确;
B、闻到酒精气味,是因为分子在不断地运动,向四周扩散,使人们闻到酒精气味,故说法正确;
C、酒精挥发,因为分子在不断地运动到空气中,同时分子间隔变大,所以酒精不见了,故说法正确;
D、酒精分子在不断地运动到空气中,气味变淡了,是因为酒精分子的更加分散了,但分子的数目是不会改变的,故说法错误。
故选D。
3.【答案】B
【详解】A、蔗糖溶解于水后会消失不见,是因为蔗糖分子是在不断地运动的,运动到水分子中间去了,故选项说法错误;
B、酒精燃烧生成二氧化碳和水,微观上分子改变,原子重新组合成新分子,故选项说法正确;
C、氧气液化时,由气态变为液态,水分子间的间隔变小,故选项说法错误;
D、冰融化成水时,水分子间隔变小,体积变小,分子数目不变,故选项说法错误。
故选B。
4.【答案】C
【详解】A、金属由原子构成,铜属于金属单质,是由铜原子直接构成的,故A错误;
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故B错误;
C、水是由非金属元素组成的化合物,是由水分子构成的,故C正确;
D、金刚石属于固态非金属单质,是由碳原子直接构成的,故D错误。故选C。
5.【答案】C
【详解】A、氢气属于气态非金属单质,由氢分子构成,不符合题意;
B、一氧化碳是由非金属元素组成的化合物,由一氧化碳分子构成,不符合题意;
C、金刚石属于碳单质,由碳原子构成,符合题意;
D、氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,不符合题意。
故选C。
6.【答案】B
【详解】A、水由水分子构成,不符合题意;
B、 CuSO4是由铜离子和硫酸根离子构成,符合题意;
C、C60是C60分子构成,不符合题意;
D、甲烷是由甲烷分子构成,不符合题意。
故选:B。
7.【答案】D
【详解】A、道尔顿是探索原子的结构较早的科学家,受当时科学水平的局限性,道尔顿认为原子是“不可再分的实心球体”,是构成物质的最小粒子。A正确;
B、由于汤姆孙等人在原子中发现了电子,提出汤姆孙葡萄干布丁模型,所以推翻了道尔顿实心球模型。B正确;
C、英国物理学家卢瑟福设计了α粒子散射实验,得出卢瑟福核式模型,修正了汤姆孙关于原子结构的汤姆孙葡萄干布丁模型。C正确;
D、卢瑟福提出了原子核式结构模型:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里。但卢瑟福核式模型也不是是最完善的原子结构模型,将会被替代。人类对原子结构的认识永无止境。D不正确。
综上所述:选择D。
8.【答案】B
【详解】A、物质是由元素组成的,所以虽然元素的种类是有限的,但由元素组成的物质种类是繁多的,故说法正确;
B、同种元素的原子核内质子数和中子数不一定相等,例如碳12、碳13、碳14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等,故说法错误;
C、原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量,故说法正确;
D、元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变,故说法正确。
故选B。
9【答案】C
【详解】A、原子序数=质子数,铌(Nb)的原子序数是41,则质子数是41,说法正确,不符合题意;
B、原子序数=核电荷数,铌(Nb)的原子序数是41,则核电荷数是41,说法正确,不符合题意;
C、原子质量约等于质子数加中子数,根据铌(Nb)的原子序数是41,不能确定原子质量是 41,说法错误,符合题意;
D、原子序数=核外电子数,铌(Nb)的原子序数是41,则核外电子数是41,说法正确,不符合题意。
故选C。
10.【答案】D
【详解】由氯原子的结构示意图可知,氯原子的质子数为17,原子中质子数=核电荷数,所以氯原子的核电荷数为17,故选D。
11.【答案】A
【详解】A、氯原子和碘原子的最外层电子数相同都有7个电子,故氯元素和碘元素的化学性质相似,正确;
B、元素只讲种类、不讲个数,故符号“2Cl”可表示2个氯原子、不能表示2个氯元素,错误;
C、原子是不带电的,同时根据原子结构示意图意义,圆圈表示原子核,故图中“”表示两种原子的原子核带正电荷,错误;
D、最外层电子数一般小于4,通常容易失电子,最外层电子数一般大于4,通常容易得电子,碘原子最外层电子数为7,大于4,故碘原子在化学反应中易得到电子,错误;
故选A
12.【答案】C
【详解】A、氟原子核外电子数为2+7=9,错误;
B、在氟化钠的形成过程中,钠原子最外层电子数为1,氟原子易失去最外层的1个电子形成带1个单位正电荷的钠离子,氟原子最外层电子数为7,氟原子易得到1个电子形成带1个单位负电荷的氟离子,即氟原子得到钠原子失去的1个电子,形成稳定结构,错误;
C、根据在化合物中各元素正负化合价代数和为0,CaF2中钙元素显+2价,NaF中钠元素显+1价,则两种物质中,氟元素的化合价均为-1价,正确;
D、用含氟牙膏刷牙可使牙齿坚固,从而有效防止蛀牙,但是牙膏中氟元素含量并不是越高越好,因为长期摄入高剂量的氟,则会引起氟骨症,重则会引起恶心、呕吐、心律不齐等急性氟中毒情况,错误。
故选C。
13.【答案】C
【详解】A、铕带“钅”字旁,属于金属元素,故选项说法错误;
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,铕元素的相对原子质量为152.0,而非原子的实际质量。故选项说法错误;
C、根据原子中核电荷数=质子数=核外电子数,则x=63-2-8-18-8-2=25,故选项说法正确;
D、由铕原子结构示意图可知,铕原子的最外层电子数为2,容易失去电子,形成Eu2+,则Eu2+的核外电子数是63-2=61,故选项说法错误;
故选:C。
14.【答案】(1)二/2
(2)3
(3)Be
(4) 得到 阴
(5)C
【详解】(1)原子核外电子层数等于该元素所在的周期数,图中各元素原子的核外电子层数均为2,因此图中各元素都属于元素周期表的第二周期;
(2)由原子结构示意图可知,圈内数字表示核电荷数,在原子中,核电荷数=核外电子数,故硼原子结构示意图中的=5-2=3;
(3)原子最外层电子数相同的元素,其化学性质相似,镁原子的最外层电子数为2,则图中与镁元素化学性质相似的是铍(Be),这两种原子在化学反应中均易失去2个电子形成阳离子;
(4)由氧原子结构示意图可知,氧原子最外层电子数为6>4,在化学反应中易得到2个电子形成阴离子;
(5)原子核外电子层数等于该元素所在的周期数,因此图中元素属于同一周期的原因是各原子的核外电子层数相同,故选:C。
15.【答案】(1)四/4
(2)不同
(3)五/5
(4)Al3+
【详解】(1)镓原子核外有4个电子层,故镓元素位于第四周期;
(2)在元素周期表中,金属和非金属颜色不同。由“金”字旁可知,镓元素属于金属元素,质子数=原子序数,A是17号元素,是氯元素,由“气”字旁可知,氯属于非金属元素,故在元素周期表中,镓元素与A元素所占方格颜色不同;
(3)元素是质子数相同的一类原子的总称,A、C质子数相同,属于同种元素,故图中涉及五种元素;
(4)质子数=原子序数,E的质子数为13,13号元素是铝元素,铝原子的最外层电子数为3,小于4,在化学反应中,容易失去最外层3个电子,从而带上3个单位的正电荷,表示为:Al3+。
命题预测
1.【答案】D
【详解】“过雨荷花满院香”是雨后的荷花更散发出沁人的芬芳,能闻到气味是因为分子在不断运动,带有气味的分子运动到人的鼻子,使人闻到气味。故选D。
2.【答案】D
【详解】本题考查物质的构成。
A、C60由C60分子构成,故A错误;
B、汞是金属,由汞原子构成,故B错误;
C、氨由氨分子构成,故C错误;
D、氢氧化钠溶液中含有钠离子、氢氧根离子和水分子,故D正确。
故选D。.
3.【答案】B
【详解】原子结构示意图左侧圆圈内的数字表示质子数,原子的质子数=核外电子数,根据题目信息,氦-3的原子核是由2个质子和1个中子构成的,所以氦-3原子的质子数为2,核外电子数也为2,故选:B。
4.【答案】B
【详解】这里的“镉、铅”等不是以单质、分子、原子、离子等形式存在,而是强调存在的元素,与具体形态无关;所以是指元素;
故选B。
5.【答案】C
【详解】A、化学变化的实质是分子的分裂和原子的重新组合,原子是化学变化中的最小微粒,说法正确;
B、元素是具有相同质子数一类原子的总称,质子数相同的原子属于同种元素,说法正确;
C、镁原子最外层电子数为2,容易失去电子,氦原子最外层电子数也为2,但氦原子具有稳定结构,镁原子和氦原子最外层电子数相同,化学性质不相似,说法错误;
D、物质是由分子、原子或离子构成的,构成一氧化碳的微粒是一氧化碳分子,说法正确;
故选:C。
6【答案】A
【详解】A、铜是由铜原子构成的,故A选项说法错误;
B、原子核是由质子和中子构成,图中带正电的为质子,不带电的为中子,中子有两个,故B选项说法正确;
C、硫酸是由阳离子氢离子和阴离子硫酸根离子构成,故C选项说法正确;
D、原子在化学变化中不能再分,是化学变化的最小粒子,故D选项说法正确。
故答案为A。
7.【答案】C
【详解】A、镓是“钅”字旁,所以镓元素为金属元素。不符合题意;
B、元素周期表一格左上角数字为原子序数=质子数,最下方数字为相对原子质量。相对原子质量≈质子数+中子数,所以镓原子的中子数是70-31=39。不符合题意;
C、原子中质子数=核外电子数,所以31=2+X+18+3,X=8。符合题意;
D、相对原子质量的单位是“1”不是“g”,镓的相对原子质量是69.72。不符合题意;
故选C。
8.【答案】B
【详解】A、根据质量守恒定律,化学反应前后,元素的种类不变,故正确;
B、该微粒是由两个氢原子和两个氧原子构成的,表示过氧化氢分子,故错误;
C、化学变化的实质就是分子分成原子,原子重新组合成新的分子的过程,故正确;
D、化学变化中,分子可分而原子不可分,没有改变的粒子是原子,故正确。
故选B。
9.【答案】B
【详解】A、元素是质子数相同的一类原子的总称,由微粒结构示意图可知,圈内数字表示质子数,则上述五种微粒只涉及四种元素,说法正确, 不符合题意;
B、①核内质子数=核外电子数,属于原子;②核内质子数=核外电子数,属于原子;③核内质子数>核外电子数,属于阳离子;④核内质子数=核外电子数,属于原子;说法错误,符合题意;
C、②③⑤最外层电子数均为8,均属于相对稳定结构,则②③⑤表示的微粒性质较稳定,说法正确,不符合题意;
D、在原子中,质子数=原子序数,则①对应氟元素,氟原子最外层电子数为7>4,在化学反应中易得到1个电子形成带1个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值且符号一致,则氟元素显-1价;④对应钠元素,钠原子最外层电子数为1<4,在化学反应中易失去1个电子形成带1个单位正电荷的阳离子,则钠元素显+1价,根据在化合物中各元素化合价的代数和为零,则①④对应元素组成化合物的化学式为NaF,说法正确,不符合题意。
故选:B。
10.【答案】(1) 4 金属
(2) C B
(3)原子
(4) Na2S -2
【详解】(1)图1中铍原子的原子序数(左上角数字)是4,根据原子序数=核电荷数=质子数=核外电子数,则铍原子的质子数是4;
铍带金字旁,属于金属元素;
(2)最外层电子数为8(一个电子层为2)属于相对稳定结构,则图2中最外层达到相对稳定结构的微观粒子是C;
元素的种类由质子数决定,质子数相同的一类原子属于同一种元素,B与C质子数(圆圈内数字)相同,则与C属于同种元素的是B;
(3)图2中B是钠单质,钠属于金属由原子构成;
(4)图2中A(硫)和B( 钠)两种元素组成化合物,其中硫元素显-2价,钠元素显+1价,则化学式为Na2S,其中A(硫)元素的化合价为-2。
11.【答案】(1) 金属 10
(2) 原子的最外层电子数相同 Li2CO3
(3)C
【详解】(1)钛是“金”字旁,属于金属元素,在原子中,质子数=核外电子数=2+8+n+2=22,解得n=10,故填:金属;10;
(2)元素的化学性质由最外层电子数决定,最外层电子数相同的原子(稀有气体除外)的化学性质相似,故锂、钠两种元素化学性质相似的原因是原子的最外层电子数相同;Li的化合价为+1,碳酸根离子显-2价,根据化合物中正负化合价代数和为零的原则,碳酸锂的化学式为Li2CO3,故填:原子的最外层电子数相同;Li2CO3;
(3)在原子中,质子数=核外电子数,氦-3原子是一种含2个质子和1个中子的原子,则模型能表示氦-3原子的是C,故填:C。
12.【答案】(1) 元素 原子
(2) 7 失去 质子数
(3)
【详解】(1)物质是由元素组成的,因此①表示元素;分子、原子和离子是构成物质的三种基本粒子,因此②表示原子;
(2)①在原子中,质子数=电子数,则x=17-2-8=7;
②钠原子和钾原子的最外层具有1个电子,在化学反应中均容易失去电子,因此钠原子和钾原子具有相似的化学性质;
③钠和镁属于不同种元素,是因为它们原子中质子数不同;
(3)由微观反应示意图可知,氮气与水在催化剂的作用下反应生成氨气和氧气,反应的化学方程式为:。
考点一 物质的组成与构成
真题训练
考法01微粒的观点解释现象
1.(2024·广东广州·中考真题)对下列宏观事实的微观解释合理的是
A.酒香不怕巷子深:分子在不断运动
B.气体的热胀冷缩:气体分子的大小发生改变
C.硫酸铜溶液显蓝色:溶液中含有硫酸根离子
D.金刚石和石墨的物理性质差异较大:原子种类不同
2.(2024·山东东营·中考真题)小东同学将少量医用酒精涂在手背上,先感到手背凉凉的,后闻到了酒精的气味,会儿发现酒精不见了,气味也变淡了。下列说法错误的是
A.手背凉凉的——分子获得能量运动速率加快 B.闻到了酒精的气味——分子在不断地运动
C.酒精不见了——分子之间的间隔变大 D.气味变淡了——分子的总数减少
3.(2024·上海·中考真题)以下说法正确的是
A.蔗糖溶于水,分子变小 B.酒精燃烧生成新分子
C.氧气液化,分子间距变大 D.冰融化成水,分子数变多
考法02 构成物质的微粒
4.(2024·江苏苏州·中考真题)下列物质由分子构成的是
A.铜 B.氯化钠 C.水 D.金刚石
5.(2024·山东青岛·中考真题)物质都是由微观粒子构成的。下列物质由原子构成的是
A.氢气 B.一氧化碳
C.金刚石 D.氯化钠
6.(2024·河南·中考真题)分子、原子、离子都是构成物质的微观粒子。下列物质由离子构成的是
A.H2O B.CuSO4 C.C60 D.CH4
考法03 原子的结构
7.(2024·山东青岛·中考真题)科学家运用了模型建构的方法探索原子的结构。下列对原子结构模型演变过程的认识,不正确的是
A.道尔顿认为原子是不可再分的实心球,是构成物质的最小粒子
B.汤姆孙等人在原子中发现了电子,推翻了道尔顿实心球模型
C.卢瑟福等人通过粒子散射实验修正了汤姆孙葡萄干布丁模型
D.卢瑟福核式模型是最完善的原子结构模型,不会被替代
8.(2024·山东烟台·中考真题)元素观、微粒观是重要的化学观念。下列有关说法错误的是
A.繁多复杂的物质世界是由种类有限的元素组成的
B.原子中的质子数和中子数一定相等
C.原子核的体积很小,但集中了原子的主要质量
D.原子得失电子变成离子后,元素种类不变
9.(2024·北京·中考真题)为实现高效光催化分解水制氢,科研人员开展纳米复合光催化材料的研究。铌(Nb)在元素周期表中的原子序数是41,下列关于Nb的说法不正确的是
A.质子数是41 B.核电荷数是41 C.原子质量是41 D.核外电子数是41
考法04 原子结构示意图
10.(2024·广西·中考真题)氯原子的结构示意图如图所示。氯原子的核电荷数为
A.2 B.7 C.8 D.17
11.(2024·江苏宿迁·中考真题)氯原子、碘原子结构示意图如图所示。下列说法正确的是
A.氯元素和碘元素的化学性质相似 B.符号“2Cl”可表示2个氯元素
C.图中“”表示两种原子带正电荷 D.碘原子在化学反应中易失去电子
12.(2024·山东菏泽·中考真题)氟元素在自然界中主要存在于萤石(主要成分)等矿物中,正常成年人体中约含2~3克。人体每日摄入4mg以上会造成中毒,含氟牙膏中常用作添加剂。下图为氟、钠、钙的原子结构示意图。下列说法正确的是
A.氟原子核外电子数为7
B.在氟化钠的形成过程中,钠原子得到氟原子失去的1个电子,形成稳定结构
C.和两种物质中,氟元素的化合价均为-1价
D.牙膏中氟元素含量越高越好
考法05 元素周期表与原子结构示意图综合考查
13.(2024·山东潍坊·中考真题)铕是一种稀土元素,可用作电视屏幕的荧光粉。如图为铕元素在元素周期表中的相关信息及原子结构示意图。下列说法正确的是
A.铕属于非金属元素 B.一个铕原子的质量为152.0g
C.x的数值为25 D.的核外电子数是65
14.(2024·山东滨州·中考真题)下图为元素周期表中同一周期元素的名称、符号和原子结构示意图。请结合图示内容回答下列问题:
(1)图中各元素都属于元素周期表的第 周期;
(2)硼原子结构示意图中的 ;
(3)图中与镁元素化学性质相似的是 (填元素符号);
(4)氧原子在化学反应中通常易 (填“得到”或“失去”)电子,形成 (填“阴”或“阳”)离子;
(5)图中元素属于同一周期的原因是各原子的______(填字母序号)相同。
A.质子数 B.中子数 C.电子层数 D.最外层电子数
15.(2024·四川广安·中考真题)金属镓(Ga)可用于制作半导体,镓元素在元素周期表的信息以及Ga、A、B、C、D、E的微粒结构示意图如下图所示。元素周期表中,金属元素、非金属元素和稀有气体元素常用不同颜色区分。
回答下列问题:
(1)镓元素位于元素周期表第 周期。
(2)在元素周期表中,镓元素与A元素所占方格颜色 (填“相同”或“不同”)。
(3)上图中,一共涉及 种元素。
(4)E失去3个电子,形成阳离子,该离子符号为 。
核心知识
知识点一 构成物质的微观粒子
1.构成物质的粒子有分子、原子、离子,它们都可以直接构成物质。
2.微观粒子的基本性质:体积小、质量小;不断运动;粒子之间都有间隔;同种粒子化学性质相同,不同种粒子化学性质不相同;
3.物质的化学性质由构成它的粒子来保持。如保持水化学性质的粒子是水分子;保持铁化学性质的粒子是铁原子;保持氯化钠化学性质的是钠离子和氯离子。
4.分子、原子、离子构成的常见物质
(1)常见的由分子构成的物质:
①一些非金属单质,如:氢气、氧气、氮气、C60
②两种非金属组成的化合物,如:水、过氧化氢、一氧化碳、二氧化碳等;
③大部分有机物,如:甲烷、酒精、葡萄糖等。
(2)常见的由原子构成的物质:
①金属单质,例如:金、铁;
②非金属固体单质,例如:金刚石、硅
③稀有气体单质,例如:氦气、氖气、氩气
(3)常见的由离子构成的物质:大多数碱和盐,如氯化钠、硫酸铜、氢氧化钠等。
5.微观粒子的概念
(1)分子:分子是保持物质化学性质的最小粒子。
(2)原子:原子是化学变化中的最小粒子。
(3)离子:离子是带电的原子或原子团。
知识点二 原子的结构
1.原子的结构
原子核(带正电) 质子(带正电)
原子(不显电性) 中子(不带电)
核外电子(带负电)
2.注意点:
(1)不同种类的原子质子数不同;
(2)在原子中,核电荷数=质子数=核外电子数;
(3)质子数不一定等于中子数;
(4)不是所有原子的原子核中都有中子。
(5)原子质量几乎全部集中在原子核上。
3.原子核外电子排布规律
(1)原子核外电子是分层排布的。
(2)离核近的电子能量低,离核远的电子能量高。
(3)第一层最多2个电子;第二层最多8个电子;最外层最多8个电子。
4.原子分类(最外层电子数决定化学性质)
种类 最外层电子数 化学性质 形成离子
金属原子 1-3 易失去电子 阳离子
非金属原子 4-7 易得到电子 阴离子
稀有气体原子 8(He是2个) 化学性质稳定,不易得失电子
5.在结构示意图中,原子、阴离子、阳离子的判断依据:
在原子中:质子数等于电子数;在阳离子中:质子数大于电子数; 在阴离子中:质子数小于电子数。
6.相对原子质量
(1)概念:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得到的值。
(2)表达式:
(3)相对原子质量与原子核内微粒的关系:相对原子质量≈质子数+中子数
7.元素周期表:
(1)结构:每个横行叫周期,共7个横行,即7个周期; 每个纵行叫族,共18个纵行,16个族(8、9、10三个纵行合成为1个族);
(2)每格的信息(5个):
A是原子序数、 B是元素符号、
C是元素名称、 D是相对原子质量;
根据元素名称的偏旁部首可判断元素是否为金属元素
(3)原子序数=质子数=核外电子数=核电荷数
(4)元素周期表排列规律:
①周期数等于原子核外电子层数;
②横行:电子层数相同,最外层电子数从左到右依次增多;
③纵行:最外层电子数相同(即化学性质相似);从上到下电子层数递增。
命题预测
1.【新考法】精典古籍再认识——古籍中的化学(2024·海南·中考真题)宋代李重元在《忆王孙 ·夏词》中写到“过雨荷花满院香”。从微观角度分析,花香飘 满院的合理解释是
A.分子可以再分 B.分子的体积变大 C.分子间有间隔 D.分子在不断运动
2.【原创题】下列物质中既有分子又有离子的是
A.C60 B.汞 C.氨 D.氢氧化钠溶液
3.【新考法】 探月工程——月壤中的元素(2024·四川巴中·中考真题)我国探月工程嫦娥五号返回器曾携带1731g月壤样品返回地球。月壤中含量丰富的氦-3可作为核聚变燃料,其原子核是由2个质子和1个中子构成的,氦-3的原子结构示意图为
A. B. C. D.
4.【新考法】 结合生产生活(2024·黑龙江牡丹江·中考真题)新版《生活饮用水卫生标准》中的水质检测修订了镉、铅等的限量。这里的镉、铅指的是
A.原子 B.元素 C.分子 D.单质
5.(2024·陕西西安·模拟预测)下列有关微粒的说法不正确的是
A.原子是化学变化中的最小微粒
B.质子数相同的原子属于同种元素
C.镁原子和氦原子最外层电子数相同,化学性质相似
D.构成一氧化碳的微粒是一氧化碳分子
6.(2024·甘肃金昌·三模)下列对分子、原子、离子的认识,不正确的是
A.铜是由铜分子构成的 B.如图,原子核中有两个中子
C.构成硫酸的阴离子是 D.化学变化中的最小粒子是原子
7.【新情境】科技前沿——6G技术(2024·四川遂宁·中考真题)2024年以“创新预见6G未来”为主题的全球6G技术大会在南京召开。氮化镓是制造芯片的材料之一。镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是
A.镓元素为非金属元素 B.镓原子的中子数是31
C.图中X的数值是8 D.镓的相对原子质量是69.72g
8.(2024·江西九江·二模)据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下将CH4、转化为甲醇(CH3OH)、甲醛(CH2O)等,主要原理如图所示。下列说法错误的是
A.反应前后元素种类不变
B.表示水分子
C.该过程可看出化学反应经历了原子重新组合
D.这一系列的催化反应中(不考虑催化剂),没有发生变化的粒子是原子
9.(2024·山东菏泽·一模)如图是五种微粒的结构示意图,下列说法不正确的是
A.上述五种微粒只涉及四种元素
B.①②④属于原子,③属于阴离子
C.②③⑤表示的微粒性质较稳定
D.①④对应元素组成化合物的化学式为NaF
10.(2024·山东枣庄·中考真题)世界是物质的。从宏观角度看,物质是由元素组成的;从微观角度看,物质又是由分子、原子和离子等微观粒子构成的。
根据图示信息,回答下列问题:
(1)图1中铍原子的质子数为 ,铍属于 (填“金属”或“非金属”)元素。
(2)图2中最外层达到相对稳定结构的微观粒子是 (填字母序号),与C属于同种元素的是 (填字母序号)。
(3)图2中B单质是由 (填“分子”或“原子”)构成的。
(4)图2中A和B两种元素组成化合物的化学式为 ,其中A元素的化合价为 。
11.(2024·甘肃临夏·中考真题)我国科学家公布了对嫦娥五号带回月球土壤样品的研究成果,准确测定了月球土壤样品中40多种元素的含量,以下为钛、锂、钠、氦-3的有关信息。
(1)钛属于 (选填“金属”或“非金属”)元素,钛原子结构示意图中n的值是 。
(2)锂、钠两种元素化学性质相似的原因是 。锂离子电池为手机等内部常用的电池,碳酸锂是生产锂离子电池的常用原料,已知Li的化合价为,碳酸锂的化学式为 。
(3)已知氦-3原子是一种含2个质子和1个中子的原子,下列模型能表示氦-3原子的是 (填序号)。
12.(2024·山东泰安·中考真题)在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)物质的组成及构成关系如图所示,图中①处表示的是 ,②处表示的是 。
(2)根据下图钠、镁、氯、钾四种原子的结构示意图,回答问题。
①氯原子的结构示意图中x的数值为 。
②钠原子和钾原子具有相似的化学性质,在化学反应中均容易 (填“得到”或“失去”)电子。
③钠和镁属于不同种元素,是因为它们原子中 不同。
(3)我国某研究团队通过构筑原子级分散的钌催化剂实现高效氮气电还原合成氨,反应前后分子变化的微观示意图如图:
该反应的化学反应方程式为 。
真题训练
1.【答案】A
【详解】A、酒香不怕巷子深,是因为酒精中含有的分子是在不断地运动,向四周扩散,使人们闻到酒香,故选项解释合理;
B、升高温度分子运动速度加快,分子之间间隔增大,降低温度分子运动速度减慢,分子之间间隔减小,所以气体的热胀冷缩主要是因为气体分子间的间隔随温度的变化而改变,而分子的大小不变,故选项解释不合理;
C、硫酸铜溶液显蓝色,是因为溶液中含有铜离子,故选项解释不合理;
D、金刚石和石墨都是由碳原子构成的单质,二者的物理性质差异很大是因为碳原子排列方式不同,故选项解释不合理;
故选:A。
2.【答案】D
【详解】A、酒精挥发从手上吸热,酒精分子获得能量运动速率加快,故说法正确;
B、闻到酒精气味,是因为分子在不断地运动,向四周扩散,使人们闻到酒精气味,故说法正确;
C、酒精挥发,因为分子在不断地运动到空气中,同时分子间隔变大,所以酒精不见了,故说法正确;
D、酒精分子在不断地运动到空气中,气味变淡了,是因为酒精分子的更加分散了,但分子的数目是不会改变的,故说法错误。
故选D。
3.【答案】B
【详解】A、蔗糖溶解于水后会消失不见,是因为蔗糖分子是在不断地运动的,运动到水分子中间去了,故选项说法错误;
B、酒精燃烧生成二氧化碳和水,微观上分子改变,原子重新组合成新分子,故选项说法正确;
C、氧气液化时,由气态变为液态,水分子间的间隔变小,故选项说法错误;
D、冰融化成水时,水分子间隔变小,体积变小,分子数目不变,故选项说法错误。
故选B。
4.【答案】C
【详解】A、金属由原子构成,铜属于金属单质,是由铜原子直接构成的,故A错误;
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故B错误;
C、水是由非金属元素组成的化合物,是由水分子构成的,故C正确;
D、金刚石属于固态非金属单质,是由碳原子直接构成的,故D错误。故选C。
5.【答案】C
【详解】A、氢气属于气态非金属单质,由氢分子构成,不符合题意;
B、一氧化碳是由非金属元素组成的化合物,由一氧化碳分子构成,不符合题意;
C、金刚石属于碳单质,由碳原子构成,符合题意;
D、氯化钠是由金属元素和非金属元素组成的化合物,由钠离子和氯离子构成,不符合题意。
故选C。
6.【答案】B
【详解】A、水由水分子构成,不符合题意;
B、 CuSO4是由铜离子和硫酸根离子构成,符合题意;
C、C60是C60分子构成,不符合题意;
D、甲烷是由甲烷分子构成,不符合题意。
故选:B。
7.【答案】D
【详解】A、道尔顿是探索原子的结构较早的科学家,受当时科学水平的局限性,道尔顿认为原子是“不可再分的实心球体”,是构成物质的最小粒子。A正确;
B、由于汤姆孙等人在原子中发现了电子,提出汤姆孙葡萄干布丁模型,所以推翻了道尔顿实心球模型。B正确;
C、英国物理学家卢瑟福设计了α粒子散射实验,得出卢瑟福核式模型,修正了汤姆孙关于原子结构的汤姆孙葡萄干布丁模型。C正确;
D、卢瑟福提出了原子核式结构模型:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里。但卢瑟福核式模型也不是是最完善的原子结构模型,将会被替代。人类对原子结构的认识永无止境。D不正确。
综上所述:选择D。
8.【答案】B
【详解】A、物质是由元素组成的,所以虽然元素的种类是有限的,但由元素组成的物质种类是繁多的,故说法正确;
B、同种元素的原子核内质子数和中子数不一定相等,例如碳12、碳13、碳14的质子数相同,但中子数不同,则原子中质子数和中子数不一定相等,故说法错误;
C、原子核体积相对于原子体积来说很小,原子的质量主要集中在原子核上,所以原子核的质量大约相当于原子的质量,故说法正确;
D、元素种类由质子数决定,原子得失电子变成离子,其质子数不变,因此元素的种类不变,故说法正确。
故选B。
9【答案】C
【详解】A、原子序数=质子数,铌(Nb)的原子序数是41,则质子数是41,说法正确,不符合题意;
B、原子序数=核电荷数,铌(Nb)的原子序数是41,则核电荷数是41,说法正确,不符合题意;
C、原子质量约等于质子数加中子数,根据铌(Nb)的原子序数是41,不能确定原子质量是 41,说法错误,符合题意;
D、原子序数=核外电子数,铌(Nb)的原子序数是41,则核外电子数是41,说法正确,不符合题意。
故选C。
10.【答案】D
【详解】由氯原子的结构示意图可知,氯原子的质子数为17,原子中质子数=核电荷数,所以氯原子的核电荷数为17,故选D。
11.【答案】A
【详解】A、氯原子和碘原子的最外层电子数相同都有7个电子,故氯元素和碘元素的化学性质相似,正确;
B、元素只讲种类、不讲个数,故符号“2Cl”可表示2个氯原子、不能表示2个氯元素,错误;
C、原子是不带电的,同时根据原子结构示意图意义,圆圈表示原子核,故图中“”表示两种原子的原子核带正电荷,错误;
D、最外层电子数一般小于4,通常容易失电子,最外层电子数一般大于4,通常容易得电子,碘原子最外层电子数为7,大于4,故碘原子在化学反应中易得到电子,错误;
故选A
12.【答案】C
【详解】A、氟原子核外电子数为2+7=9,错误;
B、在氟化钠的形成过程中,钠原子最外层电子数为1,氟原子易失去最外层的1个电子形成带1个单位正电荷的钠离子,氟原子最外层电子数为7,氟原子易得到1个电子形成带1个单位负电荷的氟离子,即氟原子得到钠原子失去的1个电子,形成稳定结构,错误;
C、根据在化合物中各元素正负化合价代数和为0,CaF2中钙元素显+2价,NaF中钠元素显+1价,则两种物质中,氟元素的化合价均为-1价,正确;
D、用含氟牙膏刷牙可使牙齿坚固,从而有效防止蛀牙,但是牙膏中氟元素含量并不是越高越好,因为长期摄入高剂量的氟,则会引起氟骨症,重则会引起恶心、呕吐、心律不齐等急性氟中毒情况,错误。
故选C。
13.【答案】C
【详解】A、铕带“钅”字旁,属于金属元素,故选项说法错误;
B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,铕元素的相对原子质量为152.0,而非原子的实际质量。故选项说法错误;
C、根据原子中核电荷数=质子数=核外电子数,则x=63-2-8-18-8-2=25,故选项说法正确;
D、由铕原子结构示意图可知,铕原子的最外层电子数为2,容易失去电子,形成Eu2+,则Eu2+的核外电子数是63-2=61,故选项说法错误;
故选:C。
14.【答案】(1)二/2
(2)3
(3)Be
(4) 得到 阴
(5)C
【详解】(1)原子核外电子层数等于该元素所在的周期数,图中各元素原子的核外电子层数均为2,因此图中各元素都属于元素周期表的第二周期;
(2)由原子结构示意图可知,圈内数字表示核电荷数,在原子中,核电荷数=核外电子数,故硼原子结构示意图中的=5-2=3;
(3)原子最外层电子数相同的元素,其化学性质相似,镁原子的最外层电子数为2,则图中与镁元素化学性质相似的是铍(Be),这两种原子在化学反应中均易失去2个电子形成阳离子;
(4)由氧原子结构示意图可知,氧原子最外层电子数为6>4,在化学反应中易得到2个电子形成阴离子;
(5)原子核外电子层数等于该元素所在的周期数,因此图中元素属于同一周期的原因是各原子的核外电子层数相同,故选:C。
15.【答案】(1)四/4
(2)不同
(3)五/5
(4)Al3+
【详解】(1)镓原子核外有4个电子层,故镓元素位于第四周期;
(2)在元素周期表中,金属和非金属颜色不同。由“金”字旁可知,镓元素属于金属元素,质子数=原子序数,A是17号元素,是氯元素,由“气”字旁可知,氯属于非金属元素,故在元素周期表中,镓元素与A元素所占方格颜色不同;
(3)元素是质子数相同的一类原子的总称,A、C质子数相同,属于同种元素,故图中涉及五种元素;
(4)质子数=原子序数,E的质子数为13,13号元素是铝元素,铝原子的最外层电子数为3,小于4,在化学反应中,容易失去最外层3个电子,从而带上3个单位的正电荷,表示为:Al3+。
命题预测
1.【答案】D
【详解】“过雨荷花满院香”是雨后的荷花更散发出沁人的芬芳,能闻到气味是因为分子在不断运动,带有气味的分子运动到人的鼻子,使人闻到气味。故选D。
2.【答案】D
【详解】本题考查物质的构成。
A、C60由C60分子构成,故A错误;
B、汞是金属,由汞原子构成,故B错误;
C、氨由氨分子构成,故C错误;
D、氢氧化钠溶液中含有钠离子、氢氧根离子和水分子,故D正确。
故选D。.
3.【答案】B
【详解】原子结构示意图左侧圆圈内的数字表示质子数,原子的质子数=核外电子数,根据题目信息,氦-3的原子核是由2个质子和1个中子构成的,所以氦-3原子的质子数为2,核外电子数也为2,故选:B。
4.【答案】B
【详解】这里的“镉、铅”等不是以单质、分子、原子、离子等形式存在,而是强调存在的元素,与具体形态无关;所以是指元素;
故选B。
5.【答案】C
【详解】A、化学变化的实质是分子的分裂和原子的重新组合,原子是化学变化中的最小微粒,说法正确;
B、元素是具有相同质子数一类原子的总称,质子数相同的原子属于同种元素,说法正确;
C、镁原子最外层电子数为2,容易失去电子,氦原子最外层电子数也为2,但氦原子具有稳定结构,镁原子和氦原子最外层电子数相同,化学性质不相似,说法错误;
D、物质是由分子、原子或离子构成的,构成一氧化碳的微粒是一氧化碳分子,说法正确;
故选:C。
6【答案】A
【详解】A、铜是由铜原子构成的,故A选项说法错误;
B、原子核是由质子和中子构成,图中带正电的为质子,不带电的为中子,中子有两个,故B选项说法正确;
C、硫酸是由阳离子氢离子和阴离子硫酸根离子构成,故C选项说法正确;
D、原子在化学变化中不能再分,是化学变化的最小粒子,故D选项说法正确。
故答案为A。
7.【答案】C
【详解】A、镓是“钅”字旁,所以镓元素为金属元素。不符合题意;
B、元素周期表一格左上角数字为原子序数=质子数,最下方数字为相对原子质量。相对原子质量≈质子数+中子数,所以镓原子的中子数是70-31=39。不符合题意;
C、原子中质子数=核外电子数,所以31=2+X+18+3,X=8。符合题意;
D、相对原子质量的单位是“1”不是“g”,镓的相对原子质量是69.72。不符合题意;
故选C。
8.【答案】B
【详解】A、根据质量守恒定律,化学反应前后,元素的种类不变,故正确;
B、该微粒是由两个氢原子和两个氧原子构成的,表示过氧化氢分子,故错误;
C、化学变化的实质就是分子分成原子,原子重新组合成新的分子的过程,故正确;
D、化学变化中,分子可分而原子不可分,没有改变的粒子是原子,故正确。
故选B。
9.【答案】B
【详解】A、元素是质子数相同的一类原子的总称,由微粒结构示意图可知,圈内数字表示质子数,则上述五种微粒只涉及四种元素,说法正确, 不符合题意;
B、①核内质子数=核外电子数,属于原子;②核内质子数=核外电子数,属于原子;③核内质子数>核外电子数,属于阳离子;④核内质子数=核外电子数,属于原子;说法错误,符合题意;
C、②③⑤最外层电子数均为8,均属于相对稳定结构,则②③⑤表示的微粒性质较稳定,说法正确,不符合题意;
D、在原子中,质子数=原子序数,则①对应氟元素,氟原子最外层电子数为7>4,在化学反应中易得到1个电子形成带1个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值且符号一致,则氟元素显-1价;④对应钠元素,钠原子最外层电子数为1<4,在化学反应中易失去1个电子形成带1个单位正电荷的阳离子,则钠元素显+1价,根据在化合物中各元素化合价的代数和为零,则①④对应元素组成化合物的化学式为NaF,说法正确,不符合题意。
故选:B。
10.【答案】(1) 4 金属
(2) C B
(3)原子
(4) Na2S -2
【详解】(1)图1中铍原子的原子序数(左上角数字)是4,根据原子序数=核电荷数=质子数=核外电子数,则铍原子的质子数是4;
铍带金字旁,属于金属元素;
(2)最外层电子数为8(一个电子层为2)属于相对稳定结构,则图2中最外层达到相对稳定结构的微观粒子是C;
元素的种类由质子数决定,质子数相同的一类原子属于同一种元素,B与C质子数(圆圈内数字)相同,则与C属于同种元素的是B;
(3)图2中B是钠单质,钠属于金属由原子构成;
(4)图2中A(硫)和B( 钠)两种元素组成化合物,其中硫元素显-2价,钠元素显+1价,则化学式为Na2S,其中A(硫)元素的化合价为-2。
11.【答案】(1) 金属 10
(2) 原子的最外层电子数相同 Li2CO3
(3)C
【详解】(1)钛是“金”字旁,属于金属元素,在原子中,质子数=核外电子数=2+8+n+2=22,解得n=10,故填:金属;10;
(2)元素的化学性质由最外层电子数决定,最外层电子数相同的原子(稀有气体除外)的化学性质相似,故锂、钠两种元素化学性质相似的原因是原子的最外层电子数相同;Li的化合价为+1,碳酸根离子显-2价,根据化合物中正负化合价代数和为零的原则,碳酸锂的化学式为Li2CO3,故填:原子的最外层电子数相同;Li2CO3;
(3)在原子中,质子数=核外电子数,氦-3原子是一种含2个质子和1个中子的原子,则模型能表示氦-3原子的是C,故填:C。
12.【答案】(1) 元素 原子
(2) 7 失去 质子数
(3)
【详解】(1)物质是由元素组成的,因此①表示元素;分子、原子和离子是构成物质的三种基本粒子,因此②表示原子;
(2)①在原子中,质子数=电子数,则x=17-2-8=7;
②钠原子和钾原子的最外层具有1个电子,在化学反应中均容易失去电子,因此钠原子和钾原子具有相似的化学性质;
③钠和镁属于不同种元素,是因为它们原子中质子数不同;
(3)由微观反应示意图可知,氮气与水在催化剂的作用下反应生成氨气和氧气,反应的化学方程式为:。
同课章节目录
