安徽师范大学附属中学2025届高三下学期模拟预测 化学试题(含答案)
文档属性
| 名称 | 安徽师范大学附属中学2025届高三下学期模拟预测 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-01 21:26:22 | ||
图片预览



文档简介
安徽师范大学附属中学2025届高三考前适应性检测
化学试题
考试时间:75分钟满分:100分
相对原子质量:Li-7 C-12 N-14 F-19 Na-23 P-31 K-39
一、选择题本题共14小题,每小题3分;共42分。在每小题给出的四个选项中,只有一项符合题目要求的。
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是
A.中国第三艘常规动力航母的燃料油主要成分为烃
B.发现了月壤中的“嫦娥石”,其成分属于无机盐
C.革新了海水原位电解制氢工艺,其关键材料多孔聚四氟乙烯有很强的耐腐蚀性
D.神舟十七号问天实验舱使用了石墨烯导热索技术,石墨烯属于有机高分子材料
2.下列说法错误的是
A.容量瓶在使用前需保持干燥,并检查是否漏液
B.铝热反应非常剧烈,操作时要戴上石棉手套和护目镜
C.利用红外光谱法可以初步判断有机物中具有哪些基团
D.用标准液润洗滴定管后,应将润洗液从滴定管下口倒出
3.化学与人类生产、生活密切相关,下列说法正确的是
A.可以用含增塑剂的聚氯乙烯薄膜生产食品包装材料
B.使用蒸馏法进行海水淡化,是因为其工艺比较成熟、能耗低
C.低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养
D.在酸催化下,等物质的量的苯酚与甲醛反应生成网状结构的酚醛树脂
4.在给定条件下,下列制备过程涉及的物质转化均可实现的是
A.硫酸工业:
B.金属Mg制备:溶液
C.HCl制备:溶液和
D.纯碱工业:溶液
5.EDTA(乙二胺四乙酸)能与大多数金属离子形成稳定的配合物,其分子结构如图所示,下列说法正确的是
A.分子式为C10H14N2O8
B.该分子结构中的所有C、N、O原子可能共平面
C.1 molEDTA最多可形成的配位键数目为6NA
D. EDTA相对分子质量与正二十一烷相近,所以沸点差异较小
6.反应可用于冶金。设为阿伏加德罗常数的值,下列说法正确的是
A.该反应消耗22.4L ,转移电子数为4
B.1mol 中含键数目为6
C.100mL 1 NaCN溶液中阴离子数为0.1
D.2.0g 与的混合物中所含质子数与中子数均为
7.物质的结构决定性质,下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 水溶性: 分子极性
B 溶解度(20℃):Na2CO3 (29g)大于NaHCO3 (8g) 阴离子电荷
C 酸性:乙酸>丙酸 推电子效应:
D 熔点:(1040℃)>(178℃) 晶体类型不同
8.某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是
A.键角:XW4 W2Y
B.电负性Y > X > W
C.最简单氢化物的沸点Y Z
D.该阴离子中不含有配位键
9.由下列实验操作和现象,得出的结论正确的是
选项 操作 现象 结论
A 向某补血口服液中滴加几滴酸性溶液 酸性溶液紫色褪去 该补血口服液中一定含有
B 将溶液加热到,用传感器监测溶液变化 溶液的逐渐减小 温度升高,水解平衡正向移动
C 将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,久置光照 试管内液面上升 甲烷和氯气发生取代反应
D 常温下,用pH计测定0.1mol L-1NaHRO3溶液的pH 溶液的pH=3.71 H2RO3为二元酸
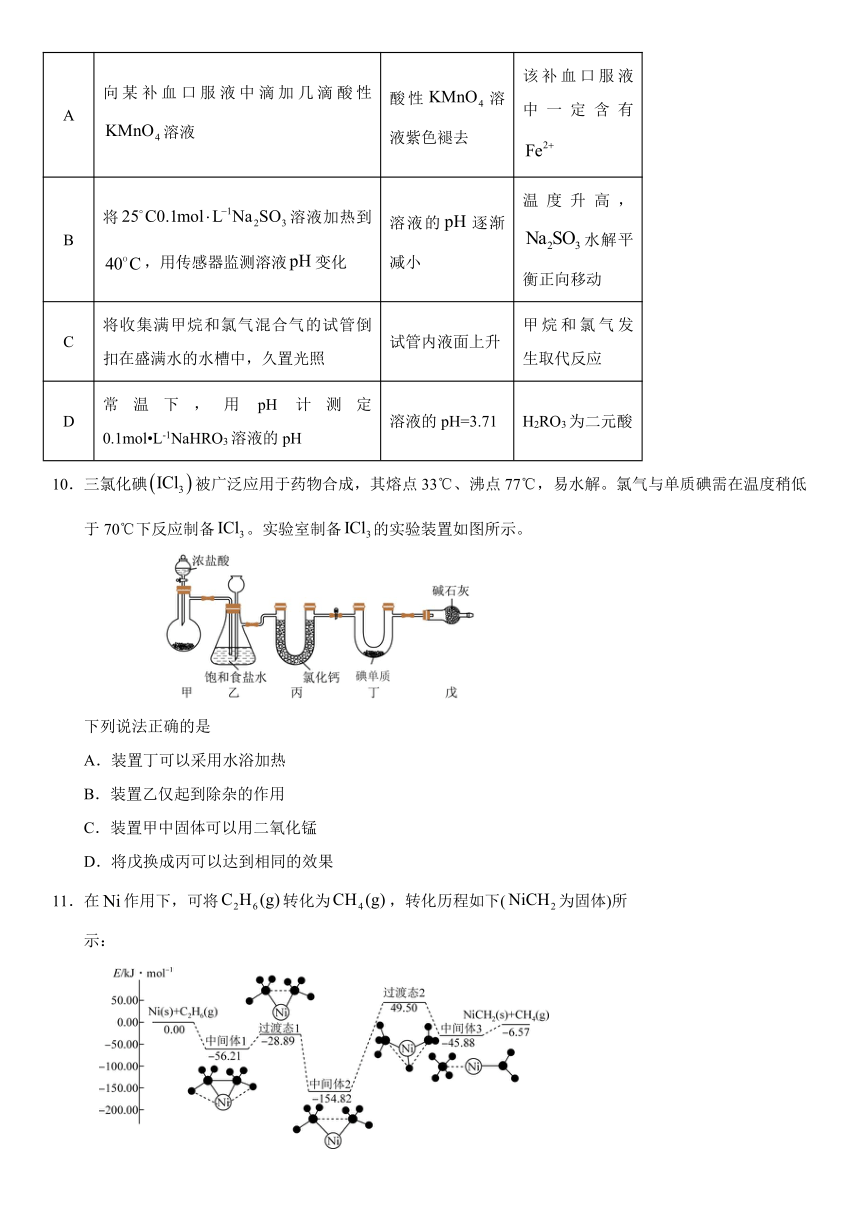
10.三氯化碘被广泛应用于药物合成,其熔点33℃、沸点77℃,易水解。氯气与单质碘需在温度稍低于70℃下反应制备。实验室制备的实验装置如图所示。
下列说法正确的是
A.装置丁可以采用水浴加热
B.装置乙仅起到除杂的作用
C.装置甲中固体可以用二氧化锰
D.将戊换成丙可以达到相同的效果
11.在作用下,可将转化为,转化历程如下(为固体)所
示:
下列说法中错误的是
A.转化中有极性键的断裂和形成
B.转化过程中的成键数目未变化
C.总反应的热化学方程式
D.转化过程中的一段时间内,可存在中间体2的浓度大于另外两种中间体的浓度
12.利用氢氧燃料电池可实现由白磷电解制备,并实现的循环利用,其工作原理如图所示。(已知:Me为甲基;电极均为石墨电极)
下列说法正确的是
A.电池工作时电极b连接电极d
B.当生成9.0g 时,电极a消耗2.24L(标准状况)
C.通电一段时间后,若隔膜e阴离子交换膜,则减小
D.电极c的电极反应方程式为
13.是一种超导材料,其立方晶胞如图所示,设阿伏加德罗常数为,以晶胞参数为单位长度建立的直角坐标系(如图),1号原子的坐标为,下列说法错误的是
A.晶胞的空间利用率为
B.晶胞中与K原子距离相等且最近的Se原子有8个
C.1号原子与3号原子之间的距离为
D.若1号原子与2号原子的距离为c nm,则2号原子坐标为
14.工业上常用除去废水中的、。在下,起始浓度的水溶液中,(表示、、的物质的量浓度)随着的变化如图中虚线所示(溶液体积变化忽略不计);若通过调节该溶液的,形成难溶硫化物以除去废水的、,金属离子浓度(表示、的物质的量浓度)随的变化如实线所示。已知:。
下列说法不正确的是
A.Q点的
B. ①、②、③曲线分别对应、、随的变化
C. 调节溶液至时,
D.的平衡常数K =104.6
二、非选择题:本题共4小题,共58分。
15.(14分)钴在新能源、新材料领域具有重要用途。某废渣含有钴、铅、铜、铁、镁、钙的价氧化物。从该废渣中提取钴和制取胆矾的一种流程如下。
已知:
①常温下,,,;
②部分阳离子以氢氧化物形式沉淀时溶液的见下表:
金属离子
开始沉淀时的 2.7 7.5 7.6 4.7
完全沉淀时的 3.7 9.0 9.1 6.2
③萃取的反应原理;;
注:加沉淀剂使一种金属离子浓度小于等于,其他金属离子不沉淀,即认为完全分离。
(1)Co位于元素周期表中第 周期第 族。
(2)“滤渣1”的主要成分为。向“滤液1”中需先加A物质,再加B物质,若加入的A为无机非金属化合物的溶液,则A试剂为 (化学式),加入B试剂的目的是 。
(3)常温下,若“滤液2”中C(Mg2+)=0.02mol/L(忽略溶液中极少量的),除去“滤液2”中的,至少需加入固体的质量为 (忽略溶液体积的变化)。
(4) “反萃取”步骤中加入的“试剂”的名称为 。
(5)“氧化沉钴”中氧化还原反应的离子方程式为 。
16.(15分)莫尔盐[(NH4)2Fe(SO4)2.6H2O]用途十分广泛。某学习小组设计如下实验制备少量的莫尔盐并完成相关实验。
Ⅰ.制取莫尔盐
(1)如上图所示连接装置,检查装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器___________(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开活塞K1和K2,加入55.0mL2mol/L稀硫酸后关闭K1。
②待大部分铁屑溶解后,进行的操作,此时可以看到有液体流入B中。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶,过滤,用无水乙醇洗涤晶体。
④装置C的作用为___________。
Ⅱ.测定已配好的莫尔盐溶液的浓度
(3)取的酸性溶液20.00mL于锥形瓶中,加入二苯胺磺酸钠作指示剂,用配制好的(NH4)2Fe(SO4)2.6H2O溶液滴定至终点,此时恰好完全转化为。进行三次平行实验,平均消耗20.00mL硫酸亚铁铵溶液。(NH4)2Fe(SO4)2.6H2O溶液中的浓度为________,若滴定至溶液刚变色时即读数,则测得的浓度将________(填“偏高”“偏低”或“无影响”)。
Ⅲ.热分解产物的检验
莫尔盐自身受热分解会产生、、、等气体,小组同学欲用下图装置检验其中的和。
(4)装置连接的合理顺序为_______(填装置编号)。
(5)D中加入的盐酸需足量,否则可能会引发的后果为_______(用化学方程式表示)。
17.(14分)的重整反应弥补甲烷—水蒸气重整反应产生较高的不
足,发生反应如下:
反应 I.
反应Ⅱ.
反应Ⅲ.
反应Ⅳ.
已知:①含碳物质的百分数:;
②对于反应,其中,、、、为各组分的平衡分压。
回答下列问题:
(1)、和标准摩尔燃烧焓数据分别为-890.3、-283.0和-285.8kJ·mol-1,则
,反应在条件下能 自发进行(填“高温”“低温”或“任意温度”)。
(2)向100kPa的容器中充入物质的量均为5mol的和,测得平衡时含碳物质的百分数随温度的变化关系如图所示,则a线对应物种为 (填化学式),在557→640℃区间时,随温度升高b曲线对应物种的百分数逐渐升高的原因是 。
当温度为 840℃时,曲线a、b对应含碳物质的百分数分别为 70%、20%,此时气体总物质的量为16.4mol,则的产率为 ,体系中C(s)的物质的量为 ,反应I的= (列计算表达式),若向平衡体系中通入少量,重新达平衡后,将 (填“增大”“减小”或“不变”)。
18(15分).某药物中间体L的合成路线如图。
已知:①C和D所含官能团相同。(2)
(1)E的名称是 ,H中的官能团名称是 。
(2)H→J的反应类型是 。
(3)写出CD→E的化学方程式 。
(4)G的结构简式为 。
(5)A有多种同分异构体,其中遇铁离子显紫色的有 种。
(6)已知,参照上述合成路线,设计以和OHCCHO合成的合成路线(无机试剂、有机溶剂任选) 。
参考答案及评分标准
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A C C C D B B D A B D A C
15、(14分,每空2分)(1)第四周期第VIII族(各1分)
(2) 硫酸铅、硫酸钙(各1分) H2O2调节PH,使铁离子转为氢氧化物沉淀除去
(3)5.46g(4)稀硫酸
(5)
16.(15分)
(1)三颈烧瓶(2分)
(2) 打开活塞K3、关闭活塞K2 (2分) 液封作用,防止空气进入B装置氧化Fe2+ (2分)
(3) 0.06(2分)偏高(2分)
(4) AEDBC (2分)
(5)2NH3+SO2+H2O=(NH4)2SO3,(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl(3分)
17.(14分,每空2分)
(1)+247.3或247(无+也给分) 高温
(2)CO该温度区间内,只发生反应II,随温度升高平衡正向移动程度增大,甲烷逐渐减少,CO2百分数逐渐增大(若答出“反应I、反应III或IV移动的”均不给分)
(3)56% 2mol
18. (15分,每空2分)
(1)3-苯基丙烯醛碳碳三键和羧基(2)加成反应
(3)+CH3CHO+H2O
(4)(5)22
(6)(3分)
化学试题
考试时间:75分钟满分:100分
相对原子质量:Li-7 C-12 N-14 F-19 Na-23 P-31 K-39
一、选择题本题共14小题,每小题3分;共42分。在每小题给出的四个选项中,只有一项符合题目要求的。
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是
A.中国第三艘常规动力航母的燃料油主要成分为烃
B.发现了月壤中的“嫦娥石”,其成分属于无机盐
C.革新了海水原位电解制氢工艺,其关键材料多孔聚四氟乙烯有很强的耐腐蚀性
D.神舟十七号问天实验舱使用了石墨烯导热索技术,石墨烯属于有机高分子材料
2.下列说法错误的是
A.容量瓶在使用前需保持干燥,并检查是否漏液
B.铝热反应非常剧烈,操作时要戴上石棉手套和护目镜
C.利用红外光谱法可以初步判断有机物中具有哪些基团
D.用标准液润洗滴定管后,应将润洗液从滴定管下口倒出
3.化学与人类生产、生活密切相关,下列说法正确的是
A.可以用含增塑剂的聚氯乙烯薄膜生产食品包装材料
B.使用蒸馏法进行海水淡化,是因为其工艺比较成熟、能耗低
C.低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养
D.在酸催化下,等物质的量的苯酚与甲醛反应生成网状结构的酚醛树脂
4.在给定条件下,下列制备过程涉及的物质转化均可实现的是
A.硫酸工业:
B.金属Mg制备:溶液
C.HCl制备:溶液和
D.纯碱工业:溶液
5.EDTA(乙二胺四乙酸)能与大多数金属离子形成稳定的配合物,其分子结构如图所示,下列说法正确的是
A.分子式为C10H14N2O8
B.该分子结构中的所有C、N、O原子可能共平面
C.1 molEDTA最多可形成的配位键数目为6NA
D. EDTA相对分子质量与正二十一烷相近,所以沸点差异较小
6.反应可用于冶金。设为阿伏加德罗常数的值,下列说法正确的是
A.该反应消耗22.4L ,转移电子数为4
B.1mol 中含键数目为6
C.100mL 1 NaCN溶液中阴离子数为0.1
D.2.0g 与的混合物中所含质子数与中子数均为
7.物质的结构决定性质,下列性质差异与结构因素匹配错误的是
选项 性质差异 结构因素
A 水溶性: 分子极性
B 溶解度(20℃):Na2CO3 (29g)大于NaHCO3 (8g) 阴离子电荷
C 酸性:乙酸>丙酸 推电子效应:
D 熔点:(1040℃)>(178℃) 晶体类型不同
8.某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q是核电荷数依次增大的短周期元素,W、Y原子序数之和等于Z,Y原子价电子数是Q原子价电子数的2倍。下列说法正确的是
A.键角:XW4 W2Y
B.电负性Y > X > W
C.最简单氢化物的沸点Y Z
D.该阴离子中不含有配位键
9.由下列实验操作和现象,得出的结论正确的是
选项 操作 现象 结论
A 向某补血口服液中滴加几滴酸性溶液 酸性溶液紫色褪去 该补血口服液中一定含有
B 将溶液加热到,用传感器监测溶液变化 溶液的逐渐减小 温度升高,水解平衡正向移动
C 将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,久置光照 试管内液面上升 甲烷和氯气发生取代反应
D 常温下,用pH计测定0.1mol L-1NaHRO3溶液的pH 溶液的pH=3.71 H2RO3为二元酸
10.三氯化碘被广泛应用于药物合成,其熔点33℃、沸点77℃,易水解。氯气与单质碘需在温度稍低于70℃下反应制备。实验室制备的实验装置如图所示。
下列说法正确的是
A.装置丁可以采用水浴加热
B.装置乙仅起到除杂的作用
C.装置甲中固体可以用二氧化锰
D.将戊换成丙可以达到相同的效果
11.在作用下,可将转化为,转化历程如下(为固体)所
示:
下列说法中错误的是
A.转化中有极性键的断裂和形成
B.转化过程中的成键数目未变化
C.总反应的热化学方程式
D.转化过程中的一段时间内,可存在中间体2的浓度大于另外两种中间体的浓度
12.利用氢氧燃料电池可实现由白磷电解制备,并实现的循环利用,其工作原理如图所示。(已知:Me为甲基;电极均为石墨电极)
下列说法正确的是
A.电池工作时电极b连接电极d
B.当生成9.0g 时,电极a消耗2.24L(标准状况)
C.通电一段时间后,若隔膜e阴离子交换膜,则减小
D.电极c的电极反应方程式为
13.是一种超导材料,其立方晶胞如图所示,设阿伏加德罗常数为,以晶胞参数为单位长度建立的直角坐标系(如图),1号原子的坐标为,下列说法错误的是
A.晶胞的空间利用率为
B.晶胞中与K原子距离相等且最近的Se原子有8个
C.1号原子与3号原子之间的距离为
D.若1号原子与2号原子的距离为c nm,则2号原子坐标为
14.工业上常用除去废水中的、。在下,起始浓度的水溶液中,(表示、、的物质的量浓度)随着的变化如图中虚线所示(溶液体积变化忽略不计);若通过调节该溶液的,形成难溶硫化物以除去废水的、,金属离子浓度(表示、的物质的量浓度)随的变化如实线所示。已知:。
下列说法不正确的是
A.Q点的
B. ①、②、③曲线分别对应、、随的变化
C. 调节溶液至时,
D.的平衡常数K =104.6
二、非选择题:本题共4小题,共58分。
15.(14分)钴在新能源、新材料领域具有重要用途。某废渣含有钴、铅、铜、铁、镁、钙的价氧化物。从该废渣中提取钴和制取胆矾的一种流程如下。
已知:
①常温下,,,;
②部分阳离子以氢氧化物形式沉淀时溶液的见下表:
金属离子
开始沉淀时的 2.7 7.5 7.6 4.7
完全沉淀时的 3.7 9.0 9.1 6.2
③萃取的反应原理;;
注:加沉淀剂使一种金属离子浓度小于等于,其他金属离子不沉淀,即认为完全分离。
(1)Co位于元素周期表中第 周期第 族。
(2)“滤渣1”的主要成分为。向“滤液1”中需先加A物质,再加B物质,若加入的A为无机非金属化合物的溶液,则A试剂为 (化学式),加入B试剂的目的是 。
(3)常温下,若“滤液2”中C(Mg2+)=0.02mol/L(忽略溶液中极少量的),除去“滤液2”中的,至少需加入固体的质量为 (忽略溶液体积的变化)。
(4) “反萃取”步骤中加入的“试剂”的名称为 。
(5)“氧化沉钴”中氧化还原反应的离子方程式为 。
16.(15分)莫尔盐[(NH4)2Fe(SO4)2.6H2O]用途十分广泛。某学习小组设计如下实验制备少量的莫尔盐并完成相关实验。
Ⅰ.制取莫尔盐
(1)如上图所示连接装置,检查装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器___________(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开活塞K1和K2,加入55.0mL2mol/L稀硫酸后关闭K1。
②待大部分铁屑溶解后,进行的操作,此时可以看到有液体流入B中。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶,过滤,用无水乙醇洗涤晶体。
④装置C的作用为___________。
Ⅱ.测定已配好的莫尔盐溶液的浓度
(3)取的酸性溶液20.00mL于锥形瓶中,加入二苯胺磺酸钠作指示剂,用配制好的(NH4)2Fe(SO4)2.6H2O溶液滴定至终点,此时恰好完全转化为。进行三次平行实验,平均消耗20.00mL硫酸亚铁铵溶液。(NH4)2Fe(SO4)2.6H2O溶液中的浓度为________,若滴定至溶液刚变色时即读数,则测得的浓度将________(填“偏高”“偏低”或“无影响”)。
Ⅲ.热分解产物的检验
莫尔盐自身受热分解会产生、、、等气体,小组同学欲用下图装置检验其中的和。
(4)装置连接的合理顺序为_______(填装置编号)。
(5)D中加入的盐酸需足量,否则可能会引发的后果为_______(用化学方程式表示)。
17.(14分)的重整反应弥补甲烷—水蒸气重整反应产生较高的不
足,发生反应如下:
反应 I.
反应Ⅱ.
反应Ⅲ.
反应Ⅳ.
已知:①含碳物质的百分数:;
②对于反应,其中,、、、为各组分的平衡分压。
回答下列问题:
(1)、和标准摩尔燃烧焓数据分别为-890.3、-283.0和-285.8kJ·mol-1,则
,反应在条件下能 自发进行(填“高温”“低温”或“任意温度”)。
(2)向100kPa的容器中充入物质的量均为5mol的和,测得平衡时含碳物质的百分数随温度的变化关系如图所示,则a线对应物种为 (填化学式),在557→640℃区间时,随温度升高b曲线对应物种的百分数逐渐升高的原因是 。
当温度为 840℃时,曲线a、b对应含碳物质的百分数分别为 70%、20%,此时气体总物质的量为16.4mol,则的产率为 ,体系中C(s)的物质的量为 ,反应I的= (列计算表达式),若向平衡体系中通入少量,重新达平衡后,将 (填“增大”“减小”或“不变”)。
18(15分).某药物中间体L的合成路线如图。
已知:①C和D所含官能团相同。(2)
(1)E的名称是 ,H中的官能团名称是 。
(2)H→J的反应类型是 。
(3)写出CD→E的化学方程式 。
(4)G的结构简式为 。
(5)A有多种同分异构体,其中遇铁离子显紫色的有 种。
(6)已知,参照上述合成路线,设计以和OHCCHO合成的合成路线(无机试剂、有机溶剂任选) 。
参考答案及评分标准
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A C C C D B B D A B D A C
15、(14分,每空2分)(1)第四周期第VIII族(各1分)
(2) 硫酸铅、硫酸钙(各1分) H2O2调节PH,使铁离子转为氢氧化物沉淀除去
(3)5.46g(4)稀硫酸
(5)
16.(15分)
(1)三颈烧瓶(2分)
(2) 打开活塞K3、关闭活塞K2 (2分) 液封作用,防止空气进入B装置氧化Fe2+ (2分)
(3) 0.06(2分)偏高(2分)
(4) AEDBC (2分)
(5)2NH3+SO2+H2O=(NH4)2SO3,(NH4)2SO3+BaCl2=BaSO3↓+2NH4Cl(3分)
17.(14分,每空2分)
(1)+247.3或247(无+也给分) 高温
(2)CO该温度区间内,只发生反应II,随温度升高平衡正向移动程度增大,甲烷逐渐减少,CO2百分数逐渐增大(若答出“反应I、反应III或IV移动的”均不给分)
(3)56% 2mol
18. (15分,每空2分)
(1)3-苯基丙烯醛碳碳三键和羧基(2)加成反应
(3)+CH3CHO+H2O
(4)(5)22
(6)(3分)
同课章节目录
