江西省南昌中学2024-2025学年高三下学期模拟预测 化学试题(含答案)
文档属性
| 名称 | 江西省南昌中学2024-2025学年高三下学期模拟预测 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 961.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-01 21:35:50 | ||
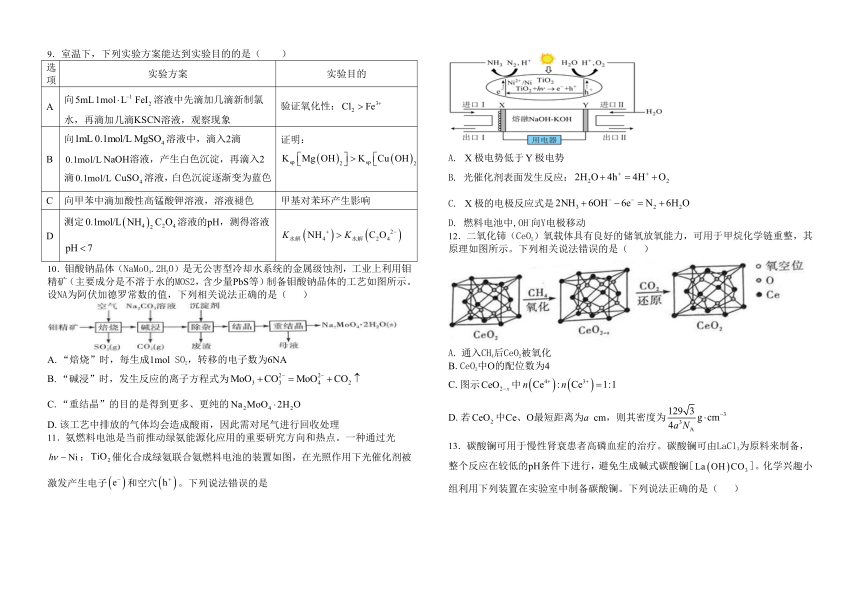
图片预览

文档简介
南昌中学2024-2025学年度“校模考”
高三化学试卷
可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Ce 140
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“科技兴国,高质量发展”一直是我国建设现代化国家的重要战略方针。下列说法不正确的是( )
A.聚碳酸酯不属于新型无机非金属材料
B.丝绸富含酰胺基,具有良好的吸湿性
C.“海水中提取碘单质”的过程中涉及氧化还原反应
D.“神舟十六号”推进器使用的氧化剂是,N2H4其中N是第ⅤA族元素
2.工业上常用乙烯水化法制乙醇,下列有关化学用语表述正确的是( )
A.乙烯分子中的键电子云:
B.乙烯的结构简式:
C.水分子的VSEPR模型名称:正四面体形
D.乙醇分子中的官能团的电子式:
3. 下列操作或装置能达到实验目的的是
A. 测定硫酸铜晶体中结晶水含量,灼烧、冷却 B. 萃取分液时,振荡和放气
C. 验证酸性:乙酸>碳酸>苯酚 D. 实验室制备并检验乙烯
4.化学物质与生活生产非常密切,下列有关说法错误的是( )
A.餐后桌上残留的油渍,可用热的纯碱溶液除去
B.胃酸患者常用含NaHCO3或Al(OH)3的药物治疗
C.SO2具有漂白性,能使品红溶液及紫色石蕊溶液褪色
D.酚醛树脂既可能有热塑性,也可能有热固性
5.下列化学反应表示正确的是( )
A.碱性条件下,氧化KI的离子方程式:
B.过氧化钾与水反应:
C.燃烧热的热化学方程式:
D.制备SO2F2:
6.已知X、Y、Z、M为原子序数依次增大的短周期主族元素,其中基态X原子中的电子只有一种自旋取向,Y的最高正化合价与最低负化合价之和为0,M的s能级上的电子总数与p能级相同,四种元素可构成离子液体,其化学式为Y2X5ZX3ZM3。下列说法正确的是( )
A.四种元素的原子半径:M>Y>Z>X
B.四种元素的基态原子的第一电离能:M>Z>Y>X
C.X与Y、Z、M均能形成两种或两种以上化合物
D.该离子液体常温下呈液态,属于共价化合物
7.化合物是一种新型抗生素中间体,其合成路线如下。已知化合物中虚线圈内所有原子共平面。
下列说法错误的是( )
A. K中虚线圈内碳原子和氮原子的杂化方式均为SP2
B. 形成M时,氮原子与L中碳原子b成键
C. Q的核磁共振氢谱有4组峰
D. M水解可生成CO18O
8.在给定条件下,下列物质转化关系正确的是( )
A. 海带提碘:碘的四氯化碳溶液含、溶液含的悬浊液
B. 航天器中利用萨巴蒂尔反应再生氧气:一定浓度
C. 工业制硫酸:黄铁矿
D. 海水提镁:海水溶液
9.室温下,下列实验方案能达到实验目的的是( )
选项 实验方案 实验目的
A 向溶液中先滴加几滴新制氯水,再滴加几滴KSCN溶液,观察现象 验证氧化性:
B 向溶液中,滴入2滴NaOH溶液,产生白色沉淀,再滴入2滴溶液,白色沉淀逐渐变为蓝色 证明:
C 向甲苯中滴加酸性高锰酸钾溶液,溶液褪色 甲基对苯环产生影响
D 测定溶液的pH,测得溶液
10.钼酸钠晶体(NaMoO4.2H2O)是无公害型冷却水系统的金属级蚀剂,工业上利用钼精矿(主要成分是不溶于水的MOS2,含少量PbS等)制备钼酸钠晶体的工艺如图所示。设NA为阿伏加德罗常数的值,下列相关说法正确的是( )
A.“焙烧”时,每生成1mol SO2,转移的电子数为6NA
B.“碱浸”时,发生反应的离子方程式为
C.“重结晶”的目的是得到更多、更纯的
D.该工艺中排放的气体均会造成酸雨,因此需对尾气进行回收处理
11.氨燃料电池是当前推动绿氨能源化应用的重要研究方向和热点。一种通过光:催化合成绿氨联合氨燃料电池的装置如图,在光照作用下光催化剂被激发产生电子和空穴。下列说法错误的是
A. 极电势低于极电势
B. 光催化剂表面发生反应:
C. 极的电极反应式是
D. 燃料电池中,OH-向Y电极移动
12.二氧化铈(CeO2)氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如图所示。下列相关说法错误的是( )
通入CH4后CeO2被氧化
B.CeO2中O的配位数为4
C.图示中
D.若中Ce、O最短距离为a cm,则其密度为
13.碳酸镧可用于慢性肾衰患者高磷血症的治疗。碳酸镧可由LaCl3为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[]。化学兴趣小组利用下列装置在实验室中制备碳酸镧。下列说法正确的是( )
A.装置连接顺序为a→c,b→d
B.为加快反应速率,可将甲装置中的CaCO3改为NaHCO3
C.操作时应先打开K2,一段时间后再打开K1
D.甲装置还可以用于实验室制备H2、O2、Cl2等
14.向一定浓度的溶液中滴加NaOH溶液,水溶液中含砷的各微粒分布系数(平衡时某微粒浓度占各种微粒浓度之和的分数)随pH变化如图所示,下列相关说法正确的是( )
As的基态电子排布式为[Ar]
B.
C.为强碱弱酸盐,溶液显碱性
D.当溶液pH=7时,
二、非选择题:本题共4小题,共58分。
15.(14分) 以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S5和SiO2等)为原料制备金属Sb和PbCl2的一种工艺流程如下:
已知:①“酸浸”浸出液中含有SbCl3、PbCl、AsCl3等;物质X、SbCl3、AsCl3均易水解;“酸浸”和“电解”过程无气体放出;
②25℃时,Ksp(PbSO4)=2.55×10-8,Ksp(PbCl2)=1.7×10-5。
回答下列问题:
(1)“滤渣”的成分是_____(填化学式),“酸浸”时需加过量盐酸的目的:①与辉锑矿充分反应;②_____。
(2)物质X是_____(填化学式),金属Y的作用是_____。
(3)“除砷”时氧化剂与还原剂物质的量之比为2:3,反应的化学方程式为_____。
(4)“浸取”时温度与NaCl溶液的浓度对铅浸出率和PbCl2溶解度的影响如图所示:
①浸取铅的最合适的条件是_____。
②循环浸取“沉铅”滤渣,向浸取后的溶液中加入适量BaCl2溶液处理后,加水使NaCl浓度稀释至1.5mol·L-1的目的是_____。
③25℃时,PbCl2(s)+2Cl-(aq)PbCl(aq)平衡常数为K1,浸取中反应PbSO4(s)+4Cl-(aq)PbCl(aq)+SO(aq)的平衡常数K=___(用含K1的代数式表示)。
16.(15分)二氯化二硫(S2Cl2)是一种黄色至略微红的液体,有剧毒。向熔融的硫中通入限量的氯气即可生成S2Cl2,进一步氯化则会得到SCl2。
已知:Ⅰ.S2Cl2、SCl2、S的部分性质如下:
物质 水溶性 密度/() 熔点/℃ 沸点/℃
遇水即水解生成HCl、、S 1.687 -80 135.6
遇水即水解生成HCl、、S 1.621 -78 59℃时分解
S —— —— 112.8 444.6
Ⅱ.、,为砖红色沉淀。
下列是某兴趣小组制备S2Cl2并分析其纯度的实验,回答下列问题:
(1)S2Cl2所有原子满足最外层8电子稳定结构,其电子式为 。
(2)写出S2Cl2溶于水发生反应的化学方程式: 。
(3)兴趣小组利用如下装置制备S2Cl2。
①A、B、C装置中均用到的玻璃容器的名称是 。
②C装置中发生反应的离子方程式为 。
③装置的正确连接顺序是e→j→k→h→i→ →f(按气流流出方向)
④D装置中碱石灰的作用是 。
(4)S2Cl2(所含杂质为SCl2)纯度的测定:准确称取1.35g所得产品溶于水,加入Ba(OH)2溶液调节pH至9.0左右,过滤后将滤液配成250.00mL溶液,用移液管量取25.00mL溶液放入锥形瓶中,加入几滴K2CrO4溶液,用0.10mol/L的AgNO3溶液滴定,平行滴定三次,平均消耗AgNO3溶液的体积为20.40mL。
①加入Ba(OH)2溶液调节pH至9.0左右的目的是 。
②滴定终点的判断依据是 。
③S2Cl2的纯度为 (保留三位有效数字)。
17.(14分)采用热分解法去除沼气中的过程中涉及的主要反应如下:
反应Ⅰ: ;
反应Ⅱ: 。
回答下列问题:
(1)反应的△H= 。
(2)已知反应Ⅰ的,该反应能自发进行的温度是 (填标号)。
A.600℃ B.700℃ C.800℃ D.900℃
(3)保持100kPa不变,将H2S与CH4按体积比2∶1投入密闭容器中,并通入一定量的N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。
①X所在曲线代表的是 (填化学式)的体积分数。
②Y所在曲线随温度的升高先增大后减小的原因是 。
③往容器中充入N2的目的是 。
④1050℃时,下列能说明容器中反应达到平衡状态的有 (填标号)。
A.容器的体积保持不变 B.容器内气体密度保持不变
C. D.含碳物质的总的体积分数保持不变
⑤1000℃达到平衡时,H2S的体积分数为0.25%,则该温度下达到平衡后H2S的去除率为 (保留三位有效数字,下同),反应Ⅰ压强平衡常数Kp= (用平衡分压代替平衡浓度计算,平衡分压=总压×体积分数)。
18.(15分)G是一种口服抗血小板聚集药物,其合成路线如下:
(1)G分子中氮原子的轨道杂化方式有______。
(2)的转化中,除使用外,还可以使用下列物质中的______(填字母)。
A.CH3COOH B.CH3OH C.CH3CH2ONa
(3)包括两步反应,第一步为取代反应,第二步为______反应。
(4)反应后生成两种产物,除G外,另一产物的结构简式为______。
(5)D的一种同分异构体同时满足下列条件,写出其结构简式:______。
①不能使FeCl3溶液发生显色反应,水解后可生成三种有机产物X、Y和Z;
②、均为氨基酸;
③Z能使FeCl3溶液发生显色反应,且含有3种化学环境不同的氢。
(6)已知(R表示烃基)在浓硫酸或其他酸作用下会转化为。
设计以、、为原料制取的合成路线流程图______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
高三化学答案
1 2 3 4 5 6 7 8
D A B C D C D B
9 10 11 12 13 14
B B D A A D
15.(14分)
(1) ①. S和SiO2 ②. 抑制SbCl3、AsCl3、SbCl5水解
(2) ①. SbCl5 ②. 将SbCl5还原为SbCl3
(3)2AsCl3+3NaH2PO2+3H2O=2As+3H3PO3+3NaCl+3HCl
(4) ①. 4.5mol·L-1NaCl溶液,85℃ ②. 降低PbCl2的溶解度,使PbCl2充分析出,提高Pb回收率 ③. 1.5×10-3K1
16.(15分)【答案】
(1)
(2)
(3)①圆底烧瓶
②
③c→d→a→b
④除去过量的氯气,防止环境污染;防止空气中的水蒸气进入装置A与反应(答出1点得1分,共2分)
(4)①防止pH过低,会转化为;防止pH过高,会与滴入的反应生成AgOH,均会干扰滴定(答“把溶液中完全转化为沉淀”给1分,答出1点得1分,共2分)
②当滴入最后半滴溶液时,白色沉淀中出现砖红色,且半分钟内砖红色未消失
③93.6%
17.(14分)【答案】
(1)+233.5(无“+”不扣分)
(2)D
(3)①
②950~1050℃时,以反应Ⅰ为主,随着温度升高,反应Ⅰ平衡右移程度比反应Ⅱ右移程度大,所以的体积分数会增大;1050~1150℃之间,反应Ⅱ平衡移动程度增大的幅度大于反应Ⅰ,的体积分数会减小(答出1点得1分,共2分)
③减小各组分的浓度,使平衡正向移动,提高的去除率
④ABD(2分,全对得2分,少选得1分,有错不给分)
⑤92.3%(2分,写0.923也给分) 121kPa(2分,未写单位扣1分)
18. (15分)(1)杂化和杂化
(2)
(3)加成反应
(4)
高三化学试卷
可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Ce 140
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“科技兴国,高质量发展”一直是我国建设现代化国家的重要战略方针。下列说法不正确的是( )
A.聚碳酸酯不属于新型无机非金属材料
B.丝绸富含酰胺基,具有良好的吸湿性
C.“海水中提取碘单质”的过程中涉及氧化还原反应
D.“神舟十六号”推进器使用的氧化剂是,N2H4其中N是第ⅤA族元素
2.工业上常用乙烯水化法制乙醇,下列有关化学用语表述正确的是( )
A.乙烯分子中的键电子云:
B.乙烯的结构简式:
C.水分子的VSEPR模型名称:正四面体形
D.乙醇分子中的官能团的电子式:
3. 下列操作或装置能达到实验目的的是
A. 测定硫酸铜晶体中结晶水含量,灼烧、冷却 B. 萃取分液时,振荡和放气
C. 验证酸性:乙酸>碳酸>苯酚 D. 实验室制备并检验乙烯
4.化学物质与生活生产非常密切,下列有关说法错误的是( )
A.餐后桌上残留的油渍,可用热的纯碱溶液除去
B.胃酸患者常用含NaHCO3或Al(OH)3的药物治疗
C.SO2具有漂白性,能使品红溶液及紫色石蕊溶液褪色
D.酚醛树脂既可能有热塑性,也可能有热固性
5.下列化学反应表示正确的是( )
A.碱性条件下,氧化KI的离子方程式:
B.过氧化钾与水反应:
C.燃烧热的热化学方程式:
D.制备SO2F2:
6.已知X、Y、Z、M为原子序数依次增大的短周期主族元素,其中基态X原子中的电子只有一种自旋取向,Y的最高正化合价与最低负化合价之和为0,M的s能级上的电子总数与p能级相同,四种元素可构成离子液体,其化学式为Y2X5ZX3ZM3。下列说法正确的是( )
A.四种元素的原子半径:M>Y>Z>X
B.四种元素的基态原子的第一电离能:M>Z>Y>X
C.X与Y、Z、M均能形成两种或两种以上化合物
D.该离子液体常温下呈液态,属于共价化合物
7.化合物是一种新型抗生素中间体,其合成路线如下。已知化合物中虚线圈内所有原子共平面。
下列说法错误的是( )
A. K中虚线圈内碳原子和氮原子的杂化方式均为SP2
B. 形成M时,氮原子与L中碳原子b成键
C. Q的核磁共振氢谱有4组峰
D. M水解可生成CO18O
8.在给定条件下,下列物质转化关系正确的是( )
A. 海带提碘:碘的四氯化碳溶液含、溶液含的悬浊液
B. 航天器中利用萨巴蒂尔反应再生氧气:一定浓度
C. 工业制硫酸:黄铁矿
D. 海水提镁:海水溶液
9.室温下,下列实验方案能达到实验目的的是( )
选项 实验方案 实验目的
A 向溶液中先滴加几滴新制氯水,再滴加几滴KSCN溶液,观察现象 验证氧化性:
B 向溶液中,滴入2滴NaOH溶液,产生白色沉淀,再滴入2滴溶液,白色沉淀逐渐变为蓝色 证明:
C 向甲苯中滴加酸性高锰酸钾溶液,溶液褪色 甲基对苯环产生影响
D 测定溶液的pH,测得溶液
10.钼酸钠晶体(NaMoO4.2H2O)是无公害型冷却水系统的金属级蚀剂,工业上利用钼精矿(主要成分是不溶于水的MOS2,含少量PbS等)制备钼酸钠晶体的工艺如图所示。设NA为阿伏加德罗常数的值,下列相关说法正确的是( )
A.“焙烧”时,每生成1mol SO2,转移的电子数为6NA
B.“碱浸”时,发生反应的离子方程式为
C.“重结晶”的目的是得到更多、更纯的
D.该工艺中排放的气体均会造成酸雨,因此需对尾气进行回收处理
11.氨燃料电池是当前推动绿氨能源化应用的重要研究方向和热点。一种通过光:催化合成绿氨联合氨燃料电池的装置如图,在光照作用下光催化剂被激发产生电子和空穴。下列说法错误的是
A. 极电势低于极电势
B. 光催化剂表面发生反应:
C. 极的电极反应式是
D. 燃料电池中,OH-向Y电极移动
12.二氧化铈(CeO2)氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如图所示。下列相关说法错误的是( )
通入CH4后CeO2被氧化
B.CeO2中O的配位数为4
C.图示中
D.若中Ce、O最短距离为a cm,则其密度为
13.碳酸镧可用于慢性肾衰患者高磷血症的治疗。碳酸镧可由LaCl3为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[]。化学兴趣小组利用下列装置在实验室中制备碳酸镧。下列说法正确的是( )
A.装置连接顺序为a→c,b→d
B.为加快反应速率,可将甲装置中的CaCO3改为NaHCO3
C.操作时应先打开K2,一段时间后再打开K1
D.甲装置还可以用于实验室制备H2、O2、Cl2等
14.向一定浓度的溶液中滴加NaOH溶液,水溶液中含砷的各微粒分布系数(平衡时某微粒浓度占各种微粒浓度之和的分数)随pH变化如图所示,下列相关说法正确的是( )
As的基态电子排布式为[Ar]
B.
C.为强碱弱酸盐,溶液显碱性
D.当溶液pH=7时,
二、非选择题:本题共4小题,共58分。
15.(14分) 以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S5和SiO2等)为原料制备金属Sb和PbCl2的一种工艺流程如下:
已知:①“酸浸”浸出液中含有SbCl3、PbCl、AsCl3等;物质X、SbCl3、AsCl3均易水解;“酸浸”和“电解”过程无气体放出;
②25℃时,Ksp(PbSO4)=2.55×10-8,Ksp(PbCl2)=1.7×10-5。
回答下列问题:
(1)“滤渣”的成分是_____(填化学式),“酸浸”时需加过量盐酸的目的:①与辉锑矿充分反应;②_____。
(2)物质X是_____(填化学式),金属Y的作用是_____。
(3)“除砷”时氧化剂与还原剂物质的量之比为2:3,反应的化学方程式为_____。
(4)“浸取”时温度与NaCl溶液的浓度对铅浸出率和PbCl2溶解度的影响如图所示:
①浸取铅的最合适的条件是_____。
②循环浸取“沉铅”滤渣,向浸取后的溶液中加入适量BaCl2溶液处理后,加水使NaCl浓度稀释至1.5mol·L-1的目的是_____。
③25℃时,PbCl2(s)+2Cl-(aq)PbCl(aq)平衡常数为K1,浸取中反应PbSO4(s)+4Cl-(aq)PbCl(aq)+SO(aq)的平衡常数K=___(用含K1的代数式表示)。
16.(15分)二氯化二硫(S2Cl2)是一种黄色至略微红的液体,有剧毒。向熔融的硫中通入限量的氯气即可生成S2Cl2,进一步氯化则会得到SCl2。
已知:Ⅰ.S2Cl2、SCl2、S的部分性质如下:
物质 水溶性 密度/() 熔点/℃ 沸点/℃
遇水即水解生成HCl、、S 1.687 -80 135.6
遇水即水解生成HCl、、S 1.621 -78 59℃时分解
S —— —— 112.8 444.6
Ⅱ.、,为砖红色沉淀。
下列是某兴趣小组制备S2Cl2并分析其纯度的实验,回答下列问题:
(1)S2Cl2所有原子满足最外层8电子稳定结构,其电子式为 。
(2)写出S2Cl2溶于水发生反应的化学方程式: 。
(3)兴趣小组利用如下装置制备S2Cl2。
①A、B、C装置中均用到的玻璃容器的名称是 。
②C装置中发生反应的离子方程式为 。
③装置的正确连接顺序是e→j→k→h→i→ →f(按气流流出方向)
④D装置中碱石灰的作用是 。
(4)S2Cl2(所含杂质为SCl2)纯度的测定:准确称取1.35g所得产品溶于水,加入Ba(OH)2溶液调节pH至9.0左右,过滤后将滤液配成250.00mL溶液,用移液管量取25.00mL溶液放入锥形瓶中,加入几滴K2CrO4溶液,用0.10mol/L的AgNO3溶液滴定,平行滴定三次,平均消耗AgNO3溶液的体积为20.40mL。
①加入Ba(OH)2溶液调节pH至9.0左右的目的是 。
②滴定终点的判断依据是 。
③S2Cl2的纯度为 (保留三位有效数字)。
17.(14分)采用热分解法去除沼气中的过程中涉及的主要反应如下:
反应Ⅰ: ;
反应Ⅱ: 。
回答下列问题:
(1)反应的△H= 。
(2)已知反应Ⅰ的,该反应能自发进行的温度是 (填标号)。
A.600℃ B.700℃ C.800℃ D.900℃
(3)保持100kPa不变,将H2S与CH4按体积比2∶1投入密闭容器中,并通入一定量的N2稀释,在不同温度下反应达到平衡时,所得H2、S2与CS2的体积分数如图所示。
①X所在曲线代表的是 (填化学式)的体积分数。
②Y所在曲线随温度的升高先增大后减小的原因是 。
③往容器中充入N2的目的是 。
④1050℃时,下列能说明容器中反应达到平衡状态的有 (填标号)。
A.容器的体积保持不变 B.容器内气体密度保持不变
C. D.含碳物质的总的体积分数保持不变
⑤1000℃达到平衡时,H2S的体积分数为0.25%,则该温度下达到平衡后H2S的去除率为 (保留三位有效数字,下同),反应Ⅰ压强平衡常数Kp= (用平衡分压代替平衡浓度计算,平衡分压=总压×体积分数)。
18.(15分)G是一种口服抗血小板聚集药物,其合成路线如下:
(1)G分子中氮原子的轨道杂化方式有______。
(2)的转化中,除使用外,还可以使用下列物质中的______(填字母)。
A.CH3COOH B.CH3OH C.CH3CH2ONa
(3)包括两步反应,第一步为取代反应,第二步为______反应。
(4)反应后生成两种产物,除G外,另一产物的结构简式为______。
(5)D的一种同分异构体同时满足下列条件,写出其结构简式:______。
①不能使FeCl3溶液发生显色反应,水解后可生成三种有机产物X、Y和Z;
②、均为氨基酸;
③Z能使FeCl3溶液发生显色反应,且含有3种化学环境不同的氢。
(6)已知(R表示烃基)在浓硫酸或其他酸作用下会转化为。
设计以、、为原料制取的合成路线流程图______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
高三化学答案
1 2 3 4 5 6 7 8
D A B C D C D B
9 10 11 12 13 14
B B D A A D
15.(14分)
(1) ①. S和SiO2 ②. 抑制SbCl3、AsCl3、SbCl5水解
(2) ①. SbCl5 ②. 将SbCl5还原为SbCl3
(3)2AsCl3+3NaH2PO2+3H2O=2As+3H3PO3+3NaCl+3HCl
(4) ①. 4.5mol·L-1NaCl溶液,85℃ ②. 降低PbCl2的溶解度,使PbCl2充分析出,提高Pb回收率 ③. 1.5×10-3K1
16.(15分)【答案】
(1)
(2)
(3)①圆底烧瓶
②
③c→d→a→b
④除去过量的氯气,防止环境污染;防止空气中的水蒸气进入装置A与反应(答出1点得1分,共2分)
(4)①防止pH过低,会转化为;防止pH过高,会与滴入的反应生成AgOH,均会干扰滴定(答“把溶液中完全转化为沉淀”给1分,答出1点得1分,共2分)
②当滴入最后半滴溶液时,白色沉淀中出现砖红色,且半分钟内砖红色未消失
③93.6%
17.(14分)【答案】
(1)+233.5(无“+”不扣分)
(2)D
(3)①
②950~1050℃时,以反应Ⅰ为主,随着温度升高,反应Ⅰ平衡右移程度比反应Ⅱ右移程度大,所以的体积分数会增大;1050~1150℃之间,反应Ⅱ平衡移动程度增大的幅度大于反应Ⅰ,的体积分数会减小(答出1点得1分,共2分)
③减小各组分的浓度,使平衡正向移动,提高的去除率
④ABD(2分,全对得2分,少选得1分,有错不给分)
⑤92.3%(2分,写0.923也给分) 121kPa(2分,未写单位扣1分)
18. (15分)(1)杂化和杂化
(2)
(3)加成反应
(4)
同课章节目录
