人教版高中化学必修第二册第六章化学反应与能量阶段重点突破练(三)课件(共22张PPT)
文档属性
| 名称 | 人教版高中化学必修第二册第六章化学反应与能量阶段重点突破练(三)课件(共22张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 09:45:32 | ||
图片预览








文档简介
(共22张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
阶段重点突破练(三)
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 煤燃烧时,化学能主要转化为热能
D. 白炽灯工作时,电能全部转化为光能
D
A. “中华有为”——华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B. 根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C. 等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D. 原电池中的电极一定要由两种不同的金属组成
C
解析:华为Mate系列手机采用的超大容量高密度电池是可充电可放电的电池,是二次 电池,故A错误;反应过程中有能量变化,根据能量守恒定律可知,反应物总能量和 生成物总能量不等,如果正反应为放热反应,则反应物总能量大于生成物总能量,如 果正反应为吸热反应,则反应物总能量小于生成物总能量,故B错误;生成物相同, 反应物中气态S比固态S能量高,且为放热反应,则硫蒸气反应放出热量多,故C正 确;原电池中的电极可能由可导电的非金属和金属组成,如Zn、石墨和稀硫酸构成的 原电池,故D错误。
A. 该反应为吸热反应
B. 该图可以表示Zn与HCl溶液反应的能量变化
C. 该反应先发生物质变化后发生能量变化
D. 断开反应物中化学键吸收的能量大于形成生成物中化学键 放出的能量
B
A. Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B. 当盐酸和氢氧化钠反应时,会放出热量
C. 化学反应过程实际上就是原子或原子团的重新组合的过程
解析:Ba(OH)2·8H2O晶体与氯化铵反应时吸热,A正确;酸和碱的中和反应为放 热反应,B正确;化学反应前后原子种类和数目不发生改变,但有新的物质生成,实 际上就是原子或原子团重新组合的过程,C正确;该反应中元素种类发生改变,不是 化学变化,D错误。
D
A. CO(g)与H2(g)反应生成1 mol CH3OH(g)释放出91 kJ的能量
B. 用碳制备原料气CO、H2的反应属于放热反应
C. 反应物的总键能高于生成物的总键能
D. 若该反应生成液态CH3OH,则放出的能量更少
A
解析:由题图可知,生成1 mol CH3OH(g)放出510 kJ-419 kJ=91 kJ的能量,A项 正确;碳与水蒸气反应制备CO和H2的反应属于吸热反应,B项错误;该反应是放热反 应,则反应物的总键能低于生成物的总键能,C项错误;同种物质气态时比液态时的 能量高,如果生成液态CH3OH,则放出的能量更多,D项错误。
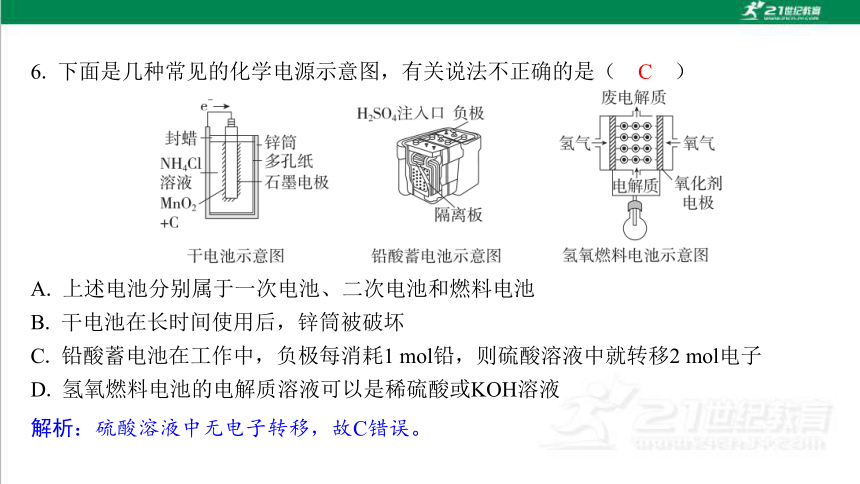
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅酸蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移2 mol电子
D. 氢氧燃料电池的电解质溶液可以是稀硫酸或KOH溶液
C
解析:硫酸溶液中无电子转移,故C错误。
A. Fe极作正极
B. KOH溶液为电池的电解质溶液
C. 电子由多孔碳极沿导线流向Fe极
D. 5.6 g Fe参与反应时,导线中流过1.204×1023个电子
B
B. 电子从Na极经导线到Ni极,再经电解质溶液回到Na极
D. 放电时,Na极发生氧化反应
B
9. (2024·三明高一期中)能源与人类的生存和发展息息相关,化学反应在人类利用 能源的历史过程中充当重要的角色。
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:
X
15.2
银(或金或石墨棒等)
FeCl3(或Fe2(SO4)3等)
Cu-2e-
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图 是氢-氧燃料电池的装置图,则:
氧化
增大
10. H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意 图。请回答下列问题。
解析:(1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的 过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。
吸收
放出
解析:(2)由图可知,H2和F2生成HF的ΔH为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A 正确。
A
解析:(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
化学
热
解析:(1)高铁电池放电时为原电池,负极发生氧化反应,正极发生还原反应。总 反应式减去正极反应式得负极反应式,正极生成OH-,故正极附近溶液碱性增强。
Zn
还原
Zn+2OH——2e-
正
(2)锂锰电池的结构示意图如图,其中电解质LiClO4溶于混合有机溶剂中,Li+通过 电解质转移到MnO2晶格中生成LiMnO2。
b
a
MnO2
否
电极Li是活泼金属,能与水反应
第六章 化学反应与能量
第一节 化学反应与能量变化
阶段重点突破练(三)
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 煤燃烧时,化学能主要转化为热能
D. 白炽灯工作时,电能全部转化为光能
D
A. “中华有为”——华为Mate系列手机采用的超大容量高密度电池是一种一次电池
B. 根据能量守恒定律,化学反应中反应物的总能量等于生成物的总能量
C. 等质量的硫蒸气和硫粉分别与氧气反应生成SO2气体,硫蒸气放出的热量多
D. 原电池中的电极一定要由两种不同的金属组成
C
解析:华为Mate系列手机采用的超大容量高密度电池是可充电可放电的电池,是二次 电池,故A错误;反应过程中有能量变化,根据能量守恒定律可知,反应物总能量和 生成物总能量不等,如果正反应为放热反应,则反应物总能量大于生成物总能量,如 果正反应为吸热反应,则反应物总能量小于生成物总能量,故B错误;生成物相同, 反应物中气态S比固态S能量高,且为放热反应,则硫蒸气反应放出热量多,故C正 确;原电池中的电极可能由可导电的非金属和金属组成,如Zn、石墨和稀硫酸构成的 原电池,故D错误。
A. 该反应为吸热反应
B. 该图可以表示Zn与HCl溶液反应的能量变化
C. 该反应先发生物质变化后发生能量变化
D. 断开反应物中化学键吸收的能量大于形成生成物中化学键 放出的能量
B
A. Ba(OH)2·8H2O晶体与NH4Cl固体的反应属于吸热反应
B. 当盐酸和氢氧化钠反应时,会放出热量
C. 化学反应过程实际上就是原子或原子团的重新组合的过程
解析:Ba(OH)2·8H2O晶体与氯化铵反应时吸热,A正确;酸和碱的中和反应为放 热反应,B正确;化学反应前后原子种类和数目不发生改变,但有新的物质生成,实 际上就是原子或原子团重新组合的过程,C正确;该反应中元素种类发生改变,不是 化学变化,D错误。
D
A. CO(g)与H2(g)反应生成1 mol CH3OH(g)释放出91 kJ的能量
B. 用碳制备原料气CO、H2的反应属于放热反应
C. 反应物的总键能高于生成物的总键能
D. 若该反应生成液态CH3OH,则放出的能量更少
A
解析:由题图可知,生成1 mol CH3OH(g)放出510 kJ-419 kJ=91 kJ的能量,A项 正确;碳与水蒸气反应制备CO和H2的反应属于吸热反应,B项错误;该反应是放热反 应,则反应物的总键能低于生成物的总键能,C项错误;同种物质气态时比液态时的 能量高,如果生成液态CH3OH,则放出的能量更多,D项错误。
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 铅酸蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移2 mol电子
D. 氢氧燃料电池的电解质溶液可以是稀硫酸或KOH溶液
C
解析:硫酸溶液中无电子转移,故C错误。
A. Fe极作正极
B. KOH溶液为电池的电解质溶液
C. 电子由多孔碳极沿导线流向Fe极
D. 5.6 g Fe参与反应时,导线中流过1.204×1023个电子
B
B. 电子从Na极经导线到Ni极,再经电解质溶液回到Na极
D. 放电时,Na极发生氧化反应
B
9. (2024·三明高一期中)能源与人类的生存和发展息息相关,化学反应在人类利用 能源的历史过程中充当重要的角色。
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:
X
15.2
银(或金或石墨棒等)
FeCl3(或Fe2(SO4)3等)
Cu-2e-
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图 是氢-氧燃料电池的装置图,则:
氧化
增大
10. H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意 图。请回答下列问题。
解析:(1)断开化学键吸收能量,形成化学键释放能量。转化Ⅰ、Ⅱ是断开化学键的 过程,吸收能量;转化Ⅲ是形成化学键的过程,放出能量。
吸收
放出
解析:(2)由图可知,H2和F2生成HF的ΔH为154 kJ·mol-1+436 kJ·mol-1-2×565 kJ·mol-1=-540 kJ·mol-1,是放热反应,则反应物的总能量大于生成物的总能量,A 正确。
A
解析:(3)氢气在氧气中燃烧是放热反应,主要是化学能转化为热能的过程。
化学
热
解析:(1)高铁电池放电时为原电池,负极发生氧化反应,正极发生还原反应。总 反应式减去正极反应式得负极反应式,正极生成OH-,故正极附近溶液碱性增强。
Zn
还原
Zn+2OH——2e-
正
(2)锂锰电池的结构示意图如图,其中电解质LiClO4溶于混合有机溶剂中,Li+通过 电解质转移到MnO2晶格中生成LiMnO2。
b
a
MnO2
否
电极Li是活泼金属,能与水反应
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
