人教版高中化学必修第二册第五章化工生产中的重要非金属元素阶段重点突破练(二)课件(共26张PPT)
文档属性
| 名称 | 人教版高中化学必修第二册第五章化工生产中的重要非金属元素阶段重点突破练(二)课件(共26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 09:57:54 | ||
图片预览








文档简介
(共26张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
阶段重点突破练(二)
A. 氨水 B. 硝酸 C. 醋 D. 卤水
B
选 项 操作和现象 结论和解释
A 铜丝溶解于稀HNO3中,生成无色气体 金属能与强酸反应置换出氢气
B NH3能与热的氧化铜反应产生红色物质 NH3有还原性
C N2与H2混合加热不反应 N的非金属性弱
D NO2被NaOH溶液吸收 NO2是酸性氧化物
B
A. 酸雨是指pH<7的降水,酸雨长时间放置,酸性变强
B. 用排空气法收集NO
C. SO2、Na2O2都能使品红溶液褪色,原理相同
D. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
解析:酸雨是指pH<5.6的降水,A错误;NO易被氧气氧化为NO2,不能用排空气法 收集NO,B错误;SO2、Na2O2都能使品红溶液褪色,原理不同,前者是化合作用, 后者是氧化作用,C错误;浓硝酸不稳定,见光易分解生成二氧化氮、氧气和水,二 氧化氮溶于硝酸而使硝酸显黄色,D正确。
D
A. N2化学性质稳定,可用作保护气
B. NO、NO2均为大气污染气体,在大气中可稳定存在
C. NO、NO2均易溶于水
D. NO、NO2均能与水发生反应
解析:氮气的化学性质稳定,因此可作为大多数物质的保护气,A项正确;一氧化氮 会与氧气反应,因此不能在空气中稳定存在,B项错误;一氧化氮难溶于水,C项错 误;一氧化氮不与水发生反应,D项错误。
A
A. X是N2O5
B. 可用排水法收集NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 从原理上看,NH3可与NO2反应实现NH3→N2的转化
B
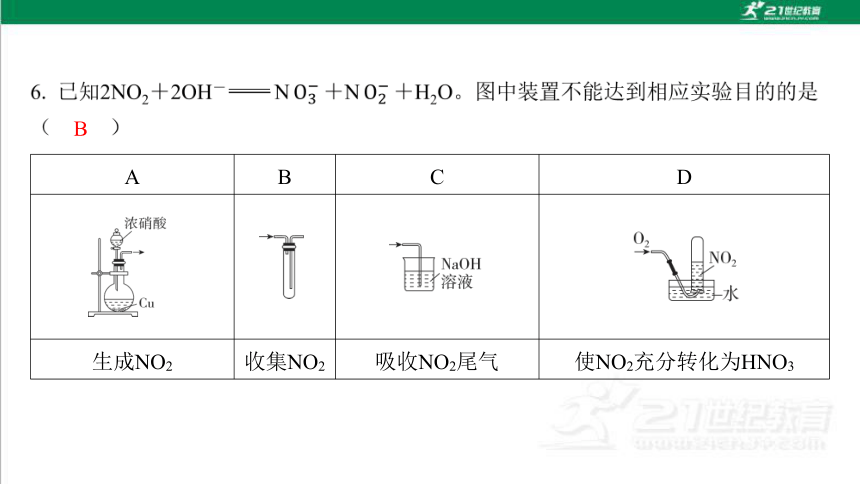
A B C D
生成NO2 收集NO2 吸收NO2尾气 使NO2充分转化为HNO3
B
C
8. (2024·德化联考)氮及其化合物的价-类二维图如图所示。
D
A. 可加热氯化铵固体制取X
B. 从物质类别角度分析,P和Z都属于酸性氧化物
C. X转化为Q的过程属于氮的固定
D. 浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
解析:根据化合价以及所属物质类别可知,X为NH3,Q为NO,Z为NO2,P为N2O5, Y为HNO3,W为NH3·H2O。直接加热氯化铵固体分解生成的HCl又会和氨气反应生成 氯化铵,需加热氯化铵和氢氧化钙的混合物制取NH3,A错误;Z为NO2,NO2与碱发 生氧化还原反应生成两种盐,故NO2不是酸性氧化物,B错误;氮的固定是指将游离 态的氮转化为化合态,X转化为Q的过程是一种化合态的氮转化为另一种化合态,不 属于氮的固定,C错误;浓硝酸见光易分解,需保存在棕色试剂瓶中,并置于冷暗 处,D正确。
序号 实验操作 现象 解释或结论
① 将过量的Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
② 浓HNO3久置或光照 变黄色 HNO3不稳定易分解
③ 铝箔插入稀HNO3中 无现象 铝箔表面被HNO3氧化,形 成致密的氧化膜
④ 用玻璃棒蘸取浓HNO3点到蓝色石蕊试纸上 试纸先变红 色后褪色 浓HNO3具有酸性和强氧化 性
D
A. ①② B. ③④ C. ②③④ D. ②④
解析:将过量的铁粉加入稀HNO3中,生成Fe2+,加入KSCN溶液时,颜色不变,故 ①错;浓HNO3久置变黄是因为HNO3分解产生的NO2溶于浓HNO3所致,故②正确; 铝箔遇浓HNO3钝化,遇稀HNO3会溶解,故③错;浓HNO3具有酸性和强氧化性;可 使蓝色石蕊试纸先变红色后褪色,故④正确。
A. ① B. ①⑤ C. ②④⑤ D. ①②③⑤
B
A. 生成的气体在标准状况下的体积为4.48 L
B. 生成的气体在标准状况下的体积为2.24 L
C. 被还原的硝酸的物质的量为(0.2-a)mol
C
回答下列问题:
将NO2转化为NO
解析:(3)B中出来的NO气体中可能会混有CO2、水蒸气,分别与Na2O2反应生成 Na2CO3、NaOH,所以C中生成的固体除NaNO2外,还可能生成Na2CO3、NaOH;为 避免杂质的生成,可以在B、C之间加一个干燥管(或U型管),所盛放的试剂应该为 碱石灰,用于吸收混合气体中的CO2和水蒸气。
Na2CO3、NaOH
干燥管(或U型管)、碱石灰
13. Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用 NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
A
d
c
f
e
i
浓硫酸
排尽装置中的空气,避免NO被氧化
液化亚硝酰氯,便于收集产品
在装置丁和戊之间增加
一个气体干燥装置
NaNO2+H2O
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
阶段重点突破练(二)
A. 氨水 B. 硝酸 C. 醋 D. 卤水
B
选 项 操作和现象 结论和解释
A 铜丝溶解于稀HNO3中,生成无色气体 金属能与强酸反应置换出氢气
B NH3能与热的氧化铜反应产生红色物质 NH3有还原性
C N2与H2混合加热不反应 N的非金属性弱
D NO2被NaOH溶液吸收 NO2是酸性氧化物
B
A. 酸雨是指pH<7的降水,酸雨长时间放置,酸性变强
B. 用排空气法收集NO
C. SO2、Na2O2都能使品红溶液褪色,原理相同
D. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
解析:酸雨是指pH<5.6的降水,A错误;NO易被氧气氧化为NO2,不能用排空气法 收集NO,B错误;SO2、Na2O2都能使品红溶液褪色,原理不同,前者是化合作用, 后者是氧化作用,C错误;浓硝酸不稳定,见光易分解生成二氧化氮、氧气和水,二 氧化氮溶于硝酸而使硝酸显黄色,D正确。
D
A. N2化学性质稳定,可用作保护气
B. NO、NO2均为大气污染气体,在大气中可稳定存在
C. NO、NO2均易溶于水
D. NO、NO2均能与水发生反应
解析:氮气的化学性质稳定,因此可作为大多数物质的保护气,A项正确;一氧化氮 会与氧气反应,因此不能在空气中稳定存在,B项错误;一氧化氮难溶于水,C项错 误;一氧化氮不与水发生反应,D项错误。
A
A. X是N2O5
B. 可用排水法收集NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 从原理上看,NH3可与NO2反应实现NH3→N2的转化
B
A B C D
生成NO2 收集NO2 吸收NO2尾气 使NO2充分转化为HNO3
B
C
8. (2024·德化联考)氮及其化合物的价-类二维图如图所示。
D
A. 可加热氯化铵固体制取X
B. 从物质类别角度分析,P和Z都属于酸性氧化物
C. X转化为Q的过程属于氮的固定
D. 浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
解析:根据化合价以及所属物质类别可知,X为NH3,Q为NO,Z为NO2,P为N2O5, Y为HNO3,W为NH3·H2O。直接加热氯化铵固体分解生成的HCl又会和氨气反应生成 氯化铵,需加热氯化铵和氢氧化钙的混合物制取NH3,A错误;Z为NO2,NO2与碱发 生氧化还原反应生成两种盐,故NO2不是酸性氧化物,B错误;氮的固定是指将游离 态的氮转化为化合态,X转化为Q的过程是一种化合态的氮转化为另一种化合态,不 属于氮的固定,C错误;浓硝酸见光易分解,需保存在棕色试剂瓶中,并置于冷暗 处,D正确。
序号 实验操作 现象 解释或结论
① 将过量的Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
② 浓HNO3久置或光照 变黄色 HNO3不稳定易分解
③ 铝箔插入稀HNO3中 无现象 铝箔表面被HNO3氧化,形 成致密的氧化膜
④ 用玻璃棒蘸取浓HNO3点到蓝色石蕊试纸上 试纸先变红 色后褪色 浓HNO3具有酸性和强氧化 性
D
A. ①② B. ③④ C. ②③④ D. ②④
解析:将过量的铁粉加入稀HNO3中,生成Fe2+,加入KSCN溶液时,颜色不变,故 ①错;浓HNO3久置变黄是因为HNO3分解产生的NO2溶于浓HNO3所致,故②正确; 铝箔遇浓HNO3钝化,遇稀HNO3会溶解,故③错;浓HNO3具有酸性和强氧化性;可 使蓝色石蕊试纸先变红色后褪色,故④正确。
A. ① B. ①⑤ C. ②④⑤ D. ①②③⑤
B
A. 生成的气体在标准状况下的体积为4.48 L
B. 生成的气体在标准状况下的体积为2.24 L
C. 被还原的硝酸的物质的量为(0.2-a)mol
C
回答下列问题:
将NO2转化为NO
解析:(3)B中出来的NO气体中可能会混有CO2、水蒸气,分别与Na2O2反应生成 Na2CO3、NaOH,所以C中生成的固体除NaNO2外,还可能生成Na2CO3、NaOH;为 避免杂质的生成,可以在B、C之间加一个干燥管(或U型管),所盛放的试剂应该为 碱石灰,用于吸收混合气体中的CO2和水蒸气。
Na2CO3、NaOH
干燥管(或U型管)、碱石灰
13. Ⅰ.氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用 NH3将NOx还原生成N2。某同学在实验室中制备NH3,回答下列问题:
A
d
c
f
e
i
浓硫酸
排尽装置中的空气,避免NO被氧化
液化亚硝酰氯,便于收集产品
在装置丁和戊之间增加
一个气体干燥装置
NaNO2+H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
