人教版高中化学必修第二册第六章化学反应与能量第二节化学反应的速率与限度实验活动6化学能转化成电能课件(共14张PPT)
文档属性
| 名称 | 人教版高中化学必修第二册第六章化学反应与能量第二节化学反应的速率与限度实验活动6化学能转化成电能课件(共14张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 958.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 10:04:06 | ||
图片预览






文档简介
(共14张PPT)
第六章 化学反应与能量
第二节 化学反应的速率与限度
实验活动6 化学能转化成电能
[实验目的]
1. 理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2. 认识原电池的构成要素及其作用。
[实验用品]
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
[实验步骤]
1. 电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指 针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
电极材料 电流表指针是
否发生偏转 解释
锌片、铜片 否 没有 电解质 溶液,不能发生原电池反应
锌片、石墨棒 否
否
电解质
否
(2)按如图所示的装置实验,记录实验现象并解释原因。
实验 装置 实验现象 解释
锌片 溶解 ,表面产 生 无色气泡 锌的还原性比H2 强 ,溶液中的 H+ 直接 得到Zn失去的电子生成 H2
①锌片 溶解 ,表面产 生 无色气泡 ;
②铜片 表面无明显现 铜的还原性比H2 弱 , 不能 置换出H2,H +在锌片表面被 还原 成 H2
溶解
无色气泡
强
H+
H2
溶解
无色气泡
表面无明显现象
弱
不能
还原
H2
实验 装置 实验现象 解释
①锌片 溶解 ,表面产 生 无色气泡 ;
②石墨棒 表面无明显现 象 石墨为惰性材料,不能置换出H2,H+在锌片表 面被 还原 成 H2
溶解
无色气泡
表面无明显现
象
还原
H2
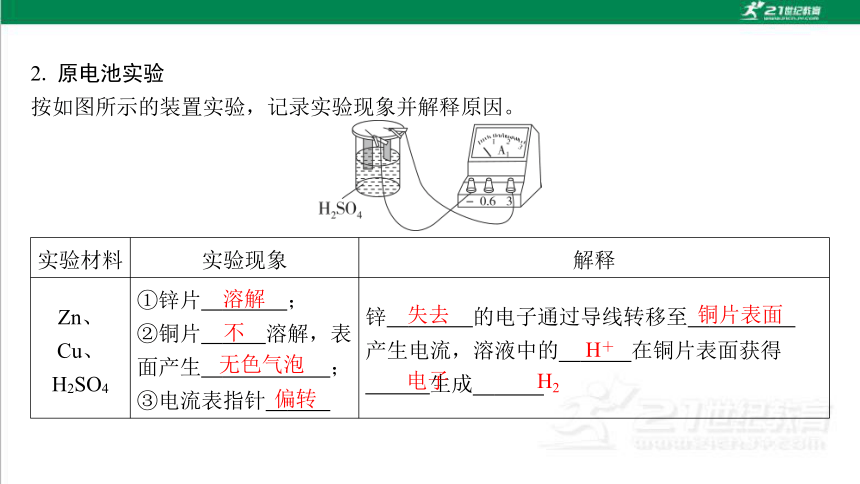
2. 原电池实验
按如图所示的装置实验,记录实验现象并解释原因。
实验材料 实验现象 解释
Zn、 Cu、
H2SO4 ①锌片 溶解 ;
②铜片 不 溶解,表 面产生 无色气泡 ;
③电流表指针 偏转 锌 失去 的电子通过导线转移至 铜片表面 产生电流,溶液中的 H+ 在铜片表面获得 电子 生成 H 2
溶解
不
无色气泡
偏转
失去
铜片表面
H+
电子
H2
实验材 料 实验现象 解释
Zn、石 墨、
H2SO4 ①锌片 溶解 ;
②石墨棒表面产生 无 色气泡 ;
③电流表指针 偏 转 锌 失去 的电子通过导线转移至 石墨棒表 面 产生电流,溶液中的 H+ 在石墨棒表面 获得 电子 生成 H 2
Cu、石 墨、
H2SO4 铜片 不溶解 ,电流 表指针 不 偏转 铜的还原性比 H2 弱, 不能 发生氧化还原 反应, 没有 电子转移,因而不能产生电流
溶解
无
色气泡
偏转
失去
石墨棒表
面
H+
电子
H2
不溶解
不偏转
H2
不能
没有
[问题和讨论]
1. 根据以上实验,说明原电池的工作原理和构成要素。
提示:(1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液 中的阳离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。②装置条件:a.活动性不 同的电极,b.电解质溶液,c.形成闭合回路。
2. 指出原电池实验中铜锌原电池的正、负极电极的材料,并写出电极反应和电池总 反应。
3. 能否用铁片作为电极代替铜锌原电池中的锌片?为什么?若能产生电流,写出电 极反应和电池总反应。
提示:可以,铁片代替锌片后,铁能够与稀硫酸反应,仍然具备构成原电池的条件, 仍然有电流产生。
4. 组装原电池时的操作应注意哪些问题?
提示:①电极材料活动性不同,且至少有一极能与电解质溶液发生氧化还原反应;② 电极可用导线连接或直接接触。
即时 练习
1. 用导线将电流表分别与铜、石墨相连,插入到FeCl3溶液中,请回答下列问题:
Cu
氧化
铜片逐渐溶解
石墨
正
Cu
氧化反应
石墨棒(或Ag、铂、金等,任选一种)
还原
反应
硝酸银溶液
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1), 测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕 色气体产生。
NO2↑+H2O
正极
Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
第六章 化学反应与能量
第二节 化学反应的速率与限度
实验活动6 化学能转化成电能
[实验目的]
1. 理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2. 认识原电池的构成要素及其作用。
[实验用品]
烧杯、导线、电流表。
锌片、铜片、石墨棒、稀硫酸。
[实验步骤]
1. 电极材料的实验
(1)用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指 针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
电极材料 电流表指针是
否发生偏转 解释
锌片、铜片 否 没有 电解质 溶液,不能发生原电池反应
锌片、石墨棒 否
否
电解质
否
(2)按如图所示的装置实验,记录实验现象并解释原因。
实验 装置 实验现象 解释
锌片 溶解 ,表面产 生 无色气泡 锌的还原性比H2 强 ,溶液中的 H+ 直接 得到Zn失去的电子生成 H2
①锌片 溶解 ,表面产 生 无色气泡 ;
②铜片 表面无明显现 铜的还原性比H2 弱 , 不能 置换出H2,H +在锌片表面被 还原 成 H2
溶解
无色气泡
强
H+
H2
溶解
无色气泡
表面无明显现象
弱
不能
还原
H2
实验 装置 实验现象 解释
①锌片 溶解 ,表面产 生 无色气泡 ;
②石墨棒 表面无明显现 象 石墨为惰性材料,不能置换出H2,H+在锌片表 面被 还原 成 H2
溶解
无色气泡
表面无明显现
象
还原
H2
2. 原电池实验
按如图所示的装置实验,记录实验现象并解释原因。
实验材料 实验现象 解释
Zn、 Cu、
H2SO4 ①锌片 溶解 ;
②铜片 不 溶解,表 面产生 无色气泡 ;
③电流表指针 偏转 锌 失去 的电子通过导线转移至 铜片表面 产生电流,溶液中的 H+ 在铜片表面获得 电子 生成 H 2
溶解
不
无色气泡
偏转
失去
铜片表面
H+
电子
H2
实验材 料 实验现象 解释
Zn、石 墨、
H2SO4 ①锌片 溶解 ;
②石墨棒表面产生 无 色气泡 ;
③电流表指针 偏 转 锌 失去 的电子通过导线转移至 石墨棒表 面 产生电流,溶液中的 H+ 在石墨棒表面 获得 电子 生成 H 2
Cu、石 墨、
H2SO4 铜片 不溶解 ,电流 表指针 不 偏转 铜的还原性比 H2 弱, 不能 发生氧化还原 反应, 没有 电子转移,因而不能产生电流
溶解
无
色气泡
偏转
失去
石墨棒表
面
H+
电子
H2
不溶解
不偏转
H2
不能
没有
[问题和讨论]
1. 根据以上实验,说明原电池的工作原理和构成要素。
提示:(1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液 中的阳离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。②装置条件:a.活动性不 同的电极,b.电解质溶液,c.形成闭合回路。
2. 指出原电池实验中铜锌原电池的正、负极电极的材料,并写出电极反应和电池总 反应。
3. 能否用铁片作为电极代替铜锌原电池中的锌片?为什么?若能产生电流,写出电 极反应和电池总反应。
提示:可以,铁片代替锌片后,铁能够与稀硫酸反应,仍然具备构成原电池的条件, 仍然有电流产生。
4. 组装原电池时的操作应注意哪些问题?
提示:①电极材料活动性不同,且至少有一极能与电解质溶液发生氧化还原反应;② 电极可用导线连接或直接接触。
即时 练习
1. 用导线将电流表分别与铜、石墨相连,插入到FeCl3溶液中,请回答下列问题:
Cu
氧化
铜片逐渐溶解
石墨
正
Cu
氧化反应
石墨棒(或Ag、铂、金等,任选一种)
还原
反应
硝酸银溶液
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1), 测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕 色气体产生。
NO2↑+H2O
正极
Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
