人教版高中化学必修第二册第五章化工生产中的重要非金属元素第一节硫及其化合物第1课时硫和二氧化硫课件
文档属性
| 名称 | 人教版高中化学必修第二册第五章化工生产中的重要非金属元素第一节硫及其化合物第1课时硫和二氧化硫课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 9.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 10:38:56 | ||
图片预览











文档简介
(共57张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫和二氧化硫
学习目标:1.了解硫的性质和用途。2.掌握SO2的化学性质及检验方法。学会设计实 验验证SO2的还原性及漂白性。3.了解SO3的主要性质。
第*页
研习任务一 硫
教材 认知
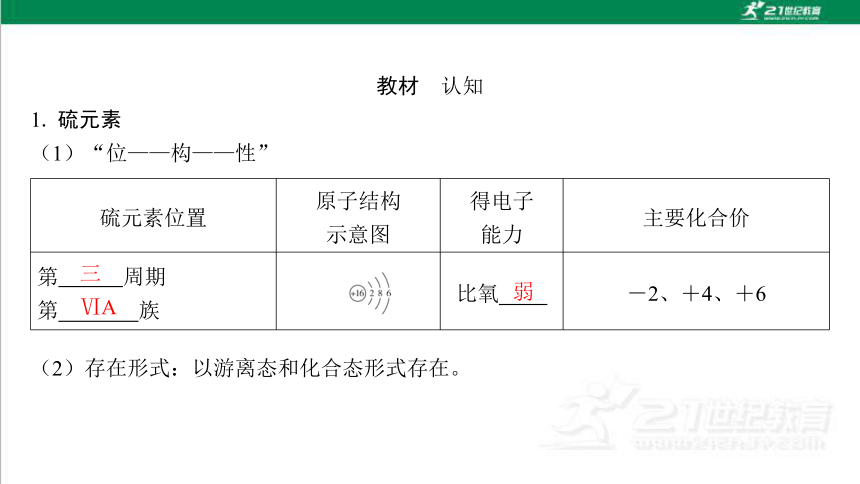
1. 硫元素
(1)“位——构——性”
硫元素位置 原子结构
示意图 得电子
能力 主要化合价
第 三 周期
第 ⅥA 族 比氧弱 。 -2、+4、+6
(2)存在形式:以游离态和化合态形式存在。
三
ⅥA
弱
2. 硫单质
(1)物理性质
俗称 颜色状态 溶解性
水 酒精 CS2
硫黄 黄色 晶体 难溶 微溶 易溶
硫黄
黄色
微溶
易溶
(2)从化合价的角度认识硫单质的化学性质
①硫与金属的反应:
氧化
②硫与非金属的反应:
还原
[思考1] 从硫元素价态变化的角度分析,硫单质有哪些化学性质?
提示:硫单质中硫元素的化合价为0,处于中间价态,故硫单质既有氧化性又有 还原性。
[思考2] 硫在空气中燃烧的产物是二氧化硫,在纯氧或者足量的氧气中燃烧的产物 是三氧化硫吗?
[思考3] 硫可以与热的KOH溶液反应生成K2S、K2SO3和水,用此反应可以清洗试管 内壁上附着的硫黄,请写出反应的离子方程式。
归纳总结
(1)硫在自然界中既有游离态又有化合态,在火山喷口处或地壳的岩层里有游 离态的硫单质。硫有S2、S4、S6、S8等多种同素异形体。
(2)硫单质燃烧时,产物只能是SO2,无论O2是否充足,均不会生成SO3。
(4)实验室中,残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶 液除去。
(6)硫与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)。
应用 体验
1. 微判断
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS
⑩Ag2S
√
②③④⑦⑧⑨⑩
第*页
研习任务二 二氧化硫
教材 认知
1. 二氧化硫物理性质
颜色 状态 气味/毒性 密度 溶解性
无色 气体 有刺激性 , 有 毒 比空
气 大 易 溶
于水
无色
气体
有刺激性
有
大
易
2. SO2的化学性质——多重性
(1)研究角度一:物质类别——酸性氧化物。
①与水反应
实验操作 实验现象
把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开 橡胶塞;片刻后,在水下用橡胶塞塞紧试管口,取出试管, 用pH试纸测定试管中溶液的酸碱度 试管内液面上升;pH 试纸变红,试管中溶 液显酸性
+H2O
CaSO3
(2)研究角度二:特殊性——漂白性。
SO2的漂白实验
褪色
恢复红色
不稳定
分解
[思考1] SO2、漂白粉、Na2O2都能使鲜花褪色,其原理相同吗?二氧化硫可广泛用 于食品的漂白吗?
提示:SO2与漂白粉、Na2O2的漂白原理不相同,SO2与有色物质发生化合反应生成不 稳定的无色物质,而漂白粉、Na2O2利用强氧化性漂白;二氧化硫不可以广泛用于食 品的漂白。
(3)研究角度三:化合价变化——氧化性与还原性。
①SO2的还原性
②SO2的氧化性
3. 可逆反应
同一
正反应
逆反应
[思考2] SO2在适当的温度并有催化剂存在的条件下,可以被氧气氧化生成 SO3。已知SO3的熔点为16.8 ℃,沸点为44.8 ℃,也是一种酸性氧化物。思考 并回答下列问题:
(1)标准状况下,22.4 L SO3所含O原子的数目是3NA吗?为什么?
提示:(1)不是,因为标准状况下SO3是固态,22.4 L SO3不是1 mol。
(2)分别写出SO3与H2O、CaO、Ca(OH)2反应的化学方程式。
4. SO2的用途
(2)漂白纸浆、毛、丝、草帽辫等。
(4)食品添加剂:加入适量二氧化硫起到漂白、防腐和抗氧化等作用。
杀菌消毒
归纳总结
(1)SO2不能漂白酸碱指示剂,能使紫色石蕊溶液变红,但不能使之褪色。
(2)SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性,而不是 漂白性。
(4)SO2、CO2通入BaCl2溶液中都不会产生沉淀。
应用 体验
1. 微判断
(3)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2。
√
B
选项 试剂 现象 结论
A 酸性KMnO4
溶液 溶液褪色 SO2有氧化性
B 品红溶液 溶液褪色 SO2有漂白性
C NaOH溶液 无明显现象 SO2与NaOH
溶液不反应
D 硫化氢水溶液 溶液变浑浊 SO2有还原性
3. 写出下列反应的离子方程式。
第*页
课堂强研习 合作学习 精研重难
课后提素养
A. 硫 B. 铜 C. 铁 D. 金
A
A. 可用硫黄熏蒸处理馒头、银耳等食品以防腐
B. 硫在足量空气中燃烧生成大量SO3
C. 二氧化硫可在葡萄酒中微量添加
D. 向SO2水溶液中滴加BaCl2溶液,有白色沉淀生成
解析:SO2是一种食品添加剂,由于SO2有毒,要严格控制其使用量,不能用硫黄熏 蒸处理馒头、银耳等食品,A错误;硫在足量空气中燃烧只能生成SO2,不能直接生 成SO3,B错误;微量SO2添加到葡萄酒中,可起到杀菌、抗氧化的作用,C正确;由 于H2SO3的酸性比HCl的酸性弱,向SO2水溶液中滴加BaCl2溶液,不能生成白色沉 淀,D错误。
C
解析:A项中元素化合价没改变,为非氧化还原反应;B和D项,SO2中S元素化合价 都升高,SO2为还原剂,表现还原性;C项中,SO2中S元素化合价降低,SO2为氧化 剂,表现氧化性,故选C。
C
A. 0.213 g·L-1 B. 0.04 g·L-1
C. 0.24 g·L-1 D. 0.076 8 g·L-1
A
5. 将SO2分别通入下列五种溶液中:
回答下列问题:
褪色
还原
褪色
漂白
褪色
白色
BaSO3
BaSO4
第*页
课时作业
[基础训练]
A. 硫单质通常是黄色或淡黄色的固体
B. 硫在空气中燃烧时生成三氧化硫
C. 硫难溶于水,易溶于CS2
D. “丹砂烧之成水银”中发生了氧化还原反应
解析:硫单质通常是黄色或淡黄色的固体,A正确;硫在空气中燃烧时生成二氧化 硫,B错误;硫难溶于水,易溶于CS2,C正确;“丹砂烧之成水银”:硫化汞受热分 解生成汞和硫,发生了氧化还原反应,D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 硫在自然界中只有化合态,没有游离态
B. 煤中含有硫元素.燃煤时加入生石灰可脱硫
C. 硫具有弱氧化性,和变价金属反应,通常将金属氧化成 低价态
D. H2S的水溶液叫作氢硫酸,氢硫酸是典型的弱酸
解析:硫在自然界中主要以化合态形式存在,在火山喷发口或地壳的岩层中有游离态 的单质硫存在,A项错误;煤中含有硫元素,燃煤时生成SO2,加入生石灰后,SO2与 CaO反应生成CaSO3,再被O2氧化生成CaSO4,可减少SO2的排放,起到脱硫的作用, B项正确;硫具有弱氧化性,与变价金属(如Fe、Cu等)反应生成低价态金属硫化 物,如FeS、Cu2S等,C项正确;氢硫酸是弱酸,D项正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪 色
B. 能使品红溶液褪色的不一定是SO2
C. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D. SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果 更好
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2024·苏州高一期末)实验室通过下列实验探究SO2的性质。
序号 实验操作和现象
Ⅰ 用充有80 mL SO2的针筒吸入10 mL蒸馏水,用橡皮塞堵住针筒前端,充分振 荡,针筒内几乎没有气体剩余
Ⅱ 取实验Ⅰ中的溶液,滴加几滴紫色石蕊试液,溶液显红色
Ⅲ 取实验Ⅰ中的溶液,滴加含有酚酞的氨水溶液,红色褪去
Ⅳ 取实验Ⅰ中的溶液,滴加BaCl2溶液,无明显现象,再加入5 mL 3%的H2O2溶 液,出现白色沉淀,向沉淀中加稀盐酸,沉淀未溶解
C
A. 实验Ⅰ说明SO2的水溶性较好
B. 实验Ⅱ说明SO2的水溶液显酸性
D. 实验Ⅳ中的白色沉淀为BaSO4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 将CO2通入①酸性高锰酸钾溶液中会出现类似的现象
C. 将CO2或SO2通入氯化钡溶液都有白色沉淀生成
B
1
2
3
4
5
6
7
8
9
10
11
12
实验
记
录 A 无色 无色 无现象 无色溶液
B 红色 无色 白色沉淀 白色沉淀
C 红色 无色 无色溶液 白色沉淀
D 无色 无色 无色溶液 无色溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. SO2排入大气易引起酸雨
B. 海水吸收二氧化硫时可能有CO2逸出
C. 处理后的海水pH增大
D. 海水脱硫工艺简单,投资及运行费用低
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
8. 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题。
解析:(1)常见烧瓶有圆底烧瓶、平底烧瓶 和蒸馏烧瓶,图示中带支管的为蒸馏烧瓶。
蒸馏烧瓶
1
2
3
4
5
6
7
8
9
10
11
12
溶液由紫红色变为无色
无
色溶液中出现黄色浑浊
还原性
氧化
性
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)SO2与品红溶液作用的可逆性指: SO2使品红溶液褪色,加热后又恢复红色,注 意实验操作中品红溶液褪色后要关闭分液漏斗 的旋塞。
品
红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
1
2
3
4
5
6
7
8
9
10
11
12
解析:(4)SO2为酸性氧化物,一般用碱性溶 液吸收,也可用酸性高锰酸钾等强氧化性溶液 吸收。
NaOH
1
2
3
4
5
6
7
8
9
10
11
12
[提升训练]
A. 向溴水中通入SO2,溶液褪色,说明SO2具有还原性
B. 向紫色石蕊溶液中通入SO2,溶液由紫色变为红色,说明SO2具有酸性
C. 向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO4
D. 向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3的酸性强于H2CO3
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ①先检验SO2、CO2,再检水蒸气
B. ②先检水蒸气,再检CO2和SO2
C. ③验证了水蒸气和SO2的存在后,再检验CO2
D. ④吸收尾气,以防止污染空气
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:检验SO2和CO2均用的是溶液,会引入水,故先检验水蒸气,SO2也能使澄清石 灰水变浑浊,先用品红溶液检验SO2,后用澄清石灰水检验CO2。根据分析,先检验 H2O,再检验SO2,最后检验CO2,后检验的水蒸气可能是混合气体通过了含水的溶液 带出的水蒸气,A错误;验水后先通澄清石灰水,SO2溶于水形成的亚硫酸的酸性强 于碳酸,生成沉淀可能是CaSO3,若SO2过量还可能没有沉淀,不能检验CO2,B错 误;根据分析,先检验H2O,再检验SO2,用足量KMnO4吸收残余的SO2,最后检验 CO2,C正确;饱和食盐水不能吸收SO2,应选用氢氧化钠溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 酸性硫酸铁溶液吸收含SO2的废气后,溶液中c(H+)减小
B. 向酸性硫酸铁溶液中滴加KSCN溶液,溶液变红
D. 该无害化处理过程可以实现原料的循环利用,降低处理成本
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. (2024·无锡高一期中)某同学设计了如下装置用于制取SO2和验证SO2的漂白 性、酸性、还原性。
1
2
3
4
5
6
7
8
9
10
11
12
解析:先通入氮气排出装置内的空气,再把硫酸滴入,亚硫酸钠固体和浓硫酸反应生 成硫酸钠、二氧化硫和水, C装置验证二氧化硫的漂白性,E装置验证二氧化硫的酸 性,酸性高锰酸钾、氯化钡和氯化铁的混合溶液都是验证二氧化硫的还原性,二氧化 硫有毒,会污染环境,用A装置进行尾气处理。
1
2
3
4
5
6
7
8
9
10
11
12
+H2O
回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
(填装置字母,还原性设计两个装置)。
C→E→D→F→B或C→E→F→D→B
1
2
3
4
5
6
7
8
9
10
11
12
2Mn2+
1
2
3
4
5
6
7
8
9
10
11
12
解析:(4)实验前必须鼓入N2,目的是排出装置内的氧气,防止二氧化硫被空气中氧气氧化而干扰F中的实验。
排出装置内的氧气,防止二氧化硫被空气中氧气
氧化而干扰F中的实验
1
2
3
4
5
6
7
8
9
10
11
12
BaSO4
二氧化硫和铁离子反应生成硫酸根和亚铁离子,硫酸根和钡离子反应生成
硫酸钡
1
2
3
4
5
6
7
8
9
10
11
12
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第1课时 硫和二氧化硫
学习目标:1.了解硫的性质和用途。2.掌握SO2的化学性质及检验方法。学会设计实 验验证SO2的还原性及漂白性。3.了解SO3的主要性质。
第*页
研习任务一 硫
教材 认知
1. 硫元素
(1)“位——构——性”
硫元素位置 原子结构
示意图 得电子
能力 主要化合价
第 三 周期
第 ⅥA 族 比氧弱 。 -2、+4、+6
(2)存在形式:以游离态和化合态形式存在。
三
ⅥA
弱
2. 硫单质
(1)物理性质
俗称 颜色状态 溶解性
水 酒精 CS2
硫黄 黄色 晶体 难溶 微溶 易溶
硫黄
黄色
微溶
易溶
(2)从化合价的角度认识硫单质的化学性质
①硫与金属的反应:
氧化
②硫与非金属的反应:
还原
[思考1] 从硫元素价态变化的角度分析,硫单质有哪些化学性质?
提示:硫单质中硫元素的化合价为0,处于中间价态,故硫单质既有氧化性又有 还原性。
[思考2] 硫在空气中燃烧的产物是二氧化硫,在纯氧或者足量的氧气中燃烧的产物 是三氧化硫吗?
[思考3] 硫可以与热的KOH溶液反应生成K2S、K2SO3和水,用此反应可以清洗试管 内壁上附着的硫黄,请写出反应的离子方程式。
归纳总结
(1)硫在自然界中既有游离态又有化合态,在火山喷口处或地壳的岩层里有游 离态的硫单质。硫有S2、S4、S6、S8等多种同素异形体。
(2)硫单质燃烧时,产物只能是SO2,无论O2是否充足,均不会生成SO3。
(4)实验室中,残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶 液除去。
(6)硫与变价金属反应时,生成低价态金属硫化物(如Cu2S、FeS)。
应用 体验
1. 微判断
①CuS ②FeS ③HCl ④SO2 ⑤SO3 ⑥FeCl2 ⑦CuCl2 ⑧Cu2S ⑨HgS
⑩Ag2S
√
②③④⑦⑧⑨⑩
第*页
研习任务二 二氧化硫
教材 认知
1. 二氧化硫物理性质
颜色 状态 气味/毒性 密度 溶解性
无色 气体 有刺激性 , 有 毒 比空
气 大 易 溶
于水
无色
气体
有刺激性
有
大
易
2. SO2的化学性质——多重性
(1)研究角度一:物质类别——酸性氧化物。
①与水反应
实验操作 实验现象
把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开 橡胶塞;片刻后,在水下用橡胶塞塞紧试管口,取出试管, 用pH试纸测定试管中溶液的酸碱度 试管内液面上升;pH 试纸变红,试管中溶 液显酸性
+H2O
CaSO3
(2)研究角度二:特殊性——漂白性。
SO2的漂白实验
褪色
恢复红色
不稳定
分解
[思考1] SO2、漂白粉、Na2O2都能使鲜花褪色,其原理相同吗?二氧化硫可广泛用 于食品的漂白吗?
提示:SO2与漂白粉、Na2O2的漂白原理不相同,SO2与有色物质发生化合反应生成不 稳定的无色物质,而漂白粉、Na2O2利用强氧化性漂白;二氧化硫不可以广泛用于食 品的漂白。
(3)研究角度三:化合价变化——氧化性与还原性。
①SO2的还原性
②SO2的氧化性
3. 可逆反应
同一
正反应
逆反应
[思考2] SO2在适当的温度并有催化剂存在的条件下,可以被氧气氧化生成 SO3。已知SO3的熔点为16.8 ℃,沸点为44.8 ℃,也是一种酸性氧化物。思考 并回答下列问题:
(1)标准状况下,22.4 L SO3所含O原子的数目是3NA吗?为什么?
提示:(1)不是,因为标准状况下SO3是固态,22.4 L SO3不是1 mol。
(2)分别写出SO3与H2O、CaO、Ca(OH)2反应的化学方程式。
4. SO2的用途
(2)漂白纸浆、毛、丝、草帽辫等。
(4)食品添加剂:加入适量二氧化硫起到漂白、防腐和抗氧化等作用。
杀菌消毒
归纳总结
(1)SO2不能漂白酸碱指示剂,能使紫色石蕊溶液变红,但不能使之褪色。
(2)SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性,而不是 漂白性。
(4)SO2、CO2通入BaCl2溶液中都不会产生沉淀。
应用 体验
1. 微判断
(3)某气体通入品红溶液后,品红溶液褪色,则该气体一定是SO2。
√
B
选项 试剂 现象 结论
A 酸性KMnO4
溶液 溶液褪色 SO2有氧化性
B 品红溶液 溶液褪色 SO2有漂白性
C NaOH溶液 无明显现象 SO2与NaOH
溶液不反应
D 硫化氢水溶液 溶液变浑浊 SO2有还原性
3. 写出下列反应的离子方程式。
第*页
课堂强研习 合作学习 精研重难
课后提素养
A. 硫 B. 铜 C. 铁 D. 金
A
A. 可用硫黄熏蒸处理馒头、银耳等食品以防腐
B. 硫在足量空气中燃烧生成大量SO3
C. 二氧化硫可在葡萄酒中微量添加
D. 向SO2水溶液中滴加BaCl2溶液,有白色沉淀生成
解析:SO2是一种食品添加剂,由于SO2有毒,要严格控制其使用量,不能用硫黄熏 蒸处理馒头、银耳等食品,A错误;硫在足量空气中燃烧只能生成SO2,不能直接生 成SO3,B错误;微量SO2添加到葡萄酒中,可起到杀菌、抗氧化的作用,C正确;由 于H2SO3的酸性比HCl的酸性弱,向SO2水溶液中滴加BaCl2溶液,不能生成白色沉 淀,D错误。
C
解析:A项中元素化合价没改变,为非氧化还原反应;B和D项,SO2中S元素化合价 都升高,SO2为还原剂,表现还原性;C项中,SO2中S元素化合价降低,SO2为氧化 剂,表现氧化性,故选C。
C
A. 0.213 g·L-1 B. 0.04 g·L-1
C. 0.24 g·L-1 D. 0.076 8 g·L-1
A
5. 将SO2分别通入下列五种溶液中:
回答下列问题:
褪色
还原
褪色
漂白
褪色
白色
BaSO3
BaSO4
第*页
课时作业
[基础训练]
A. 硫单质通常是黄色或淡黄色的固体
B. 硫在空气中燃烧时生成三氧化硫
C. 硫难溶于水,易溶于CS2
D. “丹砂烧之成水银”中发生了氧化还原反应
解析:硫单质通常是黄色或淡黄色的固体,A正确;硫在空气中燃烧时生成二氧化 硫,B错误;硫难溶于水,易溶于CS2,C正确;“丹砂烧之成水银”:硫化汞受热分 解生成汞和硫,发生了氧化还原反应,D正确。
B
1
2
3
4
5
6
7
8
9
10
11
12
A. 硫在自然界中只有化合态,没有游离态
B. 煤中含有硫元素.燃煤时加入生石灰可脱硫
C. 硫具有弱氧化性,和变价金属反应,通常将金属氧化成 低价态
D. H2S的水溶液叫作氢硫酸,氢硫酸是典型的弱酸
解析:硫在自然界中主要以化合态形式存在,在火山喷发口或地壳的岩层中有游离态 的单质硫存在,A项错误;煤中含有硫元素,燃煤时生成SO2,加入生石灰后,SO2与 CaO反应生成CaSO3,再被O2氧化生成CaSO4,可减少SO2的排放,起到脱硫的作用, B项正确;硫具有弱氧化性,与变价金属(如Fe、Cu等)反应生成低价态金属硫化 物,如FeS、Cu2S等,C项正确;氢硫酸是弱酸,D项正确。
A
1
2
3
4
5
6
7
8
9
10
11
12
A. 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪 色
B. 能使品红溶液褪色的不一定是SO2
C. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
D. SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果 更好
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
4. (2024·苏州高一期末)实验室通过下列实验探究SO2的性质。
序号 实验操作和现象
Ⅰ 用充有80 mL SO2的针筒吸入10 mL蒸馏水,用橡皮塞堵住针筒前端,充分振 荡,针筒内几乎没有气体剩余
Ⅱ 取实验Ⅰ中的溶液,滴加几滴紫色石蕊试液,溶液显红色
Ⅲ 取实验Ⅰ中的溶液,滴加含有酚酞的氨水溶液,红色褪去
Ⅳ 取实验Ⅰ中的溶液,滴加BaCl2溶液,无明显现象,再加入5 mL 3%的H2O2溶 液,出现白色沉淀,向沉淀中加稀盐酸,沉淀未溶解
C
A. 实验Ⅰ说明SO2的水溶性较好
B. 实验Ⅱ说明SO2的水溶液显酸性
D. 实验Ⅳ中的白色沉淀为BaSO4
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. 将CO2通入①酸性高锰酸钾溶液中会出现类似的现象
C. 将CO2或SO2通入氯化钡溶液都有白色沉淀生成
B
1
2
3
4
5
6
7
8
9
10
11
12
实验
记
录 A 无色 无色 无现象 无色溶液
B 红色 无色 白色沉淀 白色沉淀
C 红色 无色 无色溶液 白色沉淀
D 无色 无色 无色溶液 无色溶液
B
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A. SO2排入大气易引起酸雨
B. 海水吸收二氧化硫时可能有CO2逸出
C. 处理后的海水pH增大
D. 海水脱硫工艺简单,投资及运行费用低
C
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
8. 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题。
解析:(1)常见烧瓶有圆底烧瓶、平底烧瓶 和蒸馏烧瓶,图示中带支管的为蒸馏烧瓶。
蒸馏烧瓶
1
2
3
4
5
6
7
8
9
10
11
12
溶液由紫红色变为无色
无
色溶液中出现黄色浑浊
还原性
氧化
性
1
2
3
4
5
6
7
8
9
10
11
12
解析:(3)SO2与品红溶液作用的可逆性指: SO2使品红溶液褪色,加热后又恢复红色,注 意实验操作中品红溶液褪色后要关闭分液漏斗 的旋塞。
品
红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
1
2
3
4
5
6
7
8
9
10
11
12
解析:(4)SO2为酸性氧化物,一般用碱性溶 液吸收,也可用酸性高锰酸钾等强氧化性溶液 吸收。
NaOH
1
2
3
4
5
6
7
8
9
10
11
12
[提升训练]
A. 向溴水中通入SO2,溶液褪色,说明SO2具有还原性
B. 向紫色石蕊溶液中通入SO2,溶液由紫色变为红色,说明SO2具有酸性
C. 向SO2水溶液中滴加Ba(NO3)2溶液,产生的白色沉淀是BaSO4
D. 向SO2水溶液中加入NaHCO3粉末,有气泡产生,说明H2SO3的酸性强于H2CO3
B
1
2
3
4
5
6
7
8
9
10
11
12
A. ①先检验SO2、CO2,再检水蒸气
B. ②先检水蒸气,再检CO2和SO2
C. ③验证了水蒸气和SO2的存在后,再检验CO2
D. ④吸收尾气,以防止污染空气
C
1
2
3
4
5
6
7
8
9
10
11
12
解析:检验SO2和CO2均用的是溶液,会引入水,故先检验水蒸气,SO2也能使澄清石 灰水变浑浊,先用品红溶液检验SO2,后用澄清石灰水检验CO2。根据分析,先检验 H2O,再检验SO2,最后检验CO2,后检验的水蒸气可能是混合气体通过了含水的溶液 带出的水蒸气,A错误;验水后先通澄清石灰水,SO2溶于水形成的亚硫酸的酸性强 于碳酸,生成沉淀可能是CaSO3,若SO2过量还可能没有沉淀,不能检验CO2,B错 误;根据分析,先检验H2O,再检验SO2,用足量KMnO4吸收残余的SO2,最后检验 CO2,C正确;饱和食盐水不能吸收SO2,应选用氢氧化钠溶液,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
A. 酸性硫酸铁溶液吸收含SO2的废气后,溶液中c(H+)减小
B. 向酸性硫酸铁溶液中滴加KSCN溶液,溶液变红
D. 该无害化处理过程可以实现原料的循环利用,降低处理成本
A
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
12. (2024·无锡高一期中)某同学设计了如下装置用于制取SO2和验证SO2的漂白 性、酸性、还原性。
1
2
3
4
5
6
7
8
9
10
11
12
解析:先通入氮气排出装置内的空气,再把硫酸滴入,亚硫酸钠固体和浓硫酸反应生 成硫酸钠、二氧化硫和水, C装置验证二氧化硫的漂白性,E装置验证二氧化硫的酸 性,酸性高锰酸钾、氯化钡和氯化铁的混合溶液都是验证二氧化硫的还原性,二氧化 硫有毒,会污染环境,用A装置进行尾气处理。
1
2
3
4
5
6
7
8
9
10
11
12
+H2O
回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
(填装置字母,还原性设计两个装置)。
C→E→D→F→B或C→E→F→D→B
1
2
3
4
5
6
7
8
9
10
11
12
2Mn2+
1
2
3
4
5
6
7
8
9
10
11
12
解析:(4)实验前必须鼓入N2,目的是排出装置内的氧气,防止二氧化硫被空气中氧气氧化而干扰F中的实验。
排出装置内的氧气,防止二氧化硫被空气中氧气
氧化而干扰F中的实验
1
2
3
4
5
6
7
8
9
10
11
12
BaSO4
二氧化硫和铁离子反应生成硫酸根和亚铁离子,硫酸根和钡离子反应生成
硫酸钡
1
2
3
4
5
6
7
8
9
10
11
12
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
