安徽省六安市独山中学2024-2025学年高三下学期5月月考化学试卷(含答案)
文档属性
| 名称 | 安徽省六安市独山中学2024-2025学年高三下学期5月月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-03 23:45:07 | ||
图片预览


文档简介
独山中学2024-2025学年度第二学期高三5月份月考化学卷
选择题( 14 * 3 == 42 分 )
1.“硬核科技” 为新质生产力的发展赋能。下列说法正确的是( )
A.石墨烯涂料具有较强的抗腐蚀性,石墨烯属于电解质
B.“华龙一号” 的核反应堆以235U为燃料,235U与236U具有不同的化学性质
C.“雪龙二号“ 雷达系统使用碳化硅材料,碳化硅属于新型无机非金属材料
D.我国光量子芯片使用铌酸悝(LiNbO )晶体凋控光子、LiNbO 是共价晶体
2.下列化学用语正确的是( )
A.的系统命名:2-甲基-3-苯基丙酸
B.邻羟基苯甲醛中的氢键可以表示为
C.天然橡胶的反式结构简式为
D.分子中键的形成
3.铁及其化合物的转化关系如图。NA为阿伏加德罗常数的值,下列说法正确的是( )
A.FeCl3溶液中通入SO2可实现转化①,说明氧化性:
B.转化②中每生成0.1 molFe3O4,转移的电子数为0.9NA
C.转化③中FeCl3和FeCl2的物质的量之比为1∶2
D.过量Fe在氯气中燃烧生成FeCl2
阅读下列材料,完成以下问题。
ⅢA族元素及其化合物应用广泛。硼的熔点很高,其硬度仅次于金刚石,单质硼可以溶于热的浓硝酸生成硼酸(H3BO3),硼酸溶于水,可用作防腐剂;硼烷(B2H6,常温下呈气态)是一种潜在的高能燃料,在O2中完全燃烧生成B2O3固体和液态水;氨硼烷(H3NBH3)是最具潜力的储氢材料之一,与硼烷的相对分子质量相近,但沸点却比硼烷高得多;BF3是石油化工的重要催化剂;Al2O3熔点很高,是两性氧化物,可溶于强酸、强碱。已知25 ℃时H3BO3的电离常数Ka=5.8×10-10。
4. 下列相关的离子方程式正确的是
A. 硼与热的浓硝酸反应:B+3HNO3(浓)H3BO3+3NO2↑
B. 硼酸与过量NaOH溶液反应:H3BO3+OH-=B(OH)
C. 将精制氟硼酸钠加热到384 ℃时可得三氟化硼气体:BF=F-+BF3↑
D. Al2O3和NaOH溶液反应:Al2O3+OH-+2H2O=Al(OH)
5. 硼烷(BnHm)及其衍生物是用途极广的化学试剂,也是一种固体储氢材料。氨硼烷在一定条件下和水发生如下反应:3NH3BH3+6H2O=(NH4)3B3O6+9H2↑,下列说法错误的是
A. B原子由1s22s12p→1s22s12p2p需吸收能量
B. 沸点:氨硼烷>乙硼烷(B2H6)
C. B3O和NH3BH3中B的杂化方式不相同
D. H3NBH3分子中氢的化合价不完全相同
6.劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是( )
选项 劳动项目 化学知识
A 帮厨活动:用石膏对豆浆进行点卤 胶体遇电解质发生聚沉
B 家务劳动:用铝粉与NaOH疏通管道 铝与NaOH溶液反应产生H2
C 污水处理:用Na S除去废水中的Cu2 Na2S具有很强的还原性
D 塑料加工:聚氯乙烯树脂中加入增塑剂 增塑剂能提高塑料的柔韧性和弹性
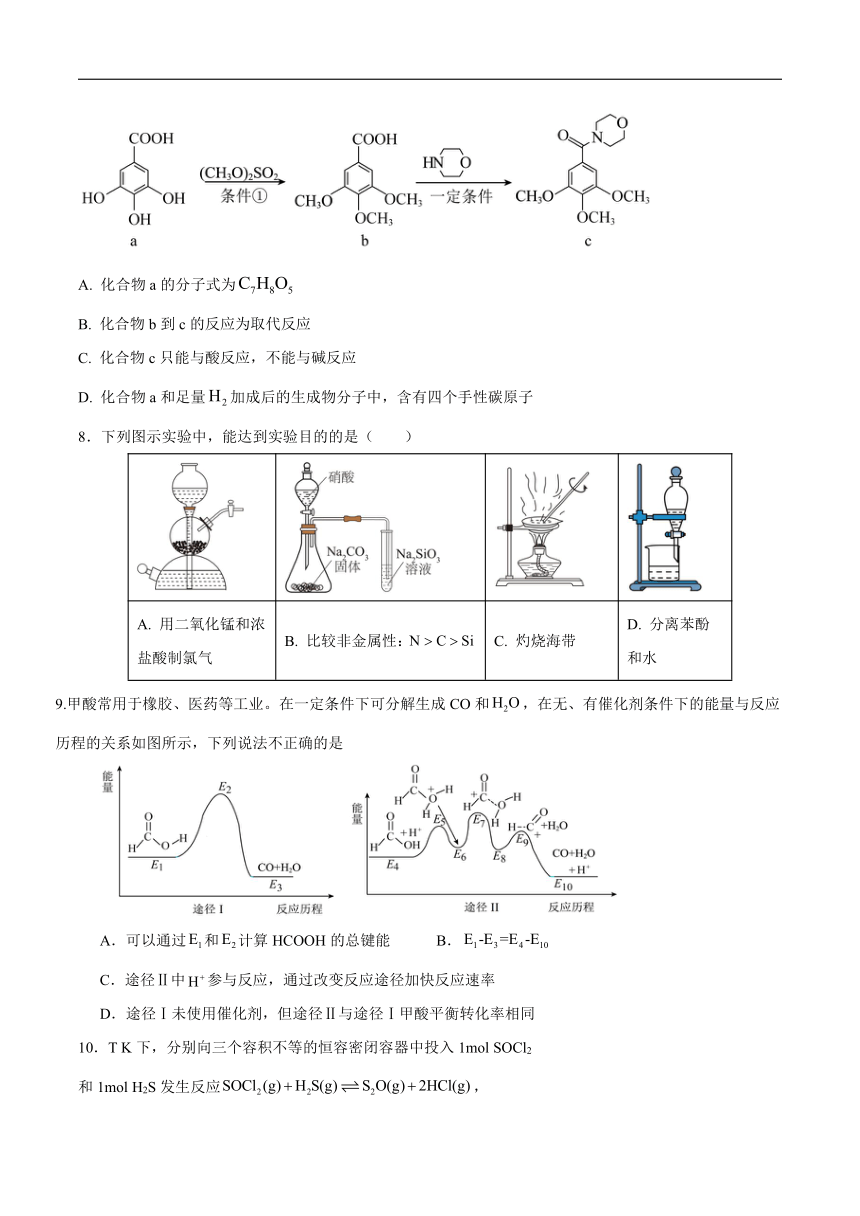
7. 有机化合物c的合成路线如图所示。下列说法正确的是
化合物a的分子式为
B. 化合物b到c的反应为取代反应
C. 化合物c只能与酸反应,不能与碱反应
D. 化合物a和足量加成后的生成物分子中,含有四个手性碳原子
8.下列图示实验中,能达到实验目的的是( )
用二氧化锰和浓盐酸制氯气 比较非金属性: 灼烧海带 分离苯酚和水
9.甲酸常用于橡胶、医药等工业。在一定条件下可分解生成CO和,在无、有催化剂条件下的能量与反应历程的关系如图所示,下列说法不正确的是
A.可以通过和计算HCOOH的总键能 B.
C.途径Ⅱ中参与反应,通过改变反应途径加快反应速率
D.途径Ⅰ未使用催化剂,但途径Ⅱ与途径Ⅰ甲酸平衡转化率相同
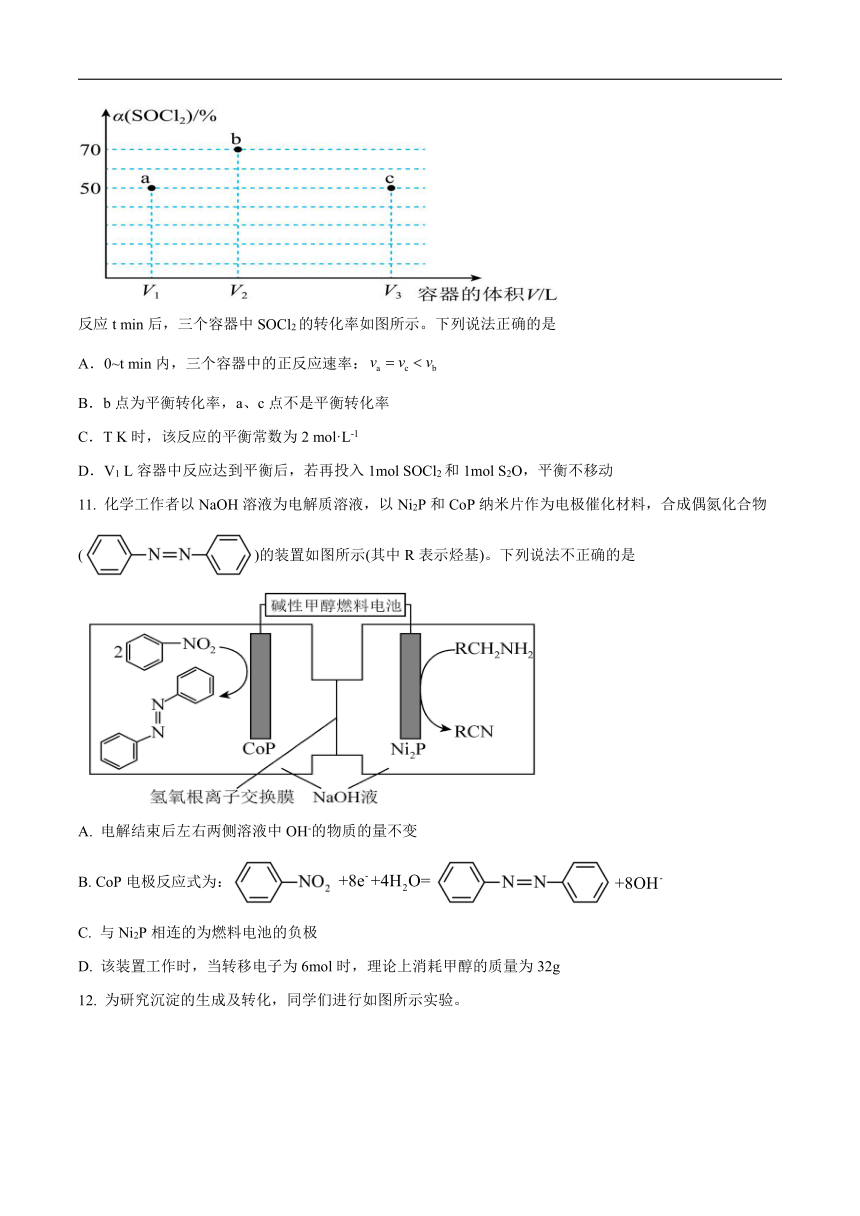
10.T K下,分别向三个容积不等的恒容密闭容器中投入1mol SOCl2
和1mol H2S发生反应,
反应t min后,三个容器中SOCl2的转化率如图所示。下列说法正确的是
A.0~t min内,三个容器中的正反应速率:
B.b点为平衡转化率,a、c点不是平衡转化率
C.T K时,该反应的平衡常数为2 mol·L-1
D.V1 L容器中反应达到平衡后,若再投入1mol SOCl2和1mol S2O,平衡不移动
11. 化学工作者以NaOH溶液为电解质溶液,以Ni2P和CoP纳米片作为电极催化材料,合成偶氮化合物()的装置如图所示(其中R表示烃基)。下列说法不正确的是
A. 电解结束后左右两侧溶液中OH-的物质的量不变
B. CoP电极反应式为:
C. 与Ni2P相连的为燃料电池的负极
D. 该装置工作时,当转移电子为6mol时,理论上消耗甲醇的质量为32g
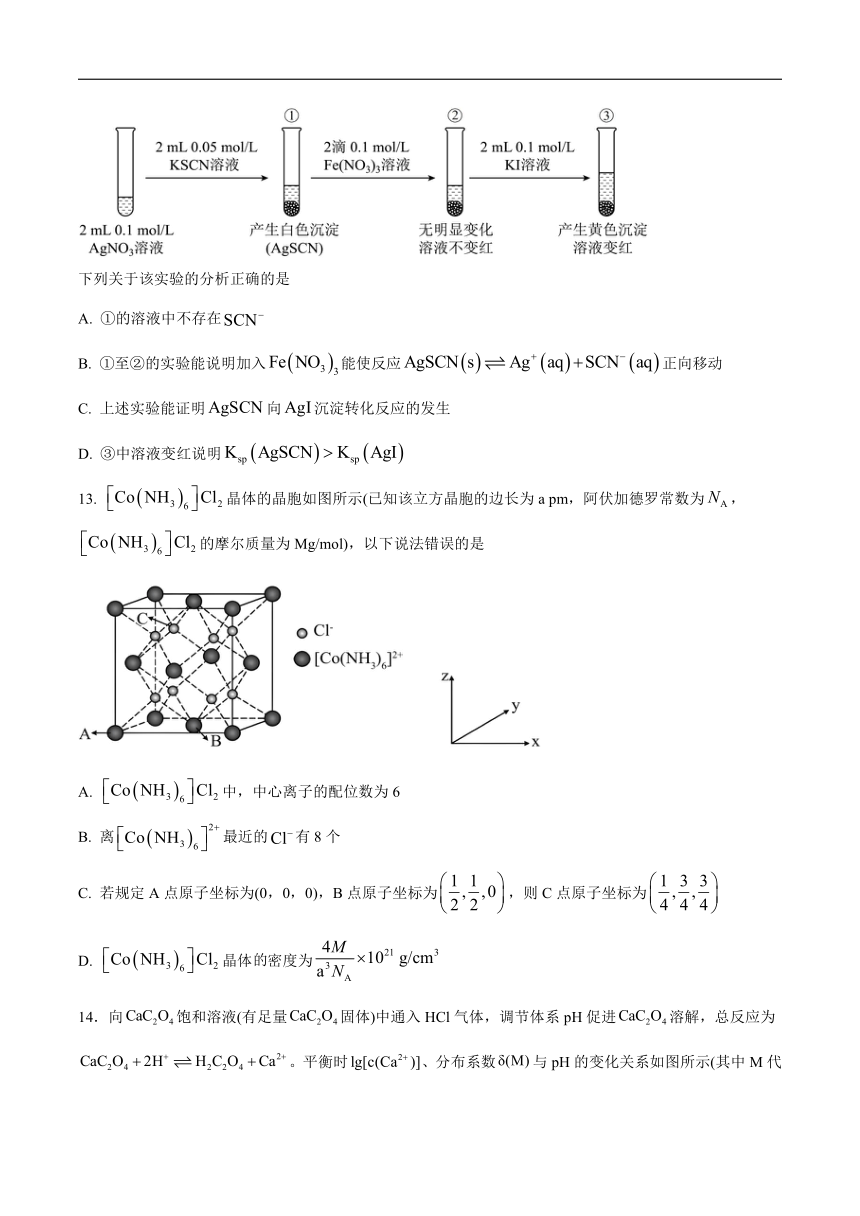
12. 为研究沉淀的生成及转化,同学们进行如图所示实验。
下列关于该实验的分析正确的是
A. ①的溶液中不存在
B. ①至②的实验能说明加入能使反应正向移动
C. 上述实验能证明向沉淀转化反应的发生
D. ③中溶液变红说明
晶体的晶胞如图所示(已知该立方晶胞的边长为a pm,阿伏加德罗常数为,的摩尔质量为Mg/mol),以下说法错误的是
中,中心离子的配位数为6
B. 离最近的有8个
C. 若规定A点原子坐标为(0,0,0),B点原子坐标为,则C点原子坐标为
D. 晶体密度为
14.向饱和溶液(有足量固体)中通入HCl气体,调节体系pH促进溶解,总反应为。平衡时、分布系数与pH的变化关系如图所示(其中M代表、或)。比如,。已知。下列说法正确的是( )
A.曲线II表示的变化关系
B.时,溶液中
C.总反应的平衡常数
D.时,
二、填空题( 共 4 大题,计 58 分 )
15. (16分)五氯化锑主要作为氟化工的催化剂,也用作纺织工业中织物的阻燃剂等。锑的两种氯化物性质如下表:
物质 熔点 沸点 部分性质
73.4℃ 223℃ 易水解
2.8℃ 68℃(1.86kPa);176℃(101.3kPa),140℃发生分解 易水解,露置空气发烟
某兴趣小组在实验师的指导下,根据反应原理,利用如下装置(夹持仪器,抽气装置已略)制备。
回答下列问题:
(1)仪器A的名称是______;球形干燥管c内应填装的试剂是_____(填名称)。
(2)仪器B中固体试剂不可能是________(填字母)。
a. b. c. d.
(3)实验前通入氮气的目的是__________。
(4)三口烧瓶内多孔玻璃泡的作用是__________。
(5)分离时采用减压蒸馏的原因__________。
(6)经元素分析仪测得产品仅含Cl、Sb两种元素,且物质的量之比为4.8∶1,则产品中SbCl5 的物质的量分数为_________。(假设该产品只含SbCl3一种杂质)
(7)常作为氯化物质的氯源,如乙烯与之反应生成1,2-二氯乙烷和另一氯化物,该反应的化学方程式为:___________。
16. (14分)某废旧锂离子电池的正极材料成分为LiNi0.5Co0.2Mn0.3O2和Al,下图为从其中回收钴、镍的工艺流程。
回答下列问题:
(1)LiNi0.5Co0.2Mn0.3O2中的Co元素为+3价,Ni2+、Ni3+和Co3+个数比为3∶2∶2,则Mn元素化合价为___________;Ni位于元素周期第___________周期,第___________族。
(2)“碱浸过滤”所得滤液的主要成分为___________。
(3)“还原焙烧”过程发生反应的化学方程式为___________。
(4)“碳化水浸”过程中反应为:Li2CO3(s)+CO2(g)+H2O(l)=2LiHCO3(aq),该反应的标准吉布斯自
由能(ΔGθ)和标准
生成焓(ΔHθ)随温
度变化如图。该过
程需要控制在
___________(填“a”“b”或c)进行,其原因是___________。
a.40 ℃~55 ℃ b.60 ℃~70 ℃ c.80 ℃~90 ℃
(5)常温下,为寻找“碳化水浸”的最佳pH,将37 g Li2CO3固体加入1 L水中,通入CO2使固体逐步溶解,当Li2CO3固体恰好完全溶解时,2c(CO)+c(HCO)≈1.0 mol·L-1,则溶液中的c(H+)为___________mol·L-1(保留两位有效数字,忽略体积变化)。
已知:Ksp(Li2CO3)=2.5×10-2, Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11
(6)“萃取”的原理是2HR+M2+2H++RM(M2+代表金属离子,HR代表萃取剂,则反萃取时加入的试剂为___________。
17.(14分)据悉,全球规模最大的乙醇生产装置在淮北启动生产,开创了一条煤炭清洁高效低碳利用的新路线。以煤的气化产物为原料合成无水乙醇的相关反应如下:
①:kJ?mol-1
②: kJ.mol-1
(1)反应的_______。
(2)以、、为原料,假设在投料比、压强不变条件下仅发生反应①、②,平衡时、、、的物质的量分数随温度变化如图所示。回答下列问题:①图中的曲线B代表的________________。
②当温度高于后,的物质的量分数随温度升高而降低的原因是________________。
③的平衡转化率随温度的升高_______(填“一直增大”、“一直减小”、“先增大后减小”、或“先减小后增大”)。
(3)一定温度下,向密闭容器中通入、和下发生反应①、②,平衡时CO的转化率为的物质的量为,则_______,反应②的___________(保留两位有效数字)。为用物质的量分数表示的平衡常数)
(4)在铜基催化剂表面可将电还原为乙醇等醇类物质,写出在酸性环境下将电还原为乙醇的电极反应方程式__________________________________________。
18. (14分)以化合物Ⅰ为原料,利用代谢工程和合成生物学技术可实现苯乙烯的绿色合成,进而制各种高级芳醇,合成路线如图(微生物酶、部分反应条件略)。
已知:
(1)化合物Ⅰ的分子式为___________;其中,含氮官能团的名称为___________。
(2)对化合物Ⅱ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
a ___________ ___________
b ___________ ___________ 酯化反应
(3)反应②的化学方程式可表示为:,化合物Z为___________。
(4)化合物Ⅳ的某同分异构体含有苯环,在核磁共振氢谱图上只有4组峰,且峰面积之比为1:2:2:3,其结构简式为___________(写一种)。
(5)关于上述合成路线中的相关物质及转化,下列说法正确的有_____(填标号)。
A. 化合物Ⅰ与混合,最多可生成2种二肽
B. 反应①中,有键和键的断裂
C. 反应③中,存在C原子杂化方式的改变,且有手性碳原子形成
D. 若反应④是原子利用率100%的反应,则另一反应物为直线形分子
(6)参考上述合成路线,以苯、为原料,合成。
①由合成,第一步反应的化学方程式为___________(注明反应条件)。
高三考前适应性测试化学参考答案
一、选择题( 14 * 3 == 42 分 )
1-5 CAABA 6-10 CBDAD 11-14 CCDB
二、填空题( 共 4 大题,计 58 分 )
15. (16分)(1) ①. 恒压滴液漏斗 ②. 碱石灰
(2)c (3)排除空气,防止、水解
(4)增大接触面积,加快反应速率 (5)降低沸点,防止分解
(6)90% (7)
16. (14分)(1) ①. +4 ②. 四 ③. Ⅷ (2)
(3)10LiNi0.5Co0.2Mn0.3O2+6C5Ni+2Co+3MnO+CO2↑+5Li2CO3
(4) ①. a ②. 高于60 ℃,ΔGθ>0,反应非自发进行
(5)2.1×10-9 (6)稀H2SO4
17.(14分)(1)
(2)①CO ②两者均为放热反应,温度升高均逆向移动,而反应①平衡逆向移动的程度大于反应②平衡逆向移动的程度 ③一直减小 (1分)
(3)①0.2 ②7.3 (4)①
18. (14分)(1) ①. ②. 氨基
(2) ①. ,催化剂,△ ②. 加成反应 ③. ,浓硫酸,加热 ④. (选用其他醇,且对应酯的结构简式书写正确均可) (3) (4)或 (5)BC
(6) ①.
选择题( 14 * 3 == 42 分 )
1.“硬核科技” 为新质生产力的发展赋能。下列说法正确的是( )
A.石墨烯涂料具有较强的抗腐蚀性,石墨烯属于电解质
B.“华龙一号” 的核反应堆以235U为燃料,235U与236U具有不同的化学性质
C.“雪龙二号“ 雷达系统使用碳化硅材料,碳化硅属于新型无机非金属材料
D.我国光量子芯片使用铌酸悝(LiNbO )晶体凋控光子、LiNbO 是共价晶体
2.下列化学用语正确的是( )
A.的系统命名:2-甲基-3-苯基丙酸
B.邻羟基苯甲醛中的氢键可以表示为
C.天然橡胶的反式结构简式为
D.分子中键的形成
3.铁及其化合物的转化关系如图。NA为阿伏加德罗常数的值,下列说法正确的是( )
A.FeCl3溶液中通入SO2可实现转化①,说明氧化性:
B.转化②中每生成0.1 molFe3O4,转移的电子数为0.9NA
C.转化③中FeCl3和FeCl2的物质的量之比为1∶2
D.过量Fe在氯气中燃烧生成FeCl2
阅读下列材料,完成以下问题。
ⅢA族元素及其化合物应用广泛。硼的熔点很高,其硬度仅次于金刚石,单质硼可以溶于热的浓硝酸生成硼酸(H3BO3),硼酸溶于水,可用作防腐剂;硼烷(B2H6,常温下呈气态)是一种潜在的高能燃料,在O2中完全燃烧生成B2O3固体和液态水;氨硼烷(H3NBH3)是最具潜力的储氢材料之一,与硼烷的相对分子质量相近,但沸点却比硼烷高得多;BF3是石油化工的重要催化剂;Al2O3熔点很高,是两性氧化物,可溶于强酸、强碱。已知25 ℃时H3BO3的电离常数Ka=5.8×10-10。
4. 下列相关的离子方程式正确的是
A. 硼与热的浓硝酸反应:B+3HNO3(浓)H3BO3+3NO2↑
B. 硼酸与过量NaOH溶液反应:H3BO3+OH-=B(OH)
C. 将精制氟硼酸钠加热到384 ℃时可得三氟化硼气体:BF=F-+BF3↑
D. Al2O3和NaOH溶液反应:Al2O3+OH-+2H2O=Al(OH)
5. 硼烷(BnHm)及其衍生物是用途极广的化学试剂,也是一种固体储氢材料。氨硼烷在一定条件下和水发生如下反应:3NH3BH3+6H2O=(NH4)3B3O6+9H2↑,下列说法错误的是
A. B原子由1s22s12p→1s22s12p2p需吸收能量
B. 沸点:氨硼烷>乙硼烷(B2H6)
C. B3O和NH3BH3中B的杂化方式不相同
D. H3NBH3分子中氢的化合价不完全相同
6.劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是( )
选项 劳动项目 化学知识
A 帮厨活动:用石膏对豆浆进行点卤 胶体遇电解质发生聚沉
B 家务劳动:用铝粉与NaOH疏通管道 铝与NaOH溶液反应产生H2
C 污水处理:用Na S除去废水中的Cu2 Na2S具有很强的还原性
D 塑料加工:聚氯乙烯树脂中加入增塑剂 增塑剂能提高塑料的柔韧性和弹性
7. 有机化合物c的合成路线如图所示。下列说法正确的是
化合物a的分子式为
B. 化合物b到c的反应为取代反应
C. 化合物c只能与酸反应,不能与碱反应
D. 化合物a和足量加成后的生成物分子中,含有四个手性碳原子
8.下列图示实验中,能达到实验目的的是( )
用二氧化锰和浓盐酸制氯气 比较非金属性: 灼烧海带 分离苯酚和水
9.甲酸常用于橡胶、医药等工业。在一定条件下可分解生成CO和,在无、有催化剂条件下的能量与反应历程的关系如图所示,下列说法不正确的是
A.可以通过和计算HCOOH的总键能 B.
C.途径Ⅱ中参与反应,通过改变反应途径加快反应速率
D.途径Ⅰ未使用催化剂,但途径Ⅱ与途径Ⅰ甲酸平衡转化率相同
10.T K下,分别向三个容积不等的恒容密闭容器中投入1mol SOCl2
和1mol H2S发生反应,
反应t min后,三个容器中SOCl2的转化率如图所示。下列说法正确的是
A.0~t min内,三个容器中的正反应速率:
B.b点为平衡转化率,a、c点不是平衡转化率
C.T K时,该反应的平衡常数为2 mol·L-1
D.V1 L容器中反应达到平衡后,若再投入1mol SOCl2和1mol S2O,平衡不移动
11. 化学工作者以NaOH溶液为电解质溶液,以Ni2P和CoP纳米片作为电极催化材料,合成偶氮化合物()的装置如图所示(其中R表示烃基)。下列说法不正确的是
A. 电解结束后左右两侧溶液中OH-的物质的量不变
B. CoP电极反应式为:
C. 与Ni2P相连的为燃料电池的负极
D. 该装置工作时,当转移电子为6mol时,理论上消耗甲醇的质量为32g
12. 为研究沉淀的生成及转化,同学们进行如图所示实验。
下列关于该实验的分析正确的是
A. ①的溶液中不存在
B. ①至②的实验能说明加入能使反应正向移动
C. 上述实验能证明向沉淀转化反应的发生
D. ③中溶液变红说明
晶体的晶胞如图所示(已知该立方晶胞的边长为a pm,阿伏加德罗常数为,的摩尔质量为Mg/mol),以下说法错误的是
中,中心离子的配位数为6
B. 离最近的有8个
C. 若规定A点原子坐标为(0,0,0),B点原子坐标为,则C点原子坐标为
D. 晶体密度为
14.向饱和溶液(有足量固体)中通入HCl气体,调节体系pH促进溶解,总反应为。平衡时、分布系数与pH的变化关系如图所示(其中M代表、或)。比如,。已知。下列说法正确的是( )
A.曲线II表示的变化关系
B.时,溶液中
C.总反应的平衡常数
D.时,
二、填空题( 共 4 大题,计 58 分 )
15. (16分)五氯化锑主要作为氟化工的催化剂,也用作纺织工业中织物的阻燃剂等。锑的两种氯化物性质如下表:
物质 熔点 沸点 部分性质
73.4℃ 223℃ 易水解
2.8℃ 68℃(1.86kPa);176℃(101.3kPa),140℃发生分解 易水解,露置空气发烟
某兴趣小组在实验师的指导下,根据反应原理,利用如下装置(夹持仪器,抽气装置已略)制备。
回答下列问题:
(1)仪器A的名称是______;球形干燥管c内应填装的试剂是_____(填名称)。
(2)仪器B中固体试剂不可能是________(填字母)。
a. b. c. d.
(3)实验前通入氮气的目的是__________。
(4)三口烧瓶内多孔玻璃泡的作用是__________。
(5)分离时采用减压蒸馏的原因__________。
(6)经元素分析仪测得产品仅含Cl、Sb两种元素,且物质的量之比为4.8∶1,则产品中SbCl5 的物质的量分数为_________。(假设该产品只含SbCl3一种杂质)
(7)常作为氯化物质的氯源,如乙烯与之反应生成1,2-二氯乙烷和另一氯化物,该反应的化学方程式为:___________。
16. (14分)某废旧锂离子电池的正极材料成分为LiNi0.5Co0.2Mn0.3O2和Al,下图为从其中回收钴、镍的工艺流程。
回答下列问题:
(1)LiNi0.5Co0.2Mn0.3O2中的Co元素为+3价,Ni2+、Ni3+和Co3+个数比为3∶2∶2,则Mn元素化合价为___________;Ni位于元素周期第___________周期,第___________族。
(2)“碱浸过滤”所得滤液的主要成分为___________。
(3)“还原焙烧”过程发生反应的化学方程式为___________。
(4)“碳化水浸”过程中反应为:Li2CO3(s)+CO2(g)+H2O(l)=2LiHCO3(aq),该反应的标准吉布斯自
由能(ΔGθ)和标准
生成焓(ΔHθ)随温
度变化如图。该过
程需要控制在
___________(填“a”“b”或c)进行,其原因是___________。
a.40 ℃~55 ℃ b.60 ℃~70 ℃ c.80 ℃~90 ℃
(5)常温下,为寻找“碳化水浸”的最佳pH,将37 g Li2CO3固体加入1 L水中,通入CO2使固体逐步溶解,当Li2CO3固体恰好完全溶解时,2c(CO)+c(HCO)≈1.0 mol·L-1,则溶液中的c(H+)为___________mol·L-1(保留两位有效数字,忽略体积变化)。
已知:Ksp(Li2CO3)=2.5×10-2, Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11
(6)“萃取”的原理是2HR+M2+2H++RM(M2+代表金属离子,HR代表萃取剂,则反萃取时加入的试剂为___________。
17.(14分)据悉,全球规模最大的乙醇生产装置在淮北启动生产,开创了一条煤炭清洁高效低碳利用的新路线。以煤的气化产物为原料合成无水乙醇的相关反应如下:
①:kJ?mol-1
②: kJ.mol-1
(1)反应的_______。
(2)以、、为原料,假设在投料比、压强不变条件下仅发生反应①、②,平衡时、、、的物质的量分数随温度变化如图所示。回答下列问题:①图中的曲线B代表的________________。
②当温度高于后,的物质的量分数随温度升高而降低的原因是________________。
③的平衡转化率随温度的升高_______(填“一直增大”、“一直减小”、“先增大后减小”、或“先减小后增大”)。
(3)一定温度下,向密闭容器中通入、和下发生反应①、②,平衡时CO的转化率为的物质的量为,则_______,反应②的___________(保留两位有效数字)。为用物质的量分数表示的平衡常数)
(4)在铜基催化剂表面可将电还原为乙醇等醇类物质,写出在酸性环境下将电还原为乙醇的电极反应方程式__________________________________________。
18. (14分)以化合物Ⅰ为原料,利用代谢工程和合成生物学技术可实现苯乙烯的绿色合成,进而制各种高级芳醇,合成路线如图(微生物酶、部分反应条件略)。
已知:
(1)化合物Ⅰ的分子式为___________;其中,含氮官能团的名称为___________。
(2)对化合物Ⅱ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
a ___________ ___________
b ___________ ___________ 酯化反应
(3)反应②的化学方程式可表示为:,化合物Z为___________。
(4)化合物Ⅳ的某同分异构体含有苯环,在核磁共振氢谱图上只有4组峰,且峰面积之比为1:2:2:3,其结构简式为___________(写一种)。
(5)关于上述合成路线中的相关物质及转化,下列说法正确的有_____(填标号)。
A. 化合物Ⅰ与混合,最多可生成2种二肽
B. 反应①中,有键和键的断裂
C. 反应③中,存在C原子杂化方式的改变,且有手性碳原子形成
D. 若反应④是原子利用率100%的反应,则另一反应物为直线形分子
(6)参考上述合成路线,以苯、为原料,合成。
①由合成,第一步反应的化学方程式为___________(注明反应条件)。
高三考前适应性测试化学参考答案
一、选择题( 14 * 3 == 42 分 )
1-5 CAABA 6-10 CBDAD 11-14 CCDB
二、填空题( 共 4 大题,计 58 分 )
15. (16分)(1) ①. 恒压滴液漏斗 ②. 碱石灰
(2)c (3)排除空气,防止、水解
(4)增大接触面积,加快反应速率 (5)降低沸点,防止分解
(6)90% (7)
16. (14分)(1) ①. +4 ②. 四 ③. Ⅷ (2)
(3)10LiNi0.5Co0.2Mn0.3O2+6C5Ni+2Co+3MnO+CO2↑+5Li2CO3
(4) ①. a ②. 高于60 ℃,ΔGθ>0,反应非自发进行
(5)2.1×10-9 (6)稀H2SO4
17.(14分)(1)
(2)①CO ②两者均为放热反应,温度升高均逆向移动,而反应①平衡逆向移动的程度大于反应②平衡逆向移动的程度 ③一直减小 (1分)
(3)①0.2 ②7.3 (4)①
18. (14分)(1) ①. ②. 氨基
(2) ①. ,催化剂,△ ②. 加成反应 ③. ,浓硫酸,加热 ④. (选用其他醇,且对应酯的结构简式书写正确均可) (3) (4)或 (5)BC
(6) ①.
同课章节目录
