海南省南阳市第一中学校2024-2025学年高三下学期第三次模拟考试化学试卷(含答案)
文档属性
| 名称 | 海南省南阳市第一中学校2024-2025学年高三下学期第三次模拟考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 00:18:52 | ||
图片预览


文档简介
南阳市一中2025年春期高三第三次模拟考试
化 学 试 题
可能用到的相对原子质量:H1 C 12 N14016 F 19 Si 28 Sc 45 Cu 64
一、单选题(每小题3分,共42分)
1.河南是华夏文明的重要发祥地,我国的59项世界遗产中河南有5项,犹如镶嵌在历史长河 中的璀璨明珠,散发着无尽的魅力与光芒。下列说法正确的是
A.“洛阳四野,山水之胜,龙门首焉。”龙门石窟是“中国石刻艺术的最高峰”,其主要成分 石灰岩可耐酸碱腐蚀
B. 安阳殷墟是中国商代晚期的都城遗址,是中国历史上最早的国家政治中心之一,其出 土的青铜器属于合金
C. 中岳嵩山,巍巍峻极,其上的嵩岳寺塔由青砖建造而成,青砖的主要成分二氧化硅是 两性氧化物
D. 驼铃声声,丝路绵延,河南段崤函古道是古代中原地区通往西域的重要通道,古代丝 绸可高温洗涤,杀菌消毒
2.宏观辨识与微观探析是化学学科核心素养之一。下列化学用语表达正确的是 LS 2s 2p
A. 轨道表示式[ 违背了洪特规则
B.邻羟基苯甲醛的分子内氢键:
COOH HOOC
(
C.
Hn
H C
)人 H.I 和Ⅱ是同一种物质
N H aN CH I
D. 由 E 原子和F 原子构成的气态团簇分子模型为 ,该物质化学式为EF
3.化学是以实验为基础的自然学科,具有安全和规范意识是重要的学科素养。下列说法正
确的是
A.在“钠在空气中燃烧”的探究实验中,无需标注实验图标:
B.体积分数为75%的酒精免洗消毒喷雾存放处应张贴警示标识:
第三次模拟化学试题 1
C. 洗涤盛有氯化钠废液的试管:
一废液
D.长期存放Na CO 标准溶液的仪器:
4.科技,特别是AI 的迅猛发展,正悄然改变着我们的生活与生产。下列说法正确的是
A.开发高浓度葡萄糖高效异构化制备果糖的新催化体系,葡萄糖转化为果糖的过程中原子 利用率为100%
B. 通过掺入5%的稀土元素钪成功研发出新型光解水催化材料。稀土元素一定位于周期表中 的 d 区
C.电解池阴极实现空气(N 和 O )电化学转化制硝酸。该过程属于氮的固定,氮的固定一定 是氮元素被氧化
D.宇树智能机器狗使用的关键材料PEEK(聚醚醚酮)是一种无机非金属材料
5.设NA为阿伏加德罗常数的值,下列说法正确的是 A.1molP 含σ键数目为4NA
B.1mol 硝基(—NO ) 与46g 二氧化氮(NO )所含的电子数均为23NA
C.1LpH=7 的醋酸铵溶液中,由水电离出的氢离子数为10-NA
D.100g质量分数为46%的酒精溶液中含有O—H 键的数目为NA
6. 千 金 子 甾 醇(C H O8) 具有抗癌、抗病毒、抗肥胖等作用,其分 子结构如图所示。下列关于千金子甾醇的说法错误的是
A.千金子甾醇分子中有8个手性碳原子 -0 CH B.1mol千金子甾醇最多能消耗3molNaOH
C.可用酸性KMnO 溶液检验千金子甾醇中的碳碳双键
D.千金子甾醇分子中碳原子的杂化方式有sp 和 sp 两种
7.双电子转移策略实现铁催化溴代烷烃的烷基羰基化反应的机理如下图所示,L 是一种中性配
体 ,I 的结构为
下列说法错误的是
A.I 中 Fe 的配位数为6
B.Ⅱ 为该反应的催化剂
C.Ⅲ→IV 的转化中铁的化合价发生改变
第三次模拟化学试题 2
D. 总催化反应方程式为
(
催化剂
)CO+RBr+R'CH→RCOOR′+HBr
8.河南省重要矿石 珍珠岩的主要成分可表示为R CaFe K ZY WX12, 其基态铁离子有5个未 成对电子,W 为最高价。X 、Y 、Z 、R、W 是原子序数依次增大的短周期主族元素,基态X 原 子的价层电子排布式为ns"np n,短周期中Y 的原子半径最大,R 的氧化物是两性氧化物。下列 叙述正确的是
A. 第一电离能:W>Z>R B.X的简单氢化物VSEPR 模型为V 形
C.熔点:Y X>WX D.离子键百分数:ZX9.下列化学用语错误的是
A. 酰胺在稀盐酸中水解:RCONH +H O+HCl—→RCOOH+NH Cl
B.CuSO 溶液渗透到含ZnS 的矿层中生成 ( CuS:ZnS(s)+Cu +(aq) 一 CuS(s)+Zn +(aq)
C. 制阿司匹林:
D. 电合成己二腈:
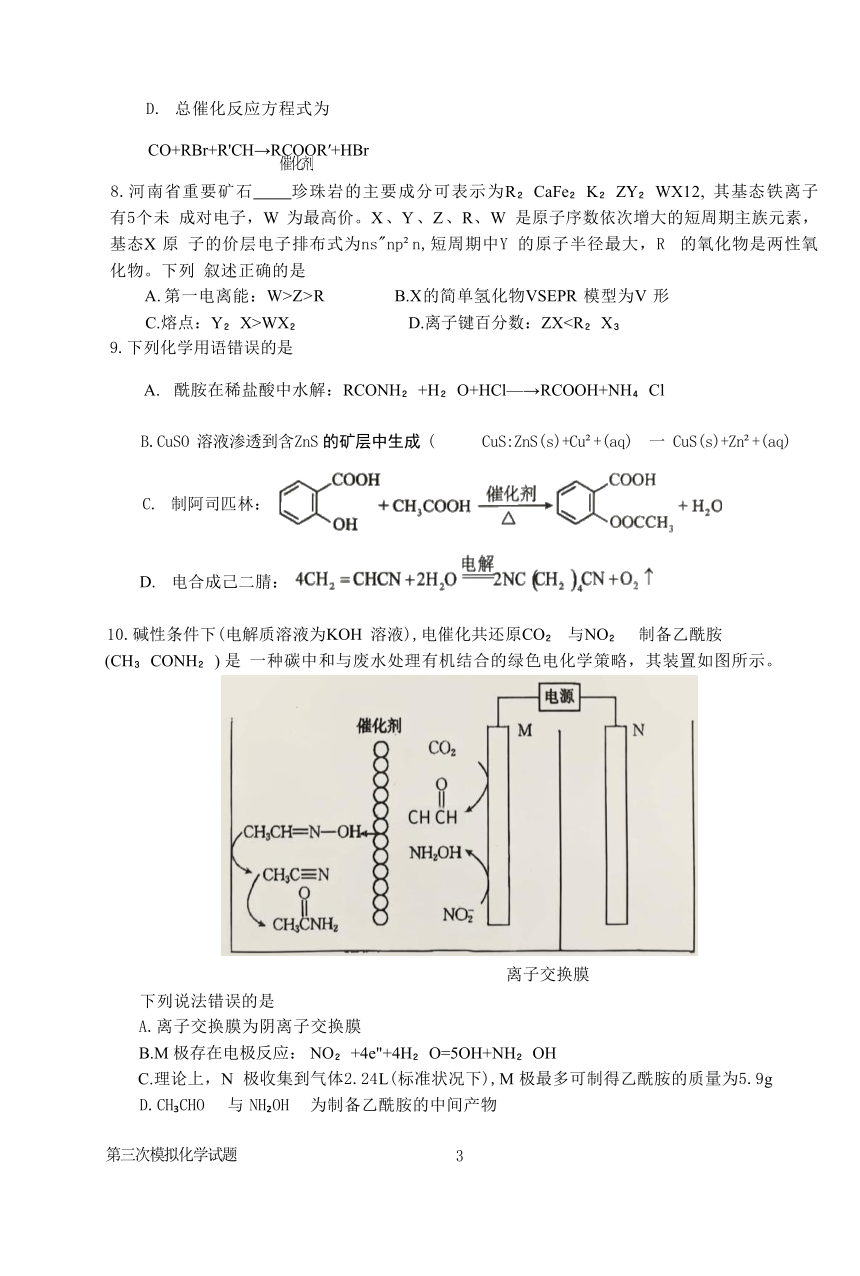
10.碱性条件下(电解质溶液为KOH 溶液),电催化共还原CO 与NO 制备乙酰胺(CH CONH ) 是 一种碳中和与废水处理有机结合的绿色电化学策略,其装置如图所示。
离子交换膜
下列说法错误的是
A.离子交换膜为阴离子交换膜
B.M 极存在电极反应: NO +4e"+4H O=5OH+NH OH
C.理论上,N 极收集到气体2.24L(标准状况下),M 极最多可制得乙酰胺的质量为5.9g
D.CH CHO 与 NH OH 为制备乙酰胺的中间产物
第三次模拟化学试题 3
11.下列实验操作能达到相应实验目的的是
选项 实验操作 实验目的
A 取涂改液(有机物)与KOH溶液混合加热,充分反应后取上层 清液,加入过量的稀硝酸酸化,再加入硝酸银溶液,观察现象 鉴定某涂改液中是否存 在含氯有机化合物
B 向酸性KMnO4溶液中滴加对甲基苯乙烯 证明乙烯基具有还原性
C 室温下,用pH试纸分别测定0.1mol · L K SO 和 0.1mol · L- K CO溶液的pH 比较S与C的非金属性强 弱
D 向滴有酚酞的NaOH溶液中通入足量的SO 验证SO 的漂白性
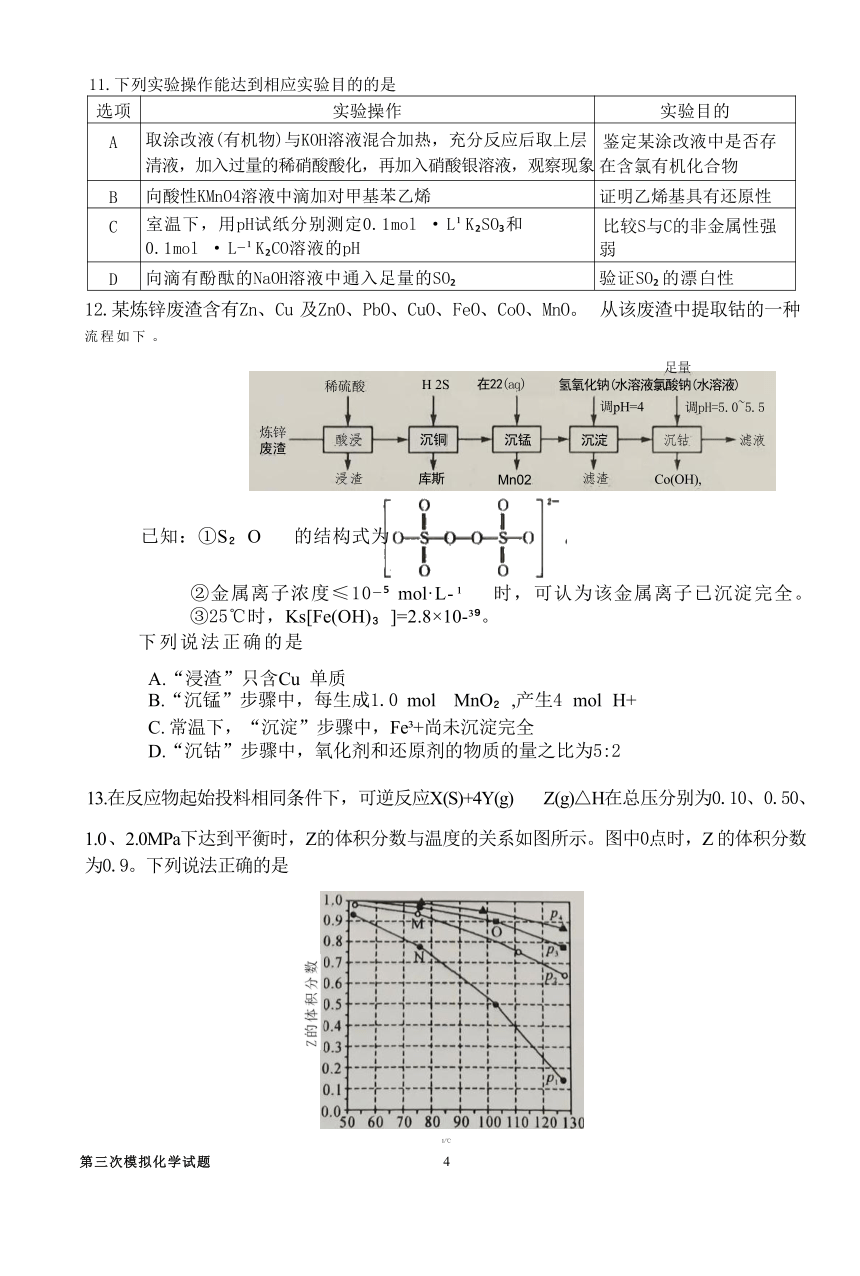
12.某炼锌废渣含有Zn、Cu 及ZnO、PbO、CuO、FeO、CoO、MnO。 从该废渣中提取钴的一种 流程如下 。
(
足量
炼锌
废渣
稀硫酸
酸浸
浸渣
H
2S
沉铜
库斯
在22
(aq)
沉锰
Mn02
氢氧化钠(水溶液氯酸钠(水溶液)
调
pH=4
调pH=5.0~5.5
沉淀
沉钴
滤液
滤渣
Co(OH),
)
已知:①S O 的结构式为
②金属离子浓度≤10- mol·L- 时,可认为该金属离子已沉淀完全。
③25℃时,Ks[Fe(OH) ]=2.8×10- 。
下列说法正确的是
A.“浸渣”只含Cu 单质
B.“沉锰”步骤中,每生成1.0 mol MnO ,产生4 mol H+
C. 常温下,“沉淀”步骤中,Fe +尚未沉淀完全
D.“沉钴”步骤中,氧化剂和还原剂的物质的量之比为5:2
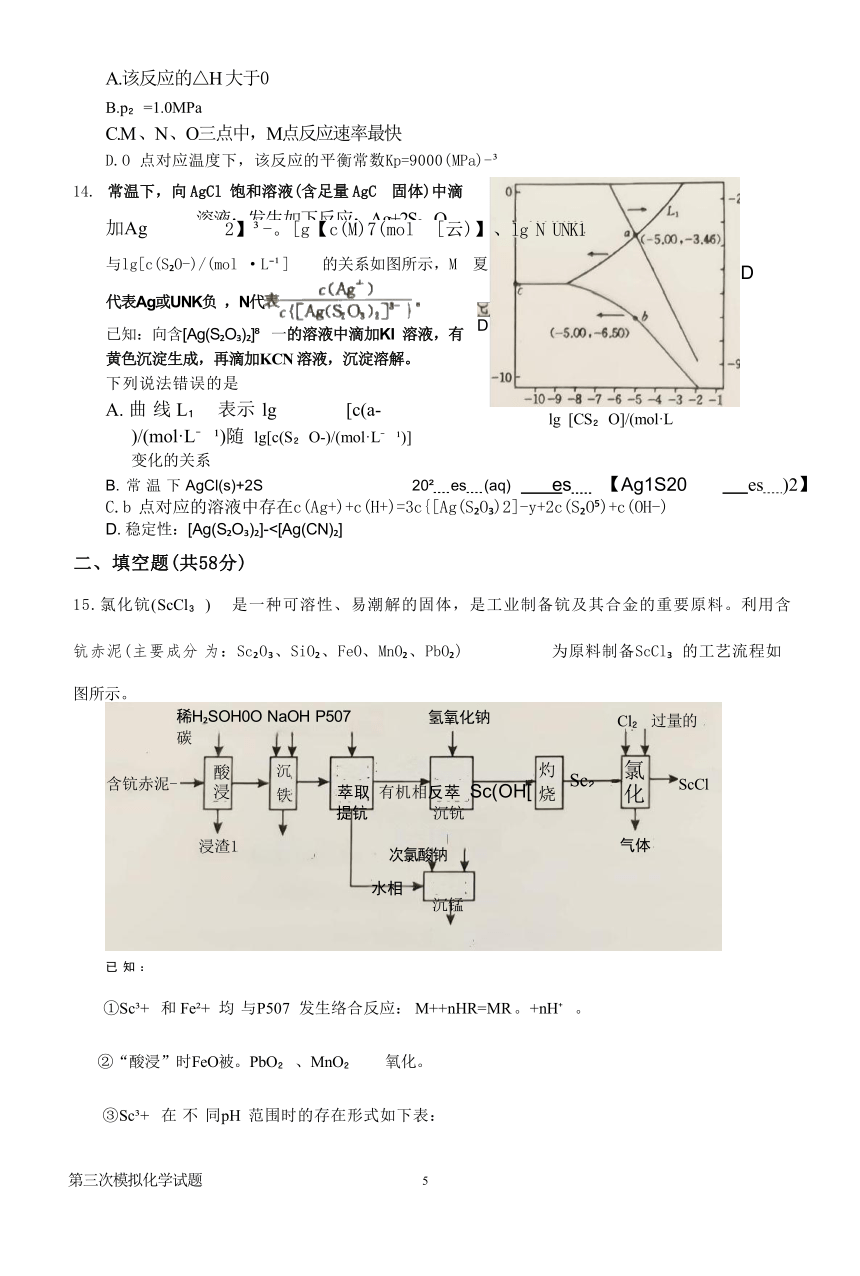
13.在反应物起始投料相同条件下,可逆反应X(S)+4Y(g) Z(g)△H在总压分别为0.10、0.50、
1.0 、2.0MPa下达到平衡时,Z的体积分数与温度的关系如图所示。图中0点时,Z 的体积分数 为0.9。下列说法正确的是
1/℃
第三次模拟化学试题 4
A.该反应的△H 大于0
B.p =1.0MPa
C.M 、N 、O三点中,M点反应速率最快
D.O 点对应温度下,该反应的平衡常数Kp=9000(MPa)-
(
加
Ag
2】 -。[g【c(M)7(
mol
[云)】、
与lg[c(S
O-)/(mol
·L
]
的关系如图所示,M
夏
) (
14.
常温下,向
AgCl
饱和溶液(含足量
AgC
固体)中滴
溶液;发生如下反应:
Ag+2S
O
)lg N UNK1
D
代表Ag或UNK负 ,N代
(
D
)已知:向含[Ag(S O ) ] 一的溶液中滴加KI 溶液,有 黄色沉淀生成,再滴加KCN 溶液,沉淀溶解。
下列说法错误的是
(
lg [CS O]/(mol·L-]
)A. 曲 线 L 表示 lg [c(a-)/(mol·L )随 lg[c(S O-)/(mol·L )] 变化的关系
B. 常 温 下 AgCl(s)+2S 20 es (aq) es 【Ag1S20 es )2】 C.b 点对应的溶液中存在c(Ag+)+c(H+)=3c{[Ag(S O )2]-y+2c(S O )+c(OH-)
D. 稳定性:[Ag(S O ) ]-<[Ag(CN) ]
二、填空题(共58分)
15.氯化钪(ScCl ) 是一种可溶性、易潮解的固体,是工业制备钪及其合金的重要原料。利用含
钪赤泥(主要成分 为:Sc O 、SiO 、FeO、MnO 、PbO ) 为原料制备ScCl 的工艺流程如
图所示。
(
稀
H
SOH0O
NaOH
P507
氢氧化钠
Cl
过量的碳
12
萃取
有机相
反萃
Sc
(
OH
[
提钪
沉钪
次氯酸钠
水相
沉锰
MnO
浸渣1
Fe(OH)
含钪赤泥-
氯化
灼
烧
酸浸
沉
铁
气体
Sc O
ScCl
)
已 知 :
①Sc + 和 Fe + 均 与P507 发生络合反应: M++nHR=MR 。+nH 。
②“酸浸”时FeO被。PbO 、MnO 氧化。
③Sc + 在 不 同pH 范围时的存在形式如下表:
第三次模拟化学试题 5
酸碱度 <4.2 4.2~5.5 5.5~6.5 6.5~9.8 >9.8
存在形式 Sc + Sc(OH) Sc(OH) Sc(OH) Sc(OH)
回答下列问题:
(1)“浸渣1”主要成分为SiO 和 (填化学式)。
(2)写出“酸浸”时MnO 氧化FeO 的离子方程式: 。
(3)“沉铁”和“萃取提钪”顺序不能颠倒,若顺序互换,产生的后果是 0
(4)“反萃沉钪”时pH 控制的范围是 ,“沉锰”时反应的离子方程式为 。
(5)加热条件下“氯化”时反应的化学方程式为 0
(6)ScF 和SCCl 晶体类型相同,其中ScF 的晶胞结构如图所示。已知ScF 熔点为1552℃, ScCl 熔点为960℃,试解释二者熔点差异的原因: 。ScF 晶体密度为ag·cm ,NA
表示阿伏加德罗常数的值,Sc 和 F 的半径分别为xpm 、ypm, 则ScF 晶体的空间利用率为
(用含a 、x 、y 和 NA的计算式表示,不必化简;
16. (15分)某实验小组为学习反应原理理论,设计了双、单核铜配合物的制备及转化实验,反 应原理如下。回答下列问题:
2CuCl +2C H N O→Cu Cl (C H N O) (一)配合物1的制备
CuCl +2C H N O→CuCl (C H N O)
第三次模拟化学试题 6
I.分别称取1.36G (0.01mol) 邻氨基苯甲酰胺
(0.01mol) 二水合氧
化铜CuCl ·2H O), 分别溶于30.0毫升无水乙醇和4.0毫升去离子水。
II.60℃水浴预热5min, 水浴加热和搅拌下,将邻氨基苯甲酰胺的乙醇溶液逐滴加入CuCl
的水溶液中,滴毕,继续保温搅拌10 min。
Ⅲ .减压抽滤,用5.0mL 无水乙醇洗涤产品2次。抽干后,将产品转移至蒸发皿中。
IV.60℃ 水浴上烘干30min, 得到产品。
V. 称量产品质量并计算产率。
(二)配合物2的制备
用冰水浴代替60℃恒温水浴,用冰水冷却的去离子水代替无水乙醇洗涤产品,其他重复上 述步骤,得到配合物2。
(1)邻氨基苯甲酰胺中所含元素的电负性由大到小的顺序是 (用元素符号表示)(1分)。
(2)邻氨基苯甲酰胺存在多种同分异构体,其中邻氨基苯甲酰胺的沸点 (填“>”、“<” 或“=”)对氨基苯甲酰胺的沸点,原因是 _o
(3)步骤II 中用无水乙醇洗涤的目的是 o
( 4 ) 根 据 实 验 制 备 原 理 , 结 合 下 图 , 解 释 温 度 与 两 种 配 合 物 的 生 成 关 系 : _; 在 一 定 条 件 下 , 配 合 物 2 可 完 全 转 化 为 配 合 物 1 , 写 出 该 反 应 的 化 学 方 程 式 :
(三)配合物1中Cu 含量的测定
I. 配 制C mol·L 的EDTA标准溶液。
。
Ⅱ.称取mg 配合物1并溶解,转移并定容于250 mL容量瓶中,摇匀。
II. 准确移取25.00 mL该溶液于锥形瓶中,依次加入20.0 mL无水乙醇、5滴PAN 指示剂 和20.0 mL邻苯二甲酸盐缓冲液(pH=5.6) 用 EDTA标准溶液滴定至溶液由紫色变为亮绿色即 为终点,重复滴定3次,平均消耗VmLEDTA标准溶液。
已知:EDTA与Cu +的化学计量数之比为1:1。
(5)配制 EDTA 标准溶液时需要用到下图仪器中的有 (填标号)。
第三次模拟化学试题 7
第三次模拟化学试题 8
A.
B.
C.
D.
(6)所得配合物1中铜元素的质量分数为 ×100%。
17.在“双碳”目标的大背景下,积极开展二氧化碳资源化利用的研究显得尤为重要。二氧化碳加氢 制甲醇是二氧化碳资源化利用的重要途径,相关反应的热化学方程式如下:
反应1:3H (g)+CO g) 一 CH OH(g) 十H O(g)△H =49.0kJ·mol
反应2:H (g)+CO (g)=Cog) 十H O(g)△H = 十41.2kJ·mol
反应3:2H (g)+CO(g) CH OH(g)△H
回答下列问题:
(1)反应3的△H =. kJ°mol 。 已知反应1、反应3的平衡常数分别为K 、K ,则反应2 的平衡常数K =. (用含K 、K 的式子表示)。
(2)反应3的△S 0(填“>”“<”或“=”)。从反应条件入手,能提高反应3CH OH(g) 平衡体积分 数的措施是 (写出一种)。
(3)以投料比n(H ):n(CO,)=3:1 进行投料,在恒温恒容的容器中只发生反应1。下列说法正确的 是_ (填标号)。
A.在反应达到平衡时,向该恒温恒容容器内再充入一定量进料比n(H ):n(CO )=3:1的 H 和 CO 的混合气体,再次达到平衡时,CH OH的体积分数不变
B.在反应达到平衡时,向该恒温恒容容器内充入一定量的氩气,平衡不移动
C.单位时间内消耗0.1molCO 同时生成0.1molCH OH, 则反应达到平衡状态
D.在反应达到平衡时,向容器内再充入一定量的H , 再次达到平衡时,H 的转化率降低
(4)在二氧化碳制甲醇的反应中,保持催化剂的活性非常重要,科学家目前在此方向持续开展 研究。In O (氧化铟)是其中的一种催化剂。天津大学的科研团队发现,往纯净的In O 中掺杂一定
量的Ni 有助于保持催化剂的活性,可提高单位时间内CO 的转化率。
(
40r
In O,
30
20-
10-
鲁
0上
240
2.5%Ni@In
20
it
10.0%Ni@In
20
it
280
300
320
340
260
)
TI℃
图 1
图1,纵坐标为二氧化碳的转化率,将掺杂0%、2.5%、10%Ni的In O 催化剂依次编号为1、2、
3,当温度在260~340℃之间时,催化剂1、2、3的催化能力由强到弱的顺序为 。
(5)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按投料比 n(H ):n(CO )=3:1 进行投料,分别在0.1MPa 和1MPa 下进行反应(反应1和反应2)。实验中温度对平 衡组成中的CO 和CH OH 的影响如图3所示。
①1MPa 时,表示CH OH 和CO的平衡组成随温度变化关系的曲线分别是 _、 _。
M点平衡组成含量高于N点,原因是 。
②当CO和CH OH的平衡物质的量分数都为0.1时,该温度下反应2的压强平衡常数 Kp= 。
(
,a
b
0.1
M,
d
200
300
400
N
700
600
500
C
)
温 度 / ℃
图 3
18.如图所示,α-非兰烃(相对分子质量为136)可以通过一系列变化转化为可用作锂电池电解液的 高聚物H。
第三次模拟化学试题 9
R R
已 知 : C CHR CHR 高锰/小时 C=0+RCOOH
回答下列问题:
(1)A 中官能团的名称为 。 α -非兰烃的结构简式 为 。
(2)α-非兰烃与等物质的量的Br, 进行加成反应,产物共有 种 (不考虑立体异构)。
(3)C→M 的反应类型为 。M 的结构简式 为 。
(4)F→G 的化学方程式为 。G 的化学名称为 。
(5)符合下列条件的化合物N 有 种 (不考虑立体异构);
①N的分子式为C H O ;
②1molN 与足量碳酸氢钠溶液反应,生成的气体在标准状况下的体积为44.8L。
其 中 核 磁 共 振 氢 谱 有 3 组 峰 , 峰 面 积 之 比 为 3 : 1 : 1 的 化 合 物 的 结 构 简 式 为
(6)设计以一氯环丁烷()为原料制备
(
___________
)的合成路线: (无机试
剂任选)。
第三次模拟化学试题 10
高三化学第三次模拟答案
题号 1 2 3 4 5 6 7
答案 B D B A B C C
题号 8 9 10 11 12 13 14
答案 A C C A B D C
15 . (14分,除标注外每空两分)
(1)PbSO (1 分 ) (2)MnO +2FeO+8H =Mn ++2Fe ++4H O
(3)无法将Sc + 和Fe + 分离开来(合理即可) (4)① . 6 . 5~9 . 8 (1分)
②.Mn ++C1O +2OH =MnO ↓+H O+Cl-
(6) ①.二者均为离子晶体,由于离子半径: FScCl , 熔
点:ScF >ScCl (合理即可)
16. (14分,除标注外每空两分)
(1)O>N>C>H(1 分 )
( 2 ) < ( 1 分 ) (邻氨基苯甲酰胺易形成分子内氢键,沸点较低,)而对氨基苯甲酰胺易形 第三次化学模拟答案
成分子间氢键,沸点较高
(3)除去未反应的邻氨基苯甲酰胺,减少产品损耗,加快干燥速率等
(4)与配合物2相比,配合物1能量更低,能垒更高,反应活化能更大,反应需要较高温,故 较 高 温 时 配 合 物 1 更 易 生 成 , 较 低 温 时 配 合 物 2 更 易 生 成
2CuCl (C H N O) 一定条件下→ Cu Cl (C H N O) +2C H N O [ 或
CuCI (C H N O) +CuCl
一 定 条 件 下 >Cu Cl C,H N O)]
(5)BD
⑥
17. (15分,除标注外每空两分)
(1)—90.2 K /K (1 分 ) (2)<(1分) 增大压强(或适当降低温度)(1分)
(3)BD(2 分,少选且正确的,给1分;选错或多选的,不给分) (4)2>3>1
(5)①a(1 分 ) d(1 分 ) M 点压强小于N 点压强,温度相同时,减小压强(从N 点 到M 点 ) 反应1平衡逆向移动, CO 和 H 的物质的量分数增大,H O 的物质的量分数减小,反应
2平衡正向移动, CO 的物质的量分数增大(或其他正确答案) ②0.4
1 8 . ( 1 5 分 , 除 标 注 外 每 空 两 分 )
( 1 ) 羧 基 ( 1 分 )
( 2 ) 3 ( 1 分 )
( 3 ) 取 代 反 应 ( 或 酯 化 反 应 ) ( 1 分 ) ( 1 分 )
(4) ) 丙 烯 酸 甲 酯 ( 1 分 )
化 学 试 题
可能用到的相对原子质量:H1 C 12 N14016 F 19 Si 28 Sc 45 Cu 64
一、单选题(每小题3分,共42分)
1.河南是华夏文明的重要发祥地,我国的59项世界遗产中河南有5项,犹如镶嵌在历史长河 中的璀璨明珠,散发着无尽的魅力与光芒。下列说法正确的是
A.“洛阳四野,山水之胜,龙门首焉。”龙门石窟是“中国石刻艺术的最高峰”,其主要成分 石灰岩可耐酸碱腐蚀
B. 安阳殷墟是中国商代晚期的都城遗址,是中国历史上最早的国家政治中心之一,其出 土的青铜器属于合金
C. 中岳嵩山,巍巍峻极,其上的嵩岳寺塔由青砖建造而成,青砖的主要成分二氧化硅是 两性氧化物
D. 驼铃声声,丝路绵延,河南段崤函古道是古代中原地区通往西域的重要通道,古代丝 绸可高温洗涤,杀菌消毒
2.宏观辨识与微观探析是化学学科核心素养之一。下列化学用语表达正确的是 LS 2s 2p
A. 轨道表示式[ 违背了洪特规则
B.邻羟基苯甲醛的分子内氢键:
COOH HOOC
(
C.
Hn
H C
)人 H.I 和Ⅱ是同一种物质
N H aN CH I
D. 由 E 原子和F 原子构成的气态团簇分子模型为 ,该物质化学式为EF
3.化学是以实验为基础的自然学科,具有安全和规范意识是重要的学科素养。下列说法正
确的是
A.在“钠在空气中燃烧”的探究实验中,无需标注实验图标:
B.体积分数为75%的酒精免洗消毒喷雾存放处应张贴警示标识:
第三次模拟化学试题 1
C. 洗涤盛有氯化钠废液的试管:
一废液
D.长期存放Na CO 标准溶液的仪器:
4.科技,特别是AI 的迅猛发展,正悄然改变着我们的生活与生产。下列说法正确的是
A.开发高浓度葡萄糖高效异构化制备果糖的新催化体系,葡萄糖转化为果糖的过程中原子 利用率为100%
B. 通过掺入5%的稀土元素钪成功研发出新型光解水催化材料。稀土元素一定位于周期表中 的 d 区
C.电解池阴极实现空气(N 和 O )电化学转化制硝酸。该过程属于氮的固定,氮的固定一定 是氮元素被氧化
D.宇树智能机器狗使用的关键材料PEEK(聚醚醚酮)是一种无机非金属材料
5.设NA为阿伏加德罗常数的值,下列说法正确的是 A.1molP 含σ键数目为4NA
B.1mol 硝基(—NO ) 与46g 二氧化氮(NO )所含的电子数均为23NA
C.1LpH=7 的醋酸铵溶液中,由水电离出的氢离子数为10-NA
D.100g质量分数为46%的酒精溶液中含有O—H 键的数目为NA
6. 千 金 子 甾 醇(C H O8) 具有抗癌、抗病毒、抗肥胖等作用,其分 子结构如图所示。下列关于千金子甾醇的说法错误的是
A.千金子甾醇分子中有8个手性碳原子 -0 CH B.1mol千金子甾醇最多能消耗3molNaOH
C.可用酸性KMnO 溶液检验千金子甾醇中的碳碳双键
D.千金子甾醇分子中碳原子的杂化方式有sp 和 sp 两种
7.双电子转移策略实现铁催化溴代烷烃的烷基羰基化反应的机理如下图所示,L 是一种中性配
体 ,I 的结构为
下列说法错误的是
A.I 中 Fe 的配位数为6
B.Ⅱ 为该反应的催化剂
C.Ⅲ→IV 的转化中铁的化合价发生改变
第三次模拟化学试题 2
D. 总催化反应方程式为
(
催化剂
)CO+RBr+R'CH→RCOOR′+HBr
8.河南省重要矿石 珍珠岩的主要成分可表示为R CaFe K ZY WX12, 其基态铁离子有5个未 成对电子,W 为最高价。X 、Y 、Z 、R、W 是原子序数依次增大的短周期主族元素,基态X 原 子的价层电子排布式为ns"np n,短周期中Y 的原子半径最大,R 的氧化物是两性氧化物。下列 叙述正确的是
A. 第一电离能:W>Z>R B.X的简单氢化物VSEPR 模型为V 形
C.熔点:Y X>WX D.离子键百分数:ZX
A. 酰胺在稀盐酸中水解:RCONH +H O+HCl—→RCOOH+NH Cl
B.CuSO 溶液渗透到含ZnS 的矿层中生成 ( CuS:ZnS(s)+Cu +(aq) 一 CuS(s)+Zn +(aq)
C. 制阿司匹林:
D. 电合成己二腈:
10.碱性条件下(电解质溶液为KOH 溶液),电催化共还原CO 与NO 制备乙酰胺(CH CONH ) 是 一种碳中和与废水处理有机结合的绿色电化学策略,其装置如图所示。
离子交换膜
下列说法错误的是
A.离子交换膜为阴离子交换膜
B.M 极存在电极反应: NO +4e"+4H O=5OH+NH OH
C.理论上,N 极收集到气体2.24L(标准状况下),M 极最多可制得乙酰胺的质量为5.9g
D.CH CHO 与 NH OH 为制备乙酰胺的中间产物
第三次模拟化学试题 3
11.下列实验操作能达到相应实验目的的是
选项 实验操作 实验目的
A 取涂改液(有机物)与KOH溶液混合加热,充分反应后取上层 清液,加入过量的稀硝酸酸化,再加入硝酸银溶液,观察现象 鉴定某涂改液中是否存 在含氯有机化合物
B 向酸性KMnO4溶液中滴加对甲基苯乙烯 证明乙烯基具有还原性
C 室温下,用pH试纸分别测定0.1mol · L K SO 和 0.1mol · L- K CO溶液的pH 比较S与C的非金属性强 弱
D 向滴有酚酞的NaOH溶液中通入足量的SO 验证SO 的漂白性
12.某炼锌废渣含有Zn、Cu 及ZnO、PbO、CuO、FeO、CoO、MnO。 从该废渣中提取钴的一种 流程如下 。
(
足量
炼锌
废渣
稀硫酸
酸浸
浸渣
H
2S
沉铜
库斯
在22
(aq)
沉锰
Mn02
氢氧化钠(水溶液氯酸钠(水溶液)
调
pH=4
调pH=5.0~5.5
沉淀
沉钴
滤液
滤渣
Co(OH),
)
已知:①S O 的结构式为
②金属离子浓度≤10- mol·L- 时,可认为该金属离子已沉淀完全。
③25℃时,Ks[Fe(OH) ]=2.8×10- 。
下列说法正确的是
A.“浸渣”只含Cu 单质
B.“沉锰”步骤中,每生成1.0 mol MnO ,产生4 mol H+
C. 常温下,“沉淀”步骤中,Fe +尚未沉淀完全
D.“沉钴”步骤中,氧化剂和还原剂的物质的量之比为5:2
13.在反应物起始投料相同条件下,可逆反应X(S)+4Y(g) Z(g)△H在总压分别为0.10、0.50、
1.0 、2.0MPa下达到平衡时,Z的体积分数与温度的关系如图所示。图中0点时,Z 的体积分数 为0.9。下列说法正确的是
1/℃
第三次模拟化学试题 4
A.该反应的△H 大于0
B.p =1.0MPa
C.M 、N 、O三点中,M点反应速率最快
D.O 点对应温度下,该反应的平衡常数Kp=9000(MPa)-
(
加
Ag
2】 -。[g【c(M)7(
mol
[云)】、
与lg[c(S
O-)/(mol
·L
]
的关系如图所示,M
夏
) (
14.
常温下,向
AgCl
饱和溶液(含足量
AgC
固体)中滴
溶液;发生如下反应:
Ag+2S
O
)lg N UNK1
D
代表Ag或UNK负 ,N代
(
D
)已知:向含[Ag(S O ) ] 一的溶液中滴加KI 溶液,有 黄色沉淀生成,再滴加KCN 溶液,沉淀溶解。
下列说法错误的是
(
lg [CS O]/(mol·L-]
)A. 曲 线 L 表示 lg [c(a-)/(mol·L )随 lg[c(S O-)/(mol·L )] 变化的关系
B. 常 温 下 AgCl(s)+2S 20 es (aq) es 【Ag1S20 es )2】 C.b 点对应的溶液中存在c(Ag+)+c(H+)=3c{[Ag(S O )2]-y+2c(S O )+c(OH-)
D. 稳定性:[Ag(S O ) ]-<[Ag(CN) ]
二、填空题(共58分)
15.氯化钪(ScCl ) 是一种可溶性、易潮解的固体,是工业制备钪及其合金的重要原料。利用含
钪赤泥(主要成分 为:Sc O 、SiO 、FeO、MnO 、PbO ) 为原料制备ScCl 的工艺流程如
图所示。
(
稀
H
SOH0O
NaOH
P507
氢氧化钠
Cl
过量的碳
12
萃取
有机相
反萃
Sc
(
OH
[
提钪
沉钪
次氯酸钠
水相
沉锰
MnO
浸渣1
Fe(OH)
含钪赤泥-
氯化
灼
烧
酸浸
沉
铁
气体
Sc O
ScCl
)
已 知 :
①Sc + 和 Fe + 均 与P507 发生络合反应: M++nHR=MR 。+nH 。
②“酸浸”时FeO被。PbO 、MnO 氧化。
③Sc + 在 不 同pH 范围时的存在形式如下表:
第三次模拟化学试题 5
酸碱度 <4.2 4.2~5.5 5.5~6.5 6.5~9.8 >9.8
存在形式 Sc + Sc(OH) Sc(OH) Sc(OH) Sc(OH)
回答下列问题:
(1)“浸渣1”主要成分为SiO 和 (填化学式)。
(2)写出“酸浸”时MnO 氧化FeO 的离子方程式: 。
(3)“沉铁”和“萃取提钪”顺序不能颠倒,若顺序互换,产生的后果是 0
(4)“反萃沉钪”时pH 控制的范围是 ,“沉锰”时反应的离子方程式为 。
(5)加热条件下“氯化”时反应的化学方程式为 0
(6)ScF 和SCCl 晶体类型相同,其中ScF 的晶胞结构如图所示。已知ScF 熔点为1552℃, ScCl 熔点为960℃,试解释二者熔点差异的原因: 。ScF 晶体密度为ag·cm ,NA
表示阿伏加德罗常数的值,Sc 和 F 的半径分别为xpm 、ypm, 则ScF 晶体的空间利用率为
(用含a 、x 、y 和 NA的计算式表示,不必化简;
16. (15分)某实验小组为学习反应原理理论,设计了双、单核铜配合物的制备及转化实验,反 应原理如下。回答下列问题:
2CuCl +2C H N O→Cu Cl (C H N O) (一)配合物1的制备
CuCl +2C H N O→CuCl (C H N O)
第三次模拟化学试题 6
I.分别称取1.36G (0.01mol) 邻氨基苯甲酰胺
(0.01mol) 二水合氧
化铜CuCl ·2H O), 分别溶于30.0毫升无水乙醇和4.0毫升去离子水。
II.60℃水浴预热5min, 水浴加热和搅拌下,将邻氨基苯甲酰胺的乙醇溶液逐滴加入CuCl
的水溶液中,滴毕,继续保温搅拌10 min。
Ⅲ .减压抽滤,用5.0mL 无水乙醇洗涤产品2次。抽干后,将产品转移至蒸发皿中。
IV.60℃ 水浴上烘干30min, 得到产品。
V. 称量产品质量并计算产率。
(二)配合物2的制备
用冰水浴代替60℃恒温水浴,用冰水冷却的去离子水代替无水乙醇洗涤产品,其他重复上 述步骤,得到配合物2。
(1)邻氨基苯甲酰胺中所含元素的电负性由大到小的顺序是 (用元素符号表示)(1分)。
(2)邻氨基苯甲酰胺存在多种同分异构体,其中邻氨基苯甲酰胺的沸点 (填“>”、“<” 或“=”)对氨基苯甲酰胺的沸点,原因是 _o
(3)步骤II 中用无水乙醇洗涤的目的是 o
( 4 ) 根 据 实 验 制 备 原 理 , 结 合 下 图 , 解 释 温 度 与 两 种 配 合 物 的 生 成 关 系 : _; 在 一 定 条 件 下 , 配 合 物 2 可 完 全 转 化 为 配 合 物 1 , 写 出 该 反 应 的 化 学 方 程 式 :
(三)配合物1中Cu 含量的测定
I. 配 制C mol·L 的EDTA标准溶液。
。
Ⅱ.称取mg 配合物1并溶解,转移并定容于250 mL容量瓶中,摇匀。
II. 准确移取25.00 mL该溶液于锥形瓶中,依次加入20.0 mL无水乙醇、5滴PAN 指示剂 和20.0 mL邻苯二甲酸盐缓冲液(pH=5.6) 用 EDTA标准溶液滴定至溶液由紫色变为亮绿色即 为终点,重复滴定3次,平均消耗VmLEDTA标准溶液。
已知:EDTA与Cu +的化学计量数之比为1:1。
(5)配制 EDTA 标准溶液时需要用到下图仪器中的有 (填标号)。
第三次模拟化学试题 7
第三次模拟化学试题 8
A.
B.
C.
D.
(6)所得配合物1中铜元素的质量分数为 ×100%。
17.在“双碳”目标的大背景下,积极开展二氧化碳资源化利用的研究显得尤为重要。二氧化碳加氢 制甲醇是二氧化碳资源化利用的重要途径,相关反应的热化学方程式如下:
反应1:3H (g)+CO g) 一 CH OH(g) 十H O(g)△H =49.0kJ·mol
反应2:H (g)+CO (g)=Cog) 十H O(g)△H = 十41.2kJ·mol
反应3:2H (g)+CO(g) CH OH(g)△H
回答下列问题:
(1)反应3的△H =. kJ°mol 。 已知反应1、反应3的平衡常数分别为K 、K ,则反应2 的平衡常数K =. (用含K 、K 的式子表示)。
(2)反应3的△S 0(填“>”“<”或“=”)。从反应条件入手,能提高反应3CH OH(g) 平衡体积分 数的措施是 (写出一种)。
(3)以投料比n(H ):n(CO,)=3:1 进行投料,在恒温恒容的容器中只发生反应1。下列说法正确的 是_ (填标号)。
A.在反应达到平衡时,向该恒温恒容容器内再充入一定量进料比n(H ):n(CO )=3:1的 H 和 CO 的混合气体,再次达到平衡时,CH OH的体积分数不变
B.在反应达到平衡时,向该恒温恒容容器内充入一定量的氩气,平衡不移动
C.单位时间内消耗0.1molCO 同时生成0.1molCH OH, 则反应达到平衡状态
D.在反应达到平衡时,向容器内再充入一定量的H , 再次达到平衡时,H 的转化率降低
(4)在二氧化碳制甲醇的反应中,保持催化剂的活性非常重要,科学家目前在此方向持续开展 研究。In O (氧化铟)是其中的一种催化剂。天津大学的科研团队发现,往纯净的In O 中掺杂一定
量的Ni 有助于保持催化剂的活性,可提高单位时间内CO 的转化率。
(
40r
In O,
30
20-
10-
鲁
0上
240
2.5%Ni@In
20
it
10.0%Ni@In
20
it
280
300
320
340
260
)
TI℃
图 1
图1,纵坐标为二氧化碳的转化率,将掺杂0%、2.5%、10%Ni的In O 催化剂依次编号为1、2、
3,当温度在260~340℃之间时,催化剂1、2、3的催化能力由强到弱的顺序为 。
(5)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按投料比 n(H ):n(CO )=3:1 进行投料,分别在0.1MPa 和1MPa 下进行反应(反应1和反应2)。实验中温度对平 衡组成中的CO 和CH OH 的影响如图3所示。
①1MPa 时,表示CH OH 和CO的平衡组成随温度变化关系的曲线分别是 _、 _。
M点平衡组成含量高于N点,原因是 。
②当CO和CH OH的平衡物质的量分数都为0.1时,该温度下反应2的压强平衡常数 Kp= 。
(
,a
b
0.1
M,
d
200
300
400
N
700
600
500
C
)
温 度 / ℃
图 3
18.如图所示,α-非兰烃(相对分子质量为136)可以通过一系列变化转化为可用作锂电池电解液的 高聚物H。
第三次模拟化学试题 9
R R
已 知 : C CHR CHR 高锰/小时 C=0+RCOOH
回答下列问题:
(1)A 中官能团的名称为 。 α -非兰烃的结构简式 为 。
(2)α-非兰烃与等物质的量的Br, 进行加成反应,产物共有 种 (不考虑立体异构)。
(3)C→M 的反应类型为 。M 的结构简式 为 。
(4)F→G 的化学方程式为 。G 的化学名称为 。
(5)符合下列条件的化合物N 有 种 (不考虑立体异构);
①N的分子式为C H O ;
②1molN 与足量碳酸氢钠溶液反应,生成的气体在标准状况下的体积为44.8L。
其 中 核 磁 共 振 氢 谱 有 3 组 峰 , 峰 面 积 之 比 为 3 : 1 : 1 的 化 合 物 的 结 构 简 式 为
(6)设计以一氯环丁烷()为原料制备
(
___________
)的合成路线: (无机试
剂任选)。
第三次模拟化学试题 10
高三化学第三次模拟答案
题号 1 2 3 4 5 6 7
答案 B D B A B C C
题号 8 9 10 11 12 13 14
答案 A C C A B D C
15 . (14分,除标注外每空两分)
(1)PbSO (1 分 ) (2)MnO +2FeO+8H =Mn ++2Fe ++4H O
(3)无法将Sc + 和Fe + 分离开来(合理即可) (4)① . 6 . 5~9 . 8 (1分)
②.Mn ++C1O +2OH =MnO ↓+H O+Cl-
(6) ①.二者均为离子晶体,由于离子半径: F
点:ScF >ScCl (合理即可)
16. (14分,除标注外每空两分)
(1)O>N>C>H(1 分 )
( 2 ) < ( 1 分 ) (邻氨基苯甲酰胺易形成分子内氢键,沸点较低,)而对氨基苯甲酰胺易形 第三次化学模拟答案
成分子间氢键,沸点较高
(3)除去未反应的邻氨基苯甲酰胺,减少产品损耗,加快干燥速率等
(4)与配合物2相比,配合物1能量更低,能垒更高,反应活化能更大,反应需要较高温,故 较 高 温 时 配 合 物 1 更 易 生 成 , 较 低 温 时 配 合 物 2 更 易 生 成
2CuCl (C H N O) 一定条件下→ Cu Cl (C H N O) +2C H N O [ 或
CuCI (C H N O) +CuCl
一 定 条 件 下 >Cu Cl C,H N O)]
(5)BD
⑥
17. (15分,除标注外每空两分)
(1)—90.2 K /K (1 分 ) (2)<(1分) 增大压强(或适当降低温度)(1分)
(3)BD(2 分,少选且正确的,给1分;选错或多选的,不给分) (4)2>3>1
(5)①a(1 分 ) d(1 分 ) M 点压强小于N 点压强,温度相同时,减小压强(从N 点 到M 点 ) 反应1平衡逆向移动, CO 和 H 的物质的量分数增大,H O 的物质的量分数减小,反应
2平衡正向移动, CO 的物质的量分数增大(或其他正确答案) ②0.4
1 8 . ( 1 5 分 , 除 标 注 外 每 空 两 分 )
( 1 ) 羧 基 ( 1 分 )
( 2 ) 3 ( 1 分 )
( 3 ) 取 代 反 应 ( 或 酯 化 反 应 ) ( 1 分 ) ( 1 分 )
(4) ) 丙 烯 酸 甲 酯 ( 1 分 )
同课章节目录
