长沙市长郡中学2025届高三下学期保温卷(二)化学试卷(图片版,含解析)
文档属性
| 名称 | 长沙市长郡中学2025届高三下学期保温卷(二)化学试卷(图片版,含解析) |  | |
| 格式 | |||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 21:33:49 | ||
图片预览

文档简介
化学保温训练(二)
一、单项选择题
8.下列实验操作或设计正确的是()
几NaOH溶液
标准液
洗瓶
蒸偏水
盐酸溶液
样品溶液
A,滴定终点前用洗瓶冲洗
B.用NaOH标准溶液
C.从食盐水中提
D.验证CL,的
锥形瓶内壁,减小误差
滴定未知浓度盐酸
取NaCl固体
助燃性
9.双电子转移策略实现铁催化溴代烷烃的烷基羰基化反应的机理如下图所示,L是一种中性配体,I的
CO
Fe,(CO)
OC、
结构为ocFe
Fe....CO
LCO.Cs,CO,
HBr
FeLCO)
R-Br
0
,C0
下列说法错误的是()
还原消除
氧化加成
A.I中Fe的配位数为6
H-FcL(CO)
B.Ⅱ为该反应的催化剂
Br V
R-FeL(CO)
Br I
C.Π→V的转化中铁的化合价发生改变
D.总催化反应方程式为
亲核进攻
猴基化一CO
CO+RBr+ROHRCOOR+HBr
R'-OH
FeL(CO)
IV
10.一种基于K*几*P℉多离子策略的钾型双离子电池,其示意图如下,充电过程中K*、L*到达锡电极,
与电极发生合金化反应,同时P℉到达石墨电极,插层进入石墨层间。下列说法错误的是()
电解液
月
x●L
●
PFs
A.放电时,Sn为负极
B.充电时,石墨电极反应式为C。+P℉e=C.P
C.放电时,当有1mol电子转移时锡电极质量减少39g
D.锂、钾与锡可形成合金,有利于电子的传输,极大的提升电池倍率性能及可逆容量
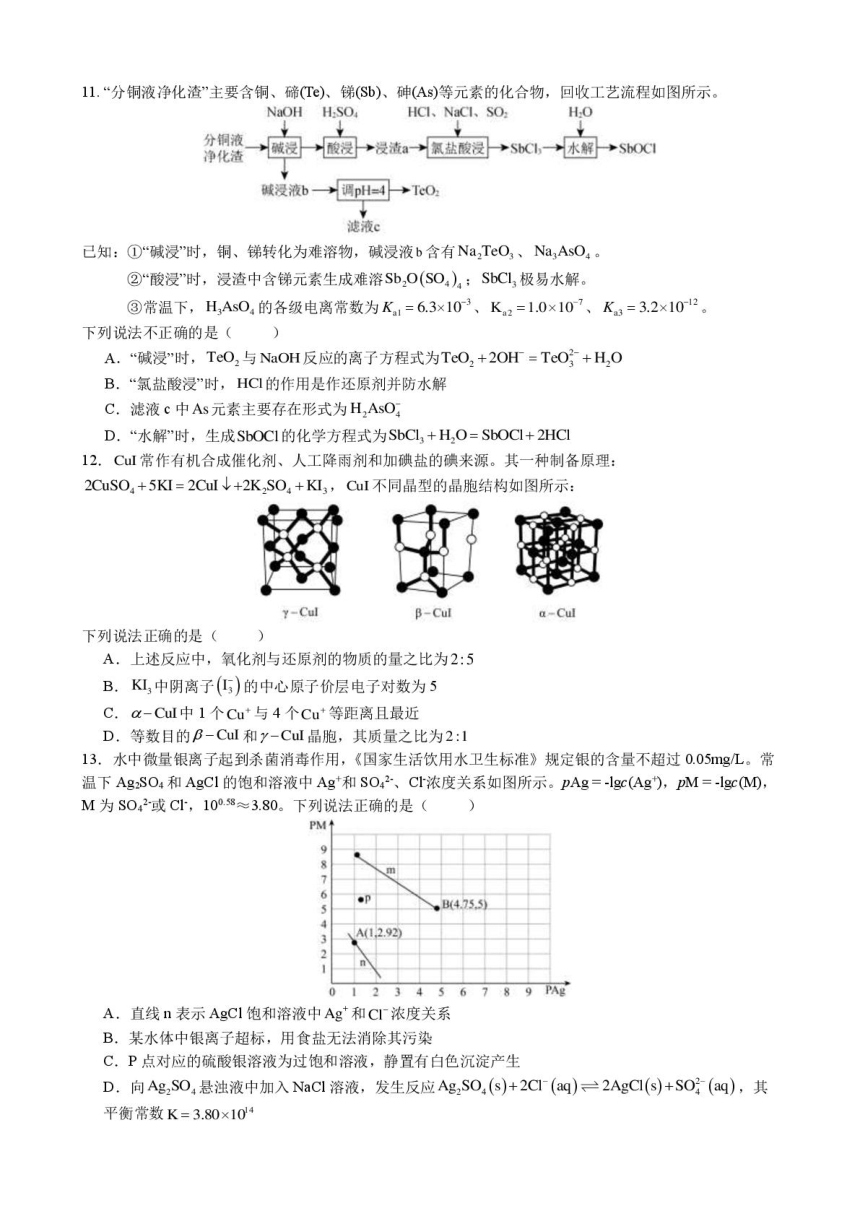
11.“分铜液净化渣”主要含铜、碲(T )、锑(S)、砷(As)等元素的化合物,回收工艺流程如图所示。
NaOH HSO
HCl、NaCI、SOa
HO
体视清→园-园浸流→区益酸园→s一→农的→s0
碱浸液b一→调pH=4→TcO,
滤液c
己知:①“碱浸时,铜、锑转化为难溶物,碱浸液b含有Na2TeO3、Na3AsO4。
②“酸浸时,浸渣中含锑元素生成难溶SbO(SO4)a:SbCl3极易水解。
③常温下,H3As0的各级电离常数为K1=6.3×103、K2=1.0×10 、K3=3.2×1012。
下列说法不正确的是()
A.“碱浸时,TeO2与NaOH反应的离子方程式为TcO,+2OH=TcO+H,O
B.“氯盐酸浸时,HCI的作用是作还原剂并防水解
C.滤液c中As元素主要存在形式为H,AsO
D.“水解'时,生成SbOC1的化学方程式为SbCl3+H,O=SbOCI-+2HCl
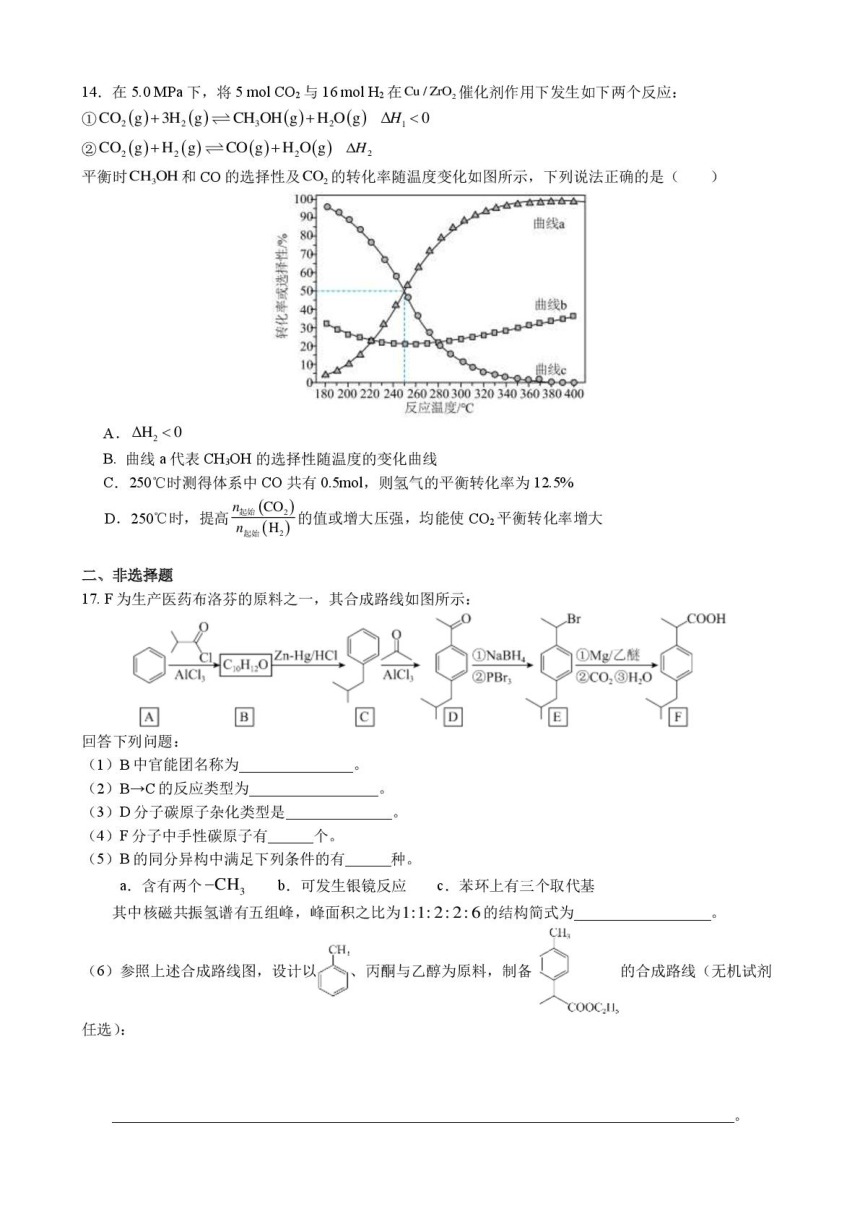
12.C常作有机合成催化剂、人工降雨剂和加碘盐的碘来源。其一种制备原理:
2CuSO,+5KI=2Cul↓+2K,SO,+KI3,Cul不同晶型的晶胞结构如图所示:
y-Cul
B-Cul
a-Cul
下列说法正确的是(
A.上述反应中,氧化剂与还原剂的物质的量之比为2:5
B.KI3中阴离子(T)的中心原子价层电子对数为5
C.a-Cul中1个Cu与4个Cu+等距离且最近
D.等数目的B-Cl和y-Cu晶胞,其质量之比为2:1
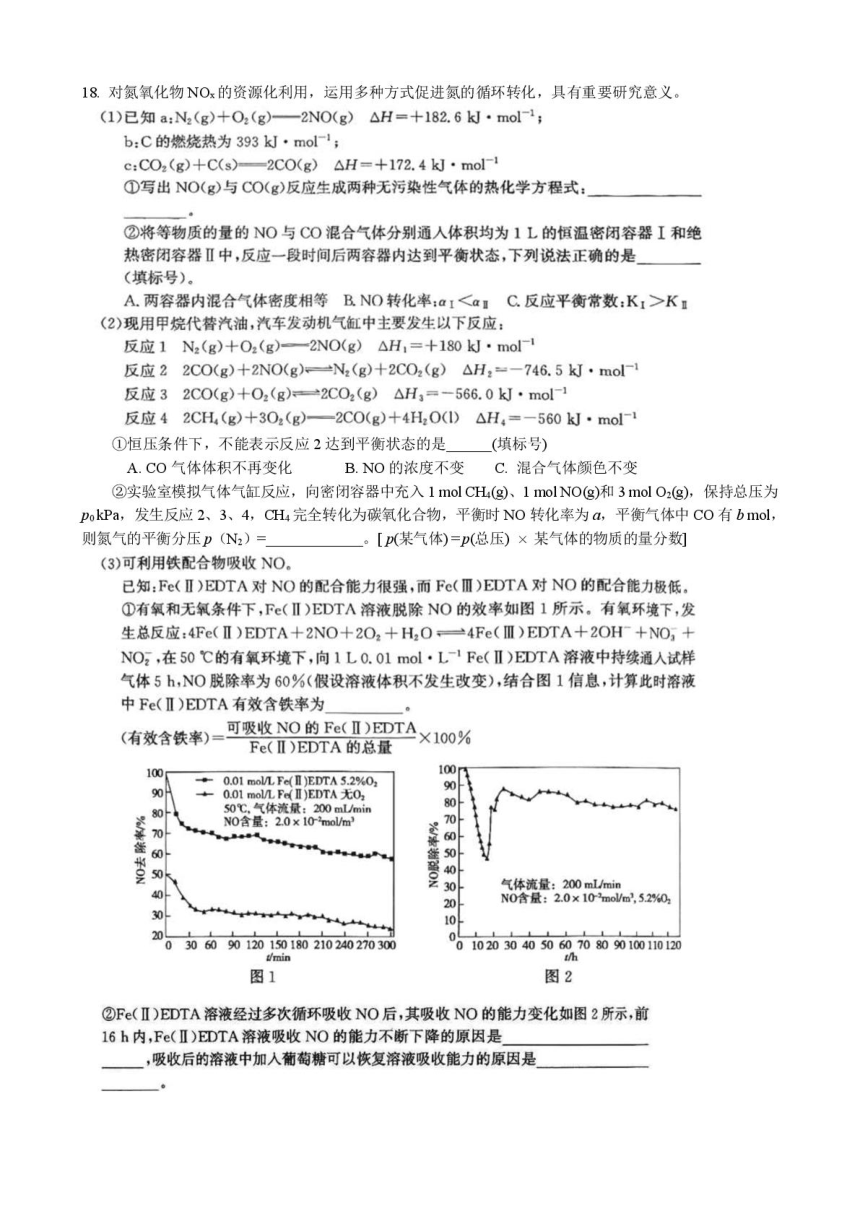
13.水中微量银离了起到杀菌消毒作用,《国家生活饮用水卫生标准》规定银的含量不超过0.05mgL。常
温下AgSO4和AgC1的饱和溶液中Ag和SO42、C1浓度关系如图所示。pAg=-lgc(Ag),M=-lgcM0,
M为S042或C,1008≈3.80。下列说法正确的是(
PM↑
9
8
.B(4755)
A(12.92)
0123456789PAg
A.直线n表示AgCI饱和溶液中Ag和CI浓度关系
B.某水体中银离子超标,用食盐无法消除其污染
C.P点对应的硫酸银溶液为过饱和溶液,静置有白色沉淀产生
D.向Ag,SO,悬浊液中加入NaCl溶液,发生反应Ag2SO,(s)+2C1(aq)2AgC1(s)+SO(aq),其
平衡常数K=3.80×104
一、单项选择题
8.下列实验操作或设计正确的是()
几NaOH溶液
标准液
洗瓶
蒸偏水
盐酸溶液
样品溶液
A,滴定终点前用洗瓶冲洗
B.用NaOH标准溶液
C.从食盐水中提
D.验证CL,的
锥形瓶内壁,减小误差
滴定未知浓度盐酸
取NaCl固体
助燃性
9.双电子转移策略实现铁催化溴代烷烃的烷基羰基化反应的机理如下图所示,L是一种中性配体,I的
CO
Fe,(CO)
OC、
结构为ocFe
Fe....CO
LCO.Cs,CO,
HBr
FeLCO)
R-Br
0
,C0
下列说法错误的是()
还原消除
氧化加成
A.I中Fe的配位数为6
H-FcL(CO)
B.Ⅱ为该反应的催化剂
Br V
R-FeL(CO)
Br I
C.Π→V的转化中铁的化合价发生改变
D.总催化反应方程式为
亲核进攻
猴基化一CO
CO+RBr+ROHRCOOR+HBr
R'-OH
FeL(CO)
IV
10.一种基于K*几*P℉多离子策略的钾型双离子电池,其示意图如下,充电过程中K*、L*到达锡电极,
与电极发生合金化反应,同时P℉到达石墨电极,插层进入石墨层间。下列说法错误的是()
电解液
月
x●L
●
PFs
A.放电时,Sn为负极
B.充电时,石墨电极反应式为C。+P℉e=C.P
C.放电时,当有1mol电子转移时锡电极质量减少39g
D.锂、钾与锡可形成合金,有利于电子的传输,极大的提升电池倍率性能及可逆容量
11.“分铜液净化渣”主要含铜、碲(T )、锑(S)、砷(As)等元素的化合物,回收工艺流程如图所示。
NaOH HSO
HCl、NaCI、SOa
HO
体视清→园-园浸流→区益酸园→s一→农的→s0
碱浸液b一→调pH=4→TcO,
滤液c
己知:①“碱浸时,铜、锑转化为难溶物,碱浸液b含有Na2TeO3、Na3AsO4。
②“酸浸时,浸渣中含锑元素生成难溶SbO(SO4)a:SbCl3极易水解。
③常温下,H3As0的各级电离常数为K1=6.3×103、K2=1.0×10 、K3=3.2×1012。
下列说法不正确的是()
A.“碱浸时,TeO2与NaOH反应的离子方程式为TcO,+2OH=TcO+H,O
B.“氯盐酸浸时,HCI的作用是作还原剂并防水解
C.滤液c中As元素主要存在形式为H,AsO
D.“水解'时,生成SbOC1的化学方程式为SbCl3+H,O=SbOCI-+2HCl
12.C常作有机合成催化剂、人工降雨剂和加碘盐的碘来源。其一种制备原理:
2CuSO,+5KI=2Cul↓+2K,SO,+KI3,Cul不同晶型的晶胞结构如图所示:
y-Cul
B-Cul
a-Cul
下列说法正确的是(
A.上述反应中,氧化剂与还原剂的物质的量之比为2:5
B.KI3中阴离子(T)的中心原子价层电子对数为5
C.a-Cul中1个Cu与4个Cu+等距离且最近
D.等数目的B-Cl和y-Cu晶胞,其质量之比为2:1
13.水中微量银离了起到杀菌消毒作用,《国家生活饮用水卫生标准》规定银的含量不超过0.05mgL。常
温下AgSO4和AgC1的饱和溶液中Ag和SO42、C1浓度关系如图所示。pAg=-lgc(Ag),M=-lgcM0,
M为S042或C,1008≈3.80。下列说法正确的是(
PM↑
9
8
.B(4755)
A(12.92)
0123456789PAg
A.直线n表示AgCI饱和溶液中Ag和CI浓度关系
B.某水体中银离子超标,用食盐无法消除其污染
C.P点对应的硫酸银溶液为过饱和溶液,静置有白色沉淀产生
D.向Ag,SO,悬浊液中加入NaCl溶液,发生反应Ag2SO,(s)+2C1(aq)2AgC1(s)+SO(aq),其
平衡常数K=3.80×104
同课章节目录
