广东省广州花都秀全中学2024-2025学年高二下学期5月月考 化学试题(含答案)
文档属性
| 名称 | 广东省广州花都秀全中学2024-2025学年高二下学期5月月考 化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 15:24:19 | ||
图片预览



文档简介
2025学年第二学期高二5月月考化学科试题
可能用到的相对分子质量: H:1 C:12 O:16 Si:28
一.单选题(1-10题每小题2分,共20分)
1.下列关于日用品中化学成分的说法错误的是
A.福尔马林溶液的主要成分是甲醛的水溶液,生物标本制作中常作防腐剂
B.面霜中添加丙三醇作保湿剂,通过化学键与水分子结合锁住水分
C.聚乙炔是一种高分子材料,可用于制备导电高分子材料
D.N,N-二甲基甲酰胺是羧酸衍生物,常用作溶剂
2.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.命名为2—甲基—5—乙基—1,3—己二烯
C.乙醇分子中羟基的电子式为: D.的电子式为:
3.下列叙述正确的是
A.和互为同分异构体 B.和互为同系物
C.属于醛类 D.分子式为C2H6O的物质,可能属于醇类
4.下列实验装置能达到实验目的的是
A.图 1 分离乙醇和乙酸 B.图 2 除去甲烷中的乙烯
C.图 3 除去溴苯中的溴单质 D.图 4乙醇在 170 ℃加热制取乙烯
5.化合物R经李比希法和质谱法分析得知其相对分子质量为136。其核磁共振氢谱与红外光谱如图,则R的结构可能是
B. C. D.
6. 下列陈述Ⅰ和陈述Ⅱ均正确但不具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 同浓度溶液的碱性:C6H5ONa<Na2CO3 酸性:C6H5OH<H2CO3
B 酸性:CH2ClCOOH>CH3COOH 电负性:Cl>H
C 稳定性: 由于水分子间存在氢键
D 对羟基苯甲醛()比邻羟基苯甲醛()的沸点高 对羟基苯甲醛形成分子间氢键, 邻羟基苯甲醛形成分子内氢键
7.苯甲酸是一种常用的食品防腐剂。某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
下列说法正确的是
A.为了加快溶解,操作I中应加入大量的水 B.操作Ⅱ趁热过滤的目的是除去泥沙和NaCl
C.操作Ⅲ温度越低越利于苯甲酸的析出和提纯 D.操作Ⅳ可用冷水洗涤晶体
8.分子式为C5H12O,且既能发生消去反应又能催化氧化为醛的化合物有( )种。
A、3 B、4 C、 5 D、6
9.一种非天然氨基酸的结构如图所示,关于该化合物,说法不正确的是
A. 能使酸性KMnO4溶液褪色
B. 最多能与等物质的量的Na反应
C. 既能与HCl反应又能与NaOH反应
D. 分子中碳原子均可在同一平面上
10.在给定条件下,下列选项所示的物质转化可以实现的是
A.CuSO4(aq)Cu(OH)2(s)Cu2O(s)
B.HC≡CHCH3CHOCH3CH(OH)CN
C.
D.CH3CH=CH2
二.单选题(11-16题每小题4分,共24分)
11.制备有机物的最后一步如图所示。下列说法正确的是
A.可以与的溶液反应
B.Y存在顺反异构体
C.最多与反应
D.反应类型为消去反应
12.下列实验装置能达到实验目的的是
A.除去乙炔中混有的等杂质 B.检验1-溴丁烷的消去产物 C.证明苯酚的酸性比碳酸的弱 D、制备并接收 乙酸乙酯
13.下列实验操作和现象均正确、且能达到实验目的的是( )
实验操作 实验现象 实验目的
A 苯和苯酚混合溶液中滴入过量浓溴水 产生白色沉淀 检验苯酚
B 溴乙烷水解液种滴加足量AgNO3溶液 产生白色沉淀 验证溴乙烷中含溴原子
C 向少量猪油中加入NaOH溶液并加热 形成均一稳定混合液 验证猪油碱性条件下发生水解反应
D 向丙烯醛(CH2=CHCHO)中先滴加足量的新制Cu(OH)2悬浊液、加热,充分反应后再滴入溴水 溴水褪色 检验分子结构中含碳碳双键
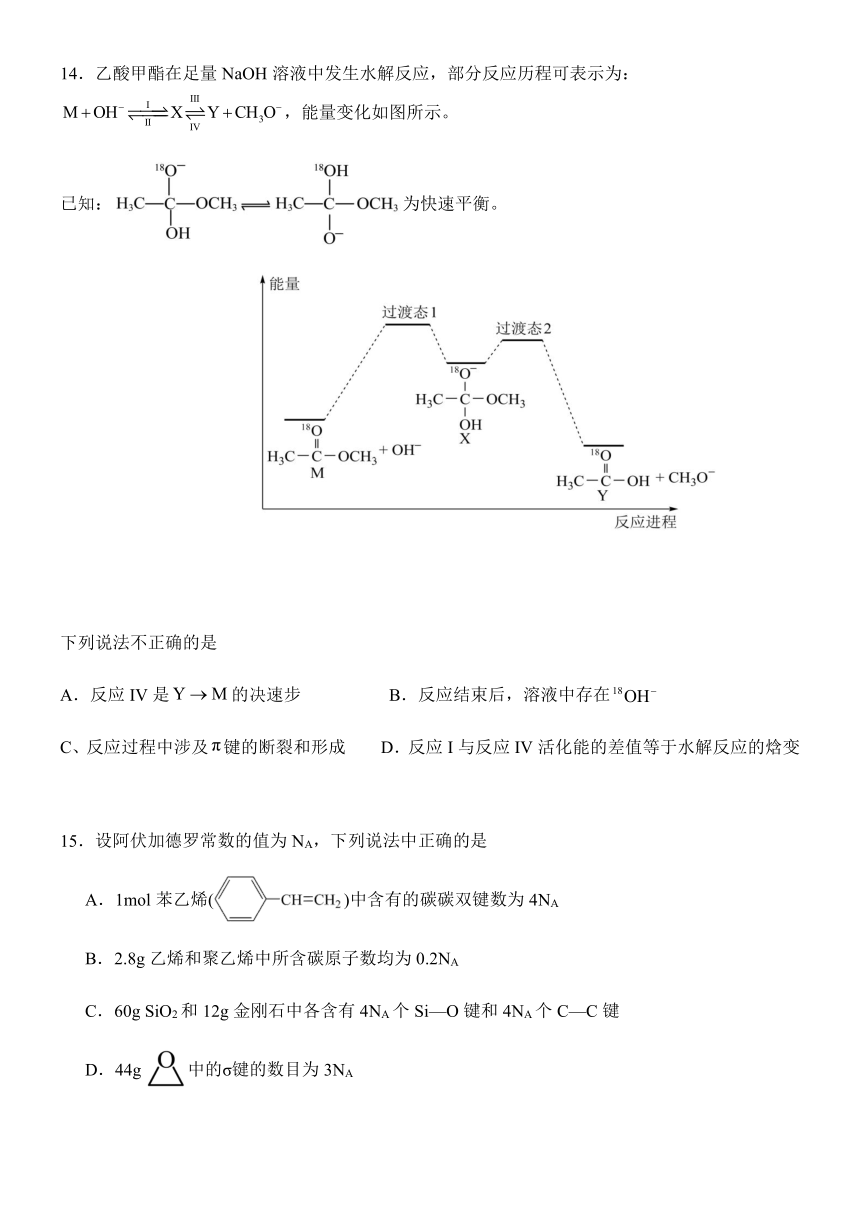
14.乙酸甲酯在足量NaOH溶液中发生水解反应,部分反应历程可表示为:,能量变化如图所示。
已知:为快速平衡。
下列说法不正确的是
反应IV是的决速步 B.反应结束后,溶液中存在
C、反应过程中涉及键的断裂和形成 D.反应I与反应IV活化能的差值等于水解反应的焓变
15.设阿伏加德罗常数的值为NA,下列说法中正确的是
A.1mol苯乙烯()中含有的碳碳双键数为4NA
B.2.8g乙烯和聚乙烯中所含碳原子数均为0.2NA
C.60g SiO2和12g金刚石中各含有4NA个Si—O键和4NA个C—C键
D.44g中的σ键的数目为3NA
16.乙酰水杨酸(),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸()、乙酸酐合成及提纯过程如下:
下列说法正确的是
A.浓硫酸的作用为催化剂、吸水剂 B.操作1和操作2均包含冷却结晶、过滤
C.饱和碳酸氢钠溶液可以用氢氧化钠溶液代替 D.盐酸的主要作用是除去碳酸氢钠
三.非选择题(共四道大题,共56分)
17.(11分)某化学兴趣小组按如图所示,在电炉加热时用纯氧氧化硬质玻璃管内有机样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)仪器a的名称为 ,若装置A的锥形瓶内固体为MnO2,则a中的液体为 。
(2)B装置中浓硫酸的作用是 ,燃烧管C中CuO的作用是 。
(3)装置F的作用是 。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,该有机物的质荷比如图所示,该有机物的分子式为 。
(5)该核磁共振氢谱中有2种峰且面积比为3∶1,则该分子可能的结构简式为 (任写一种)。
18.(13分)环己烯是重要的化工原料。其实验室制备流程如下:
实验装置(加热和夹持装置已略去)及有关数据如下:
名称 沸点/℃ 密度/(g·cm-3) 水中溶解度
环己醇 161 0.968 可溶
环己烯 83 0.823 不溶
回答下列问题:
原料环己醇中若含苯酚杂质,可用_______溶液检验苯酚,现象为______________。
圆底烧瓶A中的反应是可逆反应,写出反应的化学方程式
____________________ 。
浓硫酸也可用作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因是________(填标号)。
浓硫酸易使原料碳化并产生SO2
B. 同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
C. FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
(3)操作I的名称是_________,使用的主要玻璃仪器有:烧杯、_________。
(4) 蒸馏时用水浴加热的原因是____________________________,收集________℃的馏分作为产品。
(5) 本实验为提高产率所采取的措施是________________________。
19.(14分)化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1) E中的官能团名称是______________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出C的结构简式,用
星号(*)标出C中的手性碳__________。
(3) B到C的反应类型是__________。
(4) 写出D到E的反应方程式_____________________________________________ 。
(5) F的结构简式____________________________________________。
(6)W是分子式比C少1个CH2的六元环有机物(只有碳原子参与成环),w能与饱和碳酸氢钠溶液反应放出CO2,则W可能的结构有_____________种,其中核磁共振氢谱显示有6种不同环境
的氢,峰面积比为4:4:3:1:1:1 的结构简式为_____________________。
20. (18分)应用光化学催化和烯还原酶的光生物催化一体化技术,可实现化合物Ⅳ的合成,示意图如图(反应条件略):
(1)化合物Ⅰ的分子式为 ___________ 。化合物Ⅱ的官能团名称为 ___________ 。
(2)化合物Ⅴ为Ⅲ的同分异构体,能够发生银镜反应,在核磁共振氢谱图上只有3组峰,峰面积之比为2:2:1,Ⅴ的结构简式为 ___________ ,其名称为 ___________ 。
(3)关于上述由化合物Ⅰ到Ⅳ的转化及相关物质,下列说法正确的有 ___________ (填字母)。
A. 有π键的断裂与形成 B. 有C—Br键的断裂与C—C键的形成
C. 存在C原子杂化方式的改变,没有手性碳原子形成
D. 化合物Ⅳ可形成分子间氢键,也可以形成分子内氢键
(4)对化合物Ⅳ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
① ___________ ___________
② ___________ ___________ 取代反应
(5)已知:
以化合物Ⅱ为唯一有机原料,合成化合物。
基于你设计的合成路线,回答下列问题:
①最后一步的化学方程式为 ___________ (注明反应条件)。
②相关步骤涉及氧化反应,其有机反应物为 ___________ (写结构简式)。
③若相关步骤涉及卤代烃制醇反应,
其化学方程式为 ___________ (注明反应条件)。
高二化学5月月考参考答案
1-16:BCDDD CDABB ADCDBB
(11分)(1) 分液漏斗 (1分 ) H2O2(或双氧水)(1分)
(2) 干燥氧气 (1分) 把有机物不完全燃烧产生的CO转化为CO2 (2分)
(3)吸收空气中的二氧化碳和水蒸气 (2分) (4)C2H4O2 (2分 (5)CH3COOH、HCOOCH3 (2分)
(13 分)(1)FeCl3(1 分) 溶液显紫色 (1 分) 【写饱和溴水不给分】
(2) (2 分)
A、C(2 分)(对 1 个 1 分,错 1 个倒扣 1 分,0 分为止,不出现负分)
(3)分液(1 分) 分液漏斗(1 分)
(4)受热均匀,控制蒸馏温度不超过 100℃(2 分)(两个半句各 1 分)83 (1 分)
(5)冷凝回流反应物,同时边反应边蒸馏出产物。(2 分,若只答到前半句 1 分,只要
答到后半句 2 分)
(14分)(1)酮羰基、酯基(各1分,共2分) (2)(2分)
加成反应(2分) (4)
(5)(2分) (6)5(2分) (2分)
20、(18分)(1) C9H10 酮羰基 (各1分,共2分)
(2) BrCH2CH2CHO 3﹣溴丙醛 (各2分,共4分) (3)BD (2分)
(4) ①. 浓硫酸、加热 消去反应 ②. 浓硫酸、加热 —COO— (各1分,共4分)
(5) ①. HOCH2CH(CH3)OH+2CH3COOH +2H2O (2分)
②. CH2=CHCH3 (2分)③. BrCH2CHBrCH3+2NaOHHOCH2CH(OH)CH3+2NaBr (2分)
可能用到的相对分子质量: H:1 C:12 O:16 Si:28
一.单选题(1-10题每小题2分,共20分)
1.下列关于日用品中化学成分的说法错误的是
A.福尔马林溶液的主要成分是甲醛的水溶液,生物标本制作中常作防腐剂
B.面霜中添加丙三醇作保湿剂,通过化学键与水分子结合锁住水分
C.聚乙炔是一种高分子材料,可用于制备导电高分子材料
D.N,N-二甲基甲酰胺是羧酸衍生物,常用作溶剂
2.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.命名为2—甲基—5—乙基—1,3—己二烯
C.乙醇分子中羟基的电子式为: D.的电子式为:
3.下列叙述正确的是
A.和互为同分异构体 B.和互为同系物
C.属于醛类 D.分子式为C2H6O的物质,可能属于醇类
4.下列实验装置能达到实验目的的是
A.图 1 分离乙醇和乙酸 B.图 2 除去甲烷中的乙烯
C.图 3 除去溴苯中的溴单质 D.图 4乙醇在 170 ℃加热制取乙烯
5.化合物R经李比希法和质谱法分析得知其相对分子质量为136。其核磁共振氢谱与红外光谱如图,则R的结构可能是
B. C. D.
6. 下列陈述Ⅰ和陈述Ⅱ均正确但不具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 同浓度溶液的碱性:C6H5ONa<Na2CO3 酸性:C6H5OH<H2CO3
B 酸性:CH2ClCOOH>CH3COOH 电负性:Cl>H
C 稳定性: 由于水分子间存在氢键
D 对羟基苯甲醛()比邻羟基苯甲醛()的沸点高 对羟基苯甲醛形成分子间氢键, 邻羟基苯甲醛形成分子内氢键
7.苯甲酸是一种常用的食品防腐剂。某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
下列说法正确的是
A.为了加快溶解,操作I中应加入大量的水 B.操作Ⅱ趁热过滤的目的是除去泥沙和NaCl
C.操作Ⅲ温度越低越利于苯甲酸的析出和提纯 D.操作Ⅳ可用冷水洗涤晶体
8.分子式为C5H12O,且既能发生消去反应又能催化氧化为醛的化合物有( )种。
A、3 B、4 C、 5 D、6
9.一种非天然氨基酸的结构如图所示,关于该化合物,说法不正确的是
A. 能使酸性KMnO4溶液褪色
B. 最多能与等物质的量的Na反应
C. 既能与HCl反应又能与NaOH反应
D. 分子中碳原子均可在同一平面上
10.在给定条件下,下列选项所示的物质转化可以实现的是
A.CuSO4(aq)Cu(OH)2(s)Cu2O(s)
B.HC≡CHCH3CHOCH3CH(OH)CN
C.
D.CH3CH=CH2
二.单选题(11-16题每小题4分,共24分)
11.制备有机物的最后一步如图所示。下列说法正确的是
A.可以与的溶液反应
B.Y存在顺反异构体
C.最多与反应
D.反应类型为消去反应
12.下列实验装置能达到实验目的的是
A.除去乙炔中混有的等杂质 B.检验1-溴丁烷的消去产物 C.证明苯酚的酸性比碳酸的弱 D、制备并接收 乙酸乙酯
13.下列实验操作和现象均正确、且能达到实验目的的是( )
实验操作 实验现象 实验目的
A 苯和苯酚混合溶液中滴入过量浓溴水 产生白色沉淀 检验苯酚
B 溴乙烷水解液种滴加足量AgNO3溶液 产生白色沉淀 验证溴乙烷中含溴原子
C 向少量猪油中加入NaOH溶液并加热 形成均一稳定混合液 验证猪油碱性条件下发生水解反应
D 向丙烯醛(CH2=CHCHO)中先滴加足量的新制Cu(OH)2悬浊液、加热,充分反应后再滴入溴水 溴水褪色 检验分子结构中含碳碳双键
14.乙酸甲酯在足量NaOH溶液中发生水解反应,部分反应历程可表示为:,能量变化如图所示。
已知:为快速平衡。
下列说法不正确的是
反应IV是的决速步 B.反应结束后,溶液中存在
C、反应过程中涉及键的断裂和形成 D.反应I与反应IV活化能的差值等于水解反应的焓变
15.设阿伏加德罗常数的值为NA,下列说法中正确的是
A.1mol苯乙烯()中含有的碳碳双键数为4NA
B.2.8g乙烯和聚乙烯中所含碳原子数均为0.2NA
C.60g SiO2和12g金刚石中各含有4NA个Si—O键和4NA个C—C键
D.44g中的σ键的数目为3NA
16.乙酰水杨酸(),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸()、乙酸酐合成及提纯过程如下:
下列说法正确的是
A.浓硫酸的作用为催化剂、吸水剂 B.操作1和操作2均包含冷却结晶、过滤
C.饱和碳酸氢钠溶液可以用氢氧化钠溶液代替 D.盐酸的主要作用是除去碳酸氢钠
三.非选择题(共四道大题,共56分)
17.(11分)某化学兴趣小组按如图所示,在电炉加热时用纯氧氧化硬质玻璃管内有机样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)仪器a的名称为 ,若装置A的锥形瓶内固体为MnO2,则a中的液体为 。
(2)B装置中浓硫酸的作用是 ,燃烧管C中CuO的作用是 。
(3)装置F的作用是 。
(4)若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,该有机物的质荷比如图所示,该有机物的分子式为 。
(5)该核磁共振氢谱中有2种峰且面积比为3∶1,则该分子可能的结构简式为 (任写一种)。
18.(13分)环己烯是重要的化工原料。其实验室制备流程如下:
实验装置(加热和夹持装置已略去)及有关数据如下:
名称 沸点/℃ 密度/(g·cm-3) 水中溶解度
环己醇 161 0.968 可溶
环己烯 83 0.823 不溶
回答下列问题:
原料环己醇中若含苯酚杂质,可用_______溶液检验苯酚,现象为______________。
圆底烧瓶A中的反应是可逆反应,写出反应的化学方程式
____________________ 。
浓硫酸也可用作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因是________(填标号)。
浓硫酸易使原料碳化并产生SO2
B. 同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
C. FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
(3)操作I的名称是_________,使用的主要玻璃仪器有:烧杯、_________。
(4) 蒸馏时用水浴加热的原因是____________________________,收集________℃的馏分作为产品。
(5) 本实验为提高产率所采取的措施是________________________。
19.(14分)化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1) E中的官能团名称是______________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出C的结构简式,用
星号(*)标出C中的手性碳__________。
(3) B到C的反应类型是__________。
(4) 写出D到E的反应方程式_____________________________________________ 。
(5) F的结构简式____________________________________________。
(6)W是分子式比C少1个CH2的六元环有机物(只有碳原子参与成环),w能与饱和碳酸氢钠溶液反应放出CO2,则W可能的结构有_____________种,其中核磁共振氢谱显示有6种不同环境
的氢,峰面积比为4:4:3:1:1:1 的结构简式为_____________________。
20. (18分)应用光化学催化和烯还原酶的光生物催化一体化技术,可实现化合物Ⅳ的合成,示意图如图(反应条件略):
(1)化合物Ⅰ的分子式为 ___________ 。化合物Ⅱ的官能团名称为 ___________ 。
(2)化合物Ⅴ为Ⅲ的同分异构体,能够发生银镜反应,在核磁共振氢谱图上只有3组峰,峰面积之比为2:2:1,Ⅴ的结构简式为 ___________ ,其名称为 ___________ 。
(3)关于上述由化合物Ⅰ到Ⅳ的转化及相关物质,下列说法正确的有 ___________ (填字母)。
A. 有π键的断裂与形成 B. 有C—Br键的断裂与C—C键的形成
C. 存在C原子杂化方式的改变,没有手性碳原子形成
D. 化合物Ⅳ可形成分子间氢键,也可以形成分子内氢键
(4)对化合物Ⅳ,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
① ___________ ___________
② ___________ ___________ 取代反应
(5)已知:
以化合物Ⅱ为唯一有机原料,合成化合物。
基于你设计的合成路线,回答下列问题:
①最后一步的化学方程式为 ___________ (注明反应条件)。
②相关步骤涉及氧化反应,其有机反应物为 ___________ (写结构简式)。
③若相关步骤涉及卤代烃制醇反应,
其化学方程式为 ___________ (注明反应条件)。
高二化学5月月考参考答案
1-16:BCDDD CDABB ADCDBB
(11分)(1) 分液漏斗 (1分 ) H2O2(或双氧水)(1分)
(2) 干燥氧气 (1分) 把有机物不完全燃烧产生的CO转化为CO2 (2分)
(3)吸收空气中的二氧化碳和水蒸气 (2分) (4)C2H4O2 (2分 (5)CH3COOH、HCOOCH3 (2分)
(13 分)(1)FeCl3(1 分) 溶液显紫色 (1 分) 【写饱和溴水不给分】
(2) (2 分)
A、C(2 分)(对 1 个 1 分,错 1 个倒扣 1 分,0 分为止,不出现负分)
(3)分液(1 分) 分液漏斗(1 分)
(4)受热均匀,控制蒸馏温度不超过 100℃(2 分)(两个半句各 1 分)83 (1 分)
(5)冷凝回流反应物,同时边反应边蒸馏出产物。(2 分,若只答到前半句 1 分,只要
答到后半句 2 分)
(14分)(1)酮羰基、酯基(各1分,共2分) (2)(2分)
加成反应(2分) (4)
(5)(2分) (6)5(2分) (2分)
20、(18分)(1) C9H10 酮羰基 (各1分,共2分)
(2) BrCH2CH2CHO 3﹣溴丙醛 (各2分,共4分) (3)BD (2分)
(4) ①. 浓硫酸、加热 消去反应 ②. 浓硫酸、加热 —COO— (各1分,共4分)
(5) ①. HOCH2CH(CH3)OH+2CH3COOH +2H2O (2分)
②. CH2=CHCH3 (2分)③. BrCH2CHBrCH3+2NaOHHOCH2CH(OH)CH3+2NaBr (2分)
同课章节目录
