2025年江苏省扬州市中考二模化学试卷(含答案)
文档属性
| 名称 | 2025年江苏省扬州市中考二模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 17:35:29 | ||
图片预览



文档简介
2024-2025学年初三第二次模拟考试试卷
初三年级 化学学科
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 S-32 Mn-55 K-39
Ⅰ卷(40分)
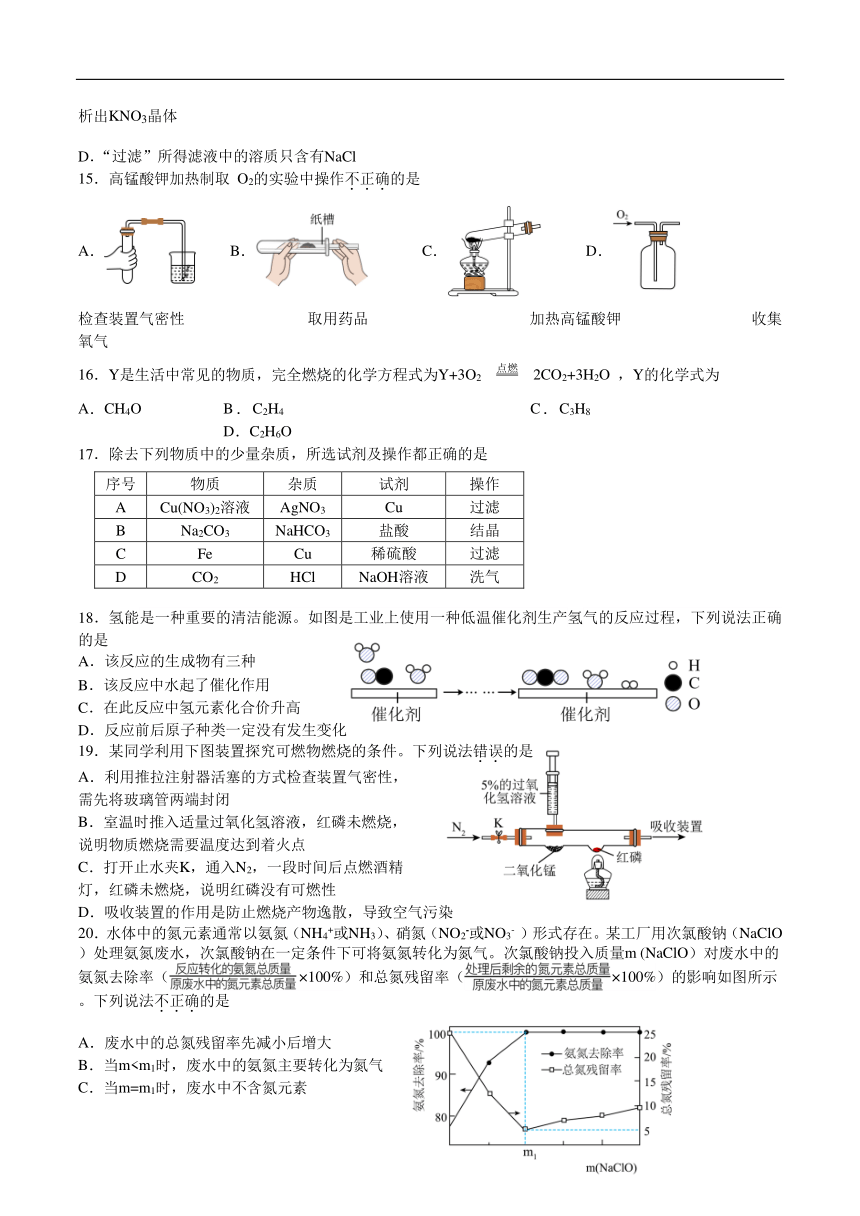
单项选择题(本题包括20小题,每小题2分。每小题只有一个选项符合题意。)
1.下列过程中发生化学变化的是
A. 大理石做华表 B. 海水晒盐
C. 稀有气体通电放光 D.加热碳酸氢铵
2.工艺精湛的后(司)母戊鼎铸造于我国商代,历经千年,表面产生绿锈。该鼎使用的材料是
A.铜合金 B.铝合金 C.钢铁 D.黄金
3.化学与环境保护、社会可持续发展密切相关,下列做法合理的是
A.进口国外电子垃圾,回收其中的贵重金属
B.将地沟油回收加工为生物柴油,提高资源的利用率
C.大量生产超薄塑料袋,方便人们的日常生活
D.洗衣粉中添加三聚磷酸钠,增强去污的效果
4.对反应进行分类有助于认识与研究。下列反应属于置换反应的是
A.3Fe+2O2 点燃 Fe3O4 B.H2CO3 △ H2O +CO2↑
C.H2+CuO △ Cu+H2O D.2NaOH+CuSO4 == Na2SO4+Cu(OH)2↓
5.氢是燃料电池的理想燃料。氢燃料电池的使用推动了氢气制取、储存和利用技术的不断创新。氨在燃料电池中与O2反应生成N2和H2O,氨易于储存,且泄漏时易被察觉,也是燃料电池的理想燃料。氨的下列性质中,与其成为燃料电池的理想燃料不相关的是
A.无色 B.有刺激性气味
C.易液化 D.在电池中与O2反应的产物无污染
6.形成正确的观念有助于学习和决策。下列观念正确的是
A.物质的性质仅由组成该物质的元素决定
B.“纯天然”物质一定好,人工合成的物质一定不好
C.化学工艺的设计原则是消耗更多的资源获得所需产品
D.化学反应中能量既不会被创造,也不会消失,而是发生形式的转化
阅读下列材料,完成7~10题。
我国科学家近年来研制了新型“连续纤维增韧”航空材料,其主要成分包括碳化硅(SiC)等隔热材料、二硫化钼(MoS2)等润滑材料和硅橡胶等密封材料。航天服具有多层结构,包含棉布织成的舒适层、橡胶质地的气密层、涤纶面料的限制层和铝合金制成的壳体。
7.下列关于航空材料的叙述不正确的是
A.耐高温 B.抗氧化 C.属于盐类 D.属于复合材料
8.下列属于无机材料的是
A.棉布 B.涤纶 C.铝合金 D.橡胶
9.在元素周期表中钼元素的某些信息如图所示,下列有关钼的说法正确的
A.元素符号为MO
B.属于非金属元素
C.相对原子质量为95.94g
D.原子核内质子数为42
10.碳化硅(SiC)晶体结构与金刚石相似,俗称金刚砂,可用于制造砂轮等磨具,用于金属、玻璃、玉石等切割。下列说法不正确的是
A.碳化硅是由一个硅原子和一个碳原子构成
B.碳化硅的熔点较高
C.碳化硅的硬度较大
D.碳化硅由原子构成
11.俗名往往反映了物质的组成、性质和用途。下列对物质俗名的理解不正确的是
A.双氧水:每个分子中含有2个氧原子
B.干冰:形态像冰,融化或汽化后没有水生成
C.熟石灰:将生石灰加热后所得产物
D.天然气:自然存在的可燃性气体
12.下列是与化学有关的古代文献,其中理解错误的是
A.《石灰吟》(明 于谦) 中“……烈火焚烧若等闲……要留清白在人间”其中“清白”指氢氧化钙
B.《咏煤炭》(明 于谦) 中“凿开混沌得乌金……不辞辛苦出山林”其中“乌金”主要成分是煤炭
C.《天工开物》(明 宋应星) 中有记载:“以消石、硫磺为主。草木灰为辅。……魂散惊而魄齑粉”,文中提到的是火药
D.《淮南万毕术》(西汉 刘安) 中有描述:“曾青得铁则化为铜”,文中的“曾青”指的是铜的化合物
13.下列有关物质的性质与用途具有对应关系的是
A.石墨质软,可用作电池的电极材料
B.不锈钢耐腐蚀,可用于制造医疗器械
C.金属铜具有金属光泽,可用作导电材料
D.浓硫酸具有脱水性,可用作干燥剂
14.《本草纲目》记载:“火药乃焰硝、硫黄、杉木炭所合……”焰硝经处理可得到含少量 NaCl 的 KNO3 溶液,将其蒸发浓缩、冷却结晶、过滤,最终得到较纯净的 KNO3 固体。 KNO3 和 NaCl 的溶解度曲线如下图所示。下列说法正确的是
A.KNO3的溶解度大于NaCl的溶解度
B.“蒸发浓缩”是为了获得较高温度下NaCl的饱和溶液
C.KNO3的溶解度随温度降低大幅减小,所以“冷却结晶”时 析出KNO3晶体
D.“过滤”所得滤液中的溶质只含有NaCl
15.高锰酸钾加热制取 O2的实验中操作不正确的是
A. B. C. D.
检查装置气密性 取用药品 加热高锰酸钾 收集氧气
16.Y是生活中常见的物质,完全燃烧的化学方程式为Y+3O2 点燃 2CO2+3H2O ,Y的化学式为
A.CH4O B.C2H4 C.C3H8 D.C2H6O
除去下列物质中的少量杂质,所选试剂及操作都正确的是
序号 物质 杂质 试剂 操作
A Cu(NO3)2溶液 AgNO3 Cu 过滤
B Na2CO3 NaHCO3 盐酸 结晶
C Fe Cu 稀硫酸 过滤
D CO2 HCl NaOH溶液 洗气
18.氢能是一种重要的清洁能源。如图是工业上使用一种低温催化剂生产氢气的反应过程,下列说法正确的是
A.该反应的生成物有三种
B.该反应中水起了催化作用
C.在此反应中氢元素化合价升高
D.反应前后原子种类一定没有发生变化
19.某同学利用下图装置探究可燃物燃烧的条件。下列说法错误的是
A.利用推拉注射器活塞的方式检查装置气密性, 需先将玻璃管两端封闭
B.室温时推入适量过氧化氢溶液,红磷未燃烧, 说明物质燃烧需要温度达到着火点
C.打开止水夹K,通入N2,一段时间后点燃酒精 灯,红磷未燃烧,说明红磷没有可燃性
D.吸收装置的作用是防止燃烧产物逸散,导致空气污染
20.水体中的氮元素通常以氨氮(NH4+或NH3)、硝氮(NO2-或NO3- )形式存在。某工厂用次氯酸钠(NaClO)处理氨氮废水,次氯酸钠在一定条件下可将氨氮转化为氮气。次氯酸钠投入质量m (NaClO)对废水中的氨氮去除率(×100%)和总氮残留率(×100%)的影响如图所示。下列说法不正确的是
A.废水中的总氮残留率先减小后增大
B.当mC.当m=m1时,废水中不含氮元素
D.当m>m1时,水体中硝氮含量升高
Ⅱ卷(60分)
非选择题(本题包括4小题,共计60分)
21.(15分)化学是造福于人类的科学,请利用所学知识回答下列问题。
Ⅰ.化学与生活
(1)石墨烯是一种新型纳米材料,具有优异的导电性和强度。
① 石墨烯是从石墨中剥离出的单层碳原子结构,它属于 ▲ (填序号)。
A.单质 B.化合物 C.混合物
② 石墨烯可用于制造柔性显示屏,主要利用其 ▲ (填“导电性”或“延展性”)。
③ 石墨烯的化学性质与石墨相似,在氧气中完全燃烧的化学方程式为 ▲ 。
(2)均衡饮食是健康生活的基础。某同学的午餐为米饭、红烧鱼和青菜和橙子。
① 米饭的主要成分是淀粉,属于糖类,曾被称为“碳水化合物”,淀粉含有 ▲ 元素,实验室可用 ▲ 检验淀粉。
② 鱼肉富含优质蛋白质,蛋白质在人体内转化为能被吸收的小分子化合物,这类化合物称为 ▲ 。下列有关蛋白质的说法正确的是 ▲ (填序号)。
A.蛋白质是构成细胞的基本物质
B.蛋白质灼烧时有烧焦羽毛的气味
C.蛋白质属于有机高分子化合物
③ 青菜和橙子中富含维生素C(C6H8O6),维生素C是一种水溶性维生素,高温易被破坏,在酸性环境下较稳定。下列关于维生素C的说法错误的是 ▲ (填序号)。
A.维生素C中碳氧元素的质量比为3:4
B.为了保持健康,建议大量补充维生素C
C.富含维生素C的蔬菜最好先切后洗
D.缺乏维生素C,会引起坏血病
(3)合理用药是健康生活的重要保障。
① 阿司匹林(C9H8O4)是一种常见的解热镇痛药,其相对分子质量为 ▲ 。
② 阿司匹林化学名乙酰水杨酸,有弱酸性,服用阿司匹林时若与碳酸氢钠(NaHCO3)同服,两者反应生成乙酰水杨酸钠(NaC9H7O4),同时生成二氧化碳会导致胃胀气。该反应的化学方程式为 ▲ 。
③ 过期的药物应投入下列哪个图标的垃圾桶 ▲ (填序号)。
A. B. C. D.
Ⅱ.化学与能源
(4)①部分环保电动汽车使用高铁电池,其原理为高铁酸钾(K2FeO4)和单质锌作用,在释放出电能的同时生成K2ZnO2、Fe2O3及ZnO。请写出反应的化学方程式 ▲ 。
②汽车发生猛烈撞击时,储气罐中的压缩氮气释放出来充满碰撞气袋,请从微观角度描述此过程中氮气发生的变化 ▲ 。
22.(23分)水是生命之源,万物之基,是人类最宝贵的自然资源。
Ⅰ.探水
(1)人类对水的组成探索不断发展:
① 18世纪末,英国化学家普里斯特利把氢气和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,氢气燃烧发出震耳的爆鸣声。写出氢气燃烧的方程式 ▲ 。
② 电解水实验装置如图1所示。通电一段时间后,请完成图2中水通电分解前后的微观示意图。
由氢气燃烧和电解水实验可得出的结论是 ▲ 。
图3是探究物质组成的两种思路,电解水实验是通过 ▲ (填“甲”或“乙”)思路推测水的组成的。
Ⅱ.制水
(2)海水淡化
③ 膜分离法利用薄膜的选择透过性实现海水淡化。石墨烯海水淡化膜工作原理如图4所示,该膜允许通过的微粒是 ▲ (填写微粒符号)。
④ 热分离法制水利用蒸发和冷凝分离水与非挥发性物质,此方法的原理是利用了两者的
▲ 不同。限制热分离法大规模应用的原因可能是 ▲ 。
Ⅲ.处理水
(3)硬水软化
⑤ 硬水是指溶有较多 ▲ (写其中一种离子符号)的水。生活中常加入 ▲ 检验(填试剂名称)。
提出问题:水中溶有钙、镁离子的较多与较少到底有没有一个定量的标准?
查阅资料:水中两种离子的总浓度通常被称为水的总硬度。我国通常将所测得的总浓度折算成每升水中含有 CaCO3的毫克数,具体的换算方法是:
总硬度 = ρ(镁离子)×100/24+ρ(钙离子)×100/40,其中ρ指单位体积溶液中所含离子的质量。总硬度450mg·L-1以上为硬水。
提出问题:影响水硬度的因素有哪些?小组成员做了如下探究。
不同温度的水样/℃ ρ钙离子/mg·L-1 ρ镁离子/mg·L-1 总硬度/mg·L-1
25 154 54 610
40 149 51 x
60 131 52 544
80 71 53 398
100 23 55 287
⑥ 该实验的目的是 ▲ 。
⑦ 计算40℃时,水总硬度x= ▲ ,属于 ▲ (填“硬水”或“软水”)。
⑧ 生活中可采用 ▲ 的方法使硬水软化。若该地山泉水中溶有一定量的Ca(HCO3)2,软化过程中Ca(HCO3)2分解为碳酸钙和两种常见氧化物,该反应的化学方程式为 ▲ 。
(4)污水净化:
⑨ 水的天然循环给陆地带来淡水,在水天然循环的蒸发、蒸腾环节中
,水分子的能量 ▲ (填“增大”“减小”或“不变”)。
⑩ 天然水中含有许多杂质,净水过程中常利用 ▲ (填物质名称)
吸附水中的颜色和异味;
为了解决人们在野外生活和工作时的饮水问题,学习小组开展了便
携式野外净水器的设计和制作。设计装置如图5所示,由图可知,净水时水最先流经
▲ 。
(5)工业生产废水处理工艺
处理生产废水过程中,可向其中投入明矾[化学式为KAl(SO4) 2·12H2O],该物质溶于水后生成氢氧化铝 ▲ (填化学式)胶状物,胶状物对杂质吸附能力很强。
金属炭法处理废水中的重金属离子:其他条件相同时,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图6。
pH相同时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是 ▲ 。
废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是 ▲
23.(11分)课外实践小组以“气体制备”为主题开展研究性学习。
(一)实验室气体制取:
(1)仪器a 的名称是 ▲ 。
(2)实验室用装置B制取二氧化碳时,反应的化学方程式为 ▲ ,向长颈漏斗中加入液体时,液面应该在 ▲ (填“m”或“n”)处。
(3)实验室用加热熟石灰和氯化铵固体混合物制取氨气,氨气易溶于水且密度比空气小,则实验室制取氨气所选择的发生装置是 ▲ (填序号),若用F装置收集氨气,如何验满? ▲ 。
(二)在“双碳”目标愿景下,氨气作为一种“零碳”
能源前景广泛。
Ⅰ.制氨
右图是电解合成氨的工艺综合流程。
(4)空气分离装置内发生 ▲ (填“物理”或“化
学”)变化。
(5)流程中电解产生氨气的反应化学方程式为 ▲ 。
Ⅱ.用氨
(6)利用氨气除去汽车尾气中的NO,生成水和一种单质。氨气与NO在催化剂作用下反应的化学方程式为 ▲ 。
24.(11分)硫酸亚铁广泛应用于医学、农业等领域。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体(FeSO4 7H2O)的实验流程如图:
(1)“酸浸”时,使用过量的稀硫酸溶解废渣,发生的反应方程式有
① Fe3O4+4H2SO4==Fe2(SO4)3+FeSO4+4H2O;② ▲ 。
(2)将“滤渣”返回“酸浸”工序,其目的是 ▲ 。
(3)与普通过滤相比,使用图1装置进行过滤的优点是 ▲ 。
(4)滤液中的阳离子有 ▲ ,向滤液中“加一定质量的Fe粉”可以将Fe2(SO4)3转化为FeSO4,化学方程式为 ▲ 。
(5)固定其他条件不变,反应温度、反应时间、铁粉过量系数【 】分别对“滤液”中Fe3+还原率(Fe3+转化为Fe2+的百分率)的影响如图2、图3、图4所示。
结合图像和数据,设计由100g“滤液”【其中Fe2(SO4)3质量分数为12%】制备FeSO4溶液的实验方案: ▲ 。
(6)制得FeSO4溶液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤,得到硫酸亚铁晶体(FeSO4 7H2O)。
(7)测定硫酸亚铁晶体样品纯度
准确称取1.500g硫酸亚铁晶体(FeSO4 7H2O的相对分子质量为278)样品溶于水,与硫酸酸化的KMnO4溶液完全反应,消耗KMnO4的质量为0.158g。
已知:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
该样品的纯度为 ▲ (精确到0.1%)。(请写出计算过程)
化学参考答案
一、单项选择题:共20题,每题2分,共40分。每题只有一个选项最符合题意。
1.D 2.A 3.B 4.C 5.A
6.D 7.C 8.C 9.D 10.A
11.C 12.A 13.B 14.C 15.C
16.D 17.A 18.D 19.C 20.C
二、非选择题:共5题,共60分。每空1分,方程式未特殊说明都2分
21.(15分)
(1)①A ②延展性③略(1分)
(2)①CHO 碘水(碘酒)②氨基酸 ABC ③ BC
(3)①180 ②略 ③B
(4) ①略②氮分子间间隔变大
22.(23)
(1)略 (1分)② 略 水是由氢氧元素组成 乙
(2)③H2O ④沸点 耗能大
(3)⑤Ca2+(Mg2+) 肥皂水 ⑥探究水温对水硬度的影响
⑦585 硬水 ⑧煮沸 略 ⑨增大 ⑩活性炭 小卵石 Al(OH)3
主要原因是铝比锌活泼,可以与Zn2+发生置换反应,而铁不能置换出锌(2分)
原因是pH升高,Al3+转化为Al(OH)3胶状物,对Zn2+有吸附作用(2分)
23.(11)
(1)水槽
(2)略 m
(3)A 湿润的红色石蕊试纸放在e管口处,变蓝则满
(二)物理 略 略
24.(11)
(1)
②略 (2)提高铁元素的浸出率 (3)过滤速度更快
(4)Fe2+ Fe3+ H+ 略
(5)在80℃水浴加热条件下,向“滤液”中加入2.016g铁粉,搅拌下反应2h后,过滤 (2分)
(7)92.7% (2分)
初三年级 化学学科
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 S-32 Mn-55 K-39
Ⅰ卷(40分)
单项选择题(本题包括20小题,每小题2分。每小题只有一个选项符合题意。)
1.下列过程中发生化学变化的是
A. 大理石做华表 B. 海水晒盐
C. 稀有气体通电放光 D.加热碳酸氢铵
2.工艺精湛的后(司)母戊鼎铸造于我国商代,历经千年,表面产生绿锈。该鼎使用的材料是
A.铜合金 B.铝合金 C.钢铁 D.黄金
3.化学与环境保护、社会可持续发展密切相关,下列做法合理的是
A.进口国外电子垃圾,回收其中的贵重金属
B.将地沟油回收加工为生物柴油,提高资源的利用率
C.大量生产超薄塑料袋,方便人们的日常生活
D.洗衣粉中添加三聚磷酸钠,增强去污的效果
4.对反应进行分类有助于认识与研究。下列反应属于置换反应的是
A.3Fe+2O2 点燃 Fe3O4 B.H2CO3 △ H2O +CO2↑
C.H2+CuO △ Cu+H2O D.2NaOH+CuSO4 == Na2SO4+Cu(OH)2↓
5.氢是燃料电池的理想燃料。氢燃料电池的使用推动了氢气制取、储存和利用技术的不断创新。氨在燃料电池中与O2反应生成N2和H2O,氨易于储存,且泄漏时易被察觉,也是燃料电池的理想燃料。氨的下列性质中,与其成为燃料电池的理想燃料不相关的是
A.无色 B.有刺激性气味
C.易液化 D.在电池中与O2反应的产物无污染
6.形成正确的观念有助于学习和决策。下列观念正确的是
A.物质的性质仅由组成该物质的元素决定
B.“纯天然”物质一定好,人工合成的物质一定不好
C.化学工艺的设计原则是消耗更多的资源获得所需产品
D.化学反应中能量既不会被创造,也不会消失,而是发生形式的转化
阅读下列材料,完成7~10题。
我国科学家近年来研制了新型“连续纤维增韧”航空材料,其主要成分包括碳化硅(SiC)等隔热材料、二硫化钼(MoS2)等润滑材料和硅橡胶等密封材料。航天服具有多层结构,包含棉布织成的舒适层、橡胶质地的气密层、涤纶面料的限制层和铝合金制成的壳体。
7.下列关于航空材料的叙述不正确的是
A.耐高温 B.抗氧化 C.属于盐类 D.属于复合材料
8.下列属于无机材料的是
A.棉布 B.涤纶 C.铝合金 D.橡胶
9.在元素周期表中钼元素的某些信息如图所示,下列有关钼的说法正确的
A.元素符号为MO
B.属于非金属元素
C.相对原子质量为95.94g
D.原子核内质子数为42
10.碳化硅(SiC)晶体结构与金刚石相似,俗称金刚砂,可用于制造砂轮等磨具,用于金属、玻璃、玉石等切割。下列说法不正确的是
A.碳化硅是由一个硅原子和一个碳原子构成
B.碳化硅的熔点较高
C.碳化硅的硬度较大
D.碳化硅由原子构成
11.俗名往往反映了物质的组成、性质和用途。下列对物质俗名的理解不正确的是
A.双氧水:每个分子中含有2个氧原子
B.干冰:形态像冰,融化或汽化后没有水生成
C.熟石灰:将生石灰加热后所得产物
D.天然气:自然存在的可燃性气体
12.下列是与化学有关的古代文献,其中理解错误的是
A.《石灰吟》(明 于谦) 中“……烈火焚烧若等闲……要留清白在人间”其中“清白”指氢氧化钙
B.《咏煤炭》(明 于谦) 中“凿开混沌得乌金……不辞辛苦出山林”其中“乌金”主要成分是煤炭
C.《天工开物》(明 宋应星) 中有记载:“以消石、硫磺为主。草木灰为辅。……魂散惊而魄齑粉”,文中提到的是火药
D.《淮南万毕术》(西汉 刘安) 中有描述:“曾青得铁则化为铜”,文中的“曾青”指的是铜的化合物
13.下列有关物质的性质与用途具有对应关系的是
A.石墨质软,可用作电池的电极材料
B.不锈钢耐腐蚀,可用于制造医疗器械
C.金属铜具有金属光泽,可用作导电材料
D.浓硫酸具有脱水性,可用作干燥剂
14.《本草纲目》记载:“火药乃焰硝、硫黄、杉木炭所合……”焰硝经处理可得到含少量 NaCl 的 KNO3 溶液,将其蒸发浓缩、冷却结晶、过滤,最终得到较纯净的 KNO3 固体。 KNO3 和 NaCl 的溶解度曲线如下图所示。下列说法正确的是
A.KNO3的溶解度大于NaCl的溶解度
B.“蒸发浓缩”是为了获得较高温度下NaCl的饱和溶液
C.KNO3的溶解度随温度降低大幅减小,所以“冷却结晶”时 析出KNO3晶体
D.“过滤”所得滤液中的溶质只含有NaCl
15.高锰酸钾加热制取 O2的实验中操作不正确的是
A. B. C. D.
检查装置气密性 取用药品 加热高锰酸钾 收集氧气
16.Y是生活中常见的物质,完全燃烧的化学方程式为Y+3O2 点燃 2CO2+3H2O ,Y的化学式为
A.CH4O B.C2H4 C.C3H8 D.C2H6O
除去下列物质中的少量杂质,所选试剂及操作都正确的是
序号 物质 杂质 试剂 操作
A Cu(NO3)2溶液 AgNO3 Cu 过滤
B Na2CO3 NaHCO3 盐酸 结晶
C Fe Cu 稀硫酸 过滤
D CO2 HCl NaOH溶液 洗气
18.氢能是一种重要的清洁能源。如图是工业上使用一种低温催化剂生产氢气的反应过程,下列说法正确的是
A.该反应的生成物有三种
B.该反应中水起了催化作用
C.在此反应中氢元素化合价升高
D.反应前后原子种类一定没有发生变化
19.某同学利用下图装置探究可燃物燃烧的条件。下列说法错误的是
A.利用推拉注射器活塞的方式检查装置气密性, 需先将玻璃管两端封闭
B.室温时推入适量过氧化氢溶液,红磷未燃烧, 说明物质燃烧需要温度达到着火点
C.打开止水夹K,通入N2,一段时间后点燃酒精 灯,红磷未燃烧,说明红磷没有可燃性
D.吸收装置的作用是防止燃烧产物逸散,导致空气污染
20.水体中的氮元素通常以氨氮(NH4+或NH3)、硝氮(NO2-或NO3- )形式存在。某工厂用次氯酸钠(NaClO)处理氨氮废水,次氯酸钠在一定条件下可将氨氮转化为氮气。次氯酸钠投入质量m (NaClO)对废水中的氨氮去除率(×100%)和总氮残留率(×100%)的影响如图所示。下列说法不正确的是
A.废水中的总氮残留率先减小后增大
B.当m
D.当m>m1时,水体中硝氮含量升高
Ⅱ卷(60分)
非选择题(本题包括4小题,共计60分)
21.(15分)化学是造福于人类的科学,请利用所学知识回答下列问题。
Ⅰ.化学与生活
(1)石墨烯是一种新型纳米材料,具有优异的导电性和强度。
① 石墨烯是从石墨中剥离出的单层碳原子结构,它属于 ▲ (填序号)。
A.单质 B.化合物 C.混合物
② 石墨烯可用于制造柔性显示屏,主要利用其 ▲ (填“导电性”或“延展性”)。
③ 石墨烯的化学性质与石墨相似,在氧气中完全燃烧的化学方程式为 ▲ 。
(2)均衡饮食是健康生活的基础。某同学的午餐为米饭、红烧鱼和青菜和橙子。
① 米饭的主要成分是淀粉,属于糖类,曾被称为“碳水化合物”,淀粉含有 ▲ 元素,实验室可用 ▲ 检验淀粉。
② 鱼肉富含优质蛋白质,蛋白质在人体内转化为能被吸收的小分子化合物,这类化合物称为 ▲ 。下列有关蛋白质的说法正确的是 ▲ (填序号)。
A.蛋白质是构成细胞的基本物质
B.蛋白质灼烧时有烧焦羽毛的气味
C.蛋白质属于有机高分子化合物
③ 青菜和橙子中富含维生素C(C6H8O6),维生素C是一种水溶性维生素,高温易被破坏,在酸性环境下较稳定。下列关于维生素C的说法错误的是 ▲ (填序号)。
A.维生素C中碳氧元素的质量比为3:4
B.为了保持健康,建议大量补充维生素C
C.富含维生素C的蔬菜最好先切后洗
D.缺乏维生素C,会引起坏血病
(3)合理用药是健康生活的重要保障。
① 阿司匹林(C9H8O4)是一种常见的解热镇痛药,其相对分子质量为 ▲ 。
② 阿司匹林化学名乙酰水杨酸,有弱酸性,服用阿司匹林时若与碳酸氢钠(NaHCO3)同服,两者反应生成乙酰水杨酸钠(NaC9H7O4),同时生成二氧化碳会导致胃胀气。该反应的化学方程式为 ▲ 。
③ 过期的药物应投入下列哪个图标的垃圾桶 ▲ (填序号)。
A. B. C. D.
Ⅱ.化学与能源
(4)①部分环保电动汽车使用高铁电池,其原理为高铁酸钾(K2FeO4)和单质锌作用,在释放出电能的同时生成K2ZnO2、Fe2O3及ZnO。请写出反应的化学方程式 ▲ 。
②汽车发生猛烈撞击时,储气罐中的压缩氮气释放出来充满碰撞气袋,请从微观角度描述此过程中氮气发生的变化 ▲ 。
22.(23分)水是生命之源,万物之基,是人类最宝贵的自然资源。
Ⅰ.探水
(1)人类对水的组成探索不断发展:
① 18世纪末,英国化学家普里斯特利把氢气和空气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,氢气燃烧发出震耳的爆鸣声。写出氢气燃烧的方程式 ▲ 。
② 电解水实验装置如图1所示。通电一段时间后,请完成图2中水通电分解前后的微观示意图。
由氢气燃烧和电解水实验可得出的结论是 ▲ 。
图3是探究物质组成的两种思路,电解水实验是通过 ▲ (填“甲”或“乙”)思路推测水的组成的。
Ⅱ.制水
(2)海水淡化
③ 膜分离法利用薄膜的选择透过性实现海水淡化。石墨烯海水淡化膜工作原理如图4所示,该膜允许通过的微粒是 ▲ (填写微粒符号)。
④ 热分离法制水利用蒸发和冷凝分离水与非挥发性物质,此方法的原理是利用了两者的
▲ 不同。限制热分离法大规模应用的原因可能是 ▲ 。
Ⅲ.处理水
(3)硬水软化
⑤ 硬水是指溶有较多 ▲ (写其中一种离子符号)的水。生活中常加入 ▲ 检验(填试剂名称)。
提出问题:水中溶有钙、镁离子的较多与较少到底有没有一个定量的标准?
查阅资料:水中两种离子的总浓度通常被称为水的总硬度。我国通常将所测得的总浓度折算成每升水中含有 CaCO3的毫克数,具体的换算方法是:
总硬度 = ρ(镁离子)×100/24+ρ(钙离子)×100/40,其中ρ指单位体积溶液中所含离子的质量。总硬度450mg·L-1以上为硬水。
提出问题:影响水硬度的因素有哪些?小组成员做了如下探究。
不同温度的水样/℃ ρ钙离子/mg·L-1 ρ镁离子/mg·L-1 总硬度/mg·L-1
25 154 54 610
40 149 51 x
60 131 52 544
80 71 53 398
100 23 55 287
⑥ 该实验的目的是 ▲ 。
⑦ 计算40℃时,水总硬度x= ▲ ,属于 ▲ (填“硬水”或“软水”)。
⑧ 生活中可采用 ▲ 的方法使硬水软化。若该地山泉水中溶有一定量的Ca(HCO3)2,软化过程中Ca(HCO3)2分解为碳酸钙和两种常见氧化物,该反应的化学方程式为 ▲ 。
(4)污水净化:
⑨ 水的天然循环给陆地带来淡水,在水天然循环的蒸发、蒸腾环节中
,水分子的能量 ▲ (填“增大”“减小”或“不变”)。
⑩ 天然水中含有许多杂质,净水过程中常利用 ▲ (填物质名称)
吸附水中的颜色和异味;
为了解决人们在野外生活和工作时的饮水问题,学习小组开展了便
携式野外净水器的设计和制作。设计装置如图5所示,由图可知,净水时水最先流经
▲ 。
(5)工业生产废水处理工艺
处理生产废水过程中,可向其中投入明矾[化学式为KAl(SO4) 2·12H2O],该物质溶于水后生成氢氧化铝 ▲ (填化学式)胶状物,胶状物对杂质吸附能力很强。
金属炭法处理废水中的重金属离子:其他条件相同时,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图6。
pH相同时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是 ▲ 。
废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是 ▲
23.(11分)课外实践小组以“气体制备”为主题开展研究性学习。
(一)实验室气体制取:
(1)仪器a 的名称是 ▲ 。
(2)实验室用装置B制取二氧化碳时,反应的化学方程式为 ▲ ,向长颈漏斗中加入液体时,液面应该在 ▲ (填“m”或“n”)处。
(3)实验室用加热熟石灰和氯化铵固体混合物制取氨气,氨气易溶于水且密度比空气小,则实验室制取氨气所选择的发生装置是 ▲ (填序号),若用F装置收集氨气,如何验满? ▲ 。
(二)在“双碳”目标愿景下,氨气作为一种“零碳”
能源前景广泛。
Ⅰ.制氨
右图是电解合成氨的工艺综合流程。
(4)空气分离装置内发生 ▲ (填“物理”或“化
学”)变化。
(5)流程中电解产生氨气的反应化学方程式为 ▲ 。
Ⅱ.用氨
(6)利用氨气除去汽车尾气中的NO,生成水和一种单质。氨气与NO在催化剂作用下反应的化学方程式为 ▲ 。
24.(11分)硫酸亚铁广泛应用于医学、农业等领域。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体(FeSO4 7H2O)的实验流程如图:
(1)“酸浸”时,使用过量的稀硫酸溶解废渣,发生的反应方程式有
① Fe3O4+4H2SO4==Fe2(SO4)3+FeSO4+4H2O;② ▲ 。
(2)将“滤渣”返回“酸浸”工序,其目的是 ▲ 。
(3)与普通过滤相比,使用图1装置进行过滤的优点是 ▲ 。
(4)滤液中的阳离子有 ▲ ,向滤液中“加一定质量的Fe粉”可以将Fe2(SO4)3转化为FeSO4,化学方程式为 ▲ 。
(5)固定其他条件不变,反应温度、反应时间、铁粉过量系数【 】分别对“滤液”中Fe3+还原率(Fe3+转化为Fe2+的百分率)的影响如图2、图3、图4所示。
结合图像和数据,设计由100g“滤液”【其中Fe2(SO4)3质量分数为12%】制备FeSO4溶液的实验方案: ▲ 。
(6)制得FeSO4溶液在真空蒸发仪中蒸发、在冰水浴中冷却结晶、过滤,得到硫酸亚铁晶体(FeSO4 7H2O)。
(7)测定硫酸亚铁晶体样品纯度
准确称取1.500g硫酸亚铁晶体(FeSO4 7H2O的相对分子质量为278)样品溶于水,与硫酸酸化的KMnO4溶液完全反应,消耗KMnO4的质量为0.158g。
已知:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O
该样品的纯度为 ▲ (精确到0.1%)。(请写出计算过程)
化学参考答案
一、单项选择题:共20题,每题2分,共40分。每题只有一个选项最符合题意。
1.D 2.A 3.B 4.C 5.A
6.D 7.C 8.C 9.D 10.A
11.C 12.A 13.B 14.C 15.C
16.D 17.A 18.D 19.C 20.C
二、非选择题:共5题,共60分。每空1分,方程式未特殊说明都2分
21.(15分)
(1)①A ②延展性③略(1分)
(2)①CHO 碘水(碘酒)②氨基酸 ABC ③ BC
(3)①180 ②略 ③B
(4) ①略②氮分子间间隔变大
22.(23)
(1)略 (1分)② 略 水是由氢氧元素组成 乙
(2)③H2O ④沸点 耗能大
(3)⑤Ca2+(Mg2+) 肥皂水 ⑥探究水温对水硬度的影响
⑦585 硬水 ⑧煮沸 略 ⑨增大 ⑩活性炭 小卵石 Al(OH)3
主要原因是铝比锌活泼,可以与Zn2+发生置换反应,而铁不能置换出锌(2分)
原因是pH升高,Al3+转化为Al(OH)3胶状物,对Zn2+有吸附作用(2分)
23.(11)
(1)水槽
(2)略 m
(3)A 湿润的红色石蕊试纸放在e管口处,变蓝则满
(二)物理 略 略
24.(11)
(1)
②略 (2)提高铁元素的浸出率 (3)过滤速度更快
(4)Fe2+ Fe3+ H+ 略
(5)在80℃水浴加热条件下,向“滤液”中加入2.016g铁粉,搅拌下反应2h后,过滤 (2分)
(7)92.7% (2分)
同课章节目录
