2025年山东省济南市天桥区九年级中考化学三模考试试题(含答案)
文档属性
| 名称 | 2025年山东省济南市天桥区九年级中考化学三模考试试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 561.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-04 16:08:12 | ||
图片预览


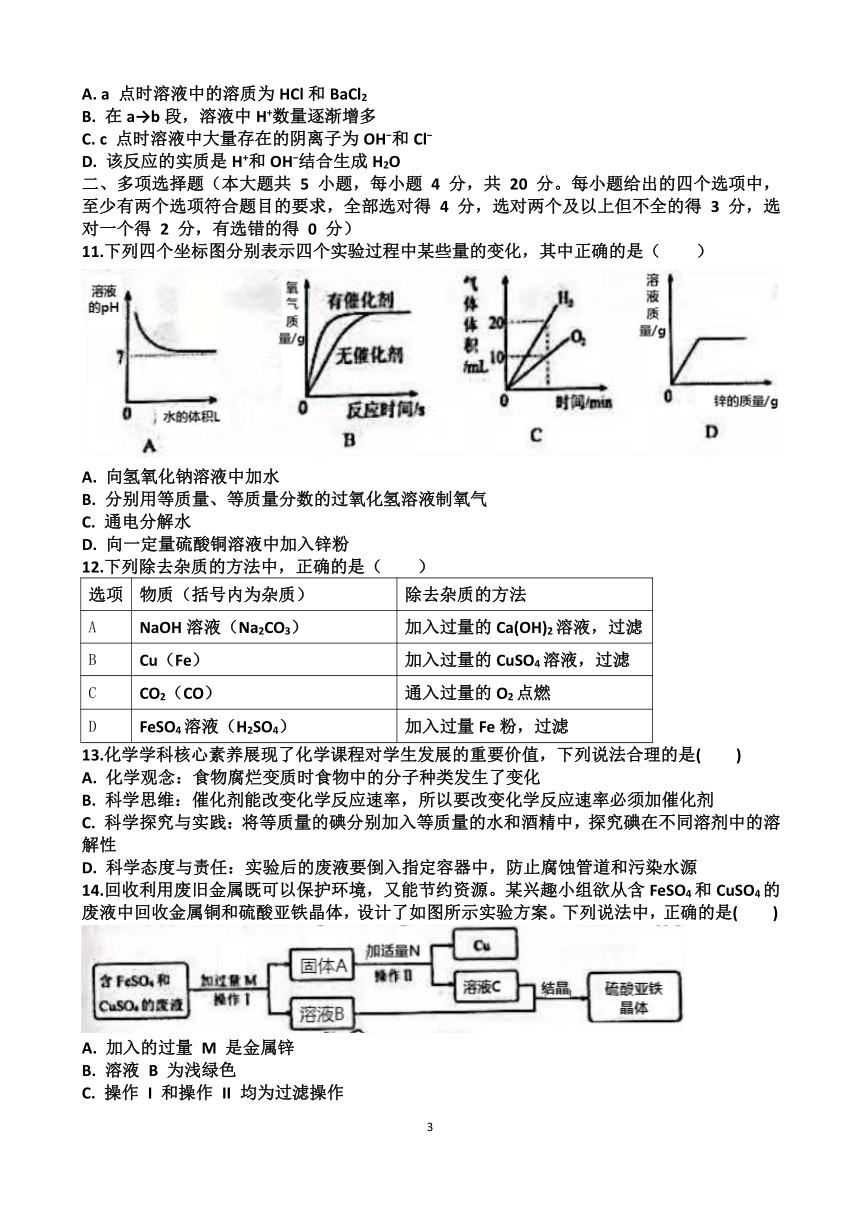

文档简介
2025 年九年级学业水平考试模拟测试化学试题
注意事项:
本试题共 8 页,满分为 100 分,考试时间为 60 分钟。
答题前,请考生务必将自己的姓名、座号和准考证号填写在答题卡规定位置。
答选择题时,必须使用 2B 铅笔填涂答题卡上相应题目的答案标号,修改时,要用橡皮擦干净,再选涂其他答案标号;答非选择题时,用 0.5mm 黑色签字笔在答题卡上题号所提示的答题区域作答,直接在试题上作答无效。
考试结束后,将本试题和答题卡一并交回。
相对原子质量:H 1 C 12 B 11 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55
Fe 56 Cu 64 Zn 65 Ag 108 Ba 137
第 I 卷(选择题 共 40 分)
一、单项选择题(本大题共 10 小题,每小题 2 分,共 20 分。每小题给出的四个选项中,只有一个选项最符合题目的要求)
1.2025 年吉祥物 ——“巳升升” 不仅蕴含了满满的中式美好寓意,又巧妙地融入了许多创新元素,同时融合了更多的传统技艺,巳升升的背部则巧妙地运用了景泰蓝工艺,勾勒出螺纹纹,寓意 “生生不息”。其制作过程含有化学变化的是( )
A. 裁剪:裁剪铜板 B. 掐丝:铜丝掐成图案
C. 烧蓝:烧制釉料 D. 磨光:将制品打磨光亮
2.中国承诺努力争取在 2060 年前实现 “碳中和”,彰显了我国的责任与担当,也是实现我国绿色可持续发展的内在要求。下列做法中,不利于实现碳中和的是( )
A. 发展CO2捕集技术 B. 退耕还林,推进生态环境建设
C. 鼓励乘坐公交出行 D. 大力提倡使用一次性餐具
3.化学实验是进行科学探究的重要方式,下列关于实验操作的说法中,不合理的是( )
A. 实验室制取气体时,先检验装置气密性,再加药品
B. 向试管中滴加液体时,胶头滴管垂悬在试管口上方
C. 实验室用CO还原Fe2O3时,应先通入CO气体,然后点燃酒精喷灯加热
D. 称量氢氧化钠等腐蚀性药品时,应将药品放在纸上称量
4.2025 年 5 月 12 日是第 17 个全国防灾减灾日,主题是 “人人讲安全,个个会应急 —— 排查身边灾害隐患”。下列说法正确的是( )
A. 电动车不能在居民楼内充电,以免发生火灾
B. 厨房天然气泄漏,应立即打开抽油烟机排气
C. 家用电器起火,立即用大量水浇灭
D. 人员被火围困在高层建筑时,应乘坐楼内电梯迅速撤退
5.下列关于物质的性质与用途对应关系中,不正确的是( )
A. 石墨具有优良的导电性,可用于制铅笔芯
B. 浓硫酸具有吸水性,可做某些气体的干燥剂
C. 盐酸能与某些金属氧化物反应,可用于金属表面除锈
D. 稀有气体在通电时能发出不同颜色的光,可制成霓虹灯
6.500 多年前,中国大量生产的景泰蓝是用蓝色的钴颜料烧制的。如图是钴元素的原子结构示意图及其在元素周期表中的部分信息。下列有关说法正确的是( )
A. 钴元素属于非金属元素
B. 钴 - 59 原子核内有 27 个中子
C. 钴的相对原子质量为 58.93g
D. 钴元素位于元素周期表的第四周期
7.以甲烷为原料合成清洁燃料的微观过程如图所示。下列说法不正确的是( )
A. 转化①中分子总数发生变化
B. 戊中 C、H、O 的质量比为 12:3:8
C. 转化②属于化合反应
D. 甲、丙、戊在氧气中充分燃烧,产物相同
8.逻辑推理是学习化学常用的思维方法,下列说法中正确的是( )
A. 酸性溶液的pH<7,所以pH<7的雨水一定是酸雨
B. 同种元素原子的质子数相同,所以不同种元素原子的质子数不同
C. 铝制品具有很好的抗腐蚀性能,所以铝的化学性质不活泼
D. 等质量、等质量分数的稀盐酸和氢氧化钠溶液充分反应后,所得溶液一定呈中性
9.现有某单一溶质的溶液 X,将其分成等量的三份,分别加入到足量的酚酞试液、稀盐酸、石灰水中,产生的现象如下表所示。则下面对该溶液 X 的叙述,不正确的是( )
加入的物质 酚酞试液 稀盐酸 石灰水
现象 变成红色 有气泡冒出 有白色沉淀
A. 溶液 X 可以和Ba(NO3)2发生复分解反应
B. 溶液 X 显碱性
C. 溶液 X 和稀盐酸反应一定有NaCl生成
D. 溶液 X 是一种盐的溶液
10.某同学在常温下进行Ba(OH)2溶液和稀盐酸发生中和反应的实验探究,利用数字化传感器,借助计算机绘制出溶液pH随所滴入Ba(OH)2溶液体积变化的曲线如图所示。下列有关说法中,不合理的是( )
A. a 点时溶液中的溶质为HCl和BaCl2
B. 在a→b段,溶液中H+数量逐渐增多
C. c 点时溶液中大量存在的阴离子为OH 和Cl
D. 该反应的实质是H+和OH 结合生成H2O
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有选错的得 0 分)
11.下列四个坐标图分别表示四个实验过程中某些量的变化,其中正确的是( )
A. 向氢氧化钠溶液中加水
B. 分别用等质量、等质量分数的过氧化氢溶液制氧气
C. 通电分解水
D. 向一定量硫酸铜溶液中加入锌粉
12.下列除去杂质的方法中,正确的是( )
选项 物质(括号内为杂质) 除去杂质的方法
A NaOH溶液(Na2CO3) 加入过量的Ca(OH)2溶液,过滤
B Cu(Fe) 加入过量的CuSO4溶液,过滤
C CO2(CO) 通入过量的O2点燃
D FeSO4溶液(H2SO4) 加入过量Fe粉,过滤
13.化学学科核心素养展现了化学课程对学生发展的重要价值,下列说法合理的是( )
A. 化学观念:食物腐烂变质时食物中的分子种类发生了变化
B. 科学思维:催化剂能改变化学反应速率,所以要改变化学反应速率必须加催化剂
C. 科学探究与实践:将等质量的碘分别加入等质量的水和酒精中,探究碘在不同溶剂中的溶解性
D. 科学态度与责任:实验后的废液要倒入指定容器中,防止腐蚀管道和污染水源
14.回收利用废旧金属既可以保护环境,又能节约资源。某兴趣小组欲从含FeSO4和CuSO4的废液中回收金属铜和硫酸亚铁晶体,设计了如图所示实验方案。下列说法中,正确的是( )
A. 加入的过量 M 是金属锌
B. 溶液 B 为浅绿色
C. 操作 I 和操作 II 均为过滤操作
D. 最后所得硫酸亚铁晶体的质量和废液中FeSO4的质量相等
15.向 12.6gNaOH与Na2CO3固体混合物中加入稀硫酸,所加稀硫酸的质量与溶液质量的关系如图所示。下列说法中,正确的是( )
A. 该反应共产生 4.4g 气体
B. 该硫酸溶液溶质的质量分数为 19.6%
C. 原混合物中NaOH与Na2CO3固体质量比为 20:53
D. a 点对应的横坐标为 10
第 II 卷(非选择题 共 60 分)
三、非选择题(本大题共 5 小题,共 60 分)
16.(10 分)(1)按要求从甲烷、氧化钙、氢氧化钡、硫酸中选择合适的物质,将其化学式填写在横线上。
① 一种可燃性气体__________; ② 一种不易挥发的酸__________;
③ 一种可溶性的碱__________; ④ 一种用作干燥剂的氧化物__________。
(2)春晚节目《满庭芳 国色》展现了五种中国传统色彩 —— 沉香、凝脂、缃叶、群青和桃红,分别对应黑、白、黄、青、赤五种本源之色,在这满庭芳的国色中也蕴藏着独特的化学内涵。
① 沉香:黄黑色,给人以稳重、力量之感。古人多以炭黑作为黑色颜料,例如敦煌壁画中黑色的人物轮廓历久弥新,这说明常温下碳的化学性质____(选填 “稳定” 或 “活泼”)之一。
② 凝脂:凝脂似玉、洁白高雅。宋代的德化窑的白瓷,是一种纯粹的凝脂白。陶瓷烧制过程中会发生一系列的化学反应,其中包括,该反应中 X 的化学式为 。
③ 缃叶:是浅黄色。古代绘画所用的黄色颜料可取自含砷(As)矿物,例如雌黄(As2S3)和雄黄(As4S4)。其中,雌黄(As2S3)中 As 元素的化合价为 。
④ 群青:古代的群青颜料由贵重的青金石研磨制成,青金石是指碱性铝硅酸盐矿物,其中含有 Na、Al、Si、O 等元素,从原子结构的角度分析,不同种元素最本质的区别是____不同。
⑤ 桃红:桃之夭夭,灼灼其华。古代的桃红胭脂可由红花汁制成,红花的染色成分为红花素(化学式为C15H12O6)。红花素属于 (选填 “有机物”“无机物”)之一,其中质量分数最高的元素是 (填元素符号)。
17.(11 分)(1)人类文明的进步与金属材料的发展关系密切。《梦溪笔谈》记载:“阳燧面洼,向日照之,光皆聚向内,离镜一二寸,光聚为一点,大如麻菽,著物则火发……”。
① “阳燧” 为铜锡合金所制,属于____(选填 “金属”“无机非金属”“有机高分子”“复合”)材料。与纯铜相比,铜锡合金的特点是____(填选项序号)。
A. 硬度大 B. 抗腐蚀性能好 C. 熔点高
② 古人将孔雀石和木炭混合,经高温煅烧得到粗铜,精炼后再熔合一定比例的锡、铅等调节性能,孔雀石的主要成分为碱式碳酸铜【化学式Cu2(OH)2CO3】,其在高温下反应生成氧化铜,利用木炭与氧化铜在高温下反应得到铜与二氧化碳,请写出该反应的化学方程式 。
③ “阳燧” 取火的原理是 。
(2)我国著名化学家侯德榜先生创立了联合制碱法,促进了世界制碱技术的发展。Na2CO3和NaCl的溶解度曲线如图所示,试回答下列问题:
① t1℃时,Na2CO3溶液中溶质的质量分数____NaCl溶液中溶质的质量分数(选填 “大于”“小于”“等于”“无法判断” 之一)。
②t1℃时,68gNaCl饱和溶液中溶质与溶剂的质量比是____(填最简整数比)。
③ 将t1℃时Na2CO3的饱和溶液和NaCl的饱和溶液分别升温到t2℃,此时所得Na2CO3溶液的溶质质量分数 NaCl溶液的溶质质量分数(选填 “大于”“小于”“等于”“无法判断” 之一)。
18.(11 分)下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),化学小组的同学利用其进行下列化学实验。
A B C D E F
请根据题目要求,回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集较为纯净的二氧化碳气体,按照要求设计实验装置,连接仪器。
① 所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
② 上述制取二氧化碳的化学方程式为 。
③ 将二氧化碳通入澄清的石灰水中,石灰水的pH将 (选填 “增大”“减小”“不变” 之一)
(2)用CO气体(含少量CO2)测定某铁的氧化物(FexOy)的元素组成比例,所选仪器按 “CO
气体(含少量CO2)→E1→C→A→E2→尾气处理装置” 的顺序连接(E1、E2为氢氧化钠洗气瓶),并检验装置的气密性,进行实验。(假设所发生的化学反应都充分反应)
① 该装置中,洗气瓶E1的作用为__________。
② 反应前硬质玻璃管中加入铁的氧化物(FexOy)试样的质量为a g,实验结束后,继续通入一氧化碳气体,直至硬质玻璃管冷却。
I.测量到 A 处硬质玻璃管中固体的质量减少b g,试推算该铁的氧化物的化学式中x、y的比值为__________(用含a和b的代数式表示)。
II. 测量反应前、后E2氢氧化钠洗气瓶的质量增加c g,试推算该铁的氧化物中氧元素的质量为 g(用含c的代数式表示)。若装置中没有连接仪器 E1,这样测算出的该铁的氧
化物中x 、y 的比值与实际值比较将 (填"偏小""偏大""基本一致"之一)。
19.(14分)(1)实验室中有两瓶没有贴标签的黑色粉末,已知是铁粉和氧化铜粉末中的各一种,小明和小红想用化学方法确定物质成分,进行了如下实验探究。
①小明各取少量两种黑色粉末,分别加入A 、B 两支试管中,分别滴加适量稀盐酸,振荡,观察到 B 试管中的黑色粉末逐渐溶解,并产生气泡,请写出B 试管中发生反应的化学方程 .
②小红从下列四种试剂中选取了一种试剂,也成功鉴别了上述两种黑色粉末。则小红所选的试剂是 (填选项序号)。
A . Zn (NO3)2溶液 B . AgNO3溶液 C . NaCI 溶液 D . NaOH 溶液
(2)已知固体样品 A 含有 Na2CO3、 K2SO4、 KCI 三种物质中的两种,固体样品 B 含有 NH4CI 、(NH4)2SO4、 CuCl2三种物质中的一种或多种,按下图所示进行实验探究,实验现象如图中所述。(设过程中所有发生的反应都恰好完全反应)
结合上述信息进行分析推理,回答下列问题:
① 气体C是 (填化学式),沉淀F是 (填化学式)。
② 混合物A中一定存在的物质是 (填化学式)。
③ 溶液B中一定大量存在的阳离子有 (填离子符号)。
④ 写出步骤 II 中生成气体G的化学方程式: 。
⑤ 固体混合物B中,(NH4)2SO4 (选填“一定存在”“一定不存在”“无法确定”),理由: 。
20.(14分)(1)我国古代就有湿法冶金技术,湿法冶金是利用置换反应从盐溶液中得到金属。现有一烧杯中盛有一定质量的 Fe(NO3)2和AgNO3的混合溶液,向其中逐渐加入锌粉。烧杯中溶液的质量随加入锌粉质量的变化关系如图所示。试回答;
① b点对应的烧杯溶液中大量存在的金属阳离子是 (填离子符号)
②e点对应的烧杯中含有的金属单质是 (填化学式)。
③写出 ed 段发生反应的化学方程式 .
(2)化学兴趣小组同学测定某纯碱样品(杂质为氯化钠)中碳酸钠的含量,他们设计了如下实验:
① 溶液A中大量存在的酸根阴离子是 ______(填离子符号)。
② 溶液B的质量是 ______ g(精确至 0.1g)。
③ 计算Na2CO3的质量分数(写出计算过程,精确至 0.1%)。
答案
1.C 2.D 3.D 4.A 5.A 6.D 7.C 8.B 9.C 10.B
11.ABC 12.BD 13.ACD 14.BC 15.AD
16.(1)① CH4 ② H2SO4 ③ Ba(OH)2 ④ CaO
(2)① 稳定 ② SiO2 ③ +3 ④ 质子数 ⑤ 有机物 C
17.(1)① 金属 AB ② ③ 凹面镜聚光使温度达着火点 (2)① 无法判断 ② 3:10 ③ 小于
18.(1)① B→C→D→F ② CaCO3+2HCl=CaCl2+H2O+CO2↑ ③ 减小
(2)① 除去 CO中的CO2 ② I. II. 偏小
19.(1) ① Fe+2HCl=FeCl2+H2↑;② B
(2) ① CO2;BaSO4
② Na2CO3、K2SO4
③ NH4+、Cu2+
④ 2NH4Cl+Ba(OH)2=BaCl2+2NH3↑+2H2O[或(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3↑+2H2O
⑤ 一定不存在;因为步骤 Ⅱ 中加入Ba(OH)2溶液产生沉淀F,而后续溶液E与D混合加稀硝酸后沉淀I,若有(NH4)2SO4,步骤 Ⅱ 会产生BaSO4沉淀, 但从流程看沉淀I是由溶液D(含SO42 等 )和溶液E混合反应而来,且步骤 Ⅱ 产生的沉淀F不是BaSO4(因有气体G,说明是铵盐反应,若有(NH4)2SO4,沉淀会有BaSO4,但结合后续沉淀I情况,可知无(NH4)2SO4,实际是NH4Cl与Ba(OH)2反应,所以(NH4)2SO4一定不存在。
20.(1) ① Zn2+、Fe2+、Ag+
② Zn、Fe、Ag
③ Zn+Fe(NO3)2=Zn(NO3)2+Fe
(2) ① CO32 、Cl
②300.3g
③Na2CO3的质量分数约为88.3%。
注意事项:
本试题共 8 页,满分为 100 分,考试时间为 60 分钟。
答题前,请考生务必将自己的姓名、座号和准考证号填写在答题卡规定位置。
答选择题时,必须使用 2B 铅笔填涂答题卡上相应题目的答案标号,修改时,要用橡皮擦干净,再选涂其他答案标号;答非选择题时,用 0.5mm 黑色签字笔在答题卡上题号所提示的答题区域作答,直接在试题上作答无效。
考试结束后,将本试题和答题卡一并交回。
相对原子质量:H 1 C 12 B 11 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55
Fe 56 Cu 64 Zn 65 Ag 108 Ba 137
第 I 卷(选择题 共 40 分)
一、单项选择题(本大题共 10 小题,每小题 2 分,共 20 分。每小题给出的四个选项中,只有一个选项最符合题目的要求)
1.2025 年吉祥物 ——“巳升升” 不仅蕴含了满满的中式美好寓意,又巧妙地融入了许多创新元素,同时融合了更多的传统技艺,巳升升的背部则巧妙地运用了景泰蓝工艺,勾勒出螺纹纹,寓意 “生生不息”。其制作过程含有化学变化的是( )
A. 裁剪:裁剪铜板 B. 掐丝:铜丝掐成图案
C. 烧蓝:烧制釉料 D. 磨光:将制品打磨光亮
2.中国承诺努力争取在 2060 年前实现 “碳中和”,彰显了我国的责任与担当,也是实现我国绿色可持续发展的内在要求。下列做法中,不利于实现碳中和的是( )
A. 发展CO2捕集技术 B. 退耕还林,推进生态环境建设
C. 鼓励乘坐公交出行 D. 大力提倡使用一次性餐具
3.化学实验是进行科学探究的重要方式,下列关于实验操作的说法中,不合理的是( )
A. 实验室制取气体时,先检验装置气密性,再加药品
B. 向试管中滴加液体时,胶头滴管垂悬在试管口上方
C. 实验室用CO还原Fe2O3时,应先通入CO气体,然后点燃酒精喷灯加热
D. 称量氢氧化钠等腐蚀性药品时,应将药品放在纸上称量
4.2025 年 5 月 12 日是第 17 个全国防灾减灾日,主题是 “人人讲安全,个个会应急 —— 排查身边灾害隐患”。下列说法正确的是( )
A. 电动车不能在居民楼内充电,以免发生火灾
B. 厨房天然气泄漏,应立即打开抽油烟机排气
C. 家用电器起火,立即用大量水浇灭
D. 人员被火围困在高层建筑时,应乘坐楼内电梯迅速撤退
5.下列关于物质的性质与用途对应关系中,不正确的是( )
A. 石墨具有优良的导电性,可用于制铅笔芯
B. 浓硫酸具有吸水性,可做某些气体的干燥剂
C. 盐酸能与某些金属氧化物反应,可用于金属表面除锈
D. 稀有气体在通电时能发出不同颜色的光,可制成霓虹灯
6.500 多年前,中国大量生产的景泰蓝是用蓝色的钴颜料烧制的。如图是钴元素的原子结构示意图及其在元素周期表中的部分信息。下列有关说法正确的是( )
A. 钴元素属于非金属元素
B. 钴 - 59 原子核内有 27 个中子
C. 钴的相对原子质量为 58.93g
D. 钴元素位于元素周期表的第四周期
7.以甲烷为原料合成清洁燃料的微观过程如图所示。下列说法不正确的是( )
A. 转化①中分子总数发生变化
B. 戊中 C、H、O 的质量比为 12:3:8
C. 转化②属于化合反应
D. 甲、丙、戊在氧气中充分燃烧,产物相同
8.逻辑推理是学习化学常用的思维方法,下列说法中正确的是( )
A. 酸性溶液的pH<7,所以pH<7的雨水一定是酸雨
B. 同种元素原子的质子数相同,所以不同种元素原子的质子数不同
C. 铝制品具有很好的抗腐蚀性能,所以铝的化学性质不活泼
D. 等质量、等质量分数的稀盐酸和氢氧化钠溶液充分反应后,所得溶液一定呈中性
9.现有某单一溶质的溶液 X,将其分成等量的三份,分别加入到足量的酚酞试液、稀盐酸、石灰水中,产生的现象如下表所示。则下面对该溶液 X 的叙述,不正确的是( )
加入的物质 酚酞试液 稀盐酸 石灰水
现象 变成红色 有气泡冒出 有白色沉淀
A. 溶液 X 可以和Ba(NO3)2发生复分解反应
B. 溶液 X 显碱性
C. 溶液 X 和稀盐酸反应一定有NaCl生成
D. 溶液 X 是一种盐的溶液
10.某同学在常温下进行Ba(OH)2溶液和稀盐酸发生中和反应的实验探究,利用数字化传感器,借助计算机绘制出溶液pH随所滴入Ba(OH)2溶液体积变化的曲线如图所示。下列有关说法中,不合理的是( )
A. a 点时溶液中的溶质为HCl和BaCl2
B. 在a→b段,溶液中H+数量逐渐增多
C. c 点时溶液中大量存在的阴离子为OH 和Cl
D. 该反应的实质是H+和OH 结合生成H2O
二、多项选择题(本大题共 5 小题,每小题 4 分,共 20 分。每小题给出的四个选项中,至少有两个选项符合题目的要求,全部选对得 4 分,选对两个及以上但不全的得 3 分,选对一个得 2 分,有选错的得 0 分)
11.下列四个坐标图分别表示四个实验过程中某些量的变化,其中正确的是( )
A. 向氢氧化钠溶液中加水
B. 分别用等质量、等质量分数的过氧化氢溶液制氧气
C. 通电分解水
D. 向一定量硫酸铜溶液中加入锌粉
12.下列除去杂质的方法中,正确的是( )
选项 物质(括号内为杂质) 除去杂质的方法
A NaOH溶液(Na2CO3) 加入过量的Ca(OH)2溶液,过滤
B Cu(Fe) 加入过量的CuSO4溶液,过滤
C CO2(CO) 通入过量的O2点燃
D FeSO4溶液(H2SO4) 加入过量Fe粉,过滤
13.化学学科核心素养展现了化学课程对学生发展的重要价值,下列说法合理的是( )
A. 化学观念:食物腐烂变质时食物中的分子种类发生了变化
B. 科学思维:催化剂能改变化学反应速率,所以要改变化学反应速率必须加催化剂
C. 科学探究与实践:将等质量的碘分别加入等质量的水和酒精中,探究碘在不同溶剂中的溶解性
D. 科学态度与责任:实验后的废液要倒入指定容器中,防止腐蚀管道和污染水源
14.回收利用废旧金属既可以保护环境,又能节约资源。某兴趣小组欲从含FeSO4和CuSO4的废液中回收金属铜和硫酸亚铁晶体,设计了如图所示实验方案。下列说法中,正确的是( )
A. 加入的过量 M 是金属锌
B. 溶液 B 为浅绿色
C. 操作 I 和操作 II 均为过滤操作
D. 最后所得硫酸亚铁晶体的质量和废液中FeSO4的质量相等
15.向 12.6gNaOH与Na2CO3固体混合物中加入稀硫酸,所加稀硫酸的质量与溶液质量的关系如图所示。下列说法中,正确的是( )
A. 该反应共产生 4.4g 气体
B. 该硫酸溶液溶质的质量分数为 19.6%
C. 原混合物中NaOH与Na2CO3固体质量比为 20:53
D. a 点对应的横坐标为 10
第 II 卷(非选择题 共 60 分)
三、非选择题(本大题共 5 小题,共 60 分)
16.(10 分)(1)按要求从甲烷、氧化钙、氢氧化钡、硫酸中选择合适的物质,将其化学式填写在横线上。
① 一种可燃性气体__________; ② 一种不易挥发的酸__________;
③ 一种可溶性的碱__________; ④ 一种用作干燥剂的氧化物__________。
(2)春晚节目《满庭芳 国色》展现了五种中国传统色彩 —— 沉香、凝脂、缃叶、群青和桃红,分别对应黑、白、黄、青、赤五种本源之色,在这满庭芳的国色中也蕴藏着独特的化学内涵。
① 沉香:黄黑色,给人以稳重、力量之感。古人多以炭黑作为黑色颜料,例如敦煌壁画中黑色的人物轮廓历久弥新,这说明常温下碳的化学性质____(选填 “稳定” 或 “活泼”)之一。
② 凝脂:凝脂似玉、洁白高雅。宋代的德化窑的白瓷,是一种纯粹的凝脂白。陶瓷烧制过程中会发生一系列的化学反应,其中包括,该反应中 X 的化学式为 。
③ 缃叶:是浅黄色。古代绘画所用的黄色颜料可取自含砷(As)矿物,例如雌黄(As2S3)和雄黄(As4S4)。其中,雌黄(As2S3)中 As 元素的化合价为 。
④ 群青:古代的群青颜料由贵重的青金石研磨制成,青金石是指碱性铝硅酸盐矿物,其中含有 Na、Al、Si、O 等元素,从原子结构的角度分析,不同种元素最本质的区别是____不同。
⑤ 桃红:桃之夭夭,灼灼其华。古代的桃红胭脂可由红花汁制成,红花的染色成分为红花素(化学式为C15H12O6)。红花素属于 (选填 “有机物”“无机物”)之一,其中质量分数最高的元素是 (填元素符号)。
17.(11 分)(1)人类文明的进步与金属材料的发展关系密切。《梦溪笔谈》记载:“阳燧面洼,向日照之,光皆聚向内,离镜一二寸,光聚为一点,大如麻菽,著物则火发……”。
① “阳燧” 为铜锡合金所制,属于____(选填 “金属”“无机非金属”“有机高分子”“复合”)材料。与纯铜相比,铜锡合金的特点是____(填选项序号)。
A. 硬度大 B. 抗腐蚀性能好 C. 熔点高
② 古人将孔雀石和木炭混合,经高温煅烧得到粗铜,精炼后再熔合一定比例的锡、铅等调节性能,孔雀石的主要成分为碱式碳酸铜【化学式Cu2(OH)2CO3】,其在高温下反应生成氧化铜,利用木炭与氧化铜在高温下反应得到铜与二氧化碳,请写出该反应的化学方程式 。
③ “阳燧” 取火的原理是 。
(2)我国著名化学家侯德榜先生创立了联合制碱法,促进了世界制碱技术的发展。Na2CO3和NaCl的溶解度曲线如图所示,试回答下列问题:
① t1℃时,Na2CO3溶液中溶质的质量分数____NaCl溶液中溶质的质量分数(选填 “大于”“小于”“等于”“无法判断” 之一)。
②t1℃时,68gNaCl饱和溶液中溶质与溶剂的质量比是____(填最简整数比)。
③ 将t1℃时Na2CO3的饱和溶液和NaCl的饱和溶液分别升温到t2℃,此时所得Na2CO3溶液的溶质质量分数 NaCl溶液的溶质质量分数(选填 “大于”“小于”“等于”“无法判断” 之一)。
18.(11 分)下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),化学小组的同学利用其进行下列化学实验。
A B C D E F
请根据题目要求,回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备并收集较为纯净的二氧化碳气体,按照要求设计实验装置,连接仪器。
① 所选仪器的连接顺序为 (从左到右填写仪器序号字母)。
② 上述制取二氧化碳的化学方程式为 。
③ 将二氧化碳通入澄清的石灰水中,石灰水的pH将 (选填 “增大”“减小”“不变” 之一)
(2)用CO气体(含少量CO2)测定某铁的氧化物(FexOy)的元素组成比例,所选仪器按 “CO
气体(含少量CO2)→E1→C→A→E2→尾气处理装置” 的顺序连接(E1、E2为氢氧化钠洗气瓶),并检验装置的气密性,进行实验。(假设所发生的化学反应都充分反应)
① 该装置中,洗气瓶E1的作用为__________。
② 反应前硬质玻璃管中加入铁的氧化物(FexOy)试样的质量为a g,实验结束后,继续通入一氧化碳气体,直至硬质玻璃管冷却。
I.测量到 A 处硬质玻璃管中固体的质量减少b g,试推算该铁的氧化物的化学式中x、y的比值为__________(用含a和b的代数式表示)。
II. 测量反应前、后E2氢氧化钠洗气瓶的质量增加c g,试推算该铁的氧化物中氧元素的质量为 g(用含c的代数式表示)。若装置中没有连接仪器 E1,这样测算出的该铁的氧
化物中x 、y 的比值与实际值比较将 (填"偏小""偏大""基本一致"之一)。
19.(14分)(1)实验室中有两瓶没有贴标签的黑色粉末,已知是铁粉和氧化铜粉末中的各一种,小明和小红想用化学方法确定物质成分,进行了如下实验探究。
①小明各取少量两种黑色粉末,分别加入A 、B 两支试管中,分别滴加适量稀盐酸,振荡,观察到 B 试管中的黑色粉末逐渐溶解,并产生气泡,请写出B 试管中发生反应的化学方程 .
②小红从下列四种试剂中选取了一种试剂,也成功鉴别了上述两种黑色粉末。则小红所选的试剂是 (填选项序号)。
A . Zn (NO3)2溶液 B . AgNO3溶液 C . NaCI 溶液 D . NaOH 溶液
(2)已知固体样品 A 含有 Na2CO3、 K2SO4、 KCI 三种物质中的两种,固体样品 B 含有 NH4CI 、(NH4)2SO4、 CuCl2三种物质中的一种或多种,按下图所示进行实验探究,实验现象如图中所述。(设过程中所有发生的反应都恰好完全反应)
结合上述信息进行分析推理,回答下列问题:
① 气体C是 (填化学式),沉淀F是 (填化学式)。
② 混合物A中一定存在的物质是 (填化学式)。
③ 溶液B中一定大量存在的阳离子有 (填离子符号)。
④ 写出步骤 II 中生成气体G的化学方程式: 。
⑤ 固体混合物B中,(NH4)2SO4 (选填“一定存在”“一定不存在”“无法确定”),理由: 。
20.(14分)(1)我国古代就有湿法冶金技术,湿法冶金是利用置换反应从盐溶液中得到金属。现有一烧杯中盛有一定质量的 Fe(NO3)2和AgNO3的混合溶液,向其中逐渐加入锌粉。烧杯中溶液的质量随加入锌粉质量的变化关系如图所示。试回答;
① b点对应的烧杯溶液中大量存在的金属阳离子是 (填离子符号)
②e点对应的烧杯中含有的金属单质是 (填化学式)。
③写出 ed 段发生反应的化学方程式 .
(2)化学兴趣小组同学测定某纯碱样品(杂质为氯化钠)中碳酸钠的含量,他们设计了如下实验:
① 溶液A中大量存在的酸根阴离子是 ______(填离子符号)。
② 溶液B的质量是 ______ g(精确至 0.1g)。
③ 计算Na2CO3的质量分数(写出计算过程,精确至 0.1%)。
答案
1.C 2.D 3.D 4.A 5.A 6.D 7.C 8.B 9.C 10.B
11.ABC 12.BD 13.ACD 14.BC 15.AD
16.(1)① CH4 ② H2SO4 ③ Ba(OH)2 ④ CaO
(2)① 稳定 ② SiO2 ③ +3 ④ 质子数 ⑤ 有机物 C
17.(1)① 金属 AB ② ③ 凹面镜聚光使温度达着火点 (2)① 无法判断 ② 3:10 ③ 小于
18.(1)① B→C→D→F ② CaCO3+2HCl=CaCl2+H2O+CO2↑ ③ 减小
(2)① 除去 CO中的CO2 ② I. II. 偏小
19.(1) ① Fe+2HCl=FeCl2+H2↑;② B
(2) ① CO2;BaSO4
② Na2CO3、K2SO4
③ NH4+、Cu2+
④ 2NH4Cl+Ba(OH)2=BaCl2+2NH3↑+2H2O[或(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3↑+2H2O
⑤ 一定不存在;因为步骤 Ⅱ 中加入Ba(OH)2溶液产生沉淀F,而后续溶液E与D混合加稀硝酸后沉淀I,若有(NH4)2SO4,步骤 Ⅱ 会产生BaSO4沉淀, 但从流程看沉淀I是由溶液D(含SO42 等 )和溶液E混合反应而来,且步骤 Ⅱ 产生的沉淀F不是BaSO4(因有气体G,说明是铵盐反应,若有(NH4)2SO4,沉淀会有BaSO4,但结合后续沉淀I情况,可知无(NH4)2SO4,实际是NH4Cl与Ba(OH)2反应,所以(NH4)2SO4一定不存在。
20.(1) ① Zn2+、Fe2+、Ag+
② Zn、Fe、Ag
③ Zn+Fe(NO3)2=Zn(NO3)2+Fe
(2) ① CO32 、Cl
②300.3g
③Na2CO3的质量分数约为88.3%。
同课章节目录
